2023-2024学年上海重点大学附中高二(上)开学化学试卷(含解析)
文档属性
| 名称 | 2023-2024学年上海重点大学附中高二(上)开学化学试卷(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 219.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 00:00:00 | ||
图片预览



文档简介
2023-2024学年上海重点大学附中高二(上)开学化学试卷
1.硫是重要的非金属元素,也是人类较早认识的化学元素之一。自然界中的硫元素主要以单质硫、硫化物和硫酸盐等形式存在。
下列物质中的硫元素不能表现出氧化性的是 ______ 单选。
A.
B.
C.
D.
下列有关浓硫酸的说法中,不正确的是 ______ 单选。
A.浓硫酸能与锌粒反应制备氢气
B.浓硫酸能与灼热的木炭反应,产生二氧化碳和二氧化硫气体
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
将铁粉与硫粉在研钵中充分混合后装入试管中,在试管口塞上带长导管的橡皮塞,并在导管末端放入一小团蘸有溶液的棉花,加热试管。
写出铁与硫反应的化学方程式 ______ 。
已知硫的熔点为,沸点为,解释试管口为什么向上倾斜 ______ 。
棉花中的用于吸收反应过程中产生的二氧化硫,写出该反应的离子方程式 ______ 。
工业上通常用接触法制硫酸。在制硫酸的生产中,若有吨硫黄最终全部转化为硫酸,则可以制得质量分数为的浓硫酸为 ______ 吨。已知的硫酸密度为,计算此溶液的物质的量浓度为 ______ 。
氮循环是大气中的氮气经微生物等作用进入土壤与海洋,为动植物所利用,最终又在微生物的参与下返回大气,如此反复循环,建立起的平衡。
土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下: ______ ______ ______ ______ ______ ______ 。配平上述反应方程式,并标出电子转移的方向和数目 ______ 。
氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生氮气时,转移电子的物质的量为 ______ 。
2.年,我国明确提出“碳达峰”与“碳中和”,研究碳元素的综合利用对这一宏伟目标的实现具有现实意义。
下列关于化学键与化合物的叙述正确的是 ______ 单选。
A.含有正离子的物质一定是离子化合物
B.离子化合物中一定含有离子键,可能含有共价键
C.分子晶体中一定含有共价键,不含离子键
D.只由共价键形成的物质一定是共价化合物
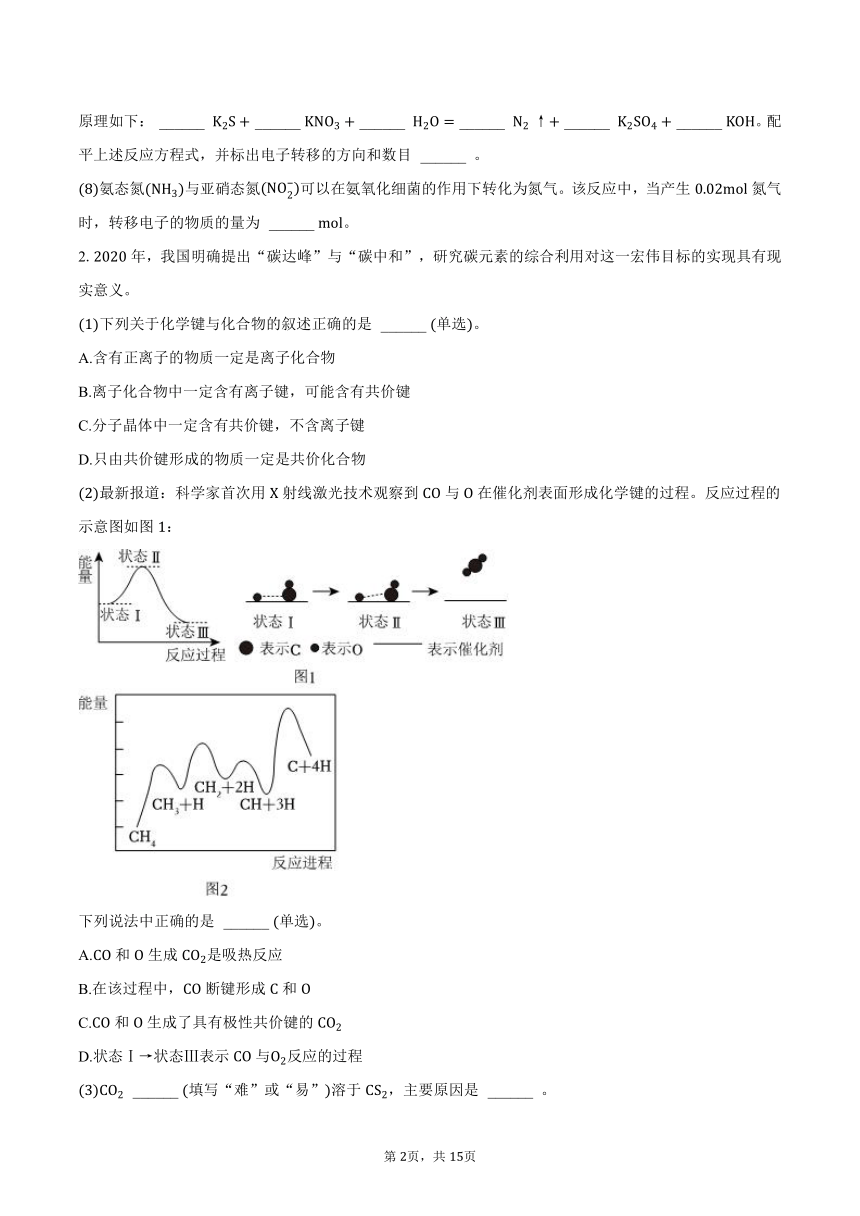
最新报道:科学家首次用射线激光技术观察到与在催化剂表面形成化学键的过程。反应过程的示意图如图:
下列说法中正确的是 ______ 单选。
A.和生成是吸热反应
B.在该过程中,断键形成和
C.和生成了具有极性共价键的
D.状态Ⅰ状态Ⅲ表示与反应的过程
______ 填写“难”或“易”溶于,主要原因是 ______ 。
沼气是一种能源,它的主要成分是,已知:
Ⅰ:
Ⅱ:
则由和制取气态甲醇的热化学方程式:中 ______ 。
实现下列变化,需克服相同类型作用力的是 ______ 双选。
A.硫酸氢钠和氯化钠分别受热熔化
B.冰的融化和水的分解
C.乙醇和溶于水
D.干冰和碘的升华
常温下,完全燃烧生成和液态水时,放出热量,则该反应的热化学方程式为 ______ 。
一定条件下,分解形成碳的反应历程如图所示。该历程分 ______ 步进行,其中,第 ______ 步的是决速步骤。
已知时,相关物质的相对能量如表所示;
物质
相对能量
转化为需要 ______ 填“吸收”或“放出” ______ 的热量。
3.空间站还原转化系统能把呼出的捕集、分离并与空间站电解水系统产生的进行加氢处理,从而实现空间站内物料的循环利用。
如图,可以借助光将转化为,该转化过程总反应的化学方程式是 ______ 。
图中所示的各物质中,含有极性共价键的非极性分子是 ______ 填化学式。
一定条件下,和还可发生如下两个平行反应:
为了提高的产率,理论上应采用的措施是 ______ 单选。
A.低温低压
B.高温低压
C.高温高压
D.低温高压
保持温度、压强,按投料比向容器中充入和,反应相同时间测得不同催化剂下转化率和选择性的相关实验数据如表所示已知选择性:转化的中生成的百分比。
催化剂 转化率 选择性
催化剂
催化剂
上述条件下,使用催化剂作催化剂,下列说法能判断反应达到平衡状态的是 ______ 单选。
A.气体压强不再变化
B.气体平均相对分子质量不再变化
C.和的物质的量之比为:
D.和的物质的量之比不再变化
一定条件下,向恒容密闭容器中充入和,只发生上述反应,达平衡时,的转化率为,则该温度下的平衡常数 ______ 保留两位小数。
若恒容密闭容器中只发生上述反应,在进气比:不同、温度不同时,测得相应的平衡转化率如图所示。则和两点的温度 ______ 填“”、“”或“”,其原因是 ______ 。
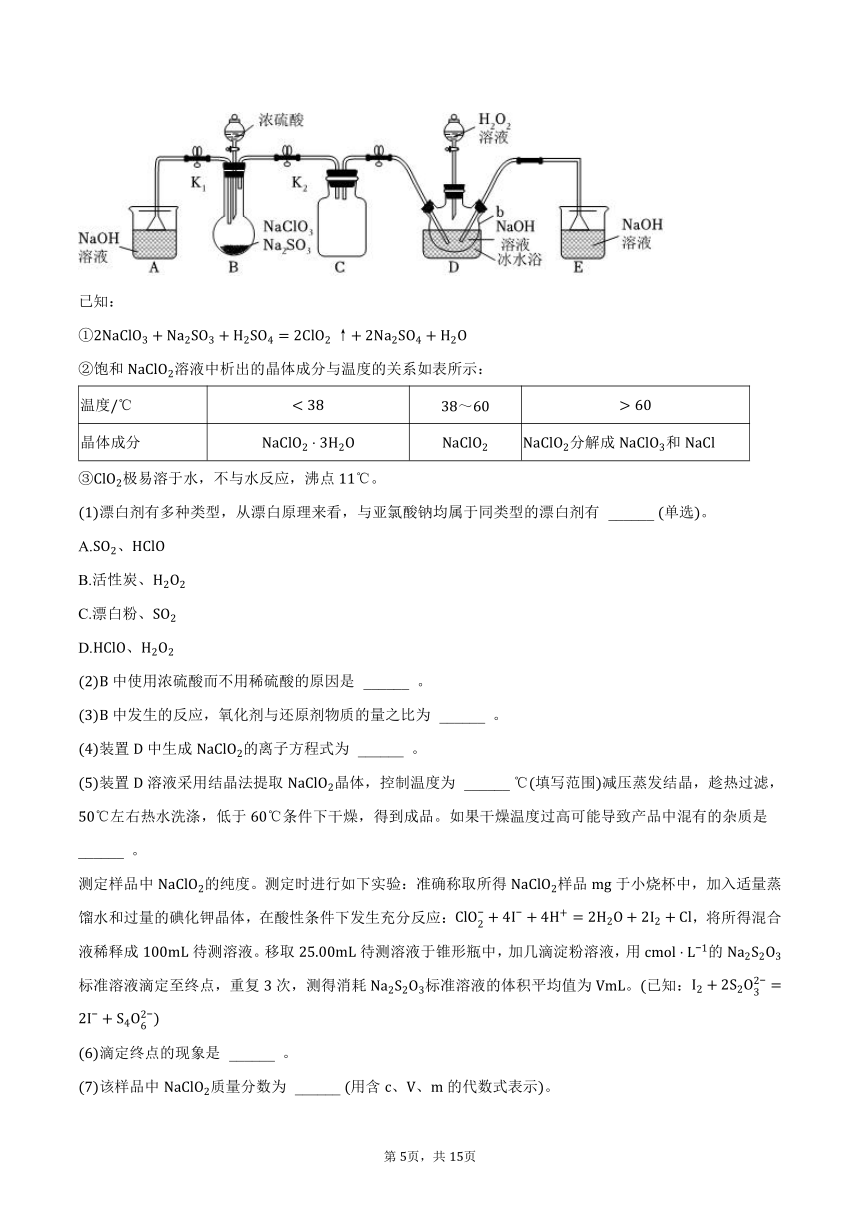
4.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白以及食品消毒、水处理、杀菌灭藻和鱼药制造。某校化学实验探究小组设计如图实验,用为原料制备亚氯酸钠。
已知:
饱和溶液中析出的晶体成分与温度的关系如表所示:
温度
晶体成分 分解成和
极易溶于水,不与水反应,沸点。
漂白剂有多种类型,从漂白原理来看,与亚氯酸钠均属于同类型的漂白剂有 ______ 单选。
A.、
B.活性炭、
C.漂白粉、
D.、
中使用浓硫酸而不用稀硫酸的原因是 ______ 。
中发生的反应,氧化剂与还原剂物质的量之比为 ______ 。
装置中生成的离子方程式为 ______ 。
装置溶液采用结晶法提取晶体,控制温度为 ______ 填写范围减压蒸发结晶,趁热过滤,左右热水洗涤,低于条件下干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是 ______ 。
测定样品中的纯度。测定时进行如下实验:准确称取所得样品于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,在酸性条件下发生充分反应:,将所得混合液稀释成待测溶液。移取待测溶液于锥形瓶中,加几滴淀粉溶液,用的标准溶液滴定至终点,重复次,测得消耗标准溶液的体积平均值为。已知:
滴定终点的现象是 ______ 。
该样品中质量分数为 ______ 用含、、的代数式表示。
5.水是一种很好的溶剂,也是物质发生化学反应的主要介质。水中世界千千万,它与我们的生活、生产密切相关,请用所学知识,解决下列问题。
某温度下纯水中的,则此时溶液中的 ______ ;在该温度下,的溶液的 ______ ;
该温度下,某溶液中由水电离产生的和的乘积为,则该溶液的 ______ 。
室温下,在的某二元酸溶液中,含元素组分的物质的量分数随变化的关系如图所示:
写出的电离方程式 ______ 。
根据图象可知室温下的电离平衡常数的数值 ______ 。
等物质的量浓度和溶液等体积混合,比较混合后的溶液中、、的大小 ______ 。
已知时,的、。
向的溶液中逐滴滴加溶液,当溶液中时,溶液的 ______ 保留位小数;此时溶液中为 ______ 取整数。
时,用沉淀、两种金属离子,所需最低浓度的对数值与的关系如图所示,请回答:
时 ______ 。
时向的、浓度均为的混合溶液中逐滴加入溶液,当溶液加到时开始生成沉淀,则此时溶液中浓度为 ______ 。
答案和解析
1.【答案】 加热反应过程中硫单质熔化,则试管口应向上倾斜
【解析】解:中元素处于最低价态,只有还原性,故A正确;
B.中化合价处于中间价态,既有氧化性又有还原性,故B错误;
C.中元素处于中间价态,既有氧化性又有还原性,故C错误;
D.中元素处于最高价态,只有氧化性,故D错误;
故答案为:;
浓硫酸具有强氧化性,能与锌粒反应生成二氧化硫气体,不能用来制备氢气,故A错误;
B.浓硫酸能与灼热的木炭反应,浓硫酸具有强氧化性,氧化碳生成二氧化碳气体,本身被还原为二氧化硫,产生二氧化碳和二氧化硫气体,故B正确;
C.浓硫酸具有吸水性,能吸收部分气体中的水蒸气,在实验中常用作干燥剂故C正确;
D.常温下,铝、铁在浓硫酸中发生钝化现象,在金属表面形成一薄层致密氧化物薄膜,阻止反应继续进行,冷的浓硫酸可以用铁质或铝质容器储存,故D正确;
故答案为:;
铁与硫反应生成硫化亚铁,反应的化学方程式为:,
故答案为:;
已知硫的熔点为,沸点为,加热反应过程中硫单质熔化,则试管口应向上倾斜,
故答案为:加热反应过程中硫单质熔化,则试管口应向上倾斜;
,
故答案为:;
在制硫酸的生产中,若有吨硫黄最终全部转化为硫酸,硫元素守恒得到硫酸物质的量,硫酸质量,则可以制得质量分数为的浓硫酸质量,已知的硫酸密度为,计算此溶液的物质的量浓度,
故答案为:;;
已,元素化合价从升高到,变化,元素化合价从降到价,变化,最小公倍数为,所以硫化钾和硫酸钾得系数均为,的系数为,的系数为,根据原子个数守恒可得,
故答案为:,,,,,;;
氧化生成和,离子方程式为,转移,即,
故答案为:。
元素处于最高价时,只有氧化性,处于中间价态时既有氧化性又有还原性,处于最低价态时只有还原性;
浓硫酸具有强氧化性,能与锌粒反应生成二氧化硫气体;
B.浓硫酸能与灼热的木炭反应生成二氧化碳、二氧化硫和水;
C.浓硫酸具有吸水性,能吸收部分气体中的水蒸气;
D.常温下,铝、铁在浓硫酸中发生钝化现象;
铁与硫反应生成硫化亚铁;
棉花中的用于吸收反应过程中产生的二氧化硫,反应生成亚硫酸钠和水;
硫元素守恒计算所制得浓硫酸溶液的质量,物质的量浓度和溶质质量分数的换算公式为:;
硝酸钾和硫化钾反应,硫元素化合价升高,氮元素化合价降低,根据得失电子守恒可解答;
根据题干信息可知:反应物是和,有生成,反应中只有氮元素发生变价,据此计算。
本题考查了物质性质和应用、溶液浓度的计算应用、氧化还原反应等知识点,注意知识的熟练掌握,题目难度不大。
2.【答案】 易 和是非极性分子,根据相似相溶的原理,易溶于 放出
【解析】解:金属晶体中含有金属阳离子即正离子,所以含有金属阳离子的物质不一定是离子化合物,故A错误;
B.含有离子键的化合物是离子化合物,所以离子化合物中一定含有离子键,可能含有共价键,如,故B正确;
C.稀有气体为单原子构成的分子,不存在化学键,故C错误;
D.共价键形成的物质可能是共价化合物,也可能是单质,故D错误,
故选:;
由图可知,状态Ⅰ的能量高于状态Ⅲ,则和生成是放热反应,故A错误;
B.根据图知,在该过程中,未断键形成和,故B错误;
C.由图可知,和生成,放热反应,中、之间形成极性共价键,故C正确;
D.状态Ⅰ状态Ⅲ表示与反应的过程,故D错误,
故选:;
非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,和是非极性分子,根据相似相溶的原理,易溶于,
故答案为:易;和是非极性分子,根据相似相溶的原理,易溶于;
根据盖斯定律ⅠⅡ可得 ,
故答案为:;
受热熔化生成和,破坏的是离子键,氯化钠属于离子晶体,熔化时克服离子键,故A正确;
B.冰融化克服的分子间作用力,水分解破坏的是和之间的共价键,故B错误;
C.乙醇溶液水破坏分子间作用力,氯化氢溶液水电离生成氢离子与氯离子,破坏共价键,二者客服作用力不同,故C错误;
D.碘和干冰都是分子晶体,二者升华时都克服分子间作用力,所以克服相同类型作用力,故D正确,
故答案为:;
完全燃烧生成和液态水时放出热量,则完全燃烧生成和液态水时放出热量,则热化学方程式为: ,
故答案为: ;
分析图可知,反应一共经历步历程,依据图象差值分析,步骤的正反应活化能最大,速率最慢,为决速步骤,
故答案为:;;
由生成物的总能量反应物的总能量,则转化为需要放出的热量,
故答案为:放出;。
根据金属晶体中含有金属阳离子;
B.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
C.稀有气体中不存在化学键;
D.由共价键形成的物质可能为单质;
由图可知,状态Ⅰ的能量高于状态Ⅲ;
B.根据图知,在该过程中,未发生变化;
C.中、之间形成极性共价键;
D.该反应是和生成;
依据相似相溶的原理进行解答;
根据盖斯定律ⅠⅡ可得;
分子晶体中存在分子间作用力,离子晶体中存在离子键,原子晶体中存在共价键,金属晶体中存在金属键,根据晶体类型分析解答;
完全燃烧生成和液态水的方程式为,完全燃烧生成和液态水时放出热量,则完全燃烧生成和液态水时放出热量,据此写出热化学方程式;
分析图可知,反应一共经历步历程,依据图象差值分析最大活化能即决速步骤;
由生成物的总能量反应物的总能量。
本题考查盖斯定律、热化学方程式的书写和有关计算、化学键等,要学生有较强的读图理解能力,注意分析图象所给的已知条件进行计算是解题的关键。
3.【答案】 、 反应为吸热反应,升高温度平衡正向移动,平衡常数变大,由于,则
【解析】解:由图可知,氢气和二氧化碳反应生成甲烷和水,,
故答案为:;
甲烷、二氧化碳分子中含碳氢、碳氧极性键,分子为对称结构,正负电荷重心重合,为非极性分子,
故答案为:、;
生成甲醇的反应为放热、气体分子数减小的反应,则低温高压利于平衡正向移动,提高甲醇产率,
故答案为:;
反应气体分子数减小的反应,气体压强不再变化,说明反应达到平衡,故A正确;
B.物质的总质量不变,反应的气体分子数减小,则气体平均相对分子质量不再变化,说明反应达到平衡,故B正确;
C.和的物质的量之比为:,不能说明正逆反应速率相等,不能说明反应达到平衡,故C错误;
D.和的投料比等于反应的系数比,故物质的量之比为定值,其不会变化,不说明反应达到平衡,故D错误;
故答案为:;
一定条件下,向恒容密闭容器中充入和,只发生上述反应,达平衡时,的转化率为,则反应氢气,生成甲醇、水均为,反应后二氧化碳、氢气分别为、,则该温度下的平衡常数,
故答案为:;
进气比::,设投料均为,二氧化碳转化率为,则平衡后二氧化碳、氢气、一氧化碳、水分别为、、、,反应为气体分子数不变的反应,则此时;同理,,反应为吸热反应,升高温度平衡正向移动,平衡常数变大,故B和两点的温度,
故答案为:;反应为吸热反应,升高温度平衡正向移动,平衡常数变大,由于,则。
由图可知,氢气和二氧化碳反应生成甲烷和水;
甲烷、二氧化碳分子中含碳氢、碳氧极性键,结构对称、正负电荷重心重合的分子为非极性分子;
生成甲醇的反应为放热、气体分子数减小的反应;
反应气体分子数减小的反应;
B.物质的总质量不变,反应的气体分子数减小;
C.和的物质的量之比为:,不能说明正逆反应速率相等;
D.和的投料比等于反应的系数比,故物质的量之比为定值,其不会变化;
该温度下的平衡常数;
反应为吸热反应,升高温度平衡正向移动,平衡常数变大。
本题考查反应中的能量变化和化学平衡,侧重考查学生焓变、平衡状态判断、平衡常数计算和平衡移动的掌握情况,试题难度中等。
4.【答案】 稀硫酸含水多,而极易溶于水,不利于逸出 : 和 当滴入最后半滴标准液时,溶液有蓝色变为无色,且半分钟内不恢复
【解析】解:漂白剂有多种类型,从漂白原理来看,亚氯酸钠、、、漂白粉都具有强氧化性,可用于漂白,二氧化硫与有色物质发生化合反应结合成无色物质,活性炭是利用吸附性漂白,故与亚氯酸钠均属于同类型的漂白剂有、、漂白粉,
故答案为:;
装置利用浓硫酸、和制备,制备过程中应使用浓硫酸,若使用稀硫酸,反应过程中会带出少量水气,极易溶解生成的,影响后续的产率,
故答案为:稀硫酸含水多,而极易溶于水,不利于逸出;
中发生的反应为:,为氧化剂,为还原剂,氧化剂与还原剂物质的量之比为:,
故答案为::;
装置用于制备,反应中氧化同时与作用生成,反应的离子方程式为,
故答案为:;
根据已知条件在之间时蒸发结晶得到纯净的,不含有结晶水,也不会分解出杂质,因此实验中应选择进行减压蒸发结晶,反应后,经以下步骤可从装置的溶液获得晶体:蒸发结晶趁热过滤热水洗涤低于干燥,得到成品,如果干燥温度过高可能导致产品中混有的杂质是和,
故答案为:;和;
确认滴定终点的现象是当滴入最后半滴标准液时,溶液有蓝色变为无色,且半分钟内不恢复,
故答案为:当滴入最后半滴标准液时,溶液有蓝色变为无色,且半分钟内不恢复;
根据题意有关系式:,所以,所称取的样品中的质量分数为,
故答案为:。
本实验欲利用制备,根据实验装置,利用装置制备,装置用于缓冲,防止装置中的液体倒吸,装置用于的合成,装置和吸收废气,防止污染空气;
漂白剂有多种类型,从漂白原理来看,亚氯酸钠、、、漂白粉都具有强氧化性,可用于漂白,二氧化硫与有色物质发生化合反应结合成无色物质,活性炭是利用吸附性漂白;
装置利用浓硫酸、和制备,制备过程中应使用浓硫酸,若使用稀硫酸,反应过程中会带出少量水气;
中发生的反应为:,为氧化剂,为还原剂;
装置用于制备,反应中氧化同时与作用生成;
根据已知条件在之间时蒸发结晶得到纯净的;温度高于时分解成和;
滴定终点前溶液为蓝色,恰好反应时,溶液变为无色;
根据题意有关系式:,根据关系式进行计算即可。
本题考查物质的制备实验的分析,明确反应过程中操作的目的,发生的相关化学反应,正确运用化学原理知识分析解决问题是关键,整体难度中等,是中档题,试题有助于培养综合分析问题的能力。
5.【答案】 或 、
【解析】解:某温度下纯水中的,则水的离子积,该温度下的溶液,,,
故答案为:;;
纯水电离产生的,由水电离产生的和的乘积为,则水电离产生的,水的电离受到抑制,有酸抑制或碱抑制,则碱抑制时溶液的,酸抑制时溶液的,
故答案为:或;
由图可知,的溶液中,则一级电离完全,二级电离存在电离平衡,的电离方程式为、,
故答案为:、;
由图可知,时,此时的电离平衡常数的数值,
故答案为:;
等物质的量浓度和溶液等体积混合时溶液呈酸性,即的电离程度大于水解程度,则、、的大小关系为,
故答案为:;
当溶液中时,,,则,
故答案为:;;
由图可知,时,,
故答案为:;
由图可知,,向的、浓度均为的混合溶液中逐滴加入溶液,当溶液加到时,开始生成沉淀溶液中,此时溶液中,
故答案为:。
某温度下纯水中的,则水的离子积;
纯水电离产生的,由水电离产生的和的乘积为,则水电离产生的;
由图可知,的溶液中,则一级电离完全,二级电离存在电离平衡;
时,此时的电离平衡常数的数值;
等物质的量浓度和溶液等体积混合时溶液呈酸性,即的电离程度大于水解程度;
当溶液中时,,则;
;
由图可知,,向的、浓度均为的混合溶液中逐滴加入溶液,当溶液加到时,开始生成沉淀溶液中,结合计算。
本题考查了沉淀溶解平衡曲线分析、弱电解质的电离,侧重于学生的分析能力、计算能力和灵活运用能力的考查,把握图线中水的电离及水的离子积的计算、电离平衡常数的计算、溶度积常数的计算是解题的关键,题目难度中等。
第1页,共1页
1.硫是重要的非金属元素,也是人类较早认识的化学元素之一。自然界中的硫元素主要以单质硫、硫化物和硫酸盐等形式存在。
下列物质中的硫元素不能表现出氧化性的是 ______ 单选。
A.
B.
C.
D.
下列有关浓硫酸的说法中,不正确的是 ______ 单选。
A.浓硫酸能与锌粒反应制备氢气
B.浓硫酸能与灼热的木炭反应,产生二氧化碳和二氧化硫气体
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
将铁粉与硫粉在研钵中充分混合后装入试管中,在试管口塞上带长导管的橡皮塞,并在导管末端放入一小团蘸有溶液的棉花,加热试管。
写出铁与硫反应的化学方程式 ______ 。
已知硫的熔点为,沸点为,解释试管口为什么向上倾斜 ______ 。
棉花中的用于吸收反应过程中产生的二氧化硫,写出该反应的离子方程式 ______ 。
工业上通常用接触法制硫酸。在制硫酸的生产中,若有吨硫黄最终全部转化为硫酸,则可以制得质量分数为的浓硫酸为 ______ 吨。已知的硫酸密度为,计算此溶液的物质的量浓度为 ______ 。
氮循环是大气中的氮气经微生物等作用进入土壤与海洋,为动植物所利用,最终又在微生物的参与下返回大气,如此反复循环,建立起的平衡。
土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下: ______ ______ ______ ______ ______ ______ 。配平上述反应方程式,并标出电子转移的方向和数目 ______ 。
氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生氮气时,转移电子的物质的量为 ______ 。
2.年,我国明确提出“碳达峰”与“碳中和”,研究碳元素的综合利用对这一宏伟目标的实现具有现实意义。
下列关于化学键与化合物的叙述正确的是 ______ 单选。
A.含有正离子的物质一定是离子化合物
B.离子化合物中一定含有离子键,可能含有共价键
C.分子晶体中一定含有共价键,不含离子键
D.只由共价键形成的物质一定是共价化合物
最新报道:科学家首次用射线激光技术观察到与在催化剂表面形成化学键的过程。反应过程的示意图如图:
下列说法中正确的是 ______ 单选。
A.和生成是吸热反应
B.在该过程中,断键形成和
C.和生成了具有极性共价键的
D.状态Ⅰ状态Ⅲ表示与反应的过程
______ 填写“难”或“易”溶于,主要原因是 ______ 。
沼气是一种能源,它的主要成分是,已知:
Ⅰ:
Ⅱ:
则由和制取气态甲醇的热化学方程式:中 ______ 。
实现下列变化,需克服相同类型作用力的是 ______ 双选。
A.硫酸氢钠和氯化钠分别受热熔化
B.冰的融化和水的分解
C.乙醇和溶于水
D.干冰和碘的升华
常温下,完全燃烧生成和液态水时,放出热量,则该反应的热化学方程式为 ______ 。
一定条件下,分解形成碳的反应历程如图所示。该历程分 ______ 步进行,其中,第 ______ 步的是决速步骤。
已知时,相关物质的相对能量如表所示;
物质
相对能量
转化为需要 ______ 填“吸收”或“放出” ______ 的热量。
3.空间站还原转化系统能把呼出的捕集、分离并与空间站电解水系统产生的进行加氢处理,从而实现空间站内物料的循环利用。
如图,可以借助光将转化为,该转化过程总反应的化学方程式是 ______ 。
图中所示的各物质中,含有极性共价键的非极性分子是 ______ 填化学式。
一定条件下,和还可发生如下两个平行反应:
为了提高的产率,理论上应采用的措施是 ______ 单选。
A.低温低压
B.高温低压
C.高温高压
D.低温高压
保持温度、压强,按投料比向容器中充入和,反应相同时间测得不同催化剂下转化率和选择性的相关实验数据如表所示已知选择性:转化的中生成的百分比。
催化剂 转化率 选择性
催化剂
催化剂
上述条件下,使用催化剂作催化剂,下列说法能判断反应达到平衡状态的是 ______ 单选。
A.气体压强不再变化
B.气体平均相对分子质量不再变化
C.和的物质的量之比为:
D.和的物质的量之比不再变化
一定条件下,向恒容密闭容器中充入和,只发生上述反应,达平衡时,的转化率为,则该温度下的平衡常数 ______ 保留两位小数。
若恒容密闭容器中只发生上述反应,在进气比:不同、温度不同时,测得相应的平衡转化率如图所示。则和两点的温度 ______ 填“”、“”或“”,其原因是 ______ 。
4.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白以及食品消毒、水处理、杀菌灭藻和鱼药制造。某校化学实验探究小组设计如图实验,用为原料制备亚氯酸钠。
已知:
饱和溶液中析出的晶体成分与温度的关系如表所示:
温度
晶体成分 分解成和
极易溶于水,不与水反应,沸点。
漂白剂有多种类型,从漂白原理来看,与亚氯酸钠均属于同类型的漂白剂有 ______ 单选。
A.、
B.活性炭、
C.漂白粉、
D.、
中使用浓硫酸而不用稀硫酸的原因是 ______ 。
中发生的反应,氧化剂与还原剂物质的量之比为 ______ 。
装置中生成的离子方程式为 ______ 。
装置溶液采用结晶法提取晶体,控制温度为 ______ 填写范围减压蒸发结晶,趁热过滤,左右热水洗涤,低于条件下干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是 ______ 。
测定样品中的纯度。测定时进行如下实验:准确称取所得样品于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,在酸性条件下发生充分反应:,将所得混合液稀释成待测溶液。移取待测溶液于锥形瓶中,加几滴淀粉溶液,用的标准溶液滴定至终点,重复次,测得消耗标准溶液的体积平均值为。已知:
滴定终点的现象是 ______ 。
该样品中质量分数为 ______ 用含、、的代数式表示。
5.水是一种很好的溶剂,也是物质发生化学反应的主要介质。水中世界千千万,它与我们的生活、生产密切相关,请用所学知识,解决下列问题。
某温度下纯水中的,则此时溶液中的 ______ ;在该温度下,的溶液的 ______ ;
该温度下,某溶液中由水电离产生的和的乘积为,则该溶液的 ______ 。
室温下,在的某二元酸溶液中,含元素组分的物质的量分数随变化的关系如图所示:
写出的电离方程式 ______ 。
根据图象可知室温下的电离平衡常数的数值 ______ 。
等物质的量浓度和溶液等体积混合,比较混合后的溶液中、、的大小 ______ 。
已知时,的、。
向的溶液中逐滴滴加溶液,当溶液中时,溶液的 ______ 保留位小数;此时溶液中为 ______ 取整数。
时,用沉淀、两种金属离子,所需最低浓度的对数值与的关系如图所示,请回答:
时 ______ 。
时向的、浓度均为的混合溶液中逐滴加入溶液,当溶液加到时开始生成沉淀,则此时溶液中浓度为 ______ 。
答案和解析
1.【答案】 加热反应过程中硫单质熔化,则试管口应向上倾斜
【解析】解:中元素处于最低价态,只有还原性,故A正确;
B.中化合价处于中间价态,既有氧化性又有还原性,故B错误;
C.中元素处于中间价态,既有氧化性又有还原性,故C错误;
D.中元素处于最高价态,只有氧化性,故D错误;
故答案为:;
浓硫酸具有强氧化性,能与锌粒反应生成二氧化硫气体,不能用来制备氢气,故A错误;
B.浓硫酸能与灼热的木炭反应,浓硫酸具有强氧化性,氧化碳生成二氧化碳气体,本身被还原为二氧化硫,产生二氧化碳和二氧化硫气体,故B正确;
C.浓硫酸具有吸水性,能吸收部分气体中的水蒸气,在实验中常用作干燥剂故C正确;
D.常温下,铝、铁在浓硫酸中发生钝化现象,在金属表面形成一薄层致密氧化物薄膜,阻止反应继续进行,冷的浓硫酸可以用铁质或铝质容器储存,故D正确;
故答案为:;
铁与硫反应生成硫化亚铁,反应的化学方程式为:,
故答案为:;
已知硫的熔点为,沸点为,加热反应过程中硫单质熔化,则试管口应向上倾斜,
故答案为:加热反应过程中硫单质熔化,则试管口应向上倾斜;
,
故答案为:;
在制硫酸的生产中,若有吨硫黄最终全部转化为硫酸,硫元素守恒得到硫酸物质的量,硫酸质量,则可以制得质量分数为的浓硫酸质量,已知的硫酸密度为,计算此溶液的物质的量浓度,
故答案为:;;
已,元素化合价从升高到,变化,元素化合价从降到价,变化,最小公倍数为,所以硫化钾和硫酸钾得系数均为,的系数为,的系数为,根据原子个数守恒可得,
故答案为:,,,,,;;
氧化生成和,离子方程式为,转移,即,
故答案为:。
元素处于最高价时,只有氧化性,处于中间价态时既有氧化性又有还原性,处于最低价态时只有还原性;
浓硫酸具有强氧化性,能与锌粒反应生成二氧化硫气体;
B.浓硫酸能与灼热的木炭反应生成二氧化碳、二氧化硫和水;
C.浓硫酸具有吸水性,能吸收部分气体中的水蒸气;
D.常温下,铝、铁在浓硫酸中发生钝化现象;
铁与硫反应生成硫化亚铁;
棉花中的用于吸收反应过程中产生的二氧化硫,反应生成亚硫酸钠和水;
硫元素守恒计算所制得浓硫酸溶液的质量,物质的量浓度和溶质质量分数的换算公式为:;
硝酸钾和硫化钾反应,硫元素化合价升高,氮元素化合价降低,根据得失电子守恒可解答;
根据题干信息可知:反应物是和,有生成,反应中只有氮元素发生变价,据此计算。
本题考查了物质性质和应用、溶液浓度的计算应用、氧化还原反应等知识点,注意知识的熟练掌握,题目难度不大。
2.【答案】 易 和是非极性分子,根据相似相溶的原理,易溶于 放出
【解析】解:金属晶体中含有金属阳离子即正离子,所以含有金属阳离子的物质不一定是离子化合物,故A错误;
B.含有离子键的化合物是离子化合物,所以离子化合物中一定含有离子键,可能含有共价键,如,故B正确;
C.稀有气体为单原子构成的分子,不存在化学键,故C错误;
D.共价键形成的物质可能是共价化合物,也可能是单质,故D错误,
故选:;
由图可知,状态Ⅰ的能量高于状态Ⅲ,则和生成是放热反应,故A错误;
B.根据图知,在该过程中,未断键形成和,故B错误;
C.由图可知,和生成,放热反应,中、之间形成极性共价键,故C正确;
D.状态Ⅰ状态Ⅲ表示与反应的过程,故D错误,
故选:;
非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,和是非极性分子,根据相似相溶的原理,易溶于,
故答案为:易;和是非极性分子,根据相似相溶的原理,易溶于;
根据盖斯定律ⅠⅡ可得 ,
故答案为:;
受热熔化生成和,破坏的是离子键,氯化钠属于离子晶体,熔化时克服离子键,故A正确;
B.冰融化克服的分子间作用力,水分解破坏的是和之间的共价键,故B错误;
C.乙醇溶液水破坏分子间作用力,氯化氢溶液水电离生成氢离子与氯离子,破坏共价键,二者客服作用力不同,故C错误;
D.碘和干冰都是分子晶体,二者升华时都克服分子间作用力,所以克服相同类型作用力,故D正确,
故答案为:;
完全燃烧生成和液态水时放出热量,则完全燃烧生成和液态水时放出热量,则热化学方程式为: ,
故答案为: ;
分析图可知,反应一共经历步历程,依据图象差值分析,步骤的正反应活化能最大,速率最慢,为决速步骤,
故答案为:;;
由生成物的总能量反应物的总能量,则转化为需要放出的热量,
故答案为:放出;。
根据金属晶体中含有金属阳离子;
B.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
C.稀有气体中不存在化学键;
D.由共价键形成的物质可能为单质;
由图可知,状态Ⅰ的能量高于状态Ⅲ;
B.根据图知,在该过程中,未发生变化;
C.中、之间形成极性共价键;
D.该反应是和生成;
依据相似相溶的原理进行解答;
根据盖斯定律ⅠⅡ可得;
分子晶体中存在分子间作用力,离子晶体中存在离子键,原子晶体中存在共价键,金属晶体中存在金属键,根据晶体类型分析解答;
完全燃烧生成和液态水的方程式为,完全燃烧生成和液态水时放出热量,则完全燃烧生成和液态水时放出热量,据此写出热化学方程式;
分析图可知,反应一共经历步历程,依据图象差值分析最大活化能即决速步骤;
由生成物的总能量反应物的总能量。
本题考查盖斯定律、热化学方程式的书写和有关计算、化学键等,要学生有较强的读图理解能力,注意分析图象所给的已知条件进行计算是解题的关键。
3.【答案】 、 反应为吸热反应,升高温度平衡正向移动,平衡常数变大,由于,则
【解析】解:由图可知,氢气和二氧化碳反应生成甲烷和水,,
故答案为:;
甲烷、二氧化碳分子中含碳氢、碳氧极性键,分子为对称结构,正负电荷重心重合,为非极性分子,
故答案为:、;
生成甲醇的反应为放热、气体分子数减小的反应,则低温高压利于平衡正向移动,提高甲醇产率,
故答案为:;
反应气体分子数减小的反应,气体压强不再变化,说明反应达到平衡,故A正确;
B.物质的总质量不变,反应的气体分子数减小,则气体平均相对分子质量不再变化,说明反应达到平衡,故B正确;
C.和的物质的量之比为:,不能说明正逆反应速率相等,不能说明反应达到平衡,故C错误;
D.和的投料比等于反应的系数比,故物质的量之比为定值,其不会变化,不说明反应达到平衡,故D错误;
故答案为:;
一定条件下,向恒容密闭容器中充入和,只发生上述反应,达平衡时,的转化率为,则反应氢气,生成甲醇、水均为,反应后二氧化碳、氢气分别为、,则该温度下的平衡常数,
故答案为:;
进气比::,设投料均为,二氧化碳转化率为,则平衡后二氧化碳、氢气、一氧化碳、水分别为、、、,反应为气体分子数不变的反应,则此时;同理,,反应为吸热反应,升高温度平衡正向移动,平衡常数变大,故B和两点的温度,
故答案为:;反应为吸热反应,升高温度平衡正向移动,平衡常数变大,由于,则。
由图可知,氢气和二氧化碳反应生成甲烷和水;
甲烷、二氧化碳分子中含碳氢、碳氧极性键,结构对称、正负电荷重心重合的分子为非极性分子;
生成甲醇的反应为放热、气体分子数减小的反应;
反应气体分子数减小的反应;
B.物质的总质量不变,反应的气体分子数减小;
C.和的物质的量之比为:,不能说明正逆反应速率相等;
D.和的投料比等于反应的系数比,故物质的量之比为定值,其不会变化;
该温度下的平衡常数;
反应为吸热反应,升高温度平衡正向移动,平衡常数变大。
本题考查反应中的能量变化和化学平衡,侧重考查学生焓变、平衡状态判断、平衡常数计算和平衡移动的掌握情况,试题难度中等。
4.【答案】 稀硫酸含水多,而极易溶于水,不利于逸出 : 和 当滴入最后半滴标准液时,溶液有蓝色变为无色,且半分钟内不恢复
【解析】解:漂白剂有多种类型,从漂白原理来看,亚氯酸钠、、、漂白粉都具有强氧化性,可用于漂白,二氧化硫与有色物质发生化合反应结合成无色物质,活性炭是利用吸附性漂白,故与亚氯酸钠均属于同类型的漂白剂有、、漂白粉,
故答案为:;
装置利用浓硫酸、和制备,制备过程中应使用浓硫酸,若使用稀硫酸,反应过程中会带出少量水气,极易溶解生成的,影响后续的产率,
故答案为:稀硫酸含水多,而极易溶于水,不利于逸出;
中发生的反应为:,为氧化剂,为还原剂,氧化剂与还原剂物质的量之比为:,
故答案为::;
装置用于制备,反应中氧化同时与作用生成,反应的离子方程式为,
故答案为:;
根据已知条件在之间时蒸发结晶得到纯净的,不含有结晶水,也不会分解出杂质,因此实验中应选择进行减压蒸发结晶,反应后,经以下步骤可从装置的溶液获得晶体:蒸发结晶趁热过滤热水洗涤低于干燥,得到成品,如果干燥温度过高可能导致产品中混有的杂质是和,
故答案为:;和;
确认滴定终点的现象是当滴入最后半滴标准液时,溶液有蓝色变为无色,且半分钟内不恢复,
故答案为:当滴入最后半滴标准液时,溶液有蓝色变为无色,且半分钟内不恢复;
根据题意有关系式:,所以,所称取的样品中的质量分数为,
故答案为:。
本实验欲利用制备,根据实验装置,利用装置制备,装置用于缓冲,防止装置中的液体倒吸,装置用于的合成,装置和吸收废气,防止污染空气;
漂白剂有多种类型,从漂白原理来看,亚氯酸钠、、、漂白粉都具有强氧化性,可用于漂白,二氧化硫与有色物质发生化合反应结合成无色物质,活性炭是利用吸附性漂白;
装置利用浓硫酸、和制备,制备过程中应使用浓硫酸,若使用稀硫酸,反应过程中会带出少量水气;
中发生的反应为:,为氧化剂,为还原剂;
装置用于制备,反应中氧化同时与作用生成;
根据已知条件在之间时蒸发结晶得到纯净的;温度高于时分解成和;
滴定终点前溶液为蓝色,恰好反应时,溶液变为无色;
根据题意有关系式:,根据关系式进行计算即可。
本题考查物质的制备实验的分析,明确反应过程中操作的目的,发生的相关化学反应,正确运用化学原理知识分析解决问题是关键,整体难度中等,是中档题,试题有助于培养综合分析问题的能力。
5.【答案】 或 、
【解析】解:某温度下纯水中的,则水的离子积,该温度下的溶液,,,
故答案为:;;
纯水电离产生的,由水电离产生的和的乘积为,则水电离产生的,水的电离受到抑制,有酸抑制或碱抑制,则碱抑制时溶液的,酸抑制时溶液的,
故答案为:或;
由图可知,的溶液中,则一级电离完全,二级电离存在电离平衡,的电离方程式为、,
故答案为:、;
由图可知,时,此时的电离平衡常数的数值,
故答案为:;
等物质的量浓度和溶液等体积混合时溶液呈酸性,即的电离程度大于水解程度,则、、的大小关系为,
故答案为:;
当溶液中时,,,则,
故答案为:;;
由图可知,时,,
故答案为:;
由图可知,,向的、浓度均为的混合溶液中逐滴加入溶液,当溶液加到时,开始生成沉淀溶液中,此时溶液中,
故答案为:。
某温度下纯水中的,则水的离子积;
纯水电离产生的,由水电离产生的和的乘积为,则水电离产生的;
由图可知,的溶液中,则一级电离完全,二级电离存在电离平衡;
时,此时的电离平衡常数的数值;
等物质的量浓度和溶液等体积混合时溶液呈酸性,即的电离程度大于水解程度;
当溶液中时,,则;
;
由图可知,,向的、浓度均为的混合溶液中逐滴加入溶液,当溶液加到时,开始生成沉淀溶液中,结合计算。
本题考查了沉淀溶解平衡曲线分析、弱电解质的电离,侧重于学生的分析能力、计算能力和灵活运用能力的考查,把握图线中水的电离及水的离子积的计算、电离平衡常数的计算、溶度积常数的计算是解题的关键,题目难度中等。
第1页,共1页
同课章节目录
