4.1.3原子结构与元素性质课件(共39张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.3原子结构与元素性质课件(共39张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 27.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 20:12:33 | ||
图片预览






文档简介
(共39张PPT)
组织建设
第一节 原子结构与元素周期表
(第3课时 原子结构与元素性质)
第四章 物质结构 元素周期律
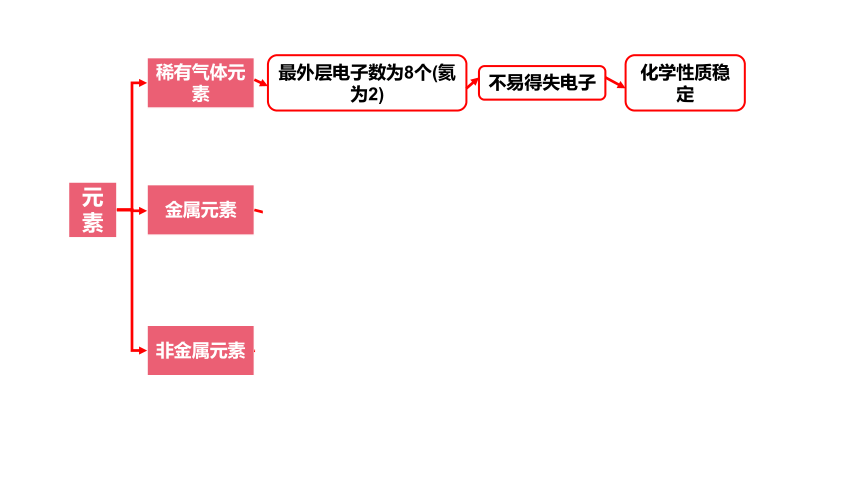
元素
稀有气体元素
金属元素
最外层电子数一般少于4个
非金属元素
最外层电子数为8个(氦为2)
最外层电子数一般多于4个
易失电子
不易得失电子
易得电子
化学性质不稳定
化学性质稳定
化学性质不稳定
金属性:失电子的能力
非金属性:得电子得能力
(1)最外层电子数为2的元素一定为金属元素( )
(2)金属元素的最外层电子数一定小于4( )
(3)非金属元素原子都易得电子( )
×
×
正误判断
×
步步高蓝本P96
8.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是a-b,L层电子数是a+b,则A、B两元素形成化合物的化学式最可能表示为
A.B3A2 B.BA2
C.A3B2 D.AB2
√
练透P179
应用体验
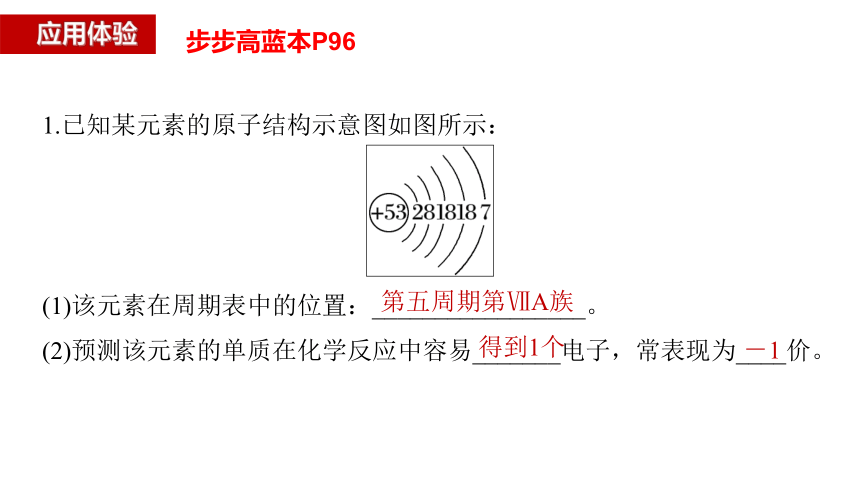
1.已知某元素的原子结构示意图如图所示:
(1)该元素在周期表中的位置:_________________。
(2)预测该元素的单质在化学反应中容易_______电子,常表现为____价。
第五周期第ⅦA族
得到1个
-1
步步高蓝本P96
碱金属
卤素
两类化学性质活泼的元素
在自然界都以化合态存在
元素:金属性
单质:还原性
元素:非金属性
单质:氧化性
Li
Rb
Na
1、比较柔软,有延展性;
2、密度都比较小;熔点也都比较低;
3、导热性和导电性也都很好,如液态钠可用作核反应。
一、碱金属单质的物理性质
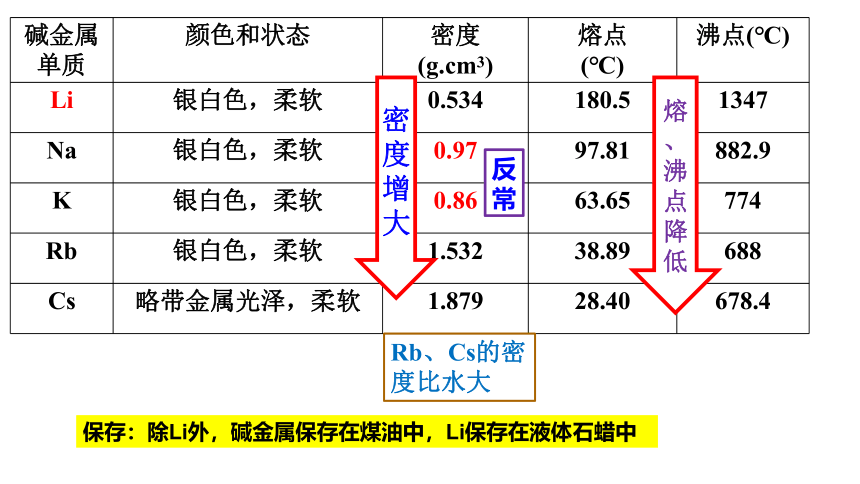
碱金属单质 颜色和状态 密度 (g.cm3) 熔点 (℃) 沸点(℃)
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
反常
熔
、沸点降低
密度增大
Rb、Cs的密度比水大
保存:除Li外,碱金属保存在煤油中,Li保存在液体石蜡中
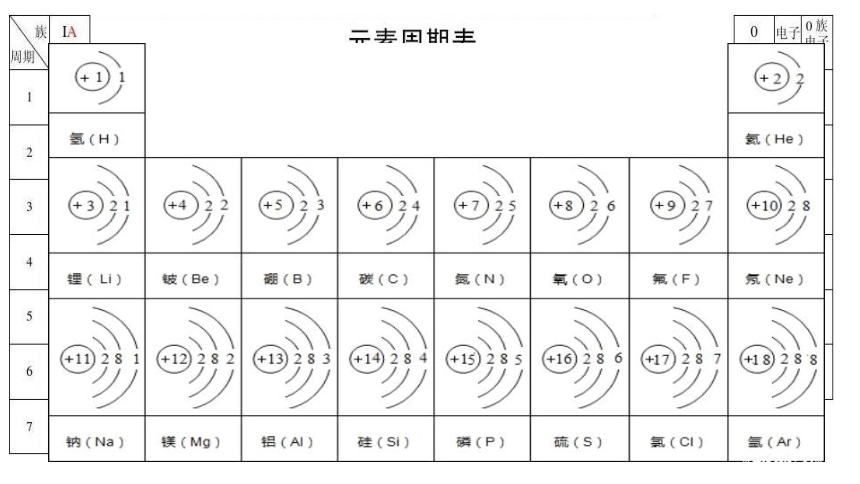
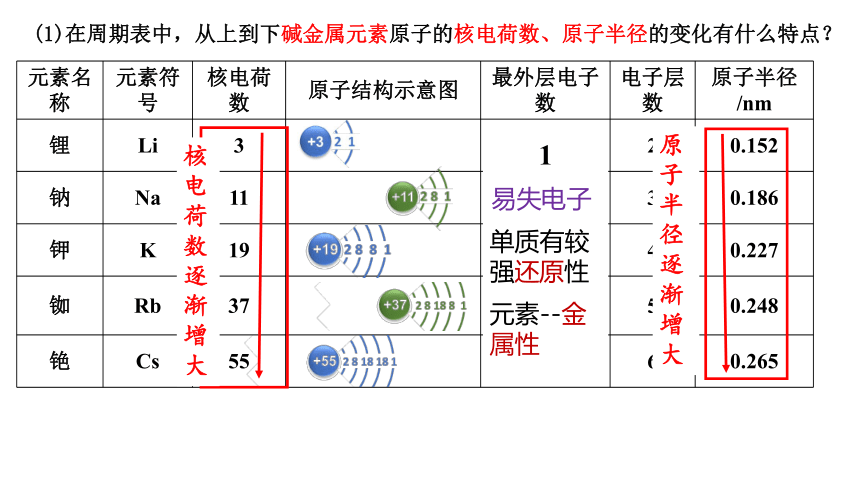
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径/nm
锂 Li 3 2 0.152
钠 Na 11 3 0.186
钾 K 19 4 0.227
铷 Rb 37 5 0.248
铯 Cs 55 6 0.265
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
1
核电荷数逐渐增大
原子半径逐渐增大
单质有较强还原性
易失电子
元素--金属性
二、化学性质
(1)碱金属与氧气反应
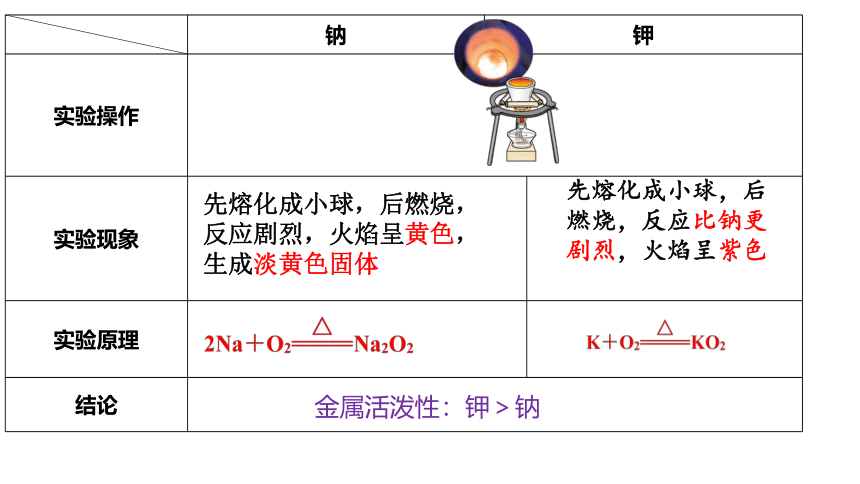
钠 钾 实验操作 实验现象
实验原理
结论 先熔化成小球,后燃烧,反应剧烈,火焰呈黄色,生成淡黄色固体
先熔化成小球,后燃烧,反应比钠更剧烈,火焰呈紫色
金属活泼性:钾>钠
4Li + O2 === Li2O
△
(1)碱金属与氧气反应:
2Na +O2 == Na2O2 (淡黄色)
△
二、碱金属元素的化学性质(相似性)
K + O2 多种氧化物 (eg:KO2超氧化钾)
→
△
(2)碱金属与水反应:
M=Li、Na、K、Rb、Cs
2M+2H2O=2MOH+H2↑
浮
熔
游
响
红(加酚酞试剂)
蓝(加石蕊试剂)
K、Na与水反应现象
Rb、Cs的密度比水大,遇水后沉在水底与水反应
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
(3)碱金属与酸反应:
2K+2H+=2K++H2↑
M=Li、Na、K、Rb、Cs
(4)碱金属与盐反应:先与水反应生成碱与氢气
再与盐反应生成新碱与新盐(复分解反应)
2Na+2H+=2Na++H2↑
2M+2H+=2M++H2↑
Li
Na
K
Rb
Cs
核电荷数增加,电子层数增加
原子半径增加,原子核对最外层电子吸引力减弱
原子失电子能力增强,元素金属性增强
单质还原性增强 : Li < Na < K < Rb < Cs
对应的离子(M+)氧化性减弱 : Li+ > Na+ > K+ > Rb+ > Cs+
三、金属性强弱的判断标志(教材P101)
一般情况下,
元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难以程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来判断。
** 置换反应:金属性强的金属能置换金属性弱的金属
【练习】3.下列说法中正确的是( )
A.碱性:LiOH>NaOH>KOH>RbOH
B.金属性:Rb>K>Na>Li
C.Fe、Na分别和稀盐酸反应时,每个铁原子失去2个电子,每个
钠原子失去1个电子,所以Fe的金属活动性强于Na
D.Rb不易与水反应放出H2
B
8.以下关于锂、钠、钾、铷、铯的叙述不正确的是
①对应的氢氧化物中,碱性最强的是CsOH
②单质熔点最高的是铯
③与O2反应均可得到多种氧化物
④单质的密度依次增大
⑤单质的还原性依次增强
⑥对应阳离子的氧化性依次增强
A.①③⑤ B.②④⑥ C.②③④⑥ D.①⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
练透P184
卤素单质 颜色(常态) 密度 熔点/℃ 沸点/℃
F2 淡黄绿色(气体) 1.69 g/L(15℃) 219.6 188.1
Cl2 黄绿色(气体) 3.124 g/L(0℃) 101 34.6
Br2 深红棕色(液体) 3.119 g/cm3(20℃) 7.2 58.78
I2 紫黑色(固体) 4.93 g/cm3 113.5 184.4
颜色假声
颜色加深
颜色假声
密度增大
颜色假声
熔
、沸点增大
一、卤素单质的物理性质
常温下,Br2是唯一的液态非金属单质,且易挥发;I2易升华
有毒,能溶于水,
易溶于四氯化碳(CCl4)
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径/nm
氟 F 9 2 0.071
氯 Cl 17 3 0.099
溴 Br 35 4 1.14
碘 I 53 5 1.33
(1)在周期表中,从上到下卤族元素原子的核电荷数、原子半径的变化有什么特点?
核电荷数逐渐增大
原子半径逐渐增大
7
单质有较强氧化性
易得电子
元素 -- 非金属性
二、卤素单质的化学性质
(1)与金属反应(化合反应)
2Fe+3Br2=2FeBr3
I2+Fe=FeI2
2Fe+3Cl2=2FeCl3
(2)与氢气反应
X2 + H2 = 2HX
(X——F、Cl、Br、I)
稳定性:HF > HCl > HBr > HI
弱酸
(3)与水反应
Cl2+H2O==HCl+HClO
X2+H2O==HX+HXO (X-Cl、Br、I)
2F2+2H2O=4HF+O2 (特例)
Br2+H2O==HBr+HBrO
(4)与碱反应
Cl2+2NaOH=NaCl+NaClO+H2O
X2+2NaOH=NaX+NaXO+H2O (X-Cl、Br、I)
F
Cl
Br
I
核电荷数增加,电子层数增加
原子半径增加,原子核对最外层电子吸引力减弱
原子得电子能力减弱,元素非金属性减弱
单质氧化性减弱 : F2 > Cl2 > Br2 > I2
对应的离子(M+)还原性增强 : F- < Cl- < Br- < I-
三、非金属性强弱的判断标志(教材P103)
一般情况下,
元素的非金属性强弱可以从其最高价氧化物的水化物的酸性强弱,或与氢气生成的气态氢化物的难易程度及其稳定性来判断。
** 置换反应:非金属性强的元素能置换非金属性弱
HClO4>HBrO4>HIO4
4.不能说明氧的非金属性比硫强的事实是
A.H2O的热稳定性强于H2S
B.H2S水溶液暴露于空气中变浑浊
C.常温下H2O是液体,H2S是气体
D.O2和H2化合比S和H2化合容易
√
步步高P100
2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
结论: 氧化性 : Cl2 > Br2 > I2
非金属性 : Cl > Br > I
(二)卤素离子的沉淀现象
AgF AgCl AgBr AgI
颜 色 白色 白色 浅黄色 黄色
逐 渐 加 深 溶解性 易溶于水 难溶于水,也难溶于稀HNO3 感光性 见光分解: 2AgX 2Ag + X2 (X=Cl、Br、I) 用 途 ①检验X-:Ag+ + X-=AgX↓(试剂为AgNO3溶液和稀HNO3) ②制作感光材料(常用AgBr) ③AgI用于人工降雨 Ag+ + X-=AgX↓ (X - Cl、Br、I)
Ag+ + Cl-=AgCl↓
【练习】下列说法正确的是( )
A.氟、氯、溴原子的最外层电子数都是7,次外层电子数都是8
B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
C.酸性:HFO4>HClO4>HBrO4>HIO4
D.砹是原子序数最大的卤族元素,根据卤素性质的相似性,砹微溶于水,易溶于CCl4
D
9.卤族元素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,原子半径依次减小
C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力
依次减弱
D.卤素单质与H2化合的难易程度由难到易的顺序为F2、Cl2、Br2、I2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
练透184
3.下列事实不能说明X元素比Y元素的非金属性强的是
①与H2化合时,X单质比Y单质容易
②X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强
③X原子的最外层电子数比Y原子的最外层电子数多
④X单质可以把Y从其氢化物中置换出来
⑤X元素的最高正价比Y的高
⑥气态氢化物溶于水后的酸性:X强于Y
A.②⑤⑥ B.③④⑥ C.①④⑥ D.③⑤⑥
√
步步高P100
拓展:同主族元素原子结构与性质的关系
最外层电子数相同
同主族元素由上到下原子半径依次增大
化学性质相似
原子得电子能力依次 ,
原子失电子能力依次 ,
元素金属性 ,
元素非金属性 。
F
Cl
Br
I
At
Li
Na
K
Rb
Cs
减弱
增强
减弱
增强
最强碱:CsOH
最强酸:HClO4
H
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
金属性逐渐增强
非金属性逐渐增强
金属性最强
非金属性最强
最强碱:CsOH
最强酸:HClO4
1.已知铍(Be)的原子序数为4,下列关于铍及其化合物的叙述正确的是
A.铍的金属性比镁强
B.氯化镁的氧化性比氯化铍强
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍易和冷水反应产生氢气
√
步步高P100
2.含有元素硒(Se)的保健品已开始进入市场。已知它是第四周期第ⅥA族元素。则下列关于硒的叙述正确的是
A.非金属性比硫强
B.气态氢化物的化学式为H2Se
C.稳定性:H2Se>H2O
D.最高价氧化物的化学式是SeO2
√
步步高P99 随堂演练
5.下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2-A.①③ B.②④ C.③⑤ D.④⑤
√
组织建设
第一节 原子结构与元素周期表
(第3课时 原子结构与元素性质)
第四章 物质结构 元素周期律
元素
稀有气体元素
金属元素
最外层电子数一般少于4个
非金属元素
最外层电子数为8个(氦为2)
最外层电子数一般多于4个
易失电子
不易得失电子
易得电子
化学性质不稳定
化学性质稳定
化学性质不稳定
金属性:失电子的能力
非金属性:得电子得能力
(1)最外层电子数为2的元素一定为金属元素( )
(2)金属元素的最外层电子数一定小于4( )
(3)非金属元素原子都易得电子( )
×
×
正误判断
×
步步高蓝本P96
8.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是a-b,L层电子数是a+b,则A、B两元素形成化合物的化学式最可能表示为
A.B3A2 B.BA2
C.A3B2 D.AB2
√
练透P179
应用体验
1.已知某元素的原子结构示意图如图所示:
(1)该元素在周期表中的位置:_________________。
(2)预测该元素的单质在化学反应中容易_______电子,常表现为____价。
第五周期第ⅦA族
得到1个
-1
步步高蓝本P96
碱金属
卤素
两类化学性质活泼的元素
在自然界都以化合态存在
元素:金属性
单质:还原性
元素:非金属性
单质:氧化性
Li
Rb
Na
1、比较柔软,有延展性;
2、密度都比较小;熔点也都比较低;
3、导热性和导电性也都很好,如液态钠可用作核反应。
一、碱金属单质的物理性质
碱金属单质 颜色和状态 密度 (g.cm3) 熔点 (℃) 沸点(℃)
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
反常
熔
、沸点降低
密度增大
Rb、Cs的密度比水大
保存:除Li外,碱金属保存在煤油中,Li保存在液体石蜡中
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径/nm
锂 Li 3 2 0.152
钠 Na 11 3 0.186
钾 K 19 4 0.227
铷 Rb 37 5 0.248
铯 Cs 55 6 0.265
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
1
核电荷数逐渐增大
原子半径逐渐增大
单质有较强还原性
易失电子
元素--金属性
二、化学性质
(1)碱金属与氧气反应
钠 钾 实验操作 实验现象
实验原理
结论 先熔化成小球,后燃烧,反应剧烈,火焰呈黄色,生成淡黄色固体
先熔化成小球,后燃烧,反应比钠更剧烈,火焰呈紫色
金属活泼性:钾>钠
4Li + O2 === Li2O
△
(1)碱金属与氧气反应:
2Na +O2 == Na2O2 (淡黄色)
△
二、碱金属元素的化学性质(相似性)
K + O2 多种氧化物 (eg:KO2超氧化钾)
→
△
(2)碱金属与水反应:
M=Li、Na、K、Rb、Cs
2M+2H2O=2MOH+H2↑
浮
熔
游
响
红(加酚酞试剂)
蓝(加石蕊试剂)
K、Na与水反应现象
Rb、Cs的密度比水大,遇水后沉在水底与水反应
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
(3)碱金属与酸反应:
2K+2H+=2K++H2↑
M=Li、Na、K、Rb、Cs
(4)碱金属与盐反应:先与水反应生成碱与氢气
再与盐反应生成新碱与新盐(复分解反应)
2Na+2H+=2Na++H2↑
2M+2H+=2M++H2↑
Li
Na
K
Rb
Cs
核电荷数增加,电子层数增加
原子半径增加,原子核对最外层电子吸引力减弱
原子失电子能力增强,元素金属性增强
单质还原性增强 : Li < Na < K < Rb < Cs
对应的离子(M+)氧化性减弱 : Li+ > Na+ > K+ > Rb+ > Cs+
三、金属性强弱的判断标志(教材P101)
一般情况下,
元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难以程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来判断。
** 置换反应:金属性强的金属能置换金属性弱的金属
【练习】3.下列说法中正确的是( )
A.碱性:LiOH>NaOH>KOH>RbOH
B.金属性:Rb>K>Na>Li
C.Fe、Na分别和稀盐酸反应时,每个铁原子失去2个电子,每个
钠原子失去1个电子,所以Fe的金属活动性强于Na
D.Rb不易与水反应放出H2
B
8.以下关于锂、钠、钾、铷、铯的叙述不正确的是
①对应的氢氧化物中,碱性最强的是CsOH
②单质熔点最高的是铯
③与O2反应均可得到多种氧化物
④单质的密度依次增大
⑤单质的还原性依次增强
⑥对应阳离子的氧化性依次增强
A.①③⑤ B.②④⑥ C.②③④⑥ D.①⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
练透P184
卤素单质 颜色(常态) 密度 熔点/℃ 沸点/℃
F2 淡黄绿色(气体) 1.69 g/L(15℃) 219.6 188.1
Cl2 黄绿色(气体) 3.124 g/L(0℃) 101 34.6
Br2 深红棕色(液体) 3.119 g/cm3(20℃) 7.2 58.78
I2 紫黑色(固体) 4.93 g/cm3 113.5 184.4
颜色假声
颜色加深
颜色假声
密度增大
颜色假声
熔
、沸点增大
一、卤素单质的物理性质
常温下,Br2是唯一的液态非金属单质,且易挥发;I2易升华
有毒,能溶于水,
易溶于四氯化碳(CCl4)
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径/nm
氟 F 9 2 0.071
氯 Cl 17 3 0.099
溴 Br 35 4 1.14
碘 I 53 5 1.33
(1)在周期表中,从上到下卤族元素原子的核电荷数、原子半径的变化有什么特点?
核电荷数逐渐增大
原子半径逐渐增大
7
单质有较强氧化性
易得电子
元素 -- 非金属性
二、卤素单质的化学性质
(1)与金属反应(化合反应)
2Fe+3Br2=2FeBr3
I2+Fe=FeI2
2Fe+3Cl2=2FeCl3
(2)与氢气反应
X2 + H2 = 2HX
(X——F、Cl、Br、I)
稳定性:HF > HCl > HBr > HI
弱酸
(3)与水反应
Cl2+H2O==HCl+HClO
X2+H2O==HX+HXO (X-Cl、Br、I)
2F2+2H2O=4HF+O2 (特例)
Br2+H2O==HBr+HBrO
(4)与碱反应
Cl2+2NaOH=NaCl+NaClO+H2O
X2+2NaOH=NaX+NaXO+H2O (X-Cl、Br、I)
F
Cl
Br
I
核电荷数增加,电子层数增加
原子半径增加,原子核对最外层电子吸引力减弱
原子得电子能力减弱,元素非金属性减弱
单质氧化性减弱 : F2 > Cl2 > Br2 > I2
对应的离子(M+)还原性增强 : F- < Cl- < Br- < I-
三、非金属性强弱的判断标志(教材P103)
一般情况下,
元素的非金属性强弱可以从其最高价氧化物的水化物的酸性强弱,或与氢气生成的气态氢化物的难易程度及其稳定性来判断。
** 置换反应:非金属性强的元素能置换非金属性弱
HClO4>HBrO4>HIO4
4.不能说明氧的非金属性比硫强的事实是
A.H2O的热稳定性强于H2S
B.H2S水溶液暴露于空气中变浑浊
C.常温下H2O是液体,H2S是气体
D.O2和H2化合比S和H2化合容易
√
步步高P100
2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
结论: 氧化性 : Cl2 > Br2 > I2
非金属性 : Cl > Br > I
(二)卤素离子的沉淀现象
AgF AgCl AgBr AgI
颜 色 白色 白色 浅黄色 黄色
逐 渐 加 深 溶解性 易溶于水 难溶于水,也难溶于稀HNO3 感光性 见光分解: 2AgX 2Ag + X2 (X=Cl、Br、I) 用 途 ①检验X-:Ag+ + X-=AgX↓(试剂为AgNO3溶液和稀HNO3) ②制作感光材料(常用AgBr) ③AgI用于人工降雨 Ag+ + X-=AgX↓ (X - Cl、Br、I)
Ag+ + Cl-=AgCl↓
【练习】下列说法正确的是( )
A.氟、氯、溴原子的最外层电子数都是7,次外层电子数都是8
B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
C.酸性:HFO4>HClO4>HBrO4>HIO4
D.砹是原子序数最大的卤族元素,根据卤素性质的相似性,砹微溶于水,易溶于CCl4
D
9.卤族元素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,原子半径依次减小
C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力
依次减弱
D.卤素单质与H2化合的难易程度由难到易的顺序为F2、Cl2、Br2、I2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
练透184
3.下列事实不能说明X元素比Y元素的非金属性强的是
①与H2化合时,X单质比Y单质容易
②X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强
③X原子的最外层电子数比Y原子的最外层电子数多
④X单质可以把Y从其氢化物中置换出来
⑤X元素的最高正价比Y的高
⑥气态氢化物溶于水后的酸性:X强于Y
A.②⑤⑥ B.③④⑥ C.①④⑥ D.③⑤⑥
√
步步高P100
拓展:同主族元素原子结构与性质的关系
最外层电子数相同
同主族元素由上到下原子半径依次增大
化学性质相似
原子得电子能力依次 ,
原子失电子能力依次 ,
元素金属性 ,
元素非金属性 。
F
Cl
Br
I
At
Li
Na
K
Rb
Cs
减弱
增强
减弱
增强
最强碱:CsOH
最强酸:HClO4
H
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
金属性逐渐增强
非金属性逐渐增强
金属性最强
非金属性最强
最强碱:CsOH
最强酸:HClO4
1.已知铍(Be)的原子序数为4,下列关于铍及其化合物的叙述正确的是
A.铍的金属性比镁强
B.氯化镁的氧化性比氯化铍强
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍易和冷水反应产生氢气
√
步步高P100
2.含有元素硒(Se)的保健品已开始进入市场。已知它是第四周期第ⅥA族元素。则下列关于硒的叙述正确的是
A.非金属性比硫强
B.气态氢化物的化学式为H2Se
C.稳定性:H2Se>H2O
D.最高价氧化物的化学式是SeO2
√
步步高P99 随堂演练
5.下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2-
√
