化学人教版(2019)必修第一册4.2物质结构 元素周期律 课件(共50张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2物质结构 元素周期律 课件(共50张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 21:30:46 | ||
图片预览



文档简介
(共50张PPT)
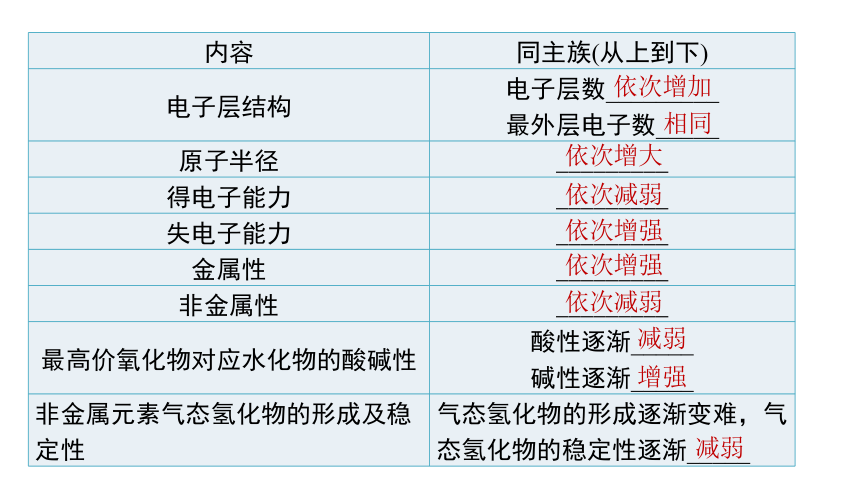
第四章 物质结构 元素周期律第二节内容 同主族(从上到下)
电子层结构 电子层数_________
最外层电子数_____
原子半径 _________
得电子能力 _________
失电子能力 _________
金属性 _________
非金属性 _________
最高价氧化物对应水化物的酸碱性 酸性逐渐_____
碱性逐渐_____
非金属元素气态氢化物的形成及稳定性 气态氢化物的形成逐渐变难,气态氢化物的稳定性逐渐_____
依次增加
相同
依次增大
依次减弱
依次增强
依次增强
依次减弱
减弱
增强
减弱
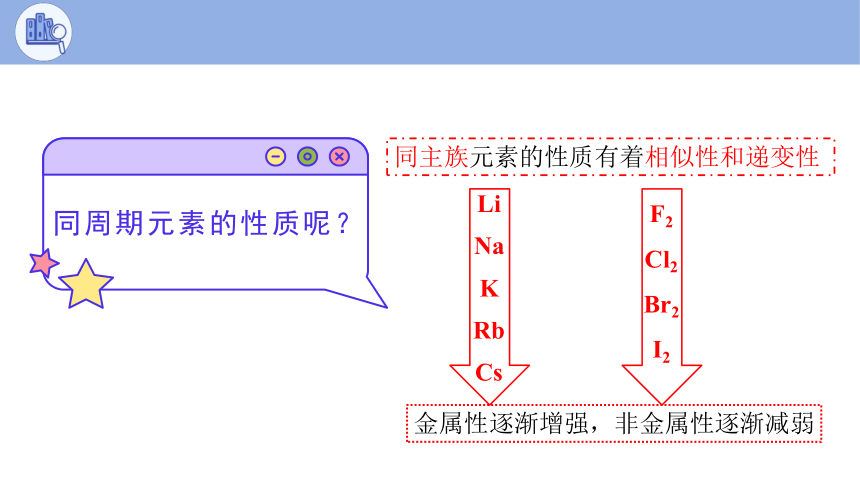
F2 Cl2 Br2 I2
Li
Na K RbCs
同主族元素的性质有着相似性和递变性
金属性逐渐增强,非金属性逐渐减弱
同周期元素的性质呢?
阅读教材p107-108表格4-5
依据元素周期表前三周期元素(1-18号)的符号及原子核外电子排布,思考并讨论:
(1)随着元素原子序数的递增,同一周期原子的核外电子层排布和元素的主要化合价呈现什么规律性变化?
(2)分析表格中的数据,观察随着原子序数递增,元素原子半径呈现什么规律性变化?
思考与讨论
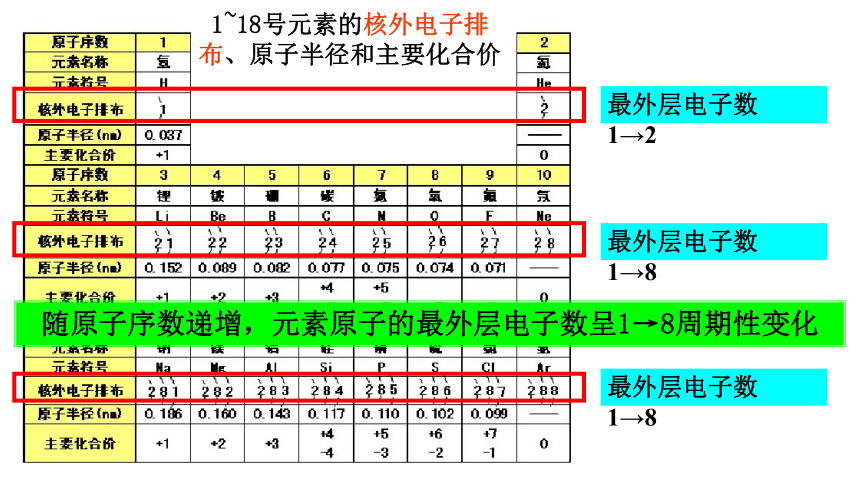
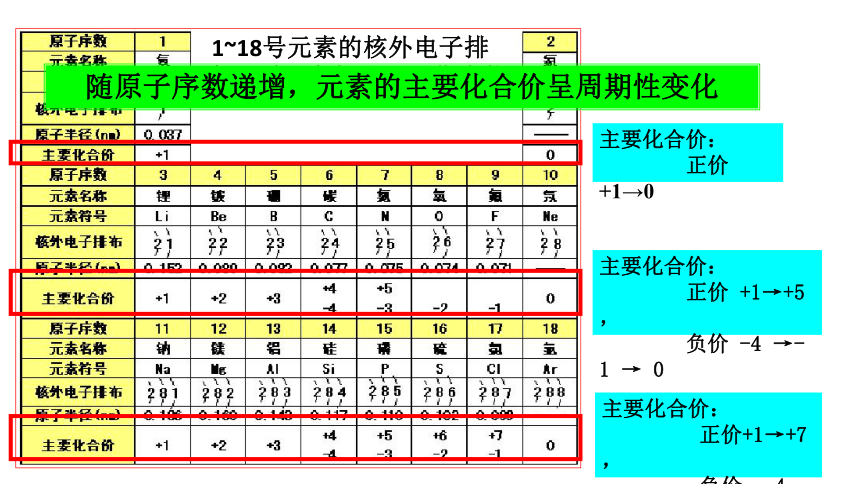
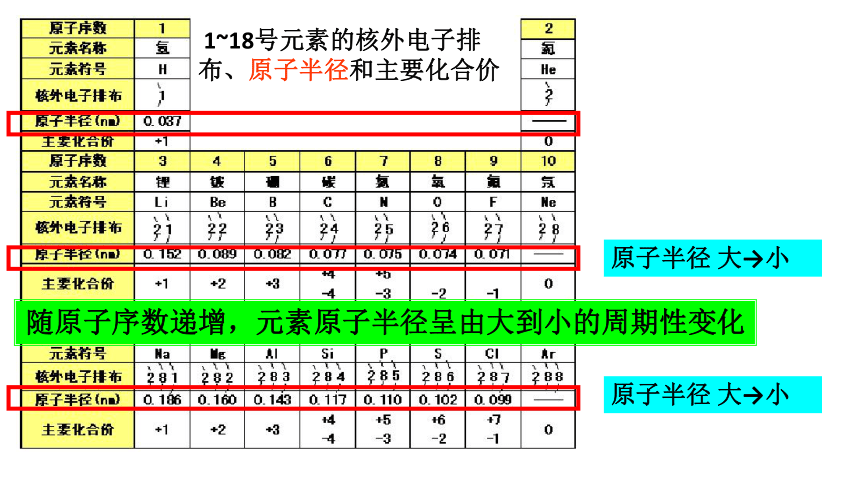
1~18号元素的核外电子排布、原子半径和主要化合价
最外层电子数 1→2
最外层电子数 1→8
最外层电子数 1→8
随原子序数递增,元素原子的最外层电子数呈1→8周期性变化
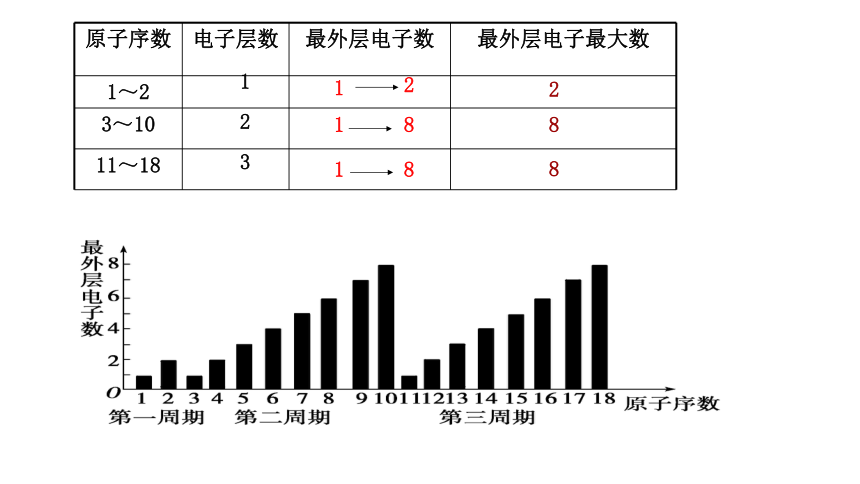
原子序数 电子层数 最外层电子数 最外层电子最大数
1~2
3~10
11~18
1
2
3
1
2
1
8
1
8
8
8
2
1~18号元素的核外电子排布、原子半径和主要化合价
主要化合价:
正价 +1→0
主要化合价:
正价 +1→+5,
负价 -4 →-1 → 0
主要化合价:
正价+1→+7,
负价:-4 →-1→0
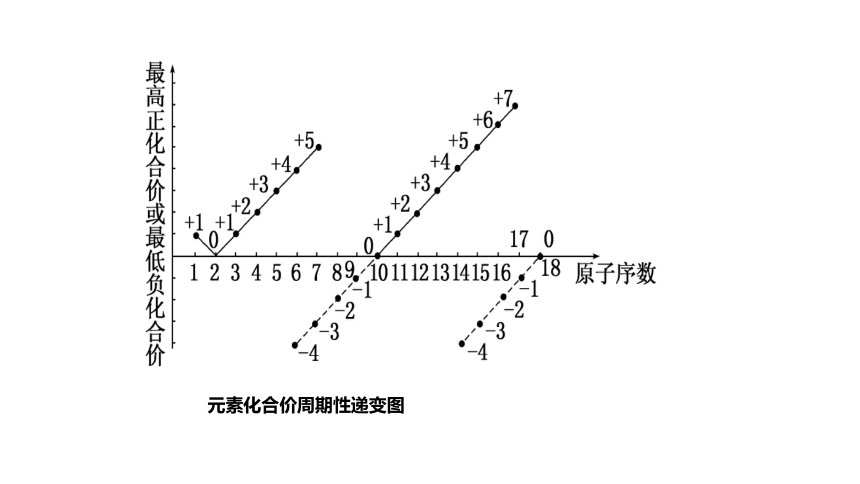
随原子序数递增,元素的主要化合价呈周期性变化
元素化合价周期性递变图
1~18号元素的核外电子排布、原子半径和主要化合价
原子半径 大→小
原子半径 大→小
随原子序数递增,元素原子半径呈由大到小的周期性变化
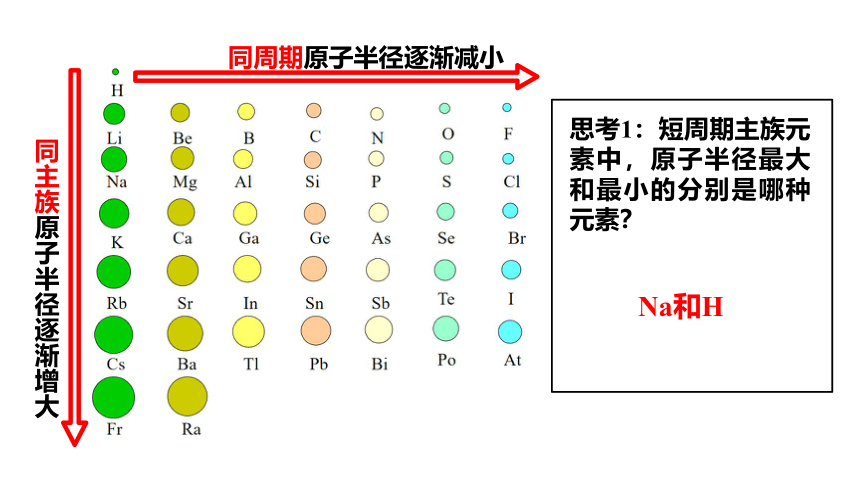
同主族原子半径逐渐增大
同周期原子半径逐渐减小
思考1:短周期主族元素中,原子半径最大和最小的分别是哪种元素?
Na和H
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有-1价,如NaH( )
(5)第三周期原子半径最大的元素为氩( )
×
√
×
×
正误判断
√
步步高P105
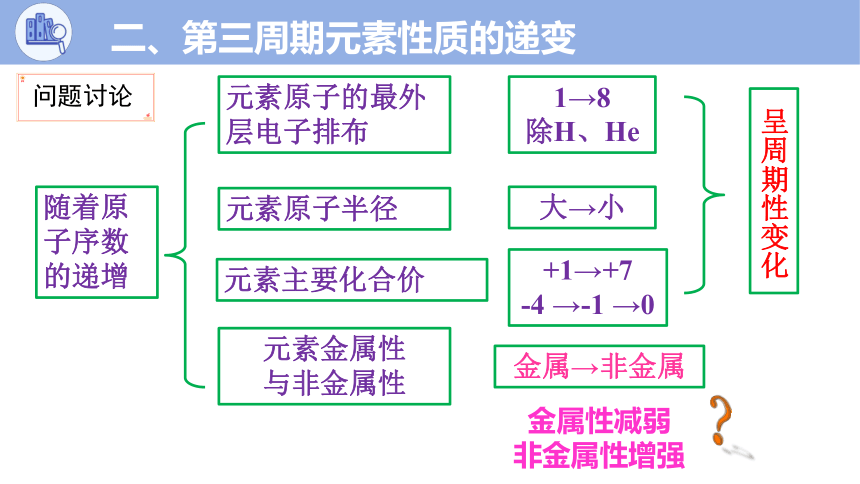
随着原子序数的递增
元素原子的最外层电子排布
元素原子半径
元素主要化合价
元素金属性
与非金属性
1→8
除H、He
大→小
+1→+7
-4 →-1 →0
金属→非金属
呈周期性变化
金属性减弱
非金属性增强
?
二、第三周期元素性质的递变
问题讨论
以第三周期元素为例,预测元素金属性/非金属性的变化趋势。
Na Mg Al Si P S Cl
元素金属性减弱
元素非金属性增强
【预测】随着原子序数的递增,元素金属性减弱,非金属性增强。
事实?
1.与水或酸反应置换氢气的难易程度
2.最高价氧化物对应水化物(最高价氢氧化物)的碱性
3.单质间的置换反应
1.与氢气化合的难易程度
2.生成氢化物的稳定性:
3.最高价氧化物对应水化物(最高价含氧酸)的酸性
4.单质间的置换反应
元素金属性强弱判断依据:
元素非金属性强弱判断依据:
复习回顾
二、第三周期元素性质的递变P109
①Na、Mg与水的反应
(1)探究Na、Mg、Al 金属性的强弱
②NaOH、Mg(OH)2、Al(OH)3的碱性强弱比较
现象
化学方程式
镁与冷水反应缓慢,滴入酚酞试液粉红色。加热至沸腾后反应加快,产生气泡,溶液红色加深。
金属性:Na > Mg
结论
Mg + 2H2O == Mg(OH)2+H2
△
取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞溶液。过一会儿加热试管至水沸腾,观察现象。
实验比较
现象
离子方程式
Al(OH)3在酸或强碱溶液中都能溶解。
Al(OH)3是两性氢氧化物,铝虽是金属,单已表现出一定的非金属性。
结论
将Al(OH)3沉淀分装在两支试管中,一支滴加2mol/L 盐酸,另一支滴加2mol/LNaOH溶液,边滴边振荡观察现象。
实验比较
Al3++ 3NH3 H2O=== Al(OH)3↓ +3NH4+
Al(OH)3 + 3H+ === Al3+ + 3H2O
Al(OH)3 +OH- === AlO2-+ 2H2O
现象
离子方程式
Mg(OH)2在酸溶液中溶解,在强碱溶液中不溶解。
Mg(OH)2的碱性强于Al(OH)3
结论
将Mg(OH)2沉淀分装在两支试管中,一支滴加2mol/L 盐酸,另一支滴加2mol/L NaOH溶液,边滴边振荡观察现象。
实验比较
Mg2++ 2NH3 H2O=== Mg(OH)2↓ +2NH4+
Mg(OH)2+ 2H+== Mg2+ + 2H2O
性质 Na Mg Al
单质与水(或酸)反应
最高价氧化物对应水化物的碱性
冷水剧烈反应
冷水缓慢、沸水迅速反应,与酸剧烈反应
与酸迅速反应
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
与水或酸反应置换出氢的剧烈程度减弱
最高价氧化物对应水化物碱性减弱
金属性:Na>Mg>Al
二、第三周期元素性质的递变
性质 Si P S Cl
最高价氧化物对应的水化物的酸性
H2SiO3
(硅酸)
弱酸
H3PO4
(磷酸)
中强酸
H2SO4
(硫酸)
强酸
HClO4
(高氯酸)
强酸(酸性比H2SO4强)
最高价氧化物对应水化物酸性增强
非金属性 :Si < P < S < Cl
Na Mg Al Si P S Cl
元素金属性逐渐减弱,非金属性逐渐增强
同一周期元素
二、第三周期元素性质的递变
结论分析
随着原子序数的递增
核外电子排布呈周期性变化
元素性质呈周期性变化
元素周期律
最外层电子数1→8
(K层电子数1→2)
同周期元素原子半径 大→小
化合价:+1→+7 -4→-1
决定了
归纳出
引起了
元素的性质随着原子序数的递增而呈现周期性的变化.
元素的金属性减弱;非金属性增强
本质
每一周期(第一周期除外)
三、元素周期律
1.除第一周期外,下列关于同周期主族元素的变化规律的叙述不正确的是
A.从左到右,原子半径逐渐减小
B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强
C.从左到右,元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐
增强
D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低负
化合价从-4递变到-1
√
1
2
3
4
步步高P107
2.如图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示
A.电子层数 B.最外层电子数 C.最高化合价 D.原子半径
1
2
3
4
√
步步高P107
2.在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是____(填元素符号,下同)。
(2)金属性最强的元素是_____。
(3)最高价氧化物对应水化物的酸性最强的是_______(填化学式,下同)。
(4)最不稳定的气态氢化物是______。
(5)最高价氧化物对应水化物的碱性最强的是_______。
(6)氧化物中具有两性的是_______。
深度思考
Cl
Na
HClO4
SiH4
NaOH
Al2O3
步步高P107
原子半径依次减小
原子半径依次减小
原子半径依次增大
原子半径依次增大
失电子能力依次增强
失电子能力依次增强
非金属性依次增强
得电子能力依次增强
得电子能力依次增强
非金属性依次增强
金属性依次增强
金属性依次增强
P185 DDACBCADD
P189 BABCAB
3.五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,下列叙述正确的是
A.元素X可能为氢或锂
B.原子半径:r(Y)>r(M)
C.Z的最高价氧化物对应的水化物不能
溶解在氢氧化钾溶液中
D.H3MO4的酸性比HWO4的强
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
练透P185
7.下列关于元素金属性和非金属性强弱比较的说法不正确的是
A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于C
B.Si与H2化合所需温度远高于S与H2化合所需温度,说明S的非金属强于Si
C.Na与冷水能发生反应,而Mg与冷水反应缓慢,说明Na的金属性强
于Mg
D.铁投入CuSO4溶液中,能置换出铜,能判断铁比铜的金属活动性强
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
练透P185
4.下列说法能说明元素X的原子得电子能力强于元素Y的原子的是
A.元素周期表中元素X位于元素Y的上一个周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
练透P189
原子
半径大
小规律
离子
半径大
小规律
“Ne型”
“Ar型”
“序大—径小”
同种元素的原子/离子
r(Si) r(O)
r(S2-) r(Na+)
r(Se2-) r(Cl-)
【拓展】粒子半径大小
原子半径依次减小
原子半径依次增大
离子半径依次增大
r(阴离子)>r(阳离子)
r(阴离子)>r(原子)>r(阳离子)
6.下列微粒半径比值大于1的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
练透P189
【练习】比较下列各组微粒半径,正确的是
①Cl<Cl-<Br-
②F-<Mg2+<Al3+
③Ca2+<Ca<Ba
④S2-<Se2-<Br-
A.①和③ B.只有② C.只有③ D.①和④
√
3.已知短周期元素的离子:aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是
A.离子半径:C3->D->B+>A2+
B.原子序数:d>c>b>a
C.原子半径:A>B>D>C
D.单质的还原性:A>B>D>C
√
步步高P108
4.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A.离子半径:Am+<Bn-
B.原子半径:A<B
C.A的原子序数比B大m+n
D.b=a-n-m
√
步步高P108
(一)主族元素化合价规律
主族元素:
最高正价 = 主族序数 = 最外层电子数
(O、F例外,氟无正价,氧无最高正价)
b. 非金属元素:
最高正价 + ︱最低负价︱= 8
(H例外,金属元素无负价)
四、元素周期律的应用
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
9.几种短周期元素的原子半径及主要化合价如下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
下列叙述正确的是
A.X、Y元素的金属性:XB.Z元素的气态氢化物是弱碱
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
√
练透P185
元素代号 L M Q R T
原子半径/nm 0.160 0.143 0.089 0.102 0.074
主要化合价 +2 +3 +2 +6、-2 -2
10.下表是部分短周期元素的原子半径及其主要化合价,根据表中信息,判断以下说法正确的是
A. L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与强酸反应又能与强碱反应
C.氢化物的稳定性:H2TD.单质与同浓度的稀盐酸反应的速率:Q>L
√
练透P185
结构
性质
决定
体现
构、位、性三者关系
位置
确定
反映
推测
反映
组织建设
(二)预测 新元素 的结构和性质
1.对已经发现的116号元素R,下列推断正确的是
①R是金属元素 ②R是非金属元素 ③其钠盐的化学式为Na2R
④其最高价氧化物对应的水化物的酸性比硫酸强 ⑤最外电子层有6个电子
A.①③④ B.①③⑤
C.②④⑤ D.①⑤
√
2.(2018·福建闽侯八中高一月考)a、b、c、d、e、f为六种短周期元素,a、b、e、f位于同一周期,c、d也位于同一周期,且d、e在同一主族,原子半径:dA.e的非金属性比f强
B.d元素可能是第一周期元素
C.六种元素中,a元素最高价氧化物对应水化物的碱性最强
D.a、b、c、d的原子序数逐渐增大
√
(三)元素推断
1.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
A.对应的简单离子的半径:X<W
B.对应的简单气态氢化物的稳定性:Y<Z
C.元素X、Z和W能形成多种化合物
D.Y的最高价氧化物对应的水化物具有强酸性
√
2.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.单质T与NaOH溶液不反应
√
组织建设
化学 · 必修2
(四)寻找
半导体材料
农药
催化剂/耐高温材料
性质相似的元素
1. 太阳能电池板,是用什么元素的单质制作的
2.最初使用的锗也是有此性能的材料,镓和硒也有.查阅周期表,找出它们分别在周期表中的位置,得出什么结论 为什么
1.半导体材料
半导体材料——硅
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
结论:在金属和非金属楼梯型交界处附近寻找半导体材料,如锗.硅等.
2.催化剂
(1).汽车尾气处理:
2NO+2CO == 2CO2+N2
(2)合成氨工业: N2+3H2 ==== 2 NH3
(3)工业制硫酸: 2SO2+O2 == 2SO3
铂-铑
V2O5
铁触媒
结论:在过渡元素中寻找催化剂材料.
3.农药
敌敌畏
蓖麻毒素
结论:在磷、砷附近寻找、合成农药.
4.耐高温、高强度、耐腐蚀的合金
4.耐高温.高强度.耐腐蚀的合金材料
钛. 钼. 钨. 铬 等可以用来合成此类合金.
飞机起落架: 钛. 钒. 铁. 铝 组成的多钛合金
飞机发动机叶片: 镍. 铁. 碳. 钴 组成的镍钴合金.
结论:从过渡元素中寻找此类合金材料.
第四章 物质结构 元素周期律第二节内容 同主族(从上到下)
电子层结构 电子层数_________
最外层电子数_____
原子半径 _________
得电子能力 _________
失电子能力 _________
金属性 _________
非金属性 _________
最高价氧化物对应水化物的酸碱性 酸性逐渐_____
碱性逐渐_____
非金属元素气态氢化物的形成及稳定性 气态氢化物的形成逐渐变难,气态氢化物的稳定性逐渐_____
依次增加
相同
依次增大
依次减弱
依次增强
依次增强
依次减弱
减弱
增强
减弱
F2 Cl2 Br2 I2
Li
Na K RbCs
同主族元素的性质有着相似性和递变性
金属性逐渐增强,非金属性逐渐减弱
同周期元素的性质呢?
阅读教材p107-108表格4-5
依据元素周期表前三周期元素(1-18号)的符号及原子核外电子排布,思考并讨论:
(1)随着元素原子序数的递增,同一周期原子的核外电子层排布和元素的主要化合价呈现什么规律性变化?
(2)分析表格中的数据,观察随着原子序数递增,元素原子半径呈现什么规律性变化?
思考与讨论
1~18号元素的核外电子排布、原子半径和主要化合价
最外层电子数 1→2
最外层电子数 1→8
最外层电子数 1→8
随原子序数递增,元素原子的最外层电子数呈1→8周期性变化
原子序数 电子层数 最外层电子数 最外层电子最大数
1~2
3~10
11~18
1
2
3
1
2
1
8
1
8
8
8
2
1~18号元素的核外电子排布、原子半径和主要化合价
主要化合价:
正价 +1→0
主要化合价:
正价 +1→+5,
负价 -4 →-1 → 0
主要化合价:
正价+1→+7,
负价:-4 →-1→0
随原子序数递增,元素的主要化合价呈周期性变化
元素化合价周期性递变图
1~18号元素的核外电子排布、原子半径和主要化合价
原子半径 大→小
原子半径 大→小
随原子序数递增,元素原子半径呈由大到小的周期性变化
同主族原子半径逐渐增大
同周期原子半径逐渐减小
思考1:短周期主族元素中,原子半径最大和最小的分别是哪种元素?
Na和H
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有-1价,如NaH( )
(5)第三周期原子半径最大的元素为氩( )
×
√
×
×
正误判断
√
步步高P105
随着原子序数的递增
元素原子的最外层电子排布
元素原子半径
元素主要化合价
元素金属性
与非金属性
1→8
除H、He
大→小
+1→+7
-4 →-1 →0
金属→非金属
呈周期性变化
金属性减弱
非金属性增强
?
二、第三周期元素性质的递变
问题讨论
以第三周期元素为例,预测元素金属性/非金属性的变化趋势。
Na Mg Al Si P S Cl
元素金属性减弱
元素非金属性增强
【预测】随着原子序数的递增,元素金属性减弱,非金属性增强。
事实?
1.与水或酸反应置换氢气的难易程度
2.最高价氧化物对应水化物(最高价氢氧化物)的碱性
3.单质间的置换反应
1.与氢气化合的难易程度
2.生成氢化物的稳定性:
3.最高价氧化物对应水化物(最高价含氧酸)的酸性
4.单质间的置换反应
元素金属性强弱判断依据:
元素非金属性强弱判断依据:
复习回顾
二、第三周期元素性质的递变P109
①Na、Mg与水的反应
(1)探究Na、Mg、Al 金属性的强弱
②NaOH、Mg(OH)2、Al(OH)3的碱性强弱比较
现象
化学方程式
镁与冷水反应缓慢,滴入酚酞试液粉红色。加热至沸腾后反应加快,产生气泡,溶液红色加深。
金属性:Na > Mg
结论
Mg + 2H2O == Mg(OH)2+H2
△
取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞溶液。过一会儿加热试管至水沸腾,观察现象。
实验比较
现象
离子方程式
Al(OH)3在酸或强碱溶液中都能溶解。
Al(OH)3是两性氢氧化物,铝虽是金属,单已表现出一定的非金属性。
结论
将Al(OH)3沉淀分装在两支试管中,一支滴加2mol/L 盐酸,另一支滴加2mol/LNaOH溶液,边滴边振荡观察现象。
实验比较
Al3++ 3NH3 H2O=== Al(OH)3↓ +3NH4+
Al(OH)3 + 3H+ === Al3+ + 3H2O
Al(OH)3 +OH- === AlO2-+ 2H2O
现象
离子方程式
Mg(OH)2在酸溶液中溶解,在强碱溶液中不溶解。
Mg(OH)2的碱性强于Al(OH)3
结论
将Mg(OH)2沉淀分装在两支试管中,一支滴加2mol/L 盐酸,另一支滴加2mol/L NaOH溶液,边滴边振荡观察现象。
实验比较
Mg2++ 2NH3 H2O=== Mg(OH)2↓ +2NH4+
Mg(OH)2+ 2H+== Mg2+ + 2H2O
性质 Na Mg Al
单质与水(或酸)反应
最高价氧化物对应水化物的碱性
冷水剧烈反应
冷水缓慢、沸水迅速反应,与酸剧烈反应
与酸迅速反应
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
与水或酸反应置换出氢的剧烈程度减弱
最高价氧化物对应水化物碱性减弱
金属性:Na>Mg>Al
二、第三周期元素性质的递变
性质 Si P S Cl
最高价氧化物对应的水化物的酸性
H2SiO3
(硅酸)
弱酸
H3PO4
(磷酸)
中强酸
H2SO4
(硫酸)
强酸
HClO4
(高氯酸)
强酸(酸性比H2SO4强)
最高价氧化物对应水化物酸性增强
非金属性 :Si < P < S < Cl
Na Mg Al Si P S Cl
元素金属性逐渐减弱,非金属性逐渐增强
同一周期元素
二、第三周期元素性质的递变
结论分析
随着原子序数的递增
核外电子排布呈周期性变化
元素性质呈周期性变化
元素周期律
最外层电子数1→8
(K层电子数1→2)
同周期元素原子半径 大→小
化合价:+1→+7 -4→-1
决定了
归纳出
引起了
元素的性质随着原子序数的递增而呈现周期性的变化.
元素的金属性减弱;非金属性增强
本质
每一周期(第一周期除外)
三、元素周期律
1.除第一周期外,下列关于同周期主族元素的变化规律的叙述不正确的是
A.从左到右,原子半径逐渐减小
B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强
C.从左到右,元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐
增强
D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低负
化合价从-4递变到-1
√
1
2
3
4
步步高P107
2.如图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示
A.电子层数 B.最外层电子数 C.最高化合价 D.原子半径
1
2
3
4
√
步步高P107
2.在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是____(填元素符号,下同)。
(2)金属性最强的元素是_____。
(3)最高价氧化物对应水化物的酸性最强的是_______(填化学式,下同)。
(4)最不稳定的气态氢化物是______。
(5)最高价氧化物对应水化物的碱性最强的是_______。
(6)氧化物中具有两性的是_______。
深度思考
Cl
Na
HClO4
SiH4
NaOH
Al2O3
步步高P107
原子半径依次减小
原子半径依次减小
原子半径依次增大
原子半径依次增大
失电子能力依次增强
失电子能力依次增强
非金属性依次增强
得电子能力依次增强
得电子能力依次增强
非金属性依次增强
金属性依次增强
金属性依次增强
P185 DDACBCADD
P189 BABCAB
3.五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,下列叙述正确的是
A.元素X可能为氢或锂
B.原子半径:r(Y)>r(M)
C.Z的最高价氧化物对应的水化物不能
溶解在氢氧化钾溶液中
D.H3MO4的酸性比HWO4的强
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
练透P185
7.下列关于元素金属性和非金属性强弱比较的说法不正确的是
A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于C
B.Si与H2化合所需温度远高于S与H2化合所需温度,说明S的非金属强于Si
C.Na与冷水能发生反应,而Mg与冷水反应缓慢,说明Na的金属性强
于Mg
D.铁投入CuSO4溶液中,能置换出铜,能判断铁比铜的金属活动性强
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
练透P185
4.下列说法能说明元素X的原子得电子能力强于元素Y的原子的是
A.元素周期表中元素X位于元素Y的上一个周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
练透P189
原子
半径大
小规律
离子
半径大
小规律
“Ne型”
“Ar型”
“序大—径小”
同种元素的原子/离子
r(Si) r(O)
r(S2-) r(Na+)
r(Se2-) r(Cl-)
【拓展】粒子半径大小
原子半径依次减小
原子半径依次增大
离子半径依次增大
r(阴离子)>r(阳离子)
r(阴离子)>r(原子)>r(阳离子)
6.下列微粒半径比值大于1的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
练透P189
【练习】比较下列各组微粒半径,正确的是
①Cl<Cl-<Br-
②F-<Mg2+<Al3+
③Ca2+<Ca<Ba
④S2-<Se2-<Br-
A.①和③ B.只有② C.只有③ D.①和④
√
3.已知短周期元素的离子:aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是
A.离子半径:C3->D->B+>A2+
B.原子序数:d>c>b>a
C.原子半径:A>B>D>C
D.单质的还原性:A>B>D>C
√
步步高P108
4.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A.离子半径:Am+<Bn-
B.原子半径:A<B
C.A的原子序数比B大m+n
D.b=a-n-m
√
步步高P108
(一)主族元素化合价规律
主族元素:
最高正价 = 主族序数 = 最外层电子数
(O、F例外,氟无正价,氧无最高正价)
b. 非金属元素:
最高正价 + ︱最低负价︱= 8
(H例外,金属元素无负价)
四、元素周期律的应用
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
9.几种短周期元素的原子半径及主要化合价如下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
下列叙述正确的是
A.X、Y元素的金属性:X
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
√
练透P185
元素代号 L M Q R T
原子半径/nm 0.160 0.143 0.089 0.102 0.074
主要化合价 +2 +3 +2 +6、-2 -2
10.下表是部分短周期元素的原子半径及其主要化合价,根据表中信息,判断以下说法正确的是
A. L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与强酸反应又能与强碱反应
C.氢化物的稳定性:H2T
√
练透P185
结构
性质
决定
体现
构、位、性三者关系
位置
确定
反映
推测
反映
组织建设
(二)预测 新元素 的结构和性质
1.对已经发现的116号元素R,下列推断正确的是
①R是金属元素 ②R是非金属元素 ③其钠盐的化学式为Na2R
④其最高价氧化物对应的水化物的酸性比硫酸强 ⑤最外电子层有6个电子
A.①③④ B.①③⑤
C.②④⑤ D.①⑤
√
2.(2018·福建闽侯八中高一月考)a、b、c、d、e、f为六种短周期元素,a、b、e、f位于同一周期,c、d也位于同一周期,且d、e在同一主族,原子半径:d
B.d元素可能是第一周期元素
C.六种元素中,a元素最高价氧化物对应水化物的碱性最强
D.a、b、c、d的原子序数逐渐增大
√
(三)元素推断
1.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
A.对应的简单离子的半径:X<W
B.对应的简单气态氢化物的稳定性:Y<Z
C.元素X、Z和W能形成多种化合物
D.Y的最高价氧化物对应的水化物具有强酸性
√
2.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.单质T与NaOH溶液不反应
√
组织建设
化学 · 必修2
(四)寻找
半导体材料
农药
催化剂/耐高温材料
性质相似的元素
1. 太阳能电池板,是用什么元素的单质制作的
2.最初使用的锗也是有此性能的材料,镓和硒也有.查阅周期表,找出它们分别在周期表中的位置,得出什么结论 为什么
1.半导体材料
半导体材料——硅
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
结论:在金属和非金属楼梯型交界处附近寻找半导体材料,如锗.硅等.
2.催化剂
(1).汽车尾气处理:
2NO+2CO == 2CO2+N2
(2)合成氨工业: N2+3H2 ==== 2 NH3
(3)工业制硫酸: 2SO2+O2 == 2SO3
铂-铑
V2O5
铁触媒
结论:在过渡元素中寻找催化剂材料.
3.农药
敌敌畏
蓖麻毒素
结论:在磷、砷附近寻找、合成农药.
4.耐高温、高强度、耐腐蚀的合金
4.耐高温.高强度.耐腐蚀的合金材料
钛. 钼. 钨. 铬 等可以用来合成此类合金.
飞机起落架: 钛. 钒. 铁. 铝 组成的多钛合金
飞机发动机叶片: 镍. 铁. 碳. 钴 组成的镍钴合金.
结论:从过渡元素中寻找此类合金材料.
