化学人教版(2019)必修第一册2.1.3碳酸钠和碳酸氢钠(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.3碳酸钠和碳酸氢钠(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 22:30:04 | ||
图片预览





文档简介
(共28张PPT)
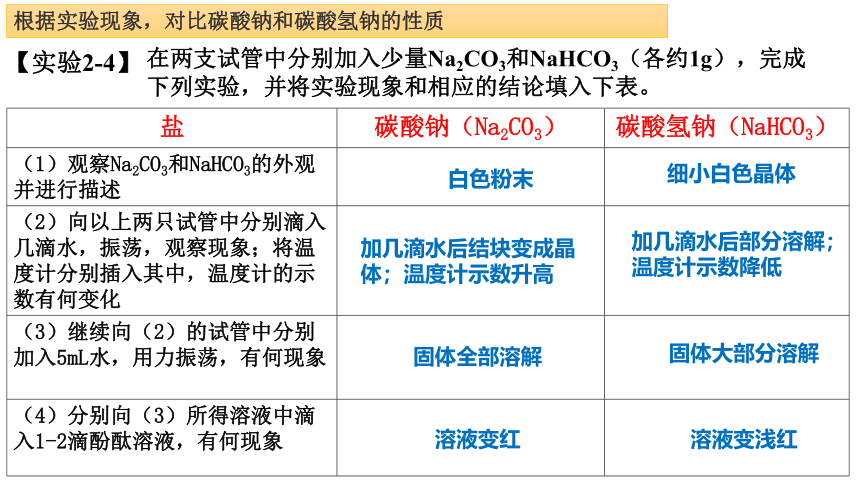
钠及其化合物碳酸钠和碳酸氢钠【实验2-4】
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两只试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1-2滴酚酞溶液,有何现象
白色粉末
细小白色晶体
加几滴水后结块变成晶体;温度计示数升高
加几滴水后部分溶解;
温度计示数降低
固体全部溶解
固体大部分溶解
溶液变红
溶液变浅红
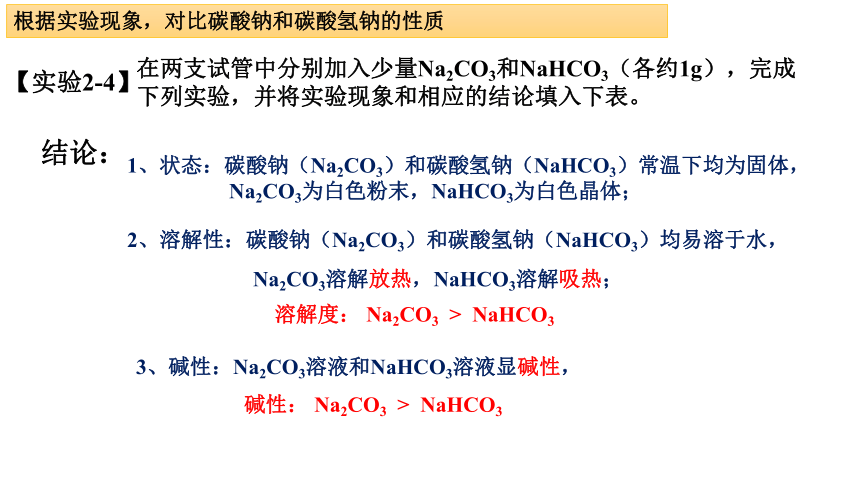
根据实验现象,对比碳酸钠和碳酸氢钠的性质
【实验2-4】
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
结论:
1、状态:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)常温下均为固体,
Na2CO3为白色粉末,NaHCO3为白色晶体;
2、溶解性:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)均易溶于水,
溶解度: Na2CO3 > NaHCO3
Na2CO3溶解放热,NaHCO3溶解吸热;
3、碱性:Na2CO3溶液和NaHCO3溶液显碱性,
碱性: Na2CO3 > NaHCO3
根据实验现象,对比碳酸钠和碳酸氢钠的性质
根据已有知识,掌握碳酸钠、碳酸氢钠的化学性质
【回顾】盐的化学性质
1、与金属反应
2、与酸反应
3、与碱反应
4、与某些盐反应
置换反应
复分解反应
难电离物(弱酸、弱碱、水)、难溶物(沉淀)、气体
根据已有知识,掌握碳酸钠的化学性质
1、与酸的反应
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过)=2NaCl+H2O+CO2 ↑
以盐酸为例,写出碳酸钠、碳酸氢钠与盐酸的化学反应方程式与离子反应方程式
CO32-+2H+=H2O+CO2↑
HCO3-+H+=H2O+CO2 ↑
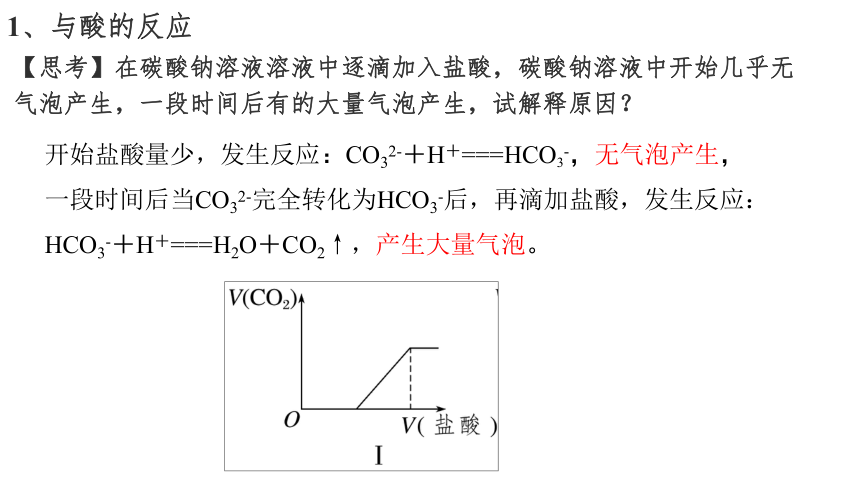
1、与酸的反应
【思考】在碳酸钠溶液溶液中逐滴加入盐酸,碳酸钠溶液中开始几乎无气泡产生,一段时间后有的大量气泡产生,试解释原因?
开始盐酸量少,发生反应:CO32-+H+===HCO3-,无气泡产生,
一段时间后当CO32-完全转化为HCO3-后,再滴加盐酸,发生反应:HCO3-+H+===H2O+CO2↑,产生大量气泡。
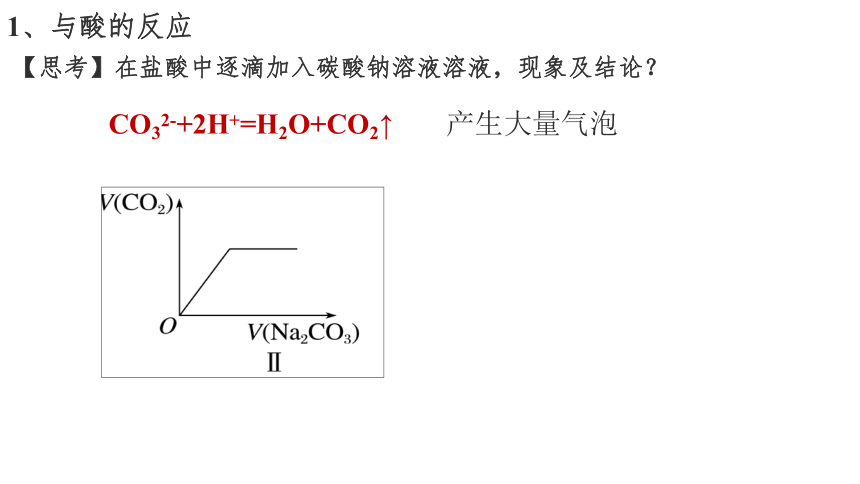
1、与酸的反应
【思考】在盐酸中逐滴加入碳酸钠溶液溶液,现象及结论?
CO32-+2H+=H2O+CO2↑
产生大量气泡
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较强,反应速率快,可以治疗用于治疗胃酸过多。
温馨提示:
胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
Na2CO3:
NaHCO3 :不反应
Na2CO3 + CO2 + H2O === 2NaHCO3
与CO2反应
Na2CO3:
NaHCO3 :
以NaOH为例
2、与碱反应
不反应
NaOH + NaHCO3 = Na2CO3 + H2O
OH- + HCO3- = CO32- + H2O
Na2CO3:
NaHCO3 :
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
以Ca(OH)2为例
2、与碱反应
CO32- + Ca2+ === CaCO3↓
HCO3 - + OH- + Ca2+ === CaCO3↓+H2O
2HCO3 - + OH- + Ca2+ === CaCO3↓ + 2H2O + CO32-
Na2CO3:
NaHCO3 :不反应
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
以CaCl2、BaCl2为例
除了盐的通性,是否存在特性呢?
3、与盐反应
CO3 2-+ Ba2+ === BaCO3↓
【实验2-5】
如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
4、稳定性
【实验2-5】
如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
化学方程式:2NaHCO3 == Na2CO3 + H2O + CO2
【结论】:NaHCO3受热易分解,稳定性:Na2CO3 > NaHCO3
加热Na2CO3 加热NaHCO3
现象
澄清石灰水不变浑浊
澄清石灰水变浑浊
4、稳定性
(1)如何实现NaHCO3固体转化为Na2CO3固体?又如何实现NaHCO3溶液转化为Na2CO3溶液?
②加入NaOH溶液,NaHCO3 + NaOH ==Na2CO3 + H2O
(2)那又该如何实现将Na2CO3溶液转化为NaHCO3溶液?
①加热,2NaHCO3 == Na2CO3 + H2O + CO2
加入CO2气体,Na2CO3 + H2O + CO2 == 2NaHCO3
加入少量酸,Na2CO3 + HCl == NaHCO3 + NaCl
【思考】Na2CO3与NaHCO3的转化
(3)现有两个无标签试剂瓶,分别装有Na2CO3和NaHCO3,我们该如何鉴别?
固体加热前后质量减少或产生使澄清石灰水变浑浊的气体的是NaHCO3
①固体:逐滴加入稀盐酸,反应剧烈的是NaHCO3
②溶液:逐滴加入稀盐酸,立即产生气体的是NaHCO3
【思考】如何鉴别Na2CO3与NaHCO3
加入CaCl2或BaCl2溶液,产生白色沉淀的是Na2CO3
加热法:
气体法:
沉淀法:
√
√
×
正误判断
(1)向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出( )
(2)Na2CO3和NaHCO3溶液分别和Ca(OH)2溶液反应,现象相同( )
(3)用加热的方法可除去碳酸氢钠固体中的碳酸钠( )
(4)用CaCl2溶液可以鉴别碳酸钠溶液与碳酸氢钠溶液( )
(5)不用其他试剂不能鉴别Na2CO3溶液与盐酸( )
×
√
步步高P37
2.下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管
内塞上沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
√
步步高P36
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是 ___ (填装置序号)。
Ⅱ
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
与实验Ⅲ相比,实验Ⅳ的优点是(填字母)_ __。
A. Ⅳ比Ⅲ复杂 B. Ⅳ比Ⅲ安全 C. Ⅳ比Ⅲ操作简便
D. Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不能
2NaHCO3
Na2CO3+H2O+CO2↑
CO2+ Ca(OH)2 === CaCO3↓+H2O
D
(3)若用实验装置Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________。
碳酸氢钠
侯氏制碱法
原料:饱和NaCl溶液、NH3、CO2
反应原理:NaCl + NH3 + CO2 == NaHCO3 + NH4Cl
2NaHCO3 == Na2CO3 + H2O + CO2
优点:原料利用率高、污染小、生产流程短、成本低
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
二、焰色试验
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征焰色。
物理现象
钡(黄绿色) 铜(绿色) 锶(洋红色) 钙(砖红色)
钠 (黄色) 钾(紫色) 锂(紫红色) 铷(紫色)
(透过蓝色钴玻璃)
3、常见金属元素焰色
4、应用:
1.鉴别一些金属元素;
2.用相应的金属化合物制作烟火。
【思 考】 1.在洗涤时能否把盐酸改为硝酸或硫酸?
盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。
硫酸不易挥发,在灼烧时不易挥发除去。
而硝酸在加热时发生分解,产生较多的污染性气体。
不能
(1)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液( )
(2)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+无K+
( )
(3)焰色试验是金属元素的化学性质( )
(4)灼烧时,所有金属或金属阳离子均有焰色( )
×
√
×
×
正误判断
步步高P36
钠及其化合物碳酸钠和碳酸氢钠【实验2-4】
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两只试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1-2滴酚酞溶液,有何现象
白色粉末
细小白色晶体
加几滴水后结块变成晶体;温度计示数升高
加几滴水后部分溶解;
温度计示数降低
固体全部溶解
固体大部分溶解
溶液变红
溶液变浅红
根据实验现象,对比碳酸钠和碳酸氢钠的性质
【实验2-4】
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
结论:
1、状态:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)常温下均为固体,
Na2CO3为白色粉末,NaHCO3为白色晶体;
2、溶解性:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)均易溶于水,
溶解度: Na2CO3 > NaHCO3
Na2CO3溶解放热,NaHCO3溶解吸热;
3、碱性:Na2CO3溶液和NaHCO3溶液显碱性,
碱性: Na2CO3 > NaHCO3
根据实验现象,对比碳酸钠和碳酸氢钠的性质
根据已有知识,掌握碳酸钠、碳酸氢钠的化学性质
【回顾】盐的化学性质
1、与金属反应
2、与酸反应
3、与碱反应
4、与某些盐反应
置换反应
复分解反应
难电离物(弱酸、弱碱、水)、难溶物(沉淀)、气体
根据已有知识,掌握碳酸钠的化学性质
1、与酸的反应
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过)=2NaCl+H2O+CO2 ↑
以盐酸为例,写出碳酸钠、碳酸氢钠与盐酸的化学反应方程式与离子反应方程式
CO32-+2H+=H2O+CO2↑
HCO3-+H+=H2O+CO2 ↑
1、与酸的反应
【思考】在碳酸钠溶液溶液中逐滴加入盐酸,碳酸钠溶液中开始几乎无气泡产生,一段时间后有的大量气泡产生,试解释原因?
开始盐酸量少,发生反应:CO32-+H+===HCO3-,无气泡产生,
一段时间后当CO32-完全转化为HCO3-后,再滴加盐酸,发生反应:HCO3-+H+===H2O+CO2↑,产生大量气泡。
1、与酸的反应
【思考】在盐酸中逐滴加入碳酸钠溶液溶液,现象及结论?
CO32-+2H+=H2O+CO2↑
产生大量气泡
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较强,反应速率快,可以治疗用于治疗胃酸过多。
温馨提示:
胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
Na2CO3:
NaHCO3 :不反应
Na2CO3 + CO2 + H2O === 2NaHCO3
与CO2反应
Na2CO3:
NaHCO3 :
以NaOH为例
2、与碱反应
不反应
NaOH + NaHCO3 = Na2CO3 + H2O
OH- + HCO3- = CO32- + H2O
Na2CO3:
NaHCO3 :
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
以Ca(OH)2为例
2、与碱反应
CO32- + Ca2+ === CaCO3↓
HCO3 - + OH- + Ca2+ === CaCO3↓+H2O
2HCO3 - + OH- + Ca2+ === CaCO3↓ + 2H2O + CO32-
Na2CO3:
NaHCO3 :不反应
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
以CaCl2、BaCl2为例
除了盐的通性,是否存在特性呢?
3、与盐反应
CO3 2-+ Ba2+ === BaCO3↓
【实验2-5】
如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
4、稳定性
【实验2-5】
如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
化学方程式:2NaHCO3 == Na2CO3 + H2O + CO2
【结论】:NaHCO3受热易分解,稳定性:Na2CO3 > NaHCO3
加热Na2CO3 加热NaHCO3
现象
澄清石灰水不变浑浊
澄清石灰水变浑浊
4、稳定性
(1)如何实现NaHCO3固体转化为Na2CO3固体?又如何实现NaHCO3溶液转化为Na2CO3溶液?
②加入NaOH溶液,NaHCO3 + NaOH ==Na2CO3 + H2O
(2)那又该如何实现将Na2CO3溶液转化为NaHCO3溶液?
①加热,2NaHCO3 == Na2CO3 + H2O + CO2
加入CO2气体,Na2CO3 + H2O + CO2 == 2NaHCO3
加入少量酸,Na2CO3 + HCl == NaHCO3 + NaCl
【思考】Na2CO3与NaHCO3的转化
(3)现有两个无标签试剂瓶,分别装有Na2CO3和NaHCO3,我们该如何鉴别?
固体加热前后质量减少或产生使澄清石灰水变浑浊的气体的是NaHCO3
①固体:逐滴加入稀盐酸,反应剧烈的是NaHCO3
②溶液:逐滴加入稀盐酸,立即产生气体的是NaHCO3
【思考】如何鉴别Na2CO3与NaHCO3
加入CaCl2或BaCl2溶液,产生白色沉淀的是Na2CO3
加热法:
气体法:
沉淀法:
√
√
×
正误判断
(1)向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出( )
(2)Na2CO3和NaHCO3溶液分别和Ca(OH)2溶液反应,现象相同( )
(3)用加热的方法可除去碳酸氢钠固体中的碳酸钠( )
(4)用CaCl2溶液可以鉴别碳酸钠溶液与碳酸氢钠溶液( )
(5)不用其他试剂不能鉴别Na2CO3溶液与盐酸( )
×
√
步步高P37
2.下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管
内塞上沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
√
步步高P36
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是 ___ (填装置序号)。
Ⅱ
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
与实验Ⅲ相比,实验Ⅳ的优点是(填字母)_ __。
A. Ⅳ比Ⅲ复杂 B. Ⅳ比Ⅲ安全 C. Ⅳ比Ⅲ操作简便
D. Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不能
2NaHCO3
Na2CO3+H2O+CO2↑
CO2+ Ca(OH)2 === CaCO3↓+H2O
D
(3)若用实验装置Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________。
碳酸氢钠
侯氏制碱法
原料:饱和NaCl溶液、NH3、CO2
反应原理:NaCl + NH3 + CO2 == NaHCO3 + NH4Cl
2NaHCO3 == Na2CO3 + H2O + CO2
优点:原料利用率高、污染小、生产流程短、成本低
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
二、焰色试验
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征焰色。
物理现象
钡(黄绿色) 铜(绿色) 锶(洋红色) 钙(砖红色)
钠 (黄色) 钾(紫色) 锂(紫红色) 铷(紫色)
(透过蓝色钴玻璃)
3、常见金属元素焰色
4、应用:
1.鉴别一些金属元素;
2.用相应的金属化合物制作烟火。
【思 考】 1.在洗涤时能否把盐酸改为硝酸或硫酸?
盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。
硫酸不易挥发,在灼烧时不易挥发除去。
而硝酸在加热时发生分解,产生较多的污染性气体。
不能
(1)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液( )
(2)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+无K+
( )
(3)焰色试验是金属元素的化学性质( )
(4)灼烧时,所有金属或金属阳离子均有焰色( )
×
√
×
×
正误判断
步步高P36
