3.2.3 pH的计算 课件(共17页PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.3 pH的计算 课件(共17页PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 23:10:30 | ||
图片预览






文档简介
pH的计算
1.会运用pH进行简单计算。
2.了解各类溶液pH的计算方法。
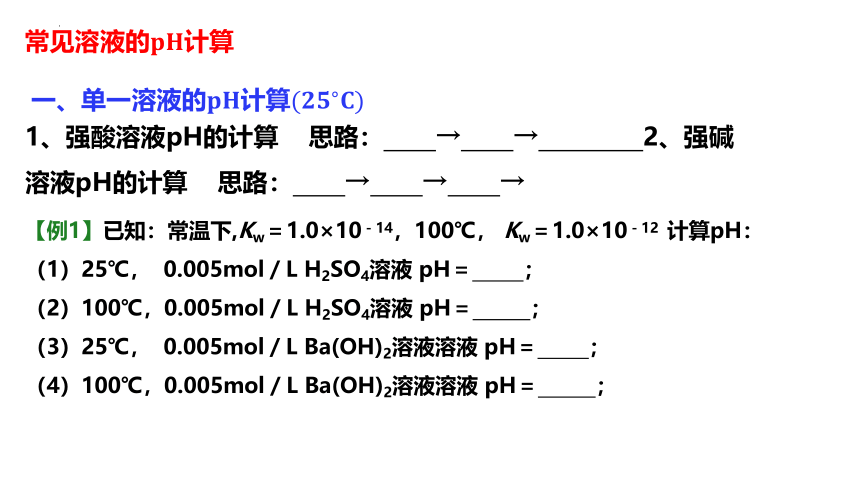
常见溶液的????????计算
?
一、单一溶液的????????计算(?????????????)
?
1、强酸溶液pH的计算 思路: → → 2、强碱溶液pH的计算 思路: → → →
【例1】已知:常温下,Kw=1.0×10-14,100℃, Kw=1.0×10-12 计算pH:
(1)25℃, 0.005mol/L H2SO4溶液 pH= ;
(2)100℃,0.005mol/L H2SO4溶液 pH= ;
(3)25℃, 0.005mol/L Ba(OH)2溶液溶液 pH= ;
(4)100℃,0.005mol/L Ba(OH)2溶液溶液 pH= ;
二、混合溶液 ???????? 的计算类型
?
3、强酸溶液(C1,V1)和强酸(C2,V2)溶液混合的pH计算 CH+=
[练习2] 0.1 mol/l HCl 溶液和0.05 mol/l H2SO4溶液等体积混合,pH= PH= 3 HCl 溶液和PH= 4 H2SO4溶液等体积混合,pH=
二、混合溶液 ???????? 的计算类型
?
4、强碱溶液(C1,V1)和强碱(C2,V2)溶液混合的pH计算 COH-=
[练习3] 0.1 mol/l NaOH溶液和0.05 mol/l Ba(OH)2溶液等体积混合,
pH=
两种溶液等体积混合且pH相差大于等于2
两种强碱等体积混合,混合液pH = pH 大-lg2 = pH大- 0.3
两种强酸等体积混合,混合液pH = pH 小+ lg2 = pH小+0.3
二、混合溶液 ???????? 的计算类型
?
5、强酸溶液(C1,V1)和强碱(C2,V2)溶液混合的pH计算思路:比较n1和n2的大小⑴恰好中和,pH= 7⑵酸过量 ⑶碱过量 CH+= C OH-=
二、混合溶液 ???????? 的计算类型
?
[练习4] pH=2 HCl 溶液和PH=12 Ba(OH)2溶液等体积混合,PH= 99 ml 0.1 mol/l HCl溶液和101 ml 0.05 mol/l Ba(OH)2溶液混合,PH=
将PH=3的强酸溶液和PH=12 强碱溶液混合,当混合溶液的PH=11时,强酸溶液和强碱溶液的体积比是?
常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,
溶液中H+浓度最接近于( )A.2×10-10 mol·L-1B.2×10-8 mol·L-1C.5×10-9 mol·L-1D.5×10-11mol·L-1
[练习5]常温下,900 mL pH=5的盐酸和100 mL pH=1的盐酸混合,
该混合溶液的pH约为( )A.2 B.3 C.4 D.5
A
A
[练习6]某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的Kw=__________。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb=_____________。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb=____________。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb=___________。
[练习7]室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
D
[练习8]常温下,有pH=12 NaOH的溶液100 ml,若将其pH变为11,(设溶液的体积可直接相加,计算结果保留到小数点后一位)写出计算过程。(1)若用pH= 10 NaOH的溶液,应加入 ml。
(2)若用水,应加入 ml。(3)若用pH= 2 HCl的溶液,应加入 ml
[练习9]将pH= 1的HCl平均分成两份,一份加入适量水,另一份加入与该HCl物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积之比是?
在 ????????????? 时,下列关于混合后溶液 ???????? 的说法中正确的是( )
A. ????????=???????? 与 ????????=???????? 的 ???????????????? 溶液等体积混合,溶液的 ???????? 约为11
B. ????????=???? 的盐酸稀释1000倍,溶液的 ????????=????
C. ????????=???? 的 ???????????????????? 溶液与 ????????=???????? 的 ???????????????? 溶液等体积混合,混合液 ????????=????
D. ????????=???????? 的 ????????????????????????? 溶液与 ????????=???? 的 ???????????? 溶液等体积混合,混合液 ????????=????
?
C
现有温度相同,pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混合后,所得溶液的pH接近于( )
A.a-lg2 B.b-lg2 C.a+lg2 D.b+lg2
B
pH=a的NaOH溶液,c(H+)=10-a mol·L-1,c(OH-)=10a-14 mol·L-1;
pH=b的NaOH溶液,c(H+)=10-b mol·L-1,c(OH-)=10b-14 mol·L-1;
而溶液等体积混合后:
c(OH-)=
由于b=a+2,所以c(OH-) ≈5×10b-15 mol·L-1;则c(H+)=2×10-b mol·L-1,所以pH=b-lg 2。
pH的应用
1.人体健康调节:如洗发时人们用的护发素主要功能是调节头发的pH使之达到适宜的酸碱度。
2.环保治理污水:酸性废水可通过投加碱性物质使之中和,碱性废水可通过投加酸性物质或利用烟道气中和。
3.农业生产调节:控制土壤的pH使之适宜作物生长,提高作物的质量和产量。
4.在医疗上:可以通过测试和调节pH来进行诊断和治疗疾病。
5.在科学实验和工业生产方面:溶液pH的控制常常是影响实验结果或产品质量、产量的关键因素。
1.会运用pH进行简单计算。
2.了解各类溶液pH的计算方法。
常见溶液的????????计算
?
一、单一溶液的????????计算(?????????????)
?
1、强酸溶液pH的计算 思路: → → 2、强碱溶液pH的计算 思路: → → →
【例1】已知:常温下,Kw=1.0×10-14,100℃, Kw=1.0×10-12 计算pH:
(1)25℃, 0.005mol/L H2SO4溶液 pH= ;
(2)100℃,0.005mol/L H2SO4溶液 pH= ;
(3)25℃, 0.005mol/L Ba(OH)2溶液溶液 pH= ;
(4)100℃,0.005mol/L Ba(OH)2溶液溶液 pH= ;
二、混合溶液 ???????? 的计算类型
?
3、强酸溶液(C1,V1)和强酸(C2,V2)溶液混合的pH计算 CH+=
[练习2] 0.1 mol/l HCl 溶液和0.05 mol/l H2SO4溶液等体积混合,pH= PH= 3 HCl 溶液和PH= 4 H2SO4溶液等体积混合,pH=
二、混合溶液 ???????? 的计算类型
?
4、强碱溶液(C1,V1)和强碱(C2,V2)溶液混合的pH计算 COH-=
[练习3] 0.1 mol/l NaOH溶液和0.05 mol/l Ba(OH)2溶液等体积混合,
pH=
两种溶液等体积混合且pH相差大于等于2
两种强碱等体积混合,混合液pH = pH 大-lg2 = pH大- 0.3
两种强酸等体积混合,混合液pH = pH 小+ lg2 = pH小+0.3
二、混合溶液 ???????? 的计算类型
?
5、强酸溶液(C1,V1)和强碱(C2,V2)溶液混合的pH计算思路:比较n1和n2的大小⑴恰好中和,pH= 7⑵酸过量 ⑶碱过量 CH+= C OH-=
二、混合溶液 ???????? 的计算类型
?
[练习4] pH=2 HCl 溶液和PH=12 Ba(OH)2溶液等体积混合,PH= 99 ml 0.1 mol/l HCl溶液和101 ml 0.05 mol/l Ba(OH)2溶液混合,PH=
将PH=3的强酸溶液和PH=12 强碱溶液混合,当混合溶液的PH=11时,强酸溶液和强碱溶液的体积比是?
常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,
溶液中H+浓度最接近于( )A.2×10-10 mol·L-1B.2×10-8 mol·L-1C.5×10-9 mol·L-1D.5×10-11mol·L-1
[练习5]常温下,900 mL pH=5的盐酸和100 mL pH=1的盐酸混合,
该混合溶液的pH约为( )A.2 B.3 C.4 D.5
A
A
[练习6]某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的Kw=__________。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb=_____________。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb=____________。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb=___________。
[练习7]室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
D
[练习8]常温下,有pH=12 NaOH的溶液100 ml,若将其pH变为11,(设溶液的体积可直接相加,计算结果保留到小数点后一位)写出计算过程。(1)若用pH= 10 NaOH的溶液,应加入 ml。
(2)若用水,应加入 ml。(3)若用pH= 2 HCl的溶液,应加入 ml
[练习9]将pH= 1的HCl平均分成两份,一份加入适量水,另一份加入与该HCl物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积之比是?
在 ????????????? 时,下列关于混合后溶液 ???????? 的说法中正确的是( )
A. ????????=???????? 与 ????????=???????? 的 ???????????????? 溶液等体积混合,溶液的 ???????? 约为11
B. ????????=???? 的盐酸稀释1000倍,溶液的 ????????=????
C. ????????=???? 的 ???????????????????? 溶液与 ????????=???????? 的 ???????????????? 溶液等体积混合,混合液 ????????=????
D. ????????=???????? 的 ????????????????????????? 溶液与 ????????=???? 的 ???????????? 溶液等体积混合,混合液 ????????=????
?
C
现有温度相同,pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混合后,所得溶液的pH接近于( )
A.a-lg2 B.b-lg2 C.a+lg2 D.b+lg2
B
pH=a的NaOH溶液,c(H+)=10-a mol·L-1,c(OH-)=10a-14 mol·L-1;
pH=b的NaOH溶液,c(H+)=10-b mol·L-1,c(OH-)=10b-14 mol·L-1;
而溶液等体积混合后:
c(OH-)=
由于b=a+2,所以c(OH-) ≈5×10b-15 mol·L-1;则c(H+)=2×10-b mol·L-1,所以pH=b-lg 2。
pH的应用
1.人体健康调节:如洗发时人们用的护发素主要功能是调节头发的pH使之达到适宜的酸碱度。
2.环保治理污水:酸性废水可通过投加碱性物质使之中和,碱性废水可通过投加酸性物质或利用烟道气中和。
3.农业生产调节:控制土壤的pH使之适宜作物生长,提高作物的质量和产量。
4.在医疗上:可以通过测试和调节pH来进行诊断和治疗疾病。
5.在科学实验和工业生产方面:溶液pH的控制常常是影响实验结果或产品质量、产量的关键因素。
