3.2.1水的电离和溶液的酸碱性 课件(共19页PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.1水的电离和溶液的酸碱性 课件(共19页PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 23:12:20 | ||
图片预览





文档简介
水的电离和溶液的酸碱性
1.理解水的电离。
2.会运用水的离子积常数进行简单计算。
新课导入
纯水的导电实验
电流计发生偏转,但是灯泡不亮。
水是极弱电解质,能发生微弱电离。
现象:
结论:
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢?怎样验证你的猜想?
室温下,1L H2O(即1000g 或55.6mol H2O)中有1×10-7mol H2O电离。
c(H+)=1×10-7mol/L
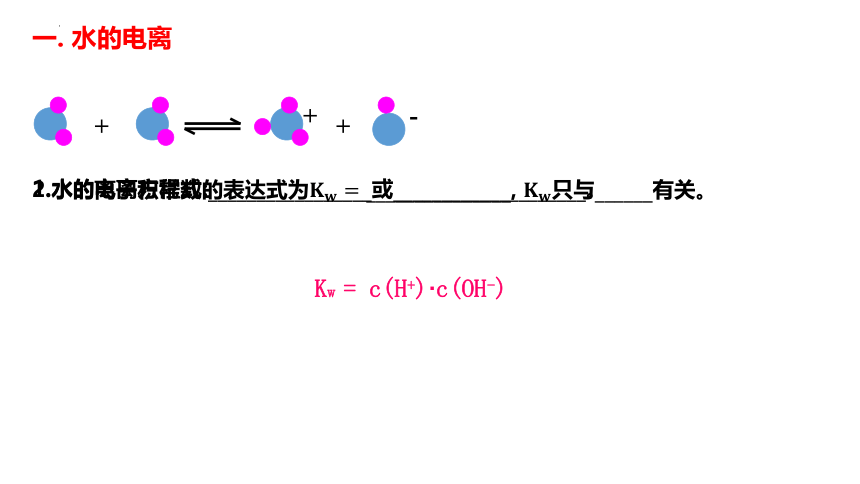
一. 水的电离
1.水的电离方程式:_________________或____________________。
2.水的离子积常数的表达式为????????= _______________, ????????只与______有关。
?
Kw = c(H+)·c(OH-)
+
+
+
-
思考感悟1
离子积表达式KW=c(H+)·c(OH-)中的c(H+)和c(OH-)一定是水电离出的c(H+)和c(OH-)吗?
提示:不是。表达式中的c(H+)和c(OH-)均表示整个溶液中的c(H+)和c(OH-),
不一定只是水电离出的c(H+)和c(OH-)。
影响KW的因素:
温度:
升温平衡正向移动,促进水的电离,KW增大。
降温平衡逆向移动,抑制水的电离,KW减小。
Kw是一个温度函数,只随温度的变化而变化。
H2O H+ + OH- △H>0
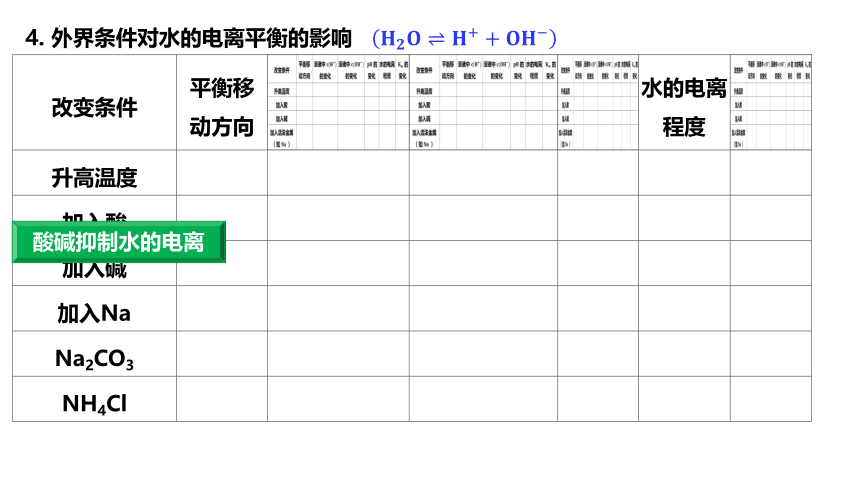
4. 外界条件对水的电离平衡的影响 ?????????????????++?????????
?
改变条件
平衡移动方向
水的电离程度
升高温度
加入酸
加入碱
加入Na
Na2CO3
NH4Cl
酸碱抑制水的电离
促进水电离的方法:
抑制水电离的方法:
升温、加入能消耗产物的物质
降温、加入酸或碱
????????????? 时,水的电离平衡?????????????????++????????? ????????>???? 。下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动, ????(?????????)减小
B. 向水中加入少量固体 ????????????????????????,????(????+) 增大, ????????不变
C. 向水中加入少量盐酸,平衡逆向移动, ????(????+)减小
D. 将水加热, ????????增大, ????(?????????)增大,呈碱性
?
B
一定温度下,水溶液中????+和?????????的浓度变化曲线如图,下列说法正确的是( )
?
A. 升高温度,可能引起由????向????的变化
B. 该温度下,水的离子积常数为????.????×?????????????????
C. 该温度下,加入????????????????????可能引起由????向????的变化
D. 该温度下,稀释溶液可能引起由????向????的变化
?
C
常温下,浓度为1×10-5 mol/L的盐酸溶液中,由水电离产生的c(H+)是多少?
解:
酸溶液中 Kw=
c(H+)酸 · c(OH-)水
c(H+)水=c(OH-)水=
Kw
c(H+)酸
=
1×10-14
1×10-5
=1×10-9 mol/L
常温下,浓度为1×10-5 mol/L的NaOH溶液中,由水电离产生的c(OH-)是多少?
解:
碱溶液中 Kw=
c(H+)水 · c(OH-)碱
c(OH-)水=c(H+)水=
Kw
c(OH-)碱
=
1×10-14
1×10-5
=1×10-9 mol/L
常温下,0.05mol/L的Ba(OH)2溶液中,c(H+)和c(OH-)各是多少?
解:
碱溶液中 Kw=
c(H+)水 · c(OH-)碱
c(H+)水=
Kw
c(OH-)碱
=
1×10-14
0.1
=1×10-13 mol/L
c(OH-)=2c[Ba(OH)2]=0.1mol/L
常温下,在0.01 mol·L-1硫酸中,水电离出的H+的浓度是( )A.5×10-13 mol·L-1 B.0.02 mol·L-1 C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
A
某溶液中由水电离产生的c(H+)水=10-11mol/L则该溶液呈酸性还是碱性?并求算该溶液中c(H+)的可能值?
解:
c(H+)水 = c(OH-)水 = 10-11mol/L
①若溶液显碱性
KW=c(H+)水 · c(OH-)碱
Kw
c(OH-)水
=
1×10-14
1×10-11
=1×10-3 mol/L
c(H+)溶液 = c(H+)水 = 10-11mol/L
②若溶液显酸性
KW=c(H+)酸 · c(OH-)水
c(H+)酸=
常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是( )
①二氧化硫水溶液 ②氯化铵水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.①③ D.③④
A
25 ℃时,下列四种溶液中,由水电离出的c(H+)之比是( )①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液A.1∶10∶100∶1B.1∶10-1∶10-12∶10-14C.14∶13∶12∶14D.14∶13∶2∶1
A
常温下,某无色溶液中,由水电离产生的c(H+)=1×10-12 mol·L-1,下列各组离子肯定能大量共存的是( )
D
(1) ????.??????????????????????????的盐酸加水稀释时,水的电离平衡向________方向移动。
?
电离
(2) ????????????? 时, ????.??????????????????????????的盐酸中, ????(????+)= ________ ??????????????????????,????(?????????)= ___________ ?????????????????????? ,水电离出的????(????+)= ____________ ?????????????????????? 。
?
(3)某温度下测得纯水中 ????(????+)=????×??????????????????????????????????? ,则此时????(?????????)= _____________;该温度下向纯水中加盐酸使 ????(????+)=????×??????????????????????????????????? ,则此时 ????(?????????)= ____________________。
?
(4)在 ?????????????时,某稀溶液中由水电离产生的????(????+)为????.????×??????????????????????????????????????? ,
下列有关该溶液的叙述正确的是______(填字母)
A. 该溶液可能呈酸性 C. 该溶液的????(????+)一定是????.??????????????????????????
B. 该溶液一定呈碱性 D. 该溶液的????(?????????)不可能为????.??????????????????????????
?
A
归纳总结
(4)酸碱抑制水的电离。
(1)酸溶液中Kw=c酸(H+)·c水(OH-)(忽略水电离出的H+的浓度)。
(2)碱溶液中Kw=c水(H+)·c碱(OH-)(忽略水电离出的OH-的浓度)。
(3)不同溶液中,c(H+)与c(OH-)不一定相等,
但由水电离出的c(H+)与c(OH-)一定相等。
1.理解水的电离。
2.会运用水的离子积常数进行简单计算。
新课导入
纯水的导电实验
电流计发生偏转,但是灯泡不亮。
水是极弱电解质,能发生微弱电离。
现象:
结论:
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢?怎样验证你的猜想?
室温下,1L H2O(即1000g 或55.6mol H2O)中有1×10-7mol H2O电离。
c(H+)=1×10-7mol/L
一. 水的电离
1.水的电离方程式:_________________或____________________。
2.水的离子积常数的表达式为????????= _______________, ????????只与______有关。
?
Kw = c(H+)·c(OH-)
+
+
+
-
思考感悟1
离子积表达式KW=c(H+)·c(OH-)中的c(H+)和c(OH-)一定是水电离出的c(H+)和c(OH-)吗?
提示:不是。表达式中的c(H+)和c(OH-)均表示整个溶液中的c(H+)和c(OH-),
不一定只是水电离出的c(H+)和c(OH-)。
影响KW的因素:
温度:
升温平衡正向移动,促进水的电离,KW增大。
降温平衡逆向移动,抑制水的电离,KW减小。
Kw是一个温度函数,只随温度的变化而变化。
H2O H+ + OH- △H>0
4. 外界条件对水的电离平衡的影响 ?????????????????++?????????
?
改变条件
平衡移动方向
水的电离程度
升高温度
加入酸
加入碱
加入Na
Na2CO3
NH4Cl
酸碱抑制水的电离
促进水电离的方法:
抑制水电离的方法:
升温、加入能消耗产物的物质
降温、加入酸或碱
????????????? 时,水的电离平衡?????????????????++????????? ????????>???? 。下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动, ????(?????????)减小
B. 向水中加入少量固体 ????????????????????????,????(????+) 增大, ????????不变
C. 向水中加入少量盐酸,平衡逆向移动, ????(????+)减小
D. 将水加热, ????????增大, ????(?????????)增大,呈碱性
?
B
一定温度下,水溶液中????+和?????????的浓度变化曲线如图,下列说法正确的是( )
?
A. 升高温度,可能引起由????向????的变化
B. 该温度下,水的离子积常数为????.????×?????????????????
C. 该温度下,加入????????????????????可能引起由????向????的变化
D. 该温度下,稀释溶液可能引起由????向????的变化
?
C
常温下,浓度为1×10-5 mol/L的盐酸溶液中,由水电离产生的c(H+)是多少?
解:
酸溶液中 Kw=
c(H+)酸 · c(OH-)水
c(H+)水=c(OH-)水=
Kw
c(H+)酸
=
1×10-14
1×10-5
=1×10-9 mol/L
常温下,浓度为1×10-5 mol/L的NaOH溶液中,由水电离产生的c(OH-)是多少?
解:
碱溶液中 Kw=
c(H+)水 · c(OH-)碱
c(OH-)水=c(H+)水=
Kw
c(OH-)碱
=
1×10-14
1×10-5
=1×10-9 mol/L
常温下,0.05mol/L的Ba(OH)2溶液中,c(H+)和c(OH-)各是多少?
解:
碱溶液中 Kw=
c(H+)水 · c(OH-)碱
c(H+)水=
Kw
c(OH-)碱
=
1×10-14
0.1
=1×10-13 mol/L
c(OH-)=2c[Ba(OH)2]=0.1mol/L
常温下,在0.01 mol·L-1硫酸中,水电离出的H+的浓度是( )A.5×10-13 mol·L-1 B.0.02 mol·L-1 C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
A
某溶液中由水电离产生的c(H+)水=10-11mol/L则该溶液呈酸性还是碱性?并求算该溶液中c(H+)的可能值?
解:
c(H+)水 = c(OH-)水 = 10-11mol/L
①若溶液显碱性
KW=c(H+)水 · c(OH-)碱
Kw
c(OH-)水
=
1×10-14
1×10-11
=1×10-3 mol/L
c(H+)溶液 = c(H+)水 = 10-11mol/L
②若溶液显酸性
KW=c(H+)酸 · c(OH-)水
c(H+)酸=
常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是( )
①二氧化硫水溶液 ②氯化铵水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.①③ D.③④
A
25 ℃时,下列四种溶液中,由水电离出的c(H+)之比是( )①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液A.1∶10∶100∶1B.1∶10-1∶10-12∶10-14C.14∶13∶12∶14D.14∶13∶2∶1
A
常温下,某无色溶液中,由水电离产生的c(H+)=1×10-12 mol·L-1,下列各组离子肯定能大量共存的是( )
D
(1) ????.??????????????????????????的盐酸加水稀释时,水的电离平衡向________方向移动。
?
电离
(2) ????????????? 时, ????.??????????????????????????的盐酸中, ????(????+)= ________ ??????????????????????,????(?????????)= ___________ ?????????????????????? ,水电离出的????(????+)= ____________ ?????????????????????? 。
?
(3)某温度下测得纯水中 ????(????+)=????×??????????????????????????????????? ,则此时????(?????????)= _____________;该温度下向纯水中加盐酸使 ????(????+)=????×??????????????????????????????????? ,则此时 ????(?????????)= ____________________。
?
(4)在 ?????????????时,某稀溶液中由水电离产生的????(????+)为????.????×??????????????????????????????????????? ,
下列有关该溶液的叙述正确的是______(填字母)
A. 该溶液可能呈酸性 C. 该溶液的????(????+)一定是????.??????????????????????????
B. 该溶液一定呈碱性 D. 该溶液的????(?????????)不可能为????.??????????????????????????
?
A
归纳总结
(4)酸碱抑制水的电离。
(1)酸溶液中Kw=c酸(H+)·c水(OH-)(忽略水电离出的H+的浓度)。
(2)碱溶液中Kw=c水(H+)·c碱(OH-)(忽略水电离出的OH-的浓度)。
(3)不同溶液中,c(H+)与c(OH-)不一定相等,
但由水电离出的c(H+)与c(OH-)一定相等。
