4.1 原子结构与元素周期表 (含解析)同步练习 2023-2024学年高一上学期人教版(2019)化学必修第一册
文档属性
| 名称 | 4.1 原子结构与元素周期表 (含解析)同步练习 2023-2024学年高一上学期人教版(2019)化学必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 368.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-28 00:00:00 | ||
图片预览


文档简介
4.1 原子结构与元素周期表 同步练习题
一、选择题
1.1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了下面的实验。他们用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。由示意图和上述发现推出的关于原子内部结构的一些假设,其中不合理的是
A.原子核体积很小,电子均匀的分布在原子核外
B.电子的质量很小
C.原子核与α粒子带同种电荷
D.原子内有相对较大的空间
2.科学家用轰击(锫)生成和,Ts就是科学家一直寻找的第117号元素。下列关于、、和的说法中不正确的是
A.、、和属于三种元素 B.和互为同位素
C.117号元素的相对原子质量为293.5 D.、表示两种核素
3.原子序数为35的元素R,在周期表中的位置为
A.第三周期第VA族 B.第四周期第VIIA族
C.第五周期第IIIA族 D.第四周期第VA族
4.与元素的化学性质关系最密切的是
A.质量数 B.电子数 C.最外层电子数 D.核外电子层数
5.下列化学用语正确的是
A.核内质子数为117,核内中子数为174的核素Ts可表示为:Ts
B.18O和16O互为同位素
C.S2-的结构示意图为
D.U中质子数和中子数相差147
6.已知镓(Ga)有两种天然同位素,一种是,其原子在天然同位素原子中所占的百分比为60%。实验测得镓元素的摩尔质量为69.8g/mol,则此推知镓的另一种同位素是
A. B. C. D.
7.经分析,某物质由同种元素组成,则此物质
A.一定是化合物 B.一定是纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
8.硒(Se)是人体必需的微量元素,以下关于与的说法正确的是
A.互为同位素 B.质量数相同
C.是同种核素 D.中子数相同
二、非选择题
9.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答下列问题:
(1)A元素是 、B元素是 、C元素是 (用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是 。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
(4)F是由两种元素组成的三原子分子,其分子式是 。
(5)G分子中含有4个原子,其分子式是 。
(6)H分子中含有8个原子,其分子式是 。
10.原子的表示。
(1)通常用表示一个原子,其中表示 ,Z表示 。
(2)补全下表。
微粒符号 质子数 中子数 质量数 核外电子数
8 8
11.和代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,与相邻,与也相邻;
②、和三种元素的原子最外层电子数之和为17。
请回答下列问题。
(1)、和三种元素是否位于同一周期? (填“是”或“否”),理由是 。
(2)是 (填元素符号,下同),是 ,是 。
(3)、、和可组成一种化合物,其中各元素原子个数之比为。写出该化合物的名称及化学式: 。
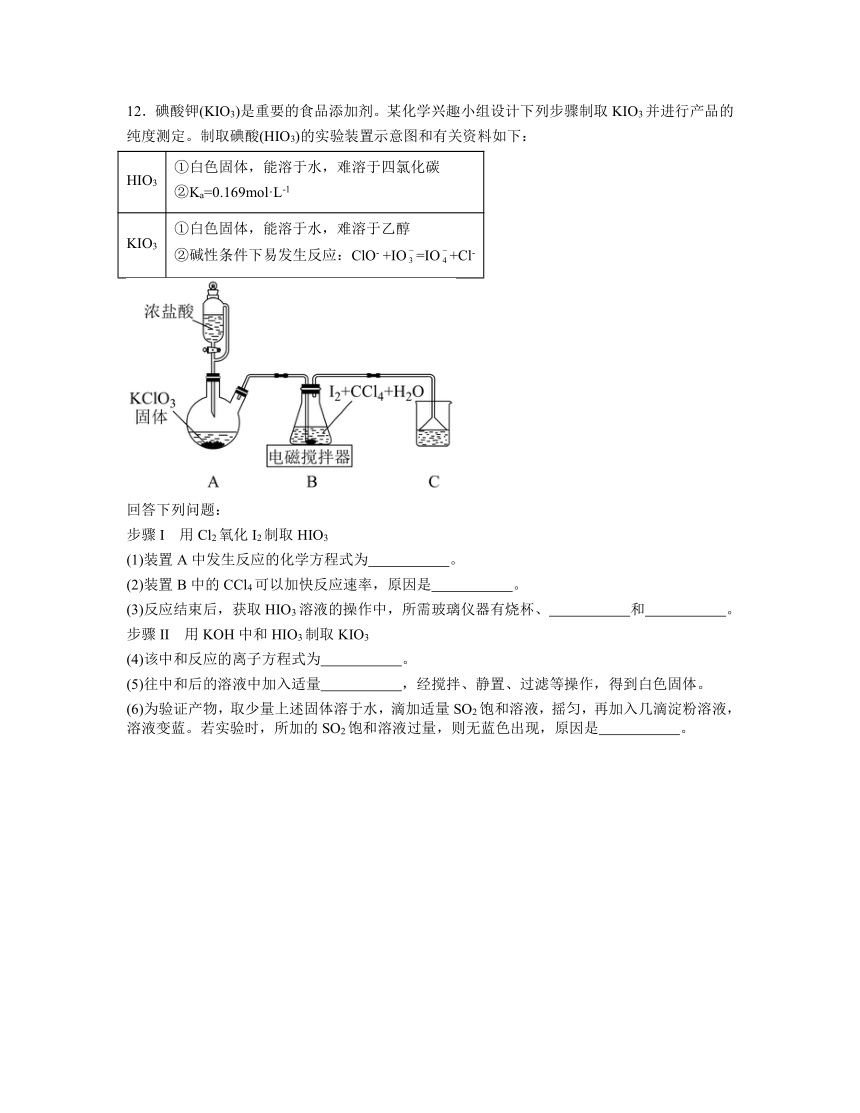
12.碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3并进行产品的纯度测定。制取碘酸(HIO3)的实验装置示意图和有关资料如下:
HIO3 ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1
KIO3 ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应:ClO- +IO=IO+Cl-
回答下列问题:
步骤I 用Cl2氧化I2制取HIO3
(1)装置A中发生反应的化学方程式为 。
(2)装置B中的CCl4可以加快反应速率,原因是 。
(3)反应结束后,获取HIO3溶液的操作中,所需玻璃仪器有烧杯、 和 。
步骤II 用KOH中和HIO3制取KIO3
(4)该中和反应的离子方程式为 。
(5)往中和后的溶液中加入适量 ,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的SO2饱和溶液过量,则无蓝色出现,原因是 。
【参考答案】
一、选择题
1.A
解析:A.原子核体积很小,电子在原子核外绕核运动,但不是均匀分布,A错误;
B.原子的质量集中在原子核上,电子的质量很小,B正确;
C.有极少数α粒子被弹了回来,说明原子核与α粒子带同种电荷且原子核质量很大,C正确;
D.大多数α粒子能穿透金箔而不改变原来的运动方向,说明原子内有相对较大的空间,D正确;
故选A。
2.C
解析:A.质子数决定元素种类,故、、和有三种质子数,故属于三种元素,A正确;
B.和质子数相同,中子数不同,互为同位素,B正确;
C.和的存在比例不明确,不能计算元素的相对原子质量,C错误;
D.、二者质子数不同,表示两种核素,D正确;
故选C。
3.B
解析:原子序数为35的元素的核外电子排布依次为2、8、18、7,其核外共有四个电子层,位于第四周期,最外层电子数为7,位于第VIIA族,则其在周期表中的位置为第四周期第VIIA族;
故答案选B。
4.C
解析:A.质量数决定原子的种类,A错误;
B.电子数的多少决定着原子核外电子排布特别是最外层电子排布,B错误;
C.最外层电子数的多少决定着元素的化学性质,一般地,金属元素最外层电子数小于4,且越少金属性越强,非金属元素最外层电子数大于4,且越多非金属性越强,C正确;
D.核外电子层数决定着元素所在的周期数,D错误;
答案为C。
5.B
解析:A.元素符号的左上方为质量数,左下方为质子数,因此核内质子数为117,中子数为174的核素Ts可表示为,A错误;
B.同位素是指质子数相同,中子数不同的核素,故和互为同位素,B正确;
C.S2-的最外层为8个电子,结构示意图为,C错误;
D.的中子数为239 92=147,质子数和中子数相差147 92=55,D错误;
故选B。
6.C
解析:设另一种镓元素的质量数为A,镓元素的摩尔质量在数值上等于相对原子质量,则根据题意,,解得A=71,所以另一种镓元素为,故选C。
7.D
解析:A.化合物一定由两种或两种以上元素组成,一种元素不可能组成化合物,A不正确;
B.一种元素可能组成几种物质,若这些物质混在一起,则为混合物,如O2与O3,B不正确;
C.一种元素组成的物质可能是纯净物,如白磷或红磷,C不正确;
D.由以上分析可知,一种元素组成的物质,可能是纯净物也可能是混合物,D正确;
故选D。
8.A
解析:A.与的质子数都为34,中子数不同,两者互为同位素,A正确;
B.的质量数为78,的质量数为80,两者质量数不同,B错误;
C.与的质子数相同,中子数不同,不是同种核素,C错误;
D.的中子数为78-34=44,的中子数为80-34=46,两者中子数不同,D错误;
答案选A。
二、非选择题
9.(1) K Cl S (2)HCl (3)F2 (4)H2S (5)H2O2(或PH3) (6)C2H6
解析:含有18个电子的简单阳离子为Ca2+和K+,简单阴离子为Cl-、S2-等,氢化物有HCl、H2S、PH3、H2O2、C2H6等,其他的如F2、Ar等;则A+、B-、C2-分别为K+、Cl-、S2-,据此分析解答。
(1)A+、B-、C2-分别为K+、Cl-、S2-,A元素是K、B元素是Cl、C元素是S;
(2)D是由两种元素组成的双原子分子,且含有18个电子,故其分子式HCl;
(3)E是所有含18个电子的微粒中氧化能力最强的分子,即非金属性最强的分子,其分子式是F2;
(4)F是由两种元素组成的三原子分子,其分子式是H2S;
(5)G分子中含有4个原子,其分子式是H2O2或PH3;
(6)H分子中含有8个原子,其分子式是C2H6。
10.(1) 质量数 质子数
(2) 6 6 12 6 16 8 8 10 18 8
解析:(1)通常用表示一个原子,其中表示质量数,Z表示质子数;
(2)中质子数为6,质量数为12,中子数为12-6=6,对于电中性的原子而言核外电子数等于质子数,故核外电子为6;质子数为8,中子数为8的核素其质量数为8+8=16,故该原子为,对于电中性的原子而言核外电子数等于质子数,故核外电子为8;中质子数为8,质量数为18,中子数为18-8=10,对于电中性的原子而言核外电子数等于质子数,故核外电子为8。
11.否 若三者处于同一周期,则三者的原子最外层电子数之和不可能为17 硫酸铵,
【分析】(1)若Y、Z、W三者处于同一周期,最外层电子数之和不可能为17;
(2)列出可能的位置关系,利用最外层电子数之和为17推断;
(3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,为铵根离子。
解析:(1)假设、、处于同一周期,根据它们的原子序数依次增大,其原子的最外屋电子数可分别设为、、,则,不为整数,不合理,即假设不成立;
(2)、、可能出现的位置关系有如下两种情况:
设的最外层电子数为,若为第一种情况,则有,解得,、、对应的三种元素分别为、、;若为第二种情况,则有,不为整数,不合理。故、、分别为、、;
(3)该化合物中硫原子与氧原子的个数之比为,即它们组成硫酸根离子,化合物中原子与氮原子的个数之比为,且的原子序数比氨的原子序数小,由此可知它们组成的离子是铵根离子,所以该化合物为硫酸铵()。
12.(1)KC1O +6HCl(浓)=KCl+3Cl ↑+3H O
(2)I 和Cl 易溶于CCl
(3) 增大了反应物浓度 分液漏斗、玻璃棒
(4)HIO3+ OHˉ=IO+H2O
(5)乙醇(或“酒精”“C2H5OH”)
(6)过量的SO 将IO (或I )还原为I-(或3SO + IO+ 3H2O=Iˉ+ 3SO+ 6H 或 SO2+I2+ 2H2O=2I + SO+ 4H )
解析:步骤Ⅰ用Cl2氧化I2制取HIO3:A装置制备氯气,B装置Cl2氧化I2制取HIO3,C装置吸收尾气;
(1)装置A用于制取氯气,反应为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)由于Cl2、I2在水中溶解度小,在CCl4中溶解度却很大,能增大反应物浓度,使反应速率显著加快;
(3)依据物质信息可知,B中反应后产生的碘酸主要在水溶液中且与CCl4互不相溶,所以必须采用分液法以获取碘酸溶液,分液需要的玻璃仪器有烧杯、分液漏斗、玻璃棒;
(4)KOH和HIO3生成KIO3和水,HIO3属于弱电解质,在离子方程式中不能用离子表示,故离子反应为:HIO3+ OHˉ=IO+H2O;
(5)KIO3在乙醇中的溶解度较低,加入适量乙醇可以使KIO3从溶液中析出,故往中和后的溶液中加入适量乙醇,经搅拌、静置、过滤等操作,得到白色固体;故答案为:乙醇(或“酒精”“C2H5OH”);
(6)依题意可知,少量饱和SO2水溶液能将KIO3还原为I2,但加入过量饱和SO2水溶液却无蓝色出现,说明也能过量的SO 将IO (或I )还原为I-(或3SO + IO+ 3H2O=Iˉ+ 3SO+ 6H 或 SO2+I2+ 2H2O=2I + SO+ 4H )
一、选择题
1.1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了下面的实验。他们用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。由示意图和上述发现推出的关于原子内部结构的一些假设,其中不合理的是
A.原子核体积很小,电子均匀的分布在原子核外
B.电子的质量很小
C.原子核与α粒子带同种电荷
D.原子内有相对较大的空间
2.科学家用轰击(锫)生成和,Ts就是科学家一直寻找的第117号元素。下列关于、、和的说法中不正确的是
A.、、和属于三种元素 B.和互为同位素
C.117号元素的相对原子质量为293.5 D.、表示两种核素
3.原子序数为35的元素R,在周期表中的位置为
A.第三周期第VA族 B.第四周期第VIIA族
C.第五周期第IIIA族 D.第四周期第VA族
4.与元素的化学性质关系最密切的是
A.质量数 B.电子数 C.最外层电子数 D.核外电子层数
5.下列化学用语正确的是
A.核内质子数为117,核内中子数为174的核素Ts可表示为:Ts
B.18O和16O互为同位素
C.S2-的结构示意图为
D.U中质子数和中子数相差147
6.已知镓(Ga)有两种天然同位素,一种是,其原子在天然同位素原子中所占的百分比为60%。实验测得镓元素的摩尔质量为69.8g/mol,则此推知镓的另一种同位素是
A. B. C. D.
7.经分析,某物质由同种元素组成,则此物质
A.一定是化合物 B.一定是纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
8.硒(Se)是人体必需的微量元素,以下关于与的说法正确的是
A.互为同位素 B.质量数相同
C.是同种核素 D.中子数相同
二、非选择题
9.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答下列问题:
(1)A元素是 、B元素是 、C元素是 (用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是 。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
(4)F是由两种元素组成的三原子分子,其分子式是 。
(5)G分子中含有4个原子,其分子式是 。
(6)H分子中含有8个原子,其分子式是 。
10.原子的表示。
(1)通常用表示一个原子,其中表示 ,Z表示 。
(2)补全下表。
微粒符号 质子数 中子数 质量数 核外电子数
8 8
11.和代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,与相邻,与也相邻;
②、和三种元素的原子最外层电子数之和为17。
请回答下列问题。
(1)、和三种元素是否位于同一周期? (填“是”或“否”),理由是 。
(2)是 (填元素符号,下同),是 ,是 。
(3)、、和可组成一种化合物,其中各元素原子个数之比为。写出该化合物的名称及化学式: 。
12.碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3并进行产品的纯度测定。制取碘酸(HIO3)的实验装置示意图和有关资料如下:
HIO3 ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1
KIO3 ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应:ClO- +IO=IO+Cl-
回答下列问题:
步骤I 用Cl2氧化I2制取HIO3
(1)装置A中发生反应的化学方程式为 。
(2)装置B中的CCl4可以加快反应速率,原因是 。
(3)反应结束后,获取HIO3溶液的操作中,所需玻璃仪器有烧杯、 和 。
步骤II 用KOH中和HIO3制取KIO3
(4)该中和反应的离子方程式为 。
(5)往中和后的溶液中加入适量 ,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的SO2饱和溶液过量,则无蓝色出现,原因是 。
【参考答案】
一、选择题
1.A
解析:A.原子核体积很小,电子在原子核外绕核运动,但不是均匀分布,A错误;
B.原子的质量集中在原子核上,电子的质量很小,B正确;
C.有极少数α粒子被弹了回来,说明原子核与α粒子带同种电荷且原子核质量很大,C正确;
D.大多数α粒子能穿透金箔而不改变原来的运动方向,说明原子内有相对较大的空间,D正确;
故选A。
2.C
解析:A.质子数决定元素种类,故、、和有三种质子数,故属于三种元素,A正确;
B.和质子数相同,中子数不同,互为同位素,B正确;
C.和的存在比例不明确,不能计算元素的相对原子质量,C错误;
D.、二者质子数不同,表示两种核素,D正确;
故选C。
3.B
解析:原子序数为35的元素的核外电子排布依次为2、8、18、7,其核外共有四个电子层,位于第四周期,最外层电子数为7,位于第VIIA族,则其在周期表中的位置为第四周期第VIIA族;
故答案选B。
4.C
解析:A.质量数决定原子的种类,A错误;
B.电子数的多少决定着原子核外电子排布特别是最外层电子排布,B错误;
C.最外层电子数的多少决定着元素的化学性质,一般地,金属元素最外层电子数小于4,且越少金属性越强,非金属元素最外层电子数大于4,且越多非金属性越强,C正确;
D.核外电子层数决定着元素所在的周期数,D错误;
答案为C。
5.B
解析:A.元素符号的左上方为质量数,左下方为质子数,因此核内质子数为117,中子数为174的核素Ts可表示为,A错误;
B.同位素是指质子数相同,中子数不同的核素,故和互为同位素,B正确;
C.S2-的最外层为8个电子,结构示意图为,C错误;
D.的中子数为239 92=147,质子数和中子数相差147 92=55,D错误;
故选B。
6.C
解析:设另一种镓元素的质量数为A,镓元素的摩尔质量在数值上等于相对原子质量,则根据题意,,解得A=71,所以另一种镓元素为,故选C。
7.D
解析:A.化合物一定由两种或两种以上元素组成,一种元素不可能组成化合物,A不正确;
B.一种元素可能组成几种物质,若这些物质混在一起,则为混合物,如O2与O3,B不正确;
C.一种元素组成的物质可能是纯净物,如白磷或红磷,C不正确;
D.由以上分析可知,一种元素组成的物质,可能是纯净物也可能是混合物,D正确;
故选D。
8.A
解析:A.与的质子数都为34,中子数不同,两者互为同位素,A正确;
B.的质量数为78,的质量数为80,两者质量数不同,B错误;
C.与的质子数相同,中子数不同,不是同种核素,C错误;
D.的中子数为78-34=44,的中子数为80-34=46,两者中子数不同,D错误;
答案选A。
二、非选择题
9.(1) K Cl S (2)HCl (3)F2 (4)H2S (5)H2O2(或PH3) (6)C2H6
解析:含有18个电子的简单阳离子为Ca2+和K+,简单阴离子为Cl-、S2-等,氢化物有HCl、H2S、PH3、H2O2、C2H6等,其他的如F2、Ar等;则A+、B-、C2-分别为K+、Cl-、S2-,据此分析解答。
(1)A+、B-、C2-分别为K+、Cl-、S2-,A元素是K、B元素是Cl、C元素是S;
(2)D是由两种元素组成的双原子分子,且含有18个电子,故其分子式HCl;
(3)E是所有含18个电子的微粒中氧化能力最强的分子,即非金属性最强的分子,其分子式是F2;
(4)F是由两种元素组成的三原子分子,其分子式是H2S;
(5)G分子中含有4个原子,其分子式是H2O2或PH3;
(6)H分子中含有8个原子,其分子式是C2H6。
10.(1) 质量数 质子数
(2) 6 6 12 6 16 8 8 10 18 8
解析:(1)通常用表示一个原子,其中表示质量数,Z表示质子数;
(2)中质子数为6,质量数为12,中子数为12-6=6,对于电中性的原子而言核外电子数等于质子数,故核外电子为6;质子数为8,中子数为8的核素其质量数为8+8=16,故该原子为,对于电中性的原子而言核外电子数等于质子数,故核外电子为8;中质子数为8,质量数为18,中子数为18-8=10,对于电中性的原子而言核外电子数等于质子数,故核外电子为8。
11.否 若三者处于同一周期,则三者的原子最外层电子数之和不可能为17 硫酸铵,
【分析】(1)若Y、Z、W三者处于同一周期,最外层电子数之和不可能为17;
(2)列出可能的位置关系,利用最外层电子数之和为17推断;
(3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,为铵根离子。
解析:(1)假设、、处于同一周期,根据它们的原子序数依次增大,其原子的最外屋电子数可分别设为、、,则,不为整数,不合理,即假设不成立;
(2)、、可能出现的位置关系有如下两种情况:
设的最外层电子数为,若为第一种情况,则有,解得,、、对应的三种元素分别为、、;若为第二种情况,则有,不为整数,不合理。故、、分别为、、;
(3)该化合物中硫原子与氧原子的个数之比为,即它们组成硫酸根离子,化合物中原子与氮原子的个数之比为,且的原子序数比氨的原子序数小,由此可知它们组成的离子是铵根离子,所以该化合物为硫酸铵()。
12.(1)KC1O +6HCl(浓)=KCl+3Cl ↑+3H O
(2)I 和Cl 易溶于CCl
(3) 增大了反应物浓度 分液漏斗、玻璃棒
(4)HIO3+ OHˉ=IO+H2O
(5)乙醇(或“酒精”“C2H5OH”)
(6)过量的SO 将IO (或I )还原为I-(或3SO + IO+ 3H2O=Iˉ+ 3SO+ 6H 或 SO2+I2+ 2H2O=2I + SO+ 4H )
解析:步骤Ⅰ用Cl2氧化I2制取HIO3:A装置制备氯气,B装置Cl2氧化I2制取HIO3,C装置吸收尾气;
(1)装置A用于制取氯气,反应为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)由于Cl2、I2在水中溶解度小,在CCl4中溶解度却很大,能增大反应物浓度,使反应速率显著加快;
(3)依据物质信息可知,B中反应后产生的碘酸主要在水溶液中且与CCl4互不相溶,所以必须采用分液法以获取碘酸溶液,分液需要的玻璃仪器有烧杯、分液漏斗、玻璃棒;
(4)KOH和HIO3生成KIO3和水,HIO3属于弱电解质,在离子方程式中不能用离子表示,故离子反应为:HIO3+ OHˉ=IO+H2O;
(5)KIO3在乙醇中的溶解度较低,加入适量乙醇可以使KIO3从溶液中析出,故往中和后的溶液中加入适量乙醇,经搅拌、静置、过滤等操作,得到白色固体;故答案为:乙醇(或“酒精”“C2H5OH”);
(6)依题意可知,少量饱和SO2水溶液能将KIO3还原为I2,但加入过量饱和SO2水溶液却无蓝色出现,说明也能过量的SO 将IO (或I )还原为I-(或3SO + IO+ 3H2O=Iˉ+ 3SO+ 6H 或 SO2+I2+ 2H2O=2I + SO+ 4H )
