4.3金属的腐蚀与防护(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 382.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-28 11:53:09 | ||
图片预览



文档简介
4.3金属的腐蚀与防护同步练习题
一、选择题
1.化学与生活息息相关,下列说法正确的是
A.掩埋废旧电池不会造成环境污染
B.保护水中的钢闸门,应将其与电源正极连接
C.“祝融号”火星车使用的太阳能电池板可将电能转化为化学能
D.为实现能源的可持续发展,必须“开源”与“节流”一起抓
2.钢铁腐蚀发生得最普遍的是
A.物理腐蚀 B.吸氧腐蚀 C.析氢腐蚀 D.摩擦损耗
3.化学能与电能的直接转化需要在一定的装置中才能实现。下列装置与对应叙述相符的是
A.装置①中的溶液浓度保持不变
B.装置②可通过牺牲阳极保护钢铁设施
C.装置③的正极电极反应式:
D.装置④的正极电极反应式:
4.化学与生活密切相关,下列说法错误的是
A.热的纯碱溶液去污能力强
B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极保护法
C.可用溶液与溶液混合制取
D.锅炉水垢中含有,可先用饱和溶液浸泡,再用盐酸除去
5.下列有关金属腐蚀的说法正确的是
A.电化学腐蚀是在外加电流作用下不纯金属发生化学反应被损耗的过程
B.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.镀锌的铁板比镀锡的铁板更容易被腐蚀
6.下列有关物质的性质与用途具有对应关系的是
A.Al(OH)3具有两性,可用作塑料制品的阻燃剂
B.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
C.(NH4)2SO4能使蛋白质盐析,可用于蛋白质的分离提纯
D.铜的金属活动性比铁弱,可在海外轮外壳上装若干铜块以减缓其腐蚀
7.据统计,2022年我国光伏发电并装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是
A.工作时电子的流向为:乙→a→b→甲
B.a为阴极,电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑
C.c为阳离子交换膜,d为阴离子交换膜,e为质子交换膜
D.制备182g四甲基氢氧化铵,两极共产生33.6L气体
8.下列有关金属腐蚀与防护的说法正确的是
A.纯铁比生铁更易生锈
B.金属腐蚀的实质是金属失去电子被还原的过程
C.轮船的船壳水线以下常装有一些锌块,这是利用了电化学保护法中的牺牲阳极法
D.在潮湿的空气中铁易发生反应:,进而形成铁锈
二、非选择题
9.完成下列问题。
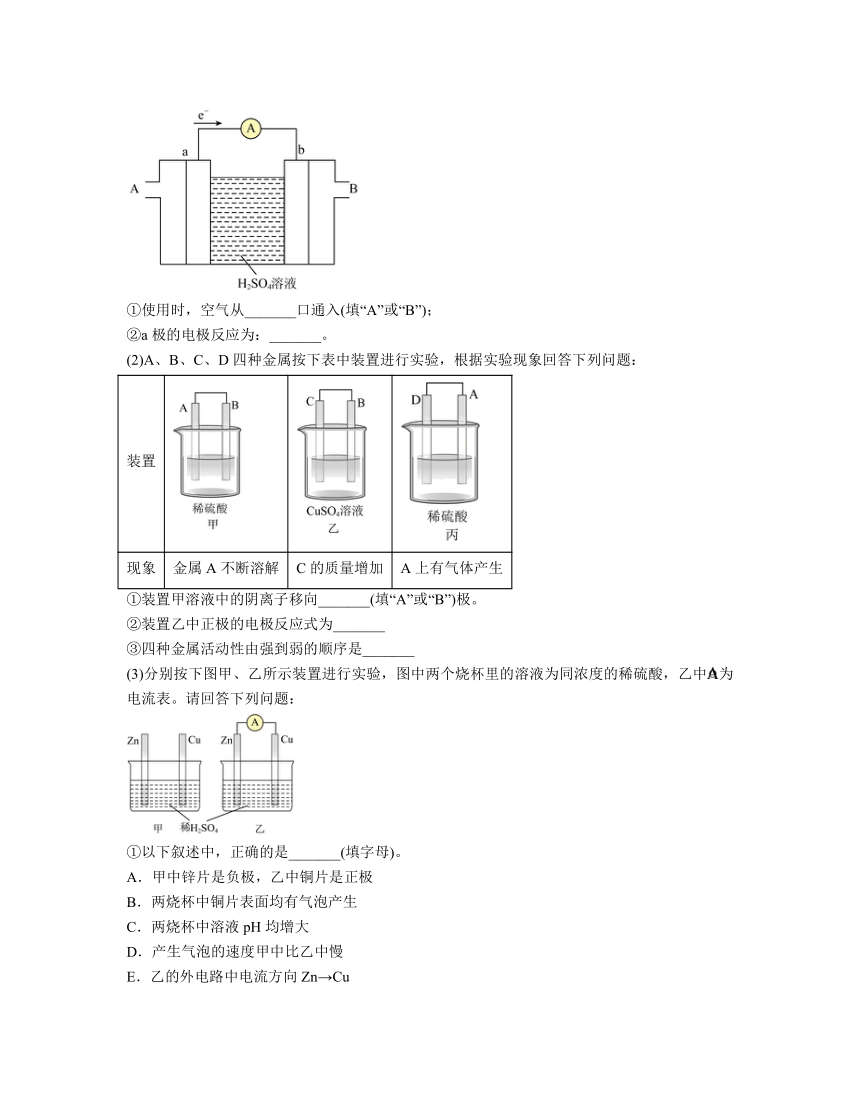
(1)燃料电池是一种高效、环境友好的供电装置,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从_______口通入(填“A”或“B”);
②a极的电极反应为:_______。
(2)A、B、C、D四种金属按下表中装置进行实验,根据实验现象回答下列问题:
装置
现象 金属A不断溶解 C的质量增加 A上有气体产生
①装置甲溶液中的阴离子移向_______(填“A”或“B”)极。
②装置乙中正极的电极反应式为_______
③四种金属活动性由强到弱的顺序是_______
(3)分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中为电流表。请回答下列问题:
①以下叙述中,正确的是_______(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中向铜片方向移动
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______。
(4)锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_______;当导线中有0.4mol电子通过时,理论上消耗的O2在标准状况下的体积是_______。
10.金属腐蚀的电化学原理可用下图模拟。
(1)写出有关电极反应式:
①铁棒上的电极反应式:_______________。
②碳棒上的电极反应式:_______________。
(2)若将O2撤走,并将NaCl溶液改为稀溶液,则此图可表示______(填“析氢”或“吸氧”)腐蚀原理;若想使铁棒不被腐蚀,可以将铁棒与外电源的______极相连。
【参考答案】
一、选择题
1.D
解析:A.废旧电池中含有重金属等金属离子,会造成土壤污染,水体污染等,A错误;
B.将水中的钢闸门与电源的正极连接,使钢闸门成为阳极,失电子速率加快,加速了钢闸门的腐蚀,B错误;
C.“祝融号”火星车使用的太阳能电池板将太阳能转化为电能,C错误;
D.解决能源危机的方法是开发新能源和节约现有能源,提高原料的利用率, D正确;
故选D。
2.B
解析:钢铁腐蚀发生得最普遍的是电化学腐蚀,电化学腐蚀包含吸氧腐蚀和析氢腐蚀,以吸氧腐蚀为主,最为普遍,故B正确;
故选B。
3.D
解析:A.装置①阳极先是锌失去电子,再是铁失去电子,再是铜失去电子,而阴极铜离子得到电子,因此溶液中的浓度会降低,故A不符合题意;
B.装置②可通过牺牲阳极保护钢铁设施,则应该接一块活泼性比铁强的金属,比如金属锌,而不是能接活泼性比铁弱的金属,或则会加快铁的腐蚀,故B不符合题意;
C.装置③的正极是铁离子得到电子变为亚铁离子,其电极反应式:,故C不符合题意;
D.装置④是氢氧酸性燃料电池,则正极电极反应式:,故D符合题意。
综上所述,答案为D。
4.C
解析:A.纯碱为Na2CO3,其水溶液中存在CO+H2OHCO+OH-,升高温度促进水解,碱性增强,去污能力增强,故A说法正确;
B.镁的金属性强于铁的金属性,构成原电池,镁作负极,防止内胆腐蚀,这种方法称为牺牲阳极法,故B说法正确;
C.Al3+和S2-在水溶液中发生双水解反应,生成氢氧化铝沉淀和H2S,因此制备硫化铝常用铝单质与硫单质反应,故C说法错误;
D.CaCO3难溶于水,CaSO4微溶于水,加入饱和碳酸钠溶液,CaSO4转化成更难溶的CaCO3,碳酸钙能与盐酸反应生成可溶于水的氯化钙,故D说法正确;
答案为C。
5.B
解析:A.电化学腐蚀是不纯金属与电解质溶液接触时发生原电池反应而损耗的过程,不需要外加电流,故A不选;
B.金属的电化学腐蚀和化学腐蚀本质相同均属于氧化还原反应,但电化学腐蚀伴有电流产生,而化学腐蚀无电流产生,故选B;
C.钢铁腐蚀最普遍的是吸氧腐蚀,正极吸收氧气,而不是负极吸收氧气,故C不选;
D.镀锌的铁板破损后,Zn作负极,Fe仍受保护,而镀锡的铁板破损后,铁作负极被腐蚀,故D不选。
答案选B
6.C
解析:A.Al(OH)3分解吸热使可燃物的温度降低,并且生成的高熔点的Al2O3能覆盖在可燃物上隔绝空气,从而作阻燃剂,与Al(OH)3具有两性无关,A错误;
B.石英的主要成分为SiO2,SiO2会和烧碱、纯碱等反应,不能用石英坩埚熔化烧碱、纯碱等固体,B错误;
C.(NH4)2SO4为非重金属盐,会降低蛋白质的溶解度,发生盐析,可用于蛋白质的分离提纯,C正确;
D.铜的金属活动性比铁弱,形成原电池时Cu为正极,Fe为负极,会加速海外轮外壳的腐蚀,D错误;
综上所述答案为C。
7.B
【分析】根据氯化钠稀溶液变为氯化钠浓溶液,则e为阳离子交换膜,最右边的钠离子穿过e进入到de中,cd处的氯离子穿过d进入到de中,因此b为阳极,a为阴极,乙为负极,甲为正极。
解析:A.电子流动方向是负极→阴极,阳极→正极,即工作时电子的流向为:乙→a,b→甲,电子不能再溶液中移动,故A错误;
B.根据前面分析得到a为阴极,在根据四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],则a电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑,故B正确;
C.根据前面分析得到e为阳离子交换膜,右边的钠离子穿过e进入到de中,故C错误;
D.b电极为阳极,则电极反应式为4OH- 4e-=2H2O+O2↑,根据2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑和电子转移分析,生成2mol(CH3)4NOH生成1mol氢气和0.5mol氧气共1.5mol气体,则制备182g四甲基氢氧化铵(物质的量为2mol),两极共产生33.6L气体(在标准状况下),故D错误。
综上所述,答案为B。
8.C
解析:A.生铁表面有电解质薄膜时容易形成原电池、能发生电化学腐蚀,故生铁更易被腐蚀,A错误;
B.金属腐蚀的实质是金属失去电子被氧化的过程,B错误;
C.锌的金属性强于铁,与铁构成原电池时,锌是负极,铁是正极被保护,因此轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法,C正确;
D.在原电池中铁只能转化为亚铁离子:Fe 2e =Fe2+ ,D错误;
答案选C。
二、非选择题
9.(1) B
(2) A D>A>B>C
(3) CD 锌片不纯,在锌片上形成原电池
(4) Zn 2.24
解析:(1)①氢氧燃料电池中,通入氢气的一极为负极,负极发生氧化反应,通入空气的一极为正极,正极发生还原反应,原电池工作时,电子由负极向正极流动,根据电子流向可知,a为负极,b为正极,则空气应从B口通入,故答案为:B;
②a极为负极,氢气在负极上发生氧化反应,电极反应式为:,故答案为:;
(2)甲中金属A不断溶解,则A作负极,B为正极,乙中C的质量增加,则C为正极,B为负极,丙中A上有气体产生,则A为正极,D为负极。
①装置甲中,A为负极,B为正极,原电池工作时阴离子向负极移动,即移向A极,故答案为:A;
②装置乙中,C为正极,正极发生还原反应,电极反应式为,故答案为:;
③原电池装置中,负极金属活泼性强于正极,则四种金属活动性由强到弱的顺序是D>A>B>C,故答案为:D>A>B>C;
(3)①A.甲中没有形成闭合回路,不能构成原电池,不存在正负极,故A错误;
B.甲中稀硫酸与铜不反应,铜片表面无气泡产生,故B错误;
C.甲、乙中的总反应均为,均消耗氢离子,则两烧杯中溶液的pH均增大,故C正确;
D.甲没有构成原电池,乙构成原电池,原电池反应能加快反应速率,即产生气泡的速率甲中比乙中慢,故D正确;
E.乙装置是原电池,Cu作正极,Zn作负极,电流由正极Cu经过外电路流向负极Zn,故E错误;
F.原电池工作时,阴离子向负极移动,乙中Zn为负极,则溶液中向锌片方向移动,故F错误;
故答案为:CD;
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,可能是锌片不纯,在锌片上形成原电池,故答案为:锌片不纯,在锌片上形成原电池;
(4)失电子发生氧化反应的金属作负极,该反应中Zn失去电子发生氧化反应,则负极材料为Zn;根据2Zn+O2=2ZnO可知,消耗1mol氧气转移4mol电子,则转移0.4mol电子时,消耗0.1mol氧气,体积为22.4L/mol×0.1mol =2.24L,故答案为:Zn;2.24。
10. Fe 2e ═Fe2+ O2+2H2O+4e ═4OH 析氢 负
【分析】图示为Fe的吸氧腐蚀,负极上Fe失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子。
解析:(1)①铁棒上的电极反应式为:Fe 2e ═Fe2+,故答案为:Fe 2e ═Fe2+;
②碳棒上的电极反应式为:O2+2H2O+4e ═4OH ,故答案为:O2+2H2O+4e ═4OH ;
(2)将NaCl溶液改为稀H2SO4溶液,变成析氢腐蚀;保护铁棒时,可以将铁棒与外加电源的负极,故答案为:析氢;负。
【点睛】保护金属防护:①牺牲阳极的阴极保护法(原电池原理);②外加电流的阴极保护法(电解池原理)
一、选择题
1.化学与生活息息相关,下列说法正确的是
A.掩埋废旧电池不会造成环境污染
B.保护水中的钢闸门,应将其与电源正极连接
C.“祝融号”火星车使用的太阳能电池板可将电能转化为化学能
D.为实现能源的可持续发展,必须“开源”与“节流”一起抓
2.钢铁腐蚀发生得最普遍的是
A.物理腐蚀 B.吸氧腐蚀 C.析氢腐蚀 D.摩擦损耗
3.化学能与电能的直接转化需要在一定的装置中才能实现。下列装置与对应叙述相符的是
A.装置①中的溶液浓度保持不变
B.装置②可通过牺牲阳极保护钢铁设施
C.装置③的正极电极反应式:
D.装置④的正极电极反应式:
4.化学与生活密切相关,下列说法错误的是
A.热的纯碱溶液去污能力强
B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极保护法
C.可用溶液与溶液混合制取
D.锅炉水垢中含有,可先用饱和溶液浸泡,再用盐酸除去
5.下列有关金属腐蚀的说法正确的是
A.电化学腐蚀是在外加电流作用下不纯金属发生化学反应被损耗的过程
B.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.镀锌的铁板比镀锡的铁板更容易被腐蚀
6.下列有关物质的性质与用途具有对应关系的是
A.Al(OH)3具有两性,可用作塑料制品的阻燃剂
B.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
C.(NH4)2SO4能使蛋白质盐析,可用于蛋白质的分离提纯
D.铜的金属活动性比铁弱,可在海外轮外壳上装若干铜块以减缓其腐蚀
7.据统计,2022年我国光伏发电并装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是
A.工作时电子的流向为:乙→a→b→甲
B.a为阴极,电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑
C.c为阳离子交换膜,d为阴离子交换膜,e为质子交换膜
D.制备182g四甲基氢氧化铵,两极共产生33.6L气体
8.下列有关金属腐蚀与防护的说法正确的是
A.纯铁比生铁更易生锈
B.金属腐蚀的实质是金属失去电子被还原的过程
C.轮船的船壳水线以下常装有一些锌块,这是利用了电化学保护法中的牺牲阳极法
D.在潮湿的空气中铁易发生反应:,进而形成铁锈
二、非选择题
9.完成下列问题。
(1)燃料电池是一种高效、环境友好的供电装置,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从_______口通入(填“A”或“B”);
②a极的电极反应为:_______。
(2)A、B、C、D四种金属按下表中装置进行实验,根据实验现象回答下列问题:
装置
现象 金属A不断溶解 C的质量增加 A上有气体产生
①装置甲溶液中的阴离子移向_______(填“A”或“B”)极。
②装置乙中正极的电极反应式为_______
③四种金属活动性由强到弱的顺序是_______
(3)分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中为电流表。请回答下列问题:
①以下叙述中,正确的是_______(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中向铜片方向移动
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______。
(4)锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_______;当导线中有0.4mol电子通过时,理论上消耗的O2在标准状况下的体积是_______。
10.金属腐蚀的电化学原理可用下图模拟。
(1)写出有关电极反应式:
①铁棒上的电极反应式:_______________。
②碳棒上的电极反应式:_______________。
(2)若将O2撤走,并将NaCl溶液改为稀溶液,则此图可表示______(填“析氢”或“吸氧”)腐蚀原理;若想使铁棒不被腐蚀,可以将铁棒与外电源的______极相连。
【参考答案】
一、选择题
1.D
解析:A.废旧电池中含有重金属等金属离子,会造成土壤污染,水体污染等,A错误;
B.将水中的钢闸门与电源的正极连接,使钢闸门成为阳极,失电子速率加快,加速了钢闸门的腐蚀,B错误;
C.“祝融号”火星车使用的太阳能电池板将太阳能转化为电能,C错误;
D.解决能源危机的方法是开发新能源和节约现有能源,提高原料的利用率, D正确;
故选D。
2.B
解析:钢铁腐蚀发生得最普遍的是电化学腐蚀,电化学腐蚀包含吸氧腐蚀和析氢腐蚀,以吸氧腐蚀为主,最为普遍,故B正确;
故选B。
3.D
解析:A.装置①阳极先是锌失去电子,再是铁失去电子,再是铜失去电子,而阴极铜离子得到电子,因此溶液中的浓度会降低,故A不符合题意;
B.装置②可通过牺牲阳极保护钢铁设施,则应该接一块活泼性比铁强的金属,比如金属锌,而不是能接活泼性比铁弱的金属,或则会加快铁的腐蚀,故B不符合题意;
C.装置③的正极是铁离子得到电子变为亚铁离子,其电极反应式:,故C不符合题意;
D.装置④是氢氧酸性燃料电池,则正极电极反应式:,故D符合题意。
综上所述,答案为D。
4.C
解析:A.纯碱为Na2CO3,其水溶液中存在CO+H2OHCO+OH-,升高温度促进水解,碱性增强,去污能力增强,故A说法正确;
B.镁的金属性强于铁的金属性,构成原电池,镁作负极,防止内胆腐蚀,这种方法称为牺牲阳极法,故B说法正确;
C.Al3+和S2-在水溶液中发生双水解反应,生成氢氧化铝沉淀和H2S,因此制备硫化铝常用铝单质与硫单质反应,故C说法错误;
D.CaCO3难溶于水,CaSO4微溶于水,加入饱和碳酸钠溶液,CaSO4转化成更难溶的CaCO3,碳酸钙能与盐酸反应生成可溶于水的氯化钙,故D说法正确;
答案为C。
5.B
解析:A.电化学腐蚀是不纯金属与电解质溶液接触时发生原电池反应而损耗的过程,不需要外加电流,故A不选;
B.金属的电化学腐蚀和化学腐蚀本质相同均属于氧化还原反应,但电化学腐蚀伴有电流产生,而化学腐蚀无电流产生,故选B;
C.钢铁腐蚀最普遍的是吸氧腐蚀,正极吸收氧气,而不是负极吸收氧气,故C不选;
D.镀锌的铁板破损后,Zn作负极,Fe仍受保护,而镀锡的铁板破损后,铁作负极被腐蚀,故D不选。
答案选B
6.C
解析:A.Al(OH)3分解吸热使可燃物的温度降低,并且生成的高熔点的Al2O3能覆盖在可燃物上隔绝空气,从而作阻燃剂,与Al(OH)3具有两性无关,A错误;
B.石英的主要成分为SiO2,SiO2会和烧碱、纯碱等反应,不能用石英坩埚熔化烧碱、纯碱等固体,B错误;
C.(NH4)2SO4为非重金属盐,会降低蛋白质的溶解度,发生盐析,可用于蛋白质的分离提纯,C正确;
D.铜的金属活动性比铁弱,形成原电池时Cu为正极,Fe为负极,会加速海外轮外壳的腐蚀,D错误;
综上所述答案为C。
7.B
【分析】根据氯化钠稀溶液变为氯化钠浓溶液,则e为阳离子交换膜,最右边的钠离子穿过e进入到de中,cd处的氯离子穿过d进入到de中,因此b为阳极,a为阴极,乙为负极,甲为正极。
解析:A.电子流动方向是负极→阴极,阳极→正极,即工作时电子的流向为:乙→a,b→甲,电子不能再溶液中移动,故A错误;
B.根据前面分析得到a为阴极,在根据四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],则a电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑,故B正确;
C.根据前面分析得到e为阳离子交换膜,右边的钠离子穿过e进入到de中,故C错误;
D.b电极为阳极,则电极反应式为4OH- 4e-=2H2O+O2↑,根据2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑和电子转移分析,生成2mol(CH3)4NOH生成1mol氢气和0.5mol氧气共1.5mol气体,则制备182g四甲基氢氧化铵(物质的量为2mol),两极共产生33.6L气体(在标准状况下),故D错误。
综上所述,答案为B。
8.C
解析:A.生铁表面有电解质薄膜时容易形成原电池、能发生电化学腐蚀,故生铁更易被腐蚀,A错误;
B.金属腐蚀的实质是金属失去电子被氧化的过程,B错误;
C.锌的金属性强于铁,与铁构成原电池时,锌是负极,铁是正极被保护,因此轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法,C正确;
D.在原电池中铁只能转化为亚铁离子:Fe 2e =Fe2+ ,D错误;
答案选C。
二、非选择题
9.(1) B
(2) A D>A>B>C
(3) CD 锌片不纯,在锌片上形成原电池
(4) Zn 2.24
解析:(1)①氢氧燃料电池中,通入氢气的一极为负极,负极发生氧化反应,通入空气的一极为正极,正极发生还原反应,原电池工作时,电子由负极向正极流动,根据电子流向可知,a为负极,b为正极,则空气应从B口通入,故答案为:B;
②a极为负极,氢气在负极上发生氧化反应,电极反应式为:,故答案为:;
(2)甲中金属A不断溶解,则A作负极,B为正极,乙中C的质量增加,则C为正极,B为负极,丙中A上有气体产生,则A为正极,D为负极。
①装置甲中,A为负极,B为正极,原电池工作时阴离子向负极移动,即移向A极,故答案为:A;
②装置乙中,C为正极,正极发生还原反应,电极反应式为,故答案为:;
③原电池装置中,负极金属活泼性强于正极,则四种金属活动性由强到弱的顺序是D>A>B>C,故答案为:D>A>B>C;
(3)①A.甲中没有形成闭合回路,不能构成原电池,不存在正负极,故A错误;
B.甲中稀硫酸与铜不反应,铜片表面无气泡产生,故B错误;
C.甲、乙中的总反应均为,均消耗氢离子,则两烧杯中溶液的pH均增大,故C正确;
D.甲没有构成原电池,乙构成原电池,原电池反应能加快反应速率,即产生气泡的速率甲中比乙中慢,故D正确;
E.乙装置是原电池,Cu作正极,Zn作负极,电流由正极Cu经过外电路流向负极Zn,故E错误;
F.原电池工作时,阴离子向负极移动,乙中Zn为负极,则溶液中向锌片方向移动,故F错误;
故答案为:CD;
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,可能是锌片不纯,在锌片上形成原电池,故答案为:锌片不纯,在锌片上形成原电池;
(4)失电子发生氧化反应的金属作负极,该反应中Zn失去电子发生氧化反应,则负极材料为Zn;根据2Zn+O2=2ZnO可知,消耗1mol氧气转移4mol电子,则转移0.4mol电子时,消耗0.1mol氧气,体积为22.4L/mol×0.1mol =2.24L,故答案为:Zn;2.24。
10. Fe 2e ═Fe2+ O2+2H2O+4e ═4OH 析氢 负
【分析】图示为Fe的吸氧腐蚀,负极上Fe失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子。
解析:(1)①铁棒上的电极反应式为:Fe 2e ═Fe2+,故答案为:Fe 2e ═Fe2+;
②碳棒上的电极反应式为:O2+2H2O+4e ═4OH ,故答案为:O2+2H2O+4e ═4OH ;
(2)将NaCl溶液改为稀H2SO4溶液,变成析氢腐蚀;保护铁棒时,可以将铁棒与外加电源的负极,故答案为:析氢;负。
【点睛】保护金属防护:①牺牲阳极的阴极保护法(原电池原理);②外加电流的阴极保护法(电解池原理)
