2.2.2氯气的制备 课件 (共32张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.2氯气的制备 课件 (共32张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-28 11:57:22 | ||
图片预览





文档简介
(共32张PPT)
实验室制备气体的基本思路
气体的制备
发生装置:根据反应物的状态和反应条件
装置
尾气处理装置:有毒有害的气体不能直接排到大气中
除杂装置:根据主要气体和杂质气体性质的差异
收集装置:根据气体的密度或水溶性
气体发生装置的基本类型:
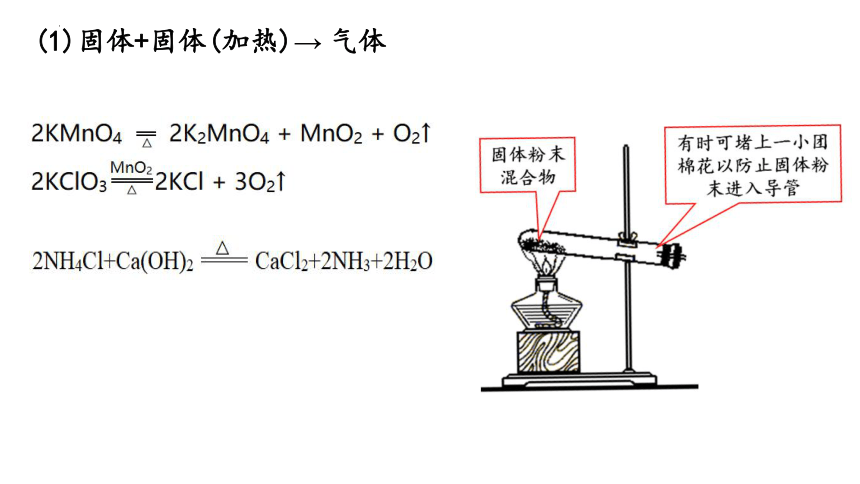
(1)固体+固体(加热)→ 气体
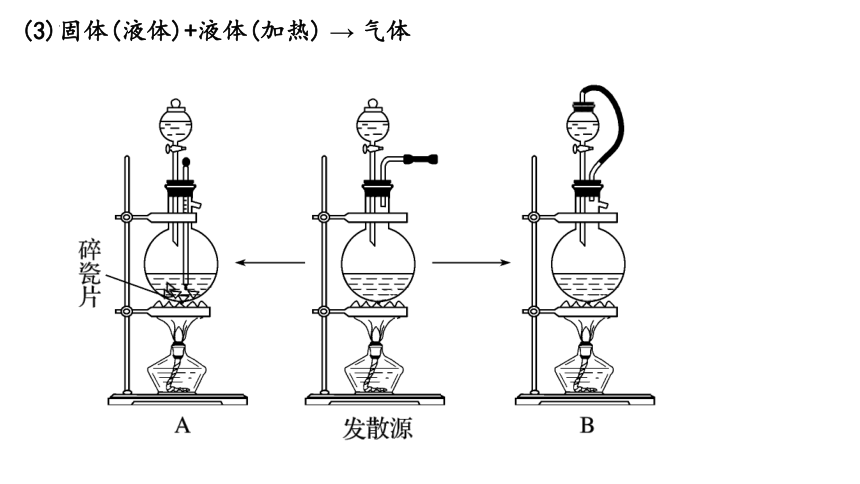
(3)固体(液体)+液体(加热) → 气体
选取气体发生装置的原则:根据反应物质的状态和反应条件
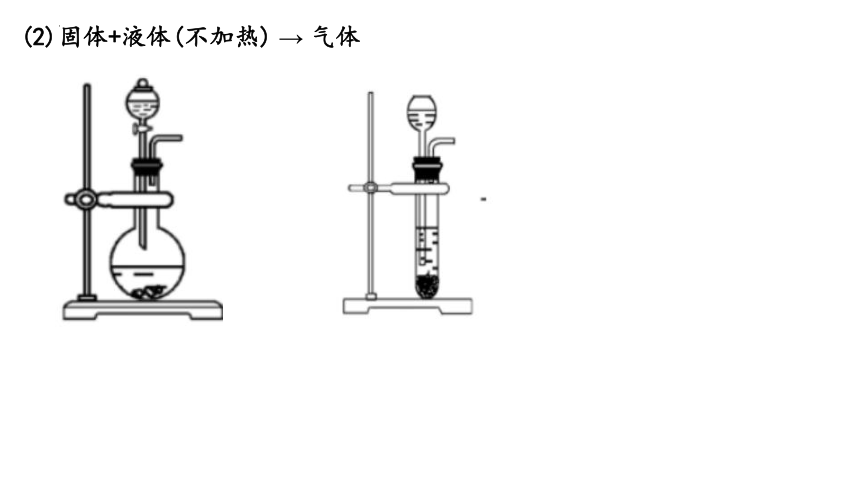
(2)固体+液体(不加热) → 气体
1.气体发生装置
(1)固体+固体(加热)→ 气体
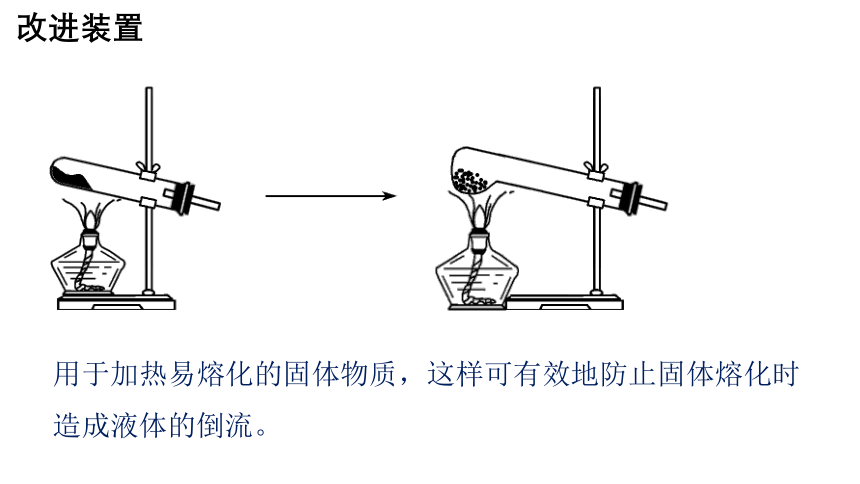
改进装置
用于加热易熔化的固体物质,这样可有效地防止固体熔化时造成液体的倒流。
(2)固体+液体(不加热) → 气体
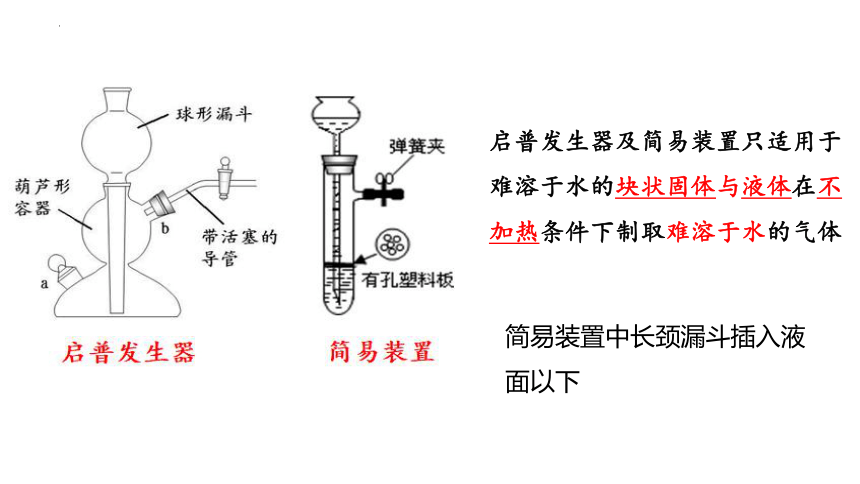
启普发生器及简易装置只适用于难溶于水的块状固体与液体在不加热条件下制取难溶于水的气体
简易装置中长颈漏斗插入液面以下
(3)固体(液体)+液体(加热) → 气体
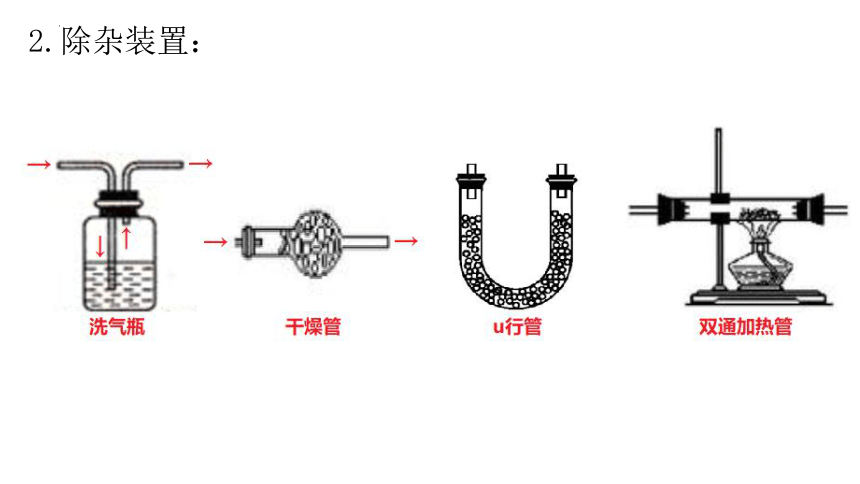
2.除杂装置:
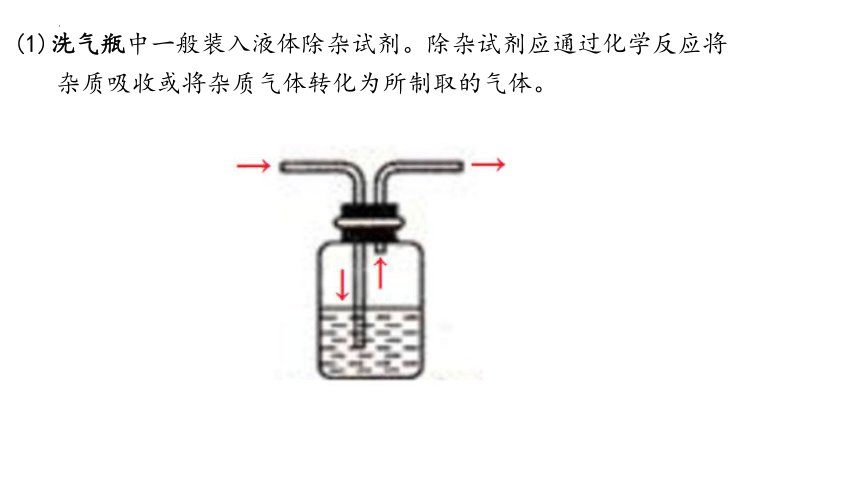
(1)洗气瓶中一般装入液体除杂试剂。除杂试剂应通过化学反应将
杂质吸收或将杂质气体转化为所制取的气体。
常见除杂试剂有:
①强碱溶液:
可吸收CO2、SO2、H2S、Cl2、NO2等呈酸性的气体。
NaOH溶液
饱和NaHCO3溶液
除去CO2中混有的HCl
②饱和溶液,可将杂质气体吸收转化:
饱和NaCl溶液
除去Cl2中混有的HCl
③浓H2SO4:
吸水性
常用于除去H2、CO2、SO2、HCl、、Cl2、CH4等气体中的水蒸气
(2)干燥管、U形管一般装入固体的干燥剂。常见的固体干燥剂有:
①酸性干燥剂,用来干燥酸性气体。
②碱性干燥剂,用来干燥碱性气体。
③中性干燥剂,既能干燥碱性气体又能干燥酸性气体。
如P2O5、硅胶等。
如CaO、碱石灰、固体NaOH等。
如无水CaCl2
用无水CuSO4固体装入干燥管中,通过颜色变化检验水蒸气的存在
将CO2、H2O(g)转化为O2
(3)双通加热管一般装入固体除杂剂,除杂试剂和混合气体中的某一组分反应
1、Cu和混合气体中O2反应而将O2除去
CuO和混合气体中的CO/H2反应除去
2、Na2O2固体
3.收集装置
向上排空气法:气体不与空气中的成分
反应,且密度比空气大
向下排空气法:气体不与空气中的成分
反应,且密度比空气小
排水法:
气体不与水(或饱和溶液)反应,且在水中溶解度小
4、常见尾气处理装置
防倒吸
4、常见尾气处理装置
燃烧法
收集法
H2、CO
正误判断
(1)装配仪器时应先上后下,先左后右( )
(2)检验装置的气密性应在加入药品之前( )
×
√
步步高P50
正误判断
(3)如图所示装置在化学实验中应用广泛,被称为“万能瓶”。
对该装置的下列用途进行正误判断。
①气体由A进B出时可以作为洗气瓶,除去气体中的杂质( )
②气体由B进A出时可用作防倒吸装置( )
③气体由A通入时可用排水法收集O2、CO等气体( )
④气体由B通入时可用于排气法收集H2、CH4等密度比空气小的气体
( )
×
√
√
√
(4)用如图所示装置制取少量纯净的CO2气体( )
×
【练习】下图为常用玻璃仪器组成的六种实验装置,均可根据不同的实验需要在其中加入不同的液体或固体试剂。请用适宜装置的序号完成下列填空:
(1)能用于干燥CO2气流的装置是_____。
(2)用于除去Cl2中HCl杂质的最佳装置是____。
AEF
A
(3)利用装置A收集CO2气体,应从____口进气。A中装满水,用排水法测
量生成H2的体积,应从____口进气。
a
b
网
科
学
氯 气 的 制备
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
【思考】足量 MnO2与含 HCl 73g 的 浓盐酸反应,可制得Cl2的质量为多少?
( HCl的相对分子质量为36.5;Cl2的相对分子质量为71)
-1
0
+4
+2
失去2×e-
得到 2e-
氧化剂
还原剂
酸性
【思考】发生反应的MnO2与 HCl的个数比为:
发生反应的氧化剂和还原剂的个数比为:
4:1
2:1
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
气体发生装置:
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
生成Cl2中含有的杂质
HCl、H2O(水蒸气)
气体净化装置:
饱和食盐水(或水)除去混有的HCl气体
浓硫酸除去水蒸气
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
气体收集装置:
向上排空气法收集
排饱和食盐水法
(2)将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸
立即变蓝,则证明已集满。
验满方法(三种方法)
(1)观察到E中充满黄绿色气体,则证明已集满。
(3)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立
即发生先变红后褪色的变化,则证明已集满。
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
尾气装置:
NaOH溶液
氯气有毒
2、制取装置:
发生装置
净化装置
收集装置
尾气处理装置
(1)实验室制取的Cl2中混有HCl气体,可通过盛有碱石灰的干燥管除去
( )
(2)MnO2与稀盐酸在加热条件下也可制取Cl2( )
(3)在实验室制取Cl2的试剂中,HCl只做还原剂( )
(4)Cl2尾气可用饱和的澄清石灰水吸收处理( )
(5)实验室可以用排水法收集Cl2( )
×
×
×
×
正误判断
×
步步高P48
NaClO+2HCl=NaCl +Cl2 ↑ +H2O
MnO2可用 KMnO4、KClO3、NaClO 等强氧化剂代替。
2KMnO4+16HCl(浓)=2KCl +2MnCl2+5Cl2↑+8H2O
浓盐酸
KMnO4
教材—练习与应用
工业制氯气
实验室制备气体的基本思路
气体的制备
发生装置:根据反应物的状态和反应条件
装置
尾气处理装置:有毒有害的气体不能直接排到大气中
除杂装置:根据主要气体和杂质气体性质的差异
收集装置:根据气体的密度或水溶性
气体发生装置的基本类型:
(1)固体+固体(加热)→ 气体
(3)固体(液体)+液体(加热) → 气体
选取气体发生装置的原则:根据反应物质的状态和反应条件
(2)固体+液体(不加热) → 气体
1.气体发生装置
(1)固体+固体(加热)→ 气体
改进装置
用于加热易熔化的固体物质,这样可有效地防止固体熔化时造成液体的倒流。
(2)固体+液体(不加热) → 气体
启普发生器及简易装置只适用于难溶于水的块状固体与液体在不加热条件下制取难溶于水的气体
简易装置中长颈漏斗插入液面以下
(3)固体(液体)+液体(加热) → 气体
2.除杂装置:
(1)洗气瓶中一般装入液体除杂试剂。除杂试剂应通过化学反应将
杂质吸收或将杂质气体转化为所制取的气体。
常见除杂试剂有:
①强碱溶液:
可吸收CO2、SO2、H2S、Cl2、NO2等呈酸性的气体。
NaOH溶液
饱和NaHCO3溶液
除去CO2中混有的HCl
②饱和溶液,可将杂质气体吸收转化:
饱和NaCl溶液
除去Cl2中混有的HCl
③浓H2SO4:
吸水性
常用于除去H2、CO2、SO2、HCl、、Cl2、CH4等气体中的水蒸气
(2)干燥管、U形管一般装入固体的干燥剂。常见的固体干燥剂有:
①酸性干燥剂,用来干燥酸性气体。
②碱性干燥剂,用来干燥碱性气体。
③中性干燥剂,既能干燥碱性气体又能干燥酸性气体。
如P2O5、硅胶等。
如CaO、碱石灰、固体NaOH等。
如无水CaCl2
用无水CuSO4固体装入干燥管中,通过颜色变化检验水蒸气的存在
将CO2、H2O(g)转化为O2
(3)双通加热管一般装入固体除杂剂,除杂试剂和混合气体中的某一组分反应
1、Cu和混合气体中O2反应而将O2除去
CuO和混合气体中的CO/H2反应除去
2、Na2O2固体
3.收集装置
向上排空气法:气体不与空气中的成分
反应,且密度比空气大
向下排空气法:气体不与空气中的成分
反应,且密度比空气小
排水法:
气体不与水(或饱和溶液)反应,且在水中溶解度小
4、常见尾气处理装置
防倒吸
4、常见尾气处理装置
燃烧法
收集法
H2、CO
正误判断
(1)装配仪器时应先上后下,先左后右( )
(2)检验装置的气密性应在加入药品之前( )
×
√
步步高P50
正误判断
(3)如图所示装置在化学实验中应用广泛,被称为“万能瓶”。
对该装置的下列用途进行正误判断。
①气体由A进B出时可以作为洗气瓶,除去气体中的杂质( )
②气体由B进A出时可用作防倒吸装置( )
③气体由A通入时可用排水法收集O2、CO等气体( )
④气体由B通入时可用于排气法收集H2、CH4等密度比空气小的气体
( )
×
√
√
√
(4)用如图所示装置制取少量纯净的CO2气体( )
×
【练习】下图为常用玻璃仪器组成的六种实验装置,均可根据不同的实验需要在其中加入不同的液体或固体试剂。请用适宜装置的序号完成下列填空:
(1)能用于干燥CO2气流的装置是_____。
(2)用于除去Cl2中HCl杂质的最佳装置是____。
AEF
A
(3)利用装置A收集CO2气体,应从____口进气。A中装满水,用排水法测
量生成H2的体积,应从____口进气。
a
b
网
科
学
氯 气 的 制备
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
【思考】足量 MnO2与含 HCl 73g 的 浓盐酸反应,可制得Cl2的质量为多少?
( HCl的相对分子质量为36.5;Cl2的相对分子质量为71)
-1
0
+4
+2
失去2×e-
得到 2e-
氧化剂
还原剂
酸性
【思考】发生反应的MnO2与 HCl的个数比为:
发生反应的氧化剂和还原剂的个数比为:
4:1
2:1
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
气体发生装置:
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
生成Cl2中含有的杂质
HCl、H2O(水蒸气)
气体净化装置:
饱和食盐水(或水)除去混有的HCl气体
浓硫酸除去水蒸气
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
气体收集装置:
向上排空气法收集
排饱和食盐水法
(2)将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸
立即变蓝,则证明已集满。
验满方法(三种方法)
(1)观察到E中充满黄绿色气体,则证明已集满。
(3)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立
即发生先变红后褪色的变化,则证明已集满。
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
(一) 实验室制法
尾气装置:
NaOH溶液
氯气有毒
2、制取装置:
发生装置
净化装置
收集装置
尾气处理装置
(1)实验室制取的Cl2中混有HCl气体,可通过盛有碱石灰的干燥管除去
( )
(2)MnO2与稀盐酸在加热条件下也可制取Cl2( )
(3)在实验室制取Cl2的试剂中,HCl只做还原剂( )
(4)Cl2尾气可用饱和的澄清石灰水吸收处理( )
(5)实验室可以用排水法收集Cl2( )
×
×
×
×
正误判断
×
步步高P48
NaClO+2HCl=NaCl +Cl2 ↑ +H2O
MnO2可用 KMnO4、KClO3、NaClO 等强氧化剂代替。
2KMnO4+16HCl(浓)=2KCl +2MnCl2+5Cl2↑+8H2O
浓盐酸
KMnO4
教材—练习与应用
工业制氯气
