2.1 钠及其化合物(含解析) 同步练习 2023-2024学年高一上学期人教版(2019)化学必修第一册
文档属性
| 名称 | 2.1 钠及其化合物(含解析) 同步练习 2023-2024学年高一上学期人教版(2019)化学必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 107.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-29 09:03:00 | ||
图片预览


文档简介
2.1 钠及其化合物 同步练习题
一、选择题
1.下列关于钠及其化合物的说法错误的是
A.钠投入到溶液中,有紫红色固体析出
B.利用钠的强还原性,可用于钛、锆等金属的冶炼
C.向饱和溶液中通入过量,溶液会变浑浊
D.钠通常保存在煤油中,实验中剩余的钠需放回试剂瓶
2.下列物质对应的化学式不正确的是
A.重晶石:BaSO4 B.纯碱:Na2CO3
C.胆矾:CuSO4·5H2O D.石膏:CaSO4
3.下列关于钠的叙述中错误的是
A.钠在Cl2中燃烧,发出明亮黄光生成白色烟
B.钠单质与氯化亚铁溶液反应生成氯化钠和铁单质
C.钠与水反应的现象能说明钠的熔点低,且与水反应放热
D.把小块钠投入饱和氯化钠溶液中,钠浮在水面上、四处游动、溶液产生白色浑浊
4.将一小块钠投入盛有水的烧杯中,实验装置图如下。下列说法错误的是
A.由实验可知钠的密度比水小,反应放热
B.反应中使酚酞变红的是氧化产物NaOH
C.将金属Na放入氯化亚铁溶液中可以看到银白色的固体,最后变成红褐色
D.将Na和Na2O2投入足量的水中,生成的气体点燃恰好完全反应,则Na和物质的量之比为2:1
5.下列物质的俗名与化学式相对应的是
A.水银—Ag B.熟石灰——CaCO3
C.苏打——Na2CO3 D.苛性钠——KOH
6.下列叙述中正确的是
A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B.Na2O能继续被氧化成Na2O2
C.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
D.Na2O2只有还原性
7.下列说法正确的是
A.常温常压下气体的摩尔体积约为24.5L/mol
B.实验室不可以将未用完的钠、钾、白磷等放回原试剂瓶
C.向碳酸氢钠中加入少量的水后,有放热现象
D.储氢材料中的氢都为单质
8.下列几种物质久置于敞口容器中,不易变质的是
A.过氧化钠 B.碳酸钠 C.金属钠 D.漂白粉
二、非选择题
9.物质的结构、性质和用途是化学研究的重要内容,其成果对生产、科技、能源、材料、环境和人类的生活都起着十分重要的意义。
(1)匹配下列物质的用途,将相应的物质字母填入横线处
A.NaCl B.明矾 C.NH4NO3 D.NaHCO3
①常用于焙制糕点,也可用作抗酸药的是_____。
②常用的调味品_____。
③能做净水剂_____。
④能做植物肥料_____。
(2)钠可做高压钠灯、原子反应堆的导热剂,写出钠与水反应的化学方程式_____;氢氧化铝能与强酸、强碱均反应是_____氢氧化物,写出氢氧化铝与NaOH溶液反应的离子方程式_____;Na2O2是_____色固体,常作为潜水艇和呼吸面具中氧气的来源,它与二氧化碳反应的化学方程式_____。
10.如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
(1)钠与水反应的化学方程式为_____________。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________。
②能证明钠的熔点低的现象是_________。
③能证明有氢氧化钠生成的现象是__________。
④能证明有气体产生的现象是A端液面________(填“上升”“下降”或“不变”,下同),B端液面________。
11.将Na2CO3和NaHCO3固体混合物29.6g溶于水,加入1.00mol/L盐酸600mL,反应完全后可以生成6.72LCO2 ((标况下)。已知盐酸过量,求
(1)固体中Na2CO3的质量为_____________?
(2)固体中NaHCO3的物质的量为________?
(3)若在上述原溶液中加入1.00mol/L盐酸400mL,反应完全后,在标准状况下可生成CO2的体积为多少________________L?
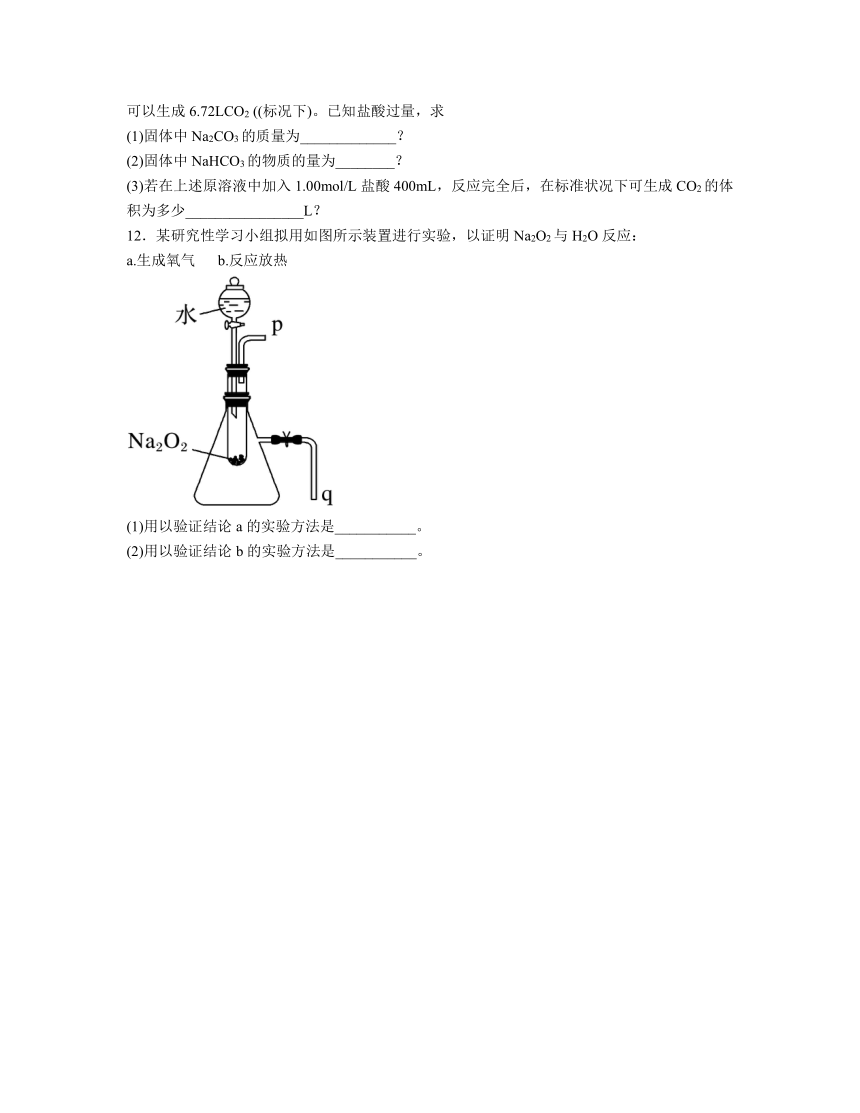
12.某研究性学习小组拟用如图所示装置进行实验,以证明Na2O2与H2O反应:
a.生成氧气 b.反应放热
(1)用以验证结论a的实验方法是___________。
(2)用以验证结论b的实验方法是___________。
【参考答案】
一、选择题
1.A
解析:A.钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,故A错误;
B.金属钠的活泼性强于金属钛、锆,可以将金属钛、钽、铌、锆等从其熔融态的盐中置换出来,所以可以用于钛、锆等金属的冶炼,故B正确;
C.CO2与Na2CO3、H2O反应生成NaHCO3,Na2CO3+H2O+CO2=2NaHCO3,由方程式知,充分反应后生成的NaHCO3质量肯定大于原溶液中的Na2CO3质量,而Na2CO3的溶解度大于NaHCO3,故生成的NaHCO3不能完全溶解,出现了白色沉淀,溶液会变浑浊,故C正确;
D.钠的密度比煤油大,钠通常保存在煤油中;钠与水、氧气反应,为保证安全,实验时多余的钠放回原瓶中,故D正确;
故选A。
2.D
解析:A.重晶石是天然的硫酸钡,化学式为BaSO4,A正确;
B.纯碱是碳酸钠的俗称,化学式为Na2CO3,B正确;
C.胆矾是带有五个结晶水的硫酸铜晶体,化学式为CuSO4·5H2O,C正确;
D.石膏的化学式为CaSO4 2H2O,D不正确;
故选D。
3.B
解析:A.钠和氯气反应火焰为黄色,生成白色氯化钠,A正确;
B.钠和氯化亚铁溶液反应时,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和氯化亚铁反应生成氢氧化亚铁和氯化钠,B错误;
C.钠和水反应的现象中有钠熔化成小球,说明钠和水反应放热,且钠的熔点低,C正确;
D.钠投入到饱和氯化钠溶液中,钠和水反应,钠浮在水面上,四处游动,反应生成氢氧化钠,因为氯化钠的溶解度比氢氧化钠,故溶液中产生白色浑浊,D正确;
故选B。
4.C
解析:A.钠浮在水面上,说明钠的密度小于水,并熔化成一个闪亮的小球,说明钠与水反应放热,故A正确;
B.钠和水发生反应2Na+2H2O=2NaOH+H2↑,NaOH是氧化产物,使酚酞变红色,故B正确;
C.将金属Na放入氯化亚铁溶液中,钠先和水反应生成NaOH,氯化亚铁再和NaOH反应生成Fe(OH)2白色絮状沉淀,Fe(OH)2具有还原性,易被溶液中的氧气最终氧化为红褐色Fe(OH)3,故C错误;
D.由可知,n(H2)=2n(O2),结合2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑,可知n(Na)=2n(Na2O2),即Na和Na2O2物质的量之比为2:1,故D正确;
故选C。
5.C
解析:A.单质汞俗称水银,化学式为Hg,故A错误;
B.熟石灰为氢氧化钙Ca(OH)2,CaCO3是大理石或石灰石,故B错误;
C.Na2CO3是苏打,小苏打为碳酸氢钠,化学式为NaHCO3,故C正确;
D.苛性钠化学式为:NaOH,故D错误;
故选:C。
6.B
解析:A.氧化钠为碱性氧化物,过氧化钠与水反应生成氢氧化钠和氧气,不是碱性氧化物,A错误;
B.氧化钠能继续被氧化为过氧化钠,B正确;
C.过氧化钠与二氧化碳的反应不是置换反应,C错误;
D.过氧化钠中氧元素为-1价,既有氧化性,又有还原性,D错误;
故选B。
7.A
解析:A.温度升高气体受热膨胀体积增大,所以常温常压下气体的摩尔体积约为24.5L/mol,A正确;
B.钠、钾金属性强可以和水发生剧烈反应且白磷易自然,为防止发生危险,所以实验室中未用完的钠、钾、白磷等应放回原试剂瓶,B错误;
C.向碳酸氢钠中加入少量的水后破坏化学键,需要吸收热量,所以有吸热现象,C错误;
D.储氢材料中有些氢是以化合物形式存在,D错误;
故选A。
8.B
解析:A.过氧化钠与空气中二氧化碳反应生成碳酸钠和氧气,可变质,A项错误;
B.碳酸钠性质稳定,在空气中不易变质,B项正确;
C.金属钠化学性质活泼,易被氧化变质,C项错误;
D.漂白粉中的有效成分次氯酸钙易与空气中的二氧化碳和水反应生成碳酸钙和次氯酸而变质,D项错误;
答案选B。
二、非选择题
9.(1) D A B C
(2) 2Na+2H2O=2NaOH+H2↑ 两性 Al(OH)3+OH-=AlO+2H2O 淡黄色 2Na2O2+2CO2=2Na2CO3+O2
解析:(1)碳酸氢钠能和酸反应且受热易分解产生气体,故常用作烘焙糕点和抗酸药;氯化钠是食盐的主要成分,故是常用的调味品;明矾溶于水电离产生的铝离子水解形成氢氧化铝胶体具有吸附性,故明矾能做净水剂;硝酸铵中含有植物生长需要的氮元素,故能做植物肥料。
(2)钠具有强还原性,和水发生氧化还原反应即2Na+2H2O=2NaOH+H2;氢氧化铝是两性氢氧化物;氢氧化铝和氢氧化钠反应生成偏铝酸钠,即;过氧化钠是淡黄色固体,能和水以及二氧化碳反应产生氧气,即。
10. 2Na+2H2O=2NaOH+H2↑ 钠浮在水面上 钠熔化为光亮的小球 溶液呈红色 上升 下降
【分析】本题主要考查金属钠和水的反应,该反应的现象为“浮”、“响”、“游”、“熔”、“红”。“浮”指钠块浮在水面上;“响”是因为反应放热,且不断有H2生成;“游”是产生的H2不断推动钠块来回移动;“熔”是因为钠块的熔点很低,反应放热使钠块熔化;“红”是因为反应生成了NaOH,使事先加入的酚酞变红。
解析:(1)钠与水反应生成NaOH和H2,其化学方程式为:2Na+2H2O=2NaOH+H2↑;
(2)①钠浮在水面上,证明钠的密度比水小;
②钠熔化为光亮的小球,证明钠的熔点低;
③反应后溶液呈红色,证明有氢氧化钠生成;
④B端压强增大,液面下降,A端液面上升,证明有气体生成。
【点睛】钠和水的反应是高中化学学习中一个很重要的化学实验,需要学生深刻记忆该实验的现象及产生的原因。
11.2g 0.1mol 4.48
【分析】设出碳酸钠、碳酸氢钠的物质的量,然后根据总质量、生成二氧化碳的量列式计算出Na2CO3、NaHCO3的物质的量。
解析:标况下6.72L二氧化碳的物质的量为:n(CO2)==0.3mol,则设Na2CO3和NaHCO3的物质的量分别为xmol和ymol,结合原子守恒可知:106x+84y=29.6 …①、x+y=0.3 …②,联解①、②得:x=0.2mol、y=0.1mol,即原混合物中Na2CO3和NaHCO3的物质的量分别为0.2mol和0.1mol;
(1)固体中Na2CO3的质量为0.2mol×106g/mol=21.2g;
(2)固体中NaHCO3的物质的量为0.1mol;
(3)400mL 1.00mol/L的盐酸中含有HCl的物质的量为:n(HCl)=0.40L×1mol/L=0.4mol,已知Na2CO3 +HCl=NaHCO3 +NaCl,则0.2molNa2CO3完全转化NaHCO3后,剩余HCl为0.4mol-0.2mol=0.2mol,溶液中NaHCO3总共为:0.1mol+0.2mol=0.3mol,再发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,0.3molNaHCO3完全反应需要0.3molHCl,大于0.2mol,NaHCO3有剩余,故生成二氧化碳的物质的量为:n(CO2)=n剩余(HCl)=0.2mol,标况下0.2mol二氧化碳的体积为:V(CO2)=0.2mol×22.4L/mol=4.48L。
12.(1)将带火星的木条靠近p处,木条复燃,证明有氧气生成
(2)将导管q插入水中,有气泡冒出,证明反应放热
解析:过氧化钠与水反应的化学方程式如下:
(1)验证生成氧气的方法就是将带火星的小木条放在p处,若木条复燃,则证明有氧气生成,故答案为:将带火星的木条靠近p处,木条复燃,证明有氧气生成;
(2)过氧化钠与水反应会放出热量,将会导致锥形瓶内气体体积膨胀,瓶内压强增大,大于外界大气压,将导管q插入水中,在大气压的作用下,导管口有气泡冒出,故答案为:将导管q插入水中,有气泡冒出,证明反应放热
一、选择题
1.下列关于钠及其化合物的说法错误的是
A.钠投入到溶液中,有紫红色固体析出
B.利用钠的强还原性,可用于钛、锆等金属的冶炼
C.向饱和溶液中通入过量,溶液会变浑浊
D.钠通常保存在煤油中,实验中剩余的钠需放回试剂瓶
2.下列物质对应的化学式不正确的是
A.重晶石:BaSO4 B.纯碱:Na2CO3
C.胆矾:CuSO4·5H2O D.石膏:CaSO4
3.下列关于钠的叙述中错误的是
A.钠在Cl2中燃烧,发出明亮黄光生成白色烟
B.钠单质与氯化亚铁溶液反应生成氯化钠和铁单质
C.钠与水反应的现象能说明钠的熔点低,且与水反应放热
D.把小块钠投入饱和氯化钠溶液中,钠浮在水面上、四处游动、溶液产生白色浑浊
4.将一小块钠投入盛有水的烧杯中,实验装置图如下。下列说法错误的是
A.由实验可知钠的密度比水小,反应放热
B.反应中使酚酞变红的是氧化产物NaOH
C.将金属Na放入氯化亚铁溶液中可以看到银白色的固体,最后变成红褐色
D.将Na和Na2O2投入足量的水中,生成的气体点燃恰好完全反应,则Na和物质的量之比为2:1
5.下列物质的俗名与化学式相对应的是
A.水银—Ag B.熟石灰——CaCO3
C.苏打——Na2CO3 D.苛性钠——KOH
6.下列叙述中正确的是
A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B.Na2O能继续被氧化成Na2O2
C.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
D.Na2O2只有还原性
7.下列说法正确的是
A.常温常压下气体的摩尔体积约为24.5L/mol
B.实验室不可以将未用完的钠、钾、白磷等放回原试剂瓶
C.向碳酸氢钠中加入少量的水后,有放热现象
D.储氢材料中的氢都为单质
8.下列几种物质久置于敞口容器中,不易变质的是
A.过氧化钠 B.碳酸钠 C.金属钠 D.漂白粉
二、非选择题
9.物质的结构、性质和用途是化学研究的重要内容,其成果对生产、科技、能源、材料、环境和人类的生活都起着十分重要的意义。
(1)匹配下列物质的用途,将相应的物质字母填入横线处
A.NaCl B.明矾 C.NH4NO3 D.NaHCO3
①常用于焙制糕点,也可用作抗酸药的是_____。
②常用的调味品_____。
③能做净水剂_____。
④能做植物肥料_____。
(2)钠可做高压钠灯、原子反应堆的导热剂,写出钠与水反应的化学方程式_____;氢氧化铝能与强酸、强碱均反应是_____氢氧化物,写出氢氧化铝与NaOH溶液反应的离子方程式_____;Na2O2是_____色固体,常作为潜水艇和呼吸面具中氧气的来源,它与二氧化碳反应的化学方程式_____。
10.如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
(1)钠与水反应的化学方程式为_____________。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________。
②能证明钠的熔点低的现象是_________。
③能证明有氢氧化钠生成的现象是__________。
④能证明有气体产生的现象是A端液面________(填“上升”“下降”或“不变”,下同),B端液面________。
11.将Na2CO3和NaHCO3固体混合物29.6g溶于水,加入1.00mol/L盐酸600mL,反应完全后可以生成6.72LCO2 ((标况下)。已知盐酸过量,求
(1)固体中Na2CO3的质量为_____________?
(2)固体中NaHCO3的物质的量为________?
(3)若在上述原溶液中加入1.00mol/L盐酸400mL,反应完全后,在标准状况下可生成CO2的体积为多少________________L?
12.某研究性学习小组拟用如图所示装置进行实验,以证明Na2O2与H2O反应:
a.生成氧气 b.反应放热
(1)用以验证结论a的实验方法是___________。
(2)用以验证结论b的实验方法是___________。
【参考答案】
一、选择题
1.A
解析:A.钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,故A错误;
B.金属钠的活泼性强于金属钛、锆,可以将金属钛、钽、铌、锆等从其熔融态的盐中置换出来,所以可以用于钛、锆等金属的冶炼,故B正确;
C.CO2与Na2CO3、H2O反应生成NaHCO3,Na2CO3+H2O+CO2=2NaHCO3,由方程式知,充分反应后生成的NaHCO3质量肯定大于原溶液中的Na2CO3质量,而Na2CO3的溶解度大于NaHCO3,故生成的NaHCO3不能完全溶解,出现了白色沉淀,溶液会变浑浊,故C正确;
D.钠的密度比煤油大,钠通常保存在煤油中;钠与水、氧气反应,为保证安全,实验时多余的钠放回原瓶中,故D正确;
故选A。
2.D
解析:A.重晶石是天然的硫酸钡,化学式为BaSO4,A正确;
B.纯碱是碳酸钠的俗称,化学式为Na2CO3,B正确;
C.胆矾是带有五个结晶水的硫酸铜晶体,化学式为CuSO4·5H2O,C正确;
D.石膏的化学式为CaSO4 2H2O,D不正确;
故选D。
3.B
解析:A.钠和氯气反应火焰为黄色,生成白色氯化钠,A正确;
B.钠和氯化亚铁溶液反应时,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和氯化亚铁反应生成氢氧化亚铁和氯化钠,B错误;
C.钠和水反应的现象中有钠熔化成小球,说明钠和水反应放热,且钠的熔点低,C正确;
D.钠投入到饱和氯化钠溶液中,钠和水反应,钠浮在水面上,四处游动,反应生成氢氧化钠,因为氯化钠的溶解度比氢氧化钠,故溶液中产生白色浑浊,D正确;
故选B。
4.C
解析:A.钠浮在水面上,说明钠的密度小于水,并熔化成一个闪亮的小球,说明钠与水反应放热,故A正确;
B.钠和水发生反应2Na+2H2O=2NaOH+H2↑,NaOH是氧化产物,使酚酞变红色,故B正确;
C.将金属Na放入氯化亚铁溶液中,钠先和水反应生成NaOH,氯化亚铁再和NaOH反应生成Fe(OH)2白色絮状沉淀,Fe(OH)2具有还原性,易被溶液中的氧气最终氧化为红褐色Fe(OH)3,故C错误;
D.由可知,n(H2)=2n(O2),结合2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑,可知n(Na)=2n(Na2O2),即Na和Na2O2物质的量之比为2:1,故D正确;
故选C。
5.C
解析:A.单质汞俗称水银,化学式为Hg,故A错误;
B.熟石灰为氢氧化钙Ca(OH)2,CaCO3是大理石或石灰石,故B错误;
C.Na2CO3是苏打,小苏打为碳酸氢钠,化学式为NaHCO3,故C正确;
D.苛性钠化学式为:NaOH,故D错误;
故选:C。
6.B
解析:A.氧化钠为碱性氧化物,过氧化钠与水反应生成氢氧化钠和氧气,不是碱性氧化物,A错误;
B.氧化钠能继续被氧化为过氧化钠,B正确;
C.过氧化钠与二氧化碳的反应不是置换反应,C错误;
D.过氧化钠中氧元素为-1价,既有氧化性,又有还原性,D错误;
故选B。
7.A
解析:A.温度升高气体受热膨胀体积增大,所以常温常压下气体的摩尔体积约为24.5L/mol,A正确;
B.钠、钾金属性强可以和水发生剧烈反应且白磷易自然,为防止发生危险,所以实验室中未用完的钠、钾、白磷等应放回原试剂瓶,B错误;
C.向碳酸氢钠中加入少量的水后破坏化学键,需要吸收热量,所以有吸热现象,C错误;
D.储氢材料中有些氢是以化合物形式存在,D错误;
故选A。
8.B
解析:A.过氧化钠与空气中二氧化碳反应生成碳酸钠和氧气,可变质,A项错误;
B.碳酸钠性质稳定,在空气中不易变质,B项正确;
C.金属钠化学性质活泼,易被氧化变质,C项错误;
D.漂白粉中的有效成分次氯酸钙易与空气中的二氧化碳和水反应生成碳酸钙和次氯酸而变质,D项错误;
答案选B。
二、非选择题
9.(1) D A B C
(2) 2Na+2H2O=2NaOH+H2↑ 两性 Al(OH)3+OH-=AlO+2H2O 淡黄色 2Na2O2+2CO2=2Na2CO3+O2
解析:(1)碳酸氢钠能和酸反应且受热易分解产生气体,故常用作烘焙糕点和抗酸药;氯化钠是食盐的主要成分,故是常用的调味品;明矾溶于水电离产生的铝离子水解形成氢氧化铝胶体具有吸附性,故明矾能做净水剂;硝酸铵中含有植物生长需要的氮元素,故能做植物肥料。
(2)钠具有强还原性,和水发生氧化还原反应即2Na+2H2O=2NaOH+H2;氢氧化铝是两性氢氧化物;氢氧化铝和氢氧化钠反应生成偏铝酸钠,即;过氧化钠是淡黄色固体,能和水以及二氧化碳反应产生氧气,即。
10. 2Na+2H2O=2NaOH+H2↑ 钠浮在水面上 钠熔化为光亮的小球 溶液呈红色 上升 下降
【分析】本题主要考查金属钠和水的反应,该反应的现象为“浮”、“响”、“游”、“熔”、“红”。“浮”指钠块浮在水面上;“响”是因为反应放热,且不断有H2生成;“游”是产生的H2不断推动钠块来回移动;“熔”是因为钠块的熔点很低,反应放热使钠块熔化;“红”是因为反应生成了NaOH,使事先加入的酚酞变红。
解析:(1)钠与水反应生成NaOH和H2,其化学方程式为:2Na+2H2O=2NaOH+H2↑;
(2)①钠浮在水面上,证明钠的密度比水小;
②钠熔化为光亮的小球,证明钠的熔点低;
③反应后溶液呈红色,证明有氢氧化钠生成;
④B端压强增大,液面下降,A端液面上升,证明有气体生成。
【点睛】钠和水的反应是高中化学学习中一个很重要的化学实验,需要学生深刻记忆该实验的现象及产生的原因。
11.2g 0.1mol 4.48
【分析】设出碳酸钠、碳酸氢钠的物质的量,然后根据总质量、生成二氧化碳的量列式计算出Na2CO3、NaHCO3的物质的量。
解析:标况下6.72L二氧化碳的物质的量为:n(CO2)==0.3mol,则设Na2CO3和NaHCO3的物质的量分别为xmol和ymol,结合原子守恒可知:106x+84y=29.6 …①、x+y=0.3 …②,联解①、②得:x=0.2mol、y=0.1mol,即原混合物中Na2CO3和NaHCO3的物质的量分别为0.2mol和0.1mol;
(1)固体中Na2CO3的质量为0.2mol×106g/mol=21.2g;
(2)固体中NaHCO3的物质的量为0.1mol;
(3)400mL 1.00mol/L的盐酸中含有HCl的物质的量为:n(HCl)=0.40L×1mol/L=0.4mol,已知Na2CO3 +HCl=NaHCO3 +NaCl,则0.2molNa2CO3完全转化NaHCO3后,剩余HCl为0.4mol-0.2mol=0.2mol,溶液中NaHCO3总共为:0.1mol+0.2mol=0.3mol,再发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,0.3molNaHCO3完全反应需要0.3molHCl,大于0.2mol,NaHCO3有剩余,故生成二氧化碳的物质的量为:n(CO2)=n剩余(HCl)=0.2mol,标况下0.2mol二氧化碳的体积为:V(CO2)=0.2mol×22.4L/mol=4.48L。
12.(1)将带火星的木条靠近p处,木条复燃,证明有氧气生成
(2)将导管q插入水中,有气泡冒出,证明反应放热
解析:过氧化钠与水反应的化学方程式如下:
(1)验证生成氧气的方法就是将带火星的小木条放在p处,若木条复燃,则证明有氧气生成,故答案为:将带火星的木条靠近p处,木条复燃,证明有氧气生成;
(2)过氧化钠与水反应会放出热量,将会导致锥形瓶内气体体积膨胀,瓶内压强增大,大于外界大气压,将导管q插入水中,在大气压的作用下,导管口有气泡冒出,故答案为:将导管q插入水中,有气泡冒出,证明反应放热
