专题5 药物合成的重要原料—卤代烃、胺、酰胺 测试卷 (含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题5 药物合成的重要原料—卤代烃、胺、酰胺 测试卷 (含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修3 |
|
|
| 格式 | docx | ||
| 文件大小 | 968.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-29 00:00:00 | ||
图片预览



文档简介
专题5《药物合成的重要原料—卤代烃、胺、酰胺》测试卷
一、单选题
1.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是
A.(CH3)2CHCH2Cl B.CH2=CHC(CH3)2CH2Cl
C.CH3CHFCH=CH2 D.CH2=CHCH2CH2Br
2.从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式为。下列判断正确的是( )
A.该有机化合物的分子式为C14H15O3
B.该有机化合物含有两种官能团
C.该有机化合物是芳香烃的衍生物
D.该有机化合物可看作环状化合物
3.已知有机物M、N、W能发生下列反应, 下列说法不正确的是
A.M、N和W均能发生氧化反应、加成反应和取代反应
B.M不能使溴水因发生化学反应而褪色
C.M与足量的H2反应后的产物的一氯代物有4种
D.W的所有碳原子不可能在同一平面上
4.有机化合物X与Y在一定条件下可反应生成Z:
下列说法正确的是
A.X是苯的同系物
B.可用的溶液除去Z中混有的Y杂质
C.含有一个碳碳双键和一个碳碳三键的X的同分异构体有4种
D.Z在酸性条件下水解生成和
5.《清热经解》中记载:“藿香正气散,夏令外感风寒,身温无汗,吐泻交作者。”藿香正气水是一个中成药,具有解表化湿,理气和中之功效。其主要成分广藿香酮结构如图。下列关于广藿香酮的叙述正确的是
A.广藿香酮的分子式为 B.分子中有一个手性碳原子
C.分子中有3种官能团 D.能使溴水、酸性高锰酸钾褪色,且原理相同
6.某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是
A.该物质的分子式为
B.该物质能使溴水、酸性溶液褪色,且褪色原理相同
C.该物质最多能和发生加成反应
D.该物质的一氯代物有6种
7.柠檬烯是一种食用香料,其结构简式如图。有关柠檬烯的分析正确的是
丁基苯:
A.柠檬烯属于芳香烃
B.相对分子质量为136
C.性质稳定,遇空气、加热均不易变质
D.它和丁基苯互为同分异构体
8.下列有机反应中,C—H键未发生断裂的是
A.乙烷与氯气在光照条件下反应
B.溴乙烷在氢氧化钠乙醇溶液中加热条件下反应
C.乙醇与乙酸在浓硫酸加热条件下反应
D.苯与浓硝酸、浓硫酸在加热的条件下反应
9.崖柏素具天然活性,有酚的通性,结构如图。关于崖柏素的说法错误的是
A.可与溴水发生取代反应
B.可与溶液反应
C.分子中的碳原子不可能全部共平面
D.与足量加成后,产物分子中含手性碳原子
10.某酯的分子式可表示为(n为整数且小于10),在酸性条件下能水解生成两种相对分子质量相等的有机物,则该酯的结构可能有(不考虑立体异构)
A.15种 B.23种 C.28种 D.32种
11.下列有关化合物X的叙述正确的是
A.X分子式为C21H20O4Br2
B.X最多可与7moLH2发生加成反应
C.X在酸性条件下水解的产物均可与NaHCO3溶液反应
D.1molX与足量NaOH溶液反应,最多消耗4molNaOH
12.环氧乙烷可用于医用口罩的消毒。工业生产环氧乙烷的两种常见途径如下,下列说法正确的是
途径Ⅰ:
途径Ⅱ: ①
②
A.环氧乙烷的官能团为醚键
B.途径Ⅰ的反应为取代反应
C.从结构分析可知环氧乙烷的性质稳定,故可用做口罩的消毒剂
D.分子中含有氯原子,故该物质可直接与硝酸银溶液反应产生白色沉淀
13.吲哚美辛是非甾体抗炎、解热及镇痛药,结构简式如下图。下列对该有机物的说法正确的是
A.分子式为
B.在的醇溶液中加热,可发生消去反应
C.该物质可与发生加成反应
D.在苯环上的一溴代物最多有5种
14.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯()与等物质的量的Br2发生加成反应
B.2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.甲苯与酸性高锰酸钾溶液的反应
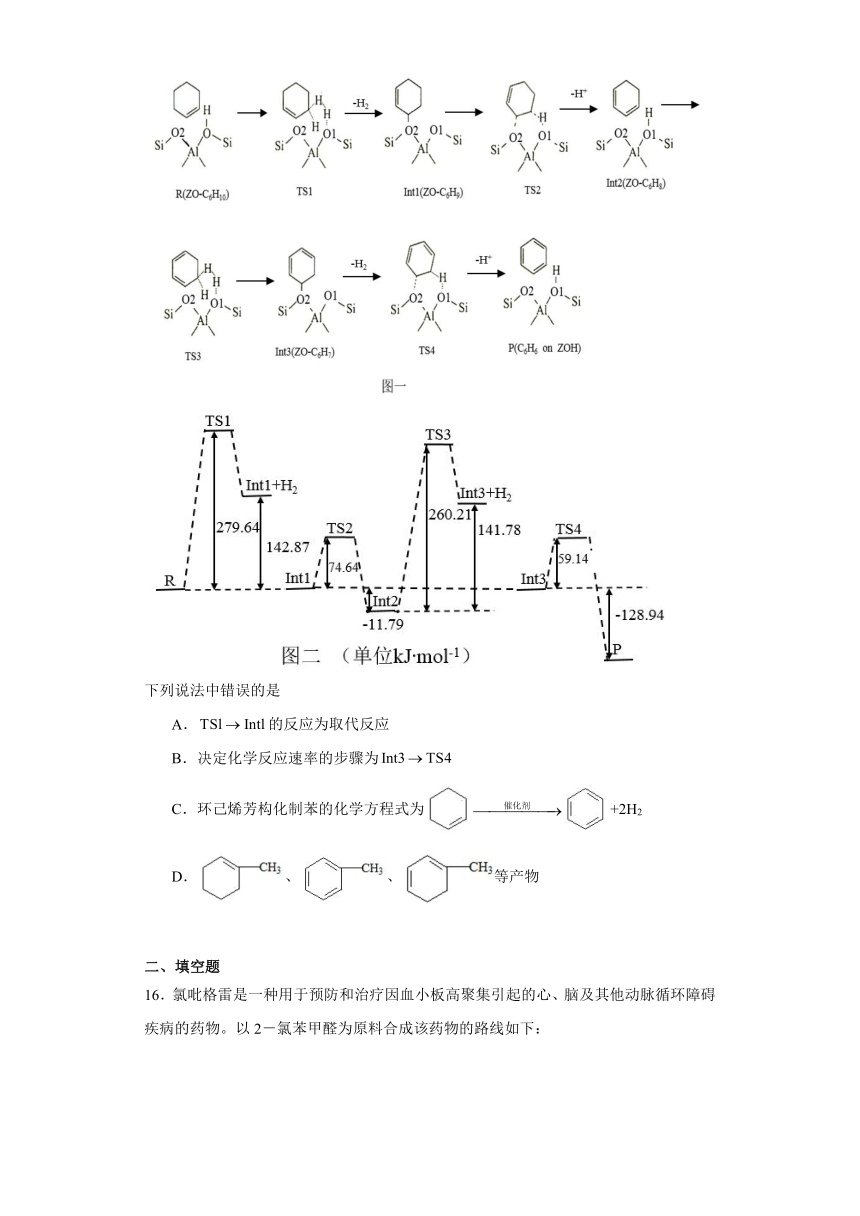
15.分子筛催化环己烯()芳构化制苯()的反应历程和过程中能垒图分别见图一和图二。
下列说法中错误的是
A.的反应为取代反应
B.决定化学反应速率的步骤为
C.环己烯芳构化制苯的化学方程式为+2H2
D.、、等产物
二、填空题
16.氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以2-氯苯甲醛为原料合成该药物的路线如下:
(1)A中官能团的名称为 ,
(2)X(C6H7BrS)的结构简式为 。
17.按要求回答下列问题:
(1)甲基戊烯的结构简式为 。
(2)等质量的四种烃在足量中燃烧,消耗最多的是 。
(3)完全燃烧甲烷和乙烯的混合气体(标准状况下),生成气体进入足量澄清石灰水中,得到沉淀。则混合气体中甲烷和乙烯的体积比为___________(填序号)
A. B. C. D.
(4)同温同压下,某烯烃蒸气的密度是密度的42倍,分子中所有碳原子一定在同一平面上,该烯烃的结构简式 ,该烯烃在一定条件下发生加聚反应的化学方程式 。
(5)化合物A和B的分子式都是,A的核磁共振氢谐如图所示,请写出B的结构简式 。
18.有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥乙烯使溴的四氯化碳溶液褪色
⑦实验室制乙烯 ⑧由甲苯制取TNT
⑨溴乙烷和氢氧化钠的乙醇溶液共热
⑩乙苯的制备:
(1)其中属于取代反应的是 ;属于氧化反应的是 ;属于加成反应的是 ;属于消去反应的是 ;属于聚合反应的是
(2)写出⑧和⑨的化学方程式:
⑧
⑨
三、实验题
19.下图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置(省去了加热装置),回答下列问题:
已知:浓硫酸与溴化钠共热时发生反应:
(1)仪器A、C的名称分别为 、 ;B的作用为 。
(2)装置A中生成溴乙烷的化学方程式为 。
(3)若选用的硫酸浓度过大,D中得到的产品则会因混入少量溴而呈棕黄色,生成这一副产物的原因为 (用化学方程式表示);为纯化产物,最好选择下列的 溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.碘化钠 D.亚硫酸钠
(4)若实验中使用了10g乙醇、20.6g溴化钠,且浓硫酸足量,经过分离、提纯、干燥后,最终得到10.9g溴乙烷,则本实验中溴乙烷的产率为 (保留3位有效数字)。
(5)检验溴乙烷中溴元素的方法为:取样, ,若产生淡黄色沉淀,则该物质中存在溴元素。
20.实验室用乙醇制备1,2-二溴乙烷的反应原理如下:①乙醇在浓硫酸的存在下制取乙烯,②乙烯与溴反应制得1,2-二溴乙烷。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
乙醇 1,2-二溴乙烷 乙醚
状态 无色液体 无色液体 无色液体
密度/g·cm-3 0.79 2.2 0.71
沸点/℃ 78.5 132 34.6
熔点/℃ -130 9 -116
回答下列问题:
(1)写出乙醇在浓硫酸的存在下制取乙烯的化学方程式 ;浓硫酸所起的作用是 。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)若产物中有少量副产物乙醚,可用 的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是 ,但又不能过度冷却(如用冰水),其原因是 。
21.实验室用如图所示装置制取溴乙烷。在试管I中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管II中加入冰水混合物,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式: 。
(2)溴乙烷的官能团为 (结构简式)。
(3)试管II中冰水混合物的作用是 。
(4)若试管II中获得的有机物呈棕黄色,除去其中的杂质最佳的试剂是 (填序号)。
a.CCl4 b.NaOH溶液 c.Na2SO3溶液 d.稀硫酸
(5)设计实验证明溴乙烷中含有溴元素(说明操作、现象和结论): 。
(6)已知溴乙烷可以与钠发生反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr。应用该反应原理,下列化合物中可以与钠反应合成环丁烷的是 (填序号)。
a.CH3CH2CH2CH2Br b.CH3CHBrCH2CH2Br
c.CH3CH2CHBrCH2Br d.CH2BrCH2CH2CH2Br
(7)写出由溴苯制备环己酮的流程: 。
(合成路线常用的表示方式为:甲乙……目标产物)
试卷第2页,共9页
参考答案:
1.B
【详解】A.(CH3)2CHCH2Cl,不含不饱和键,不能加成,卤代烃能水解,与-X相连碳的相邻碳上有氢原子,能消去,故A错误;
B.CH2=CHC(CH3)2CH2Cl含有双键,能加成,卤代烃能水解,与Cl相连碳的相邻碳上没有氢原子,不能消去,故B正确;
C.CH3CHFCH=CH2含有双键,能加成,卤代烃能水解,与F原子相连碳的相邻碳上有氢原子,能发生消去反应,故C错误;
D.CH2=CHCH2CH2Br含有双键,能加成,卤代烃能水解,与Br相连碳的相邻碳上有氢原子,能消去,故D错误;
故选B。
2.D
【详解】A.根据结构简式可以判断,该有机化合物中的碳原子数目为15,氢原子数目为18,氧原子数目为3,故分子式为C15H18O3,A项错误;
B.该有机化合物含有双键、羰基、酯基三种官能团,B项错误;
C.该有机化合物含有双键的碳六元环,不含苯环,C项错误;
D.该有机化合物含有两个碳六元环和一个碳氧环,D项正确;
故选:D。
3.C
【详解】A.苯环、碳碳双键可发生加成反应,均可发生燃烧为氧化反应,苯环及甲基可发生取代反应,则M、N和W均能发生氧化反应、加成反应和取代反应,A正确;
B.甲苯不能与溴水发生反应,但能萃取溴水中的溴,所以M不能使溴水因发生化学反应而褪色,B正确;
C.甲苯与足量的H2反应后的产物为甲基环己烷,其一氯代物有5种,C错误;
D.甲烷为正四面体结构,由于W中含有甲基,具有甲烷的结构特点,则W的所有碳原子不可能在同一平面上,D正确;
因此,本题答案为C。
【点睛】不要把甲苯的一氯代物种数和甲基环己烷的一氯代物的种数混同。
4.C
【详解】A.X的不饱和度为3,而苯的不饱和度为4,故可确定X不是苯的同系物;或者根据分子式判断:X分子式为,不符合苯的同系物通式, A错误;
B.Y和Z分子中均含有碳碳双键,均可与的溶液发生加成反应,故无法实现除杂,B错误;
C.若主链含有5个C原子,有3种,分别为、、,若主链有4个C原子,只能为,共4种,C正确;
D.Z在酸性条件下水解生成和,D错误。
故选C。
5.A
【详解】A.由结构可知,广藿香酮的分子式为,A正确;
B.手性碳原子是连有四个不同基团的碳原子;分子中无手性碳原子,B错误;
C.分子中含有碳碳双键、羟基、酯基、酮羰基四种官能团,C错误;
D.含有碳碳双键,故使溴水、酸性高锰酸钾褪色,但原理不相同,前者为加成反应,后者为氧化反应,D错误;
故选A。
6.D
【详解】A.依图示结构,该物质的分子式为,A错误;
B.该物质能使溴水褪色是碳碳双键与溴单质发生了加成反应,使酸性溶液褪色是发生了氧化还原反应,B错误;
C.1个苯环可与3个H2加成,1个碳碳双键可与1个H2加成,酯基中碳氧双键不能与H2加成,故该物质最多能和发生加成反应,C错误;
D.该物质处于不同化学环境的H有6种,一氯代物有6种,D正确;
故选D。
7.B
【详解】A.芳香烃是指含有苯环的碳氢化合物,柠檬烯中无苯环结构,所以柠檬烯不属于芳香烃,故A错误;
B.柠檬烯的化学式为:C10H16,所以相对分子质量为:136,故B正确;
C.柠檬烯中含有碳碳双键,易发生加成反应,氧化反应,含有烷基,易发生取代反应等,故C错误;
D.丁基苯分子式为:C10H14,与柠檬烯的分子式不同,不是同分异构体,故D错误;
故选B。
8.C
【详解】A.乙烷与氯气在光照条件下反应,氯原子取代乙烷分子中的H原子,C—H键发生断裂,故不选A;
B.溴乙烷在氢氧化钠乙醇溶液中加热条件下反应消去反应生成乙烯,溴乙烷分子中断裂1个C—H键、1个C—Br键,故不选B;
C.乙醇与乙酸在浓硫酸加热条件下发生酯化反应,乙醇分子断裂O—H键,乙酸分子断裂C—O键,C—H键未发生断裂,故选C;
D.苯与浓硝酸、浓硫酸在加热的条件下发生取代反应,硝基取代苯环上的1个H原子,C—H键发生断裂,故不选D;
选C。
9.B
【分析】由题中信息可知,γ-崖柏素中碳环具有类苯环的共轭体系,其分子中羟基具有类似的酚羟基的性质。此外,该分子中还有羰基可与氢气发生加成反应转化为脂环醇。
【详解】A.酚可与溴水发生取代反应,γ-崖柏素有酚的通性,且γ-崖柏素的环上有可以被取代的H,故γ-崖柏素可与溴水发生取代反应,A说法正确;
B.酚类物质不与NaHCO3溶液反应,γ-崖柏素分子中没有可与NaHCO3溶液反应的官能团,故其不可与NaHCO3溶液反应,B说法错误;
C.γ-崖柏素分子中有一个异丙基,异丙基中间的碳原子与其相连的3个碳原子不共面,故其分子中的碳原子不可能全部共平面,C说法正确;
D.γ-崖柏素与足量H2加成后转化为 ,产物分子中含手性碳原子(与羟基相连的C原子是手性碳原子),D说法正确;
综上所述,本题选B。
10.B
【详解】分子式为CnH2nO2(n为整数)的酯的相对分子质量不大于160,则14n+32<160,解得:n≤9(n为整数),在酸性条件下水解生成相对分子质量相等的饱和醇和酸,则醇分子中碳原子数比酸中碳原子数多1,满足条件的酯可能组合为:①C2H5OH和HCOOH,②C3H7OH(2种)和CH3COOH,③C4H9OH(4种)和CH3CH2COOH,④C5H11OH(8种)和C3H7COOH(两种),第①组形成的酯有1种,第②组形成的酯有2种,第③组形成的酯有4种,第④组形成的酯有8×2=16种,共有23种,B正确;
故选B。
11.D
【详解】A. X分子式为C21H22O4Br2,A错误;
B. X所含苯环和羰基均可与氢气加成、酯基不能与氢气加成,题目中没有说明X的物质的量所以不能确定氢气的物质的量。1molX最多可与7moLH2发生加成反应,B错误;
C. 酯基可以水解、X在酸性条件下水解的产物中只有乙酸可与NaHCO3溶液反应,C错误;
D. 酯基、Br均可与氢氧化溶液反应,其中直接与苯环相连的1个Br消耗2个OH-,则1molX最多消耗4molNaOH,D正确;
答案选D。
12.A
【详解】A.由结构简式可知,环氧乙烷的官能团为醚键,故A正确;
B.由方程式可知,途径Ⅰ的反应为在银做催化剂条件下,乙烯与氧气共热发生催化氧化反应生成环氧乙烷,故B错误;
C.环氧乙烷是三元环有机物,稳定性较差,但环氧乙烷对消毒物品的穿透力强,可达到物品深部,杀灭病原微生物,常用于医用口罩的消毒,故C错误;
D.是非电解质,不能电离出能与硝酸银溶液反应产生白色沉淀的氯离子,故D错误;
故选A。
13.D
【详解】A. 由结构简式,分子式为,故A错误;
B. 在的醇溶液中加热,卤原子不能发生消去反应,故B错误;
C. 羟基和酰胺键不能与氢气发生加成反应,该物质可与发生加成反应,故C错误;
D. 如图在苯环上的一溴代物最多有5种,故D正确;
故选D。
14.D
【详解】A. 异戊二烯()与等物质的量的Br2发生加成反应,可发生1,2-加成或1,4-加成,则存在同分异构体,选项A错误;
B.2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热发生消去反应可生成1-丁烯和2-丁烯,则存在同分异构体,选项B错误;
C. 甲苯中甲基的邻对位能发生取代反应,则在一定条件下发生硝化生成两种一硝基甲苯,存在同分异构体,选项C错误;
D. 甲苯与酸性高锰酸钾溶液的反应,生成苯甲酸,没有同分异构体,故D正确;
故选D。
15.B
【详解】A.观察TS1及Int1的结构简式可知TS1Int1的反应应为取代反应,A项正确;
B. 升高温度,反应速率变化最大的步骤应该是活化能最大的步骤,由题图可知,应该是R TS1的反应,B项错误;
C.根据图中的结构简式可知环己烯芳构化反应为+2H2,C项正确;
D.由环己烯芳构化的反应进程可知,经芳构化反应可能得到、,D项正确;
答案选B。
16.(1)醛基、氯原子
(2)
【分析】A发生取代反应生成B,B发生水解反应生成C,C发生酯化反应生成D,D发生取代反应生成E,根据X分子式结合E结构简式知,X为 ;E发生取代反应生成氯吡格雷。
【详解】(1)根据A结构简式 可知A中含有的含氧官能团是醛基;
(2)D( )与分子式为的X物质反应产生E: ,根据D、E结构的不同,可知X结构简式为 。
17.(1)
(2)
(3)D
(4)
(5)
【详解】(1)该分子中主链上含有5个碳原子,甲基位于3号碳原子上,碳碳双键位于2、3号碳原子之间,其结构简式为;
故答案为:;
(2)质量一定时,分析耗氧量,可利用最简式,CH4、C2H6、C3H8、C4H10四种烃的最简式分别为,在最简式中,H原子个数越多,耗氧越多,所以消耗O2最多的是CH4;
故答案为:;
(3)完全燃烧甲烷和乙烯,生成气体进入足量澄清石灰水中,得到沉淀,反应方程式为:,6g碳酸钙的物质的量= ,则燃烧后生成的二氧化碳物质的量为0.06mol,根据碳原子数守恒可知,甲烷和乙烯中含有的碳原子总物质的量为0.06mol,标准状况下甲烷和乙烯的混合气体,物质的量为,设甲烷的物质的量为xmol,乙烯的物质的量为ymol,根据碳原子数守恒可得,根据气体总物质的量关系可得,解得,相同条件下气体的体积之比等于物质的量之比,因此混合气体中甲烷和乙烯的体积之比为4:1;
故答案选:D;
(4)同温同压下,某烯烃蒸气的密度是密度的42倍,则该烯烃相对分子质量M=42×2=84,由于烯烃分子通式是CnH2n,则14n=84,所以该烯烃分子式为C6H12,若分子中所有碳原子一定在同一平面上,则该分子可看作是乙烯分子中4个H原子被甲基取代产生的物质,因此该烯烃的结构简式;该烯烃分子中有不饱和碳碳双键,在一定条件下断裂双键中较活泼的键,然后这些不饱和C原子彼此相连,形成长链,就得到高分子化合物,反应方程式为:;
故答案为:;;
(5)化合物C2H4Br2的结构有两种:有两种类型的氢原子;CH2Br-CH2Br只有一种类型的氢原子,由A的核磁共振氢谱判断A只有一种氢,所以A的结构简式为CH2Br-CH2Br,B的结构简式为
故答案为:。
18.(1) ③⑧ ①④ ②⑤⑥⑩ ⑦⑨ ⑤
(2) +3HNO3+3H2O CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
【分析】①乙烷在空气中燃烧反应属于氧化反应;
②由乙炔制氯乙烯是乙烯与HCl发生的加成反应产生的;
③甲烷与氯气在光照的条件下发生取代反应,产生一氯甲烷等氯代烃和HCl;
④乙烯使酸性高锰酸钾溶液褪色,发生的是氧化反应;
⑤由乙烯制聚乙烯发生的是加聚反应,加聚反应是特殊的加成反应;
⑥乙烯使溴的四氯化碳溶液褪色,发生的是加成反应;
⑦实验室利用浓硫酸与乙醇混合加热170℃制乙烯,发生的是消去反应;
⑧由甲苯制取TNT发生的是取代反应;
⑨溴乙烷和氢氧化钠的乙醇溶液共热发生的是消去反应;
⑩苯与乙烯制备乙苯属于加成反应。
【详解】(1)其中属于取代反应的是③⑧;属于氧化反应的是①④;属于加成反应的是②⑤⑥⑩;属于消去反应的是⑦⑨;属于聚合反应的是⑤;
(2)⑧的化学方程式是+3HNO3+3H2O ;⑨的化学方程式是:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O。
19.(1) 三颈圆底烧瓶或三颈烧瓶、三口烧瓶 恒压滴液漏斗 冷凝回流
(2)C2H5-OH+H-BrC2H5-Br+H2O
(3) D
(4)50.0%
(5)将其与氢氧化钠溶液混合加热,而后加硝酸酸化,再加入硝酸银溶液
【分析】本实验的原理是乙醇与浓氢溴酸混合加热发生取代反应,生成溴乙烷,反应的化学方程式为:,溴乙烷沸点低,用冷水冷凝收集。
【详解】(1)仪器A名称为三颈烧瓶,也称三颈圆底烧瓶或三口烧瓶,仪器C名称为恒压滴液漏斗;B为冷凝管,作用是冷凝回流;
(2)装置A中生成溴乙烷的化学方程式为;
(3)若D中得到的产品混有,是因为浓硫酸具有强氧化性,把溴化氢中的溴氧化生成,反应的化学方程式为:,为纯化产物,需要把除去,对各试剂分析如下:
A.溴乙烷与均能溶解在四氯化碳中,无法除去,A错误;
B.在水中溶解度不大,且硫酸钠与不反应,无法除去,B错误;
C.能与发生置换反应,生成的能溶解在溴乙烷中,形成新的杂质,C错误;
D.亚硫酸钠具有较强的还原性,能把还原成而除去,D正确;
故选D;
(4)根据化学方程式、,经比较得乙醇过量,按溴化钠质量计算溴乙烷理论产量:,,本实验中溴乙烷的产率为。
(5)溴乙烷中的溴需要把C-Br断开,形成才能检验,故应先进行溴乙烷的水解反应或消去反应,再用硝酸银溶液进行检验。故答案为:将其与氢氧化钠溶液混合加热,而后加硝酸酸化,再加入硝酸银溶液。
20. C2H5OHCH2=CH2↑+H2O 催化剂、脱水剂 d 蒸馏 溴在常温下易挥发,乙烯与溴反应时放热,溴易挥发,冷却可避免溴的大量挥发 产品熔点低,过度冷却而凝固而堵塞导管
【分析】装置A是乙醇在浓硫酸的存在下170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据长玻璃管中内外液面高低变化,可以判断是否发生堵塞,二氧化碳、二氧化硫能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品,由此分析。
【详解】(1)乙醇在浓硫酸的存在下170℃脱水生成乙烯,化学方程式为C2H5OHCH2=CH2↑+H2O,该反应中浓硫酸所起的作用是催化剂和脱水剂;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140℃发生副反应生成乙醚,所以要制备乙烯应尽可能快地把反应温度提高到170°C,故最主要的原因是减少副产物乙醚的生成,;
(3)该反应的产物是1,2-二溴乙烷,若产物中有少量副产物乙醚,由表格中数据可知,乙醚和1,2-二溴乙烷互溶,且沸点相差较大,可用蒸馏的方法除去;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,反应过程中应用冷水冷却装置D;但1,2-二溴乙烷的凝固点9°C较低,不能过度冷却,否则会使产品凝固而堵塞导管。
21.(1)CH3CH2OH+HBr CH3CH2Br+H2O
(2)
(3)使溴乙烷冷凝,减少其挥发
(4)c
(5)取少量除杂后的溴乙烷于试管中,加入适量NaOH溶液,振荡,加热,充分反应后,静置,液体分层,取反应后的上清液于另一试管中,加入过量稀硝酸酸化,再滴入硝酸银溶液,若有淡黄色沉淀生成,说明溶液中含有Br-,则溴乙烷中含有溴元素
(6)d
(7)
【分析】实验室用乙醇和溴化钠制取溴乙烷,在试管I中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管II中加入冰水混合物,在烧杯中注入自来水,溴乙烷在试管II中收集,以此解答。
【详解】(1)在加热的条件下,乙醇和溴化氢发生取代反应,生成溴乙烷和水,据此写出反应的化学方程式为:CH3CH2OH+HBr CH3CH2Br+H2O。
(2)溴乙烷的官能团为。
(3)试管II中冰水混合物的作用是使溴乙烷冷凝。
(4)粗制的C2H5Br呈棕黄色,说明含有单质溴,则
a.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故a不选;
b.加入NaOH溶液,会导致溴乙烷水解,故b不选;
c.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故c选;
d.溴和溴乙烷都不和稀硫酸反应,且在稀硫酸中溶解度很小,不能将二者分离,故d不选;
故选c。
(5)将溴乙烷加入氢氧化钠溶液加热,让溴乙烷水解生成溴离子,液体分层,上层是溴化钠;水解后的溴离子在上层,用硝酸酸化,为检验溴离子排除干扰,向酸化的溶液中滴加AgNO3溶液,有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素。
(6)根据题目信息:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,可知反应的原理为:碳溴键发生断裂,溴原子与钠形成氯化钠,与氯原子相连的碳相连形成新的碳碳键,若合成环丁烷,分子中一定含有两个溴原子,分子中含有4个碳原子且两个溴原子在两端,故选d。
(7)由逆向合成法分析,可由发生催化氧化得到,可由在碱性条件下水解得到,可由发生加成反应得到,合成路线为:
一、单选题
1.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是
A.(CH3)2CHCH2Cl B.CH2=CHC(CH3)2CH2Cl
C.CH3CHFCH=CH2 D.CH2=CHCH2CH2Br
2.从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式为。下列判断正确的是( )
A.该有机化合物的分子式为C14H15O3
B.该有机化合物含有两种官能团
C.该有机化合物是芳香烃的衍生物
D.该有机化合物可看作环状化合物
3.已知有机物M、N、W能发生下列反应, 下列说法不正确的是
A.M、N和W均能发生氧化反应、加成反应和取代反应
B.M不能使溴水因发生化学反应而褪色
C.M与足量的H2反应后的产物的一氯代物有4种
D.W的所有碳原子不可能在同一平面上
4.有机化合物X与Y在一定条件下可反应生成Z:
下列说法正确的是
A.X是苯的同系物
B.可用的溶液除去Z中混有的Y杂质
C.含有一个碳碳双键和一个碳碳三键的X的同分异构体有4种
D.Z在酸性条件下水解生成和
5.《清热经解》中记载:“藿香正气散,夏令外感风寒,身温无汗,吐泻交作者。”藿香正气水是一个中成药,具有解表化湿,理气和中之功效。其主要成分广藿香酮结构如图。下列关于广藿香酮的叙述正确的是
A.广藿香酮的分子式为 B.分子中有一个手性碳原子
C.分子中有3种官能团 D.能使溴水、酸性高锰酸钾褪色,且原理相同
6.某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是
A.该物质的分子式为
B.该物质能使溴水、酸性溶液褪色,且褪色原理相同
C.该物质最多能和发生加成反应
D.该物质的一氯代物有6种
7.柠檬烯是一种食用香料,其结构简式如图。有关柠檬烯的分析正确的是
丁基苯:
A.柠檬烯属于芳香烃
B.相对分子质量为136
C.性质稳定,遇空气、加热均不易变质
D.它和丁基苯互为同分异构体
8.下列有机反应中,C—H键未发生断裂的是
A.乙烷与氯气在光照条件下反应
B.溴乙烷在氢氧化钠乙醇溶液中加热条件下反应
C.乙醇与乙酸在浓硫酸加热条件下反应
D.苯与浓硝酸、浓硫酸在加热的条件下反应
9.崖柏素具天然活性,有酚的通性,结构如图。关于崖柏素的说法错误的是
A.可与溴水发生取代反应
B.可与溶液反应
C.分子中的碳原子不可能全部共平面
D.与足量加成后,产物分子中含手性碳原子
10.某酯的分子式可表示为(n为整数且小于10),在酸性条件下能水解生成两种相对分子质量相等的有机物,则该酯的结构可能有(不考虑立体异构)
A.15种 B.23种 C.28种 D.32种
11.下列有关化合物X的叙述正确的是
A.X分子式为C21H20O4Br2
B.X最多可与7moLH2发生加成反应
C.X在酸性条件下水解的产物均可与NaHCO3溶液反应
D.1molX与足量NaOH溶液反应,最多消耗4molNaOH
12.环氧乙烷可用于医用口罩的消毒。工业生产环氧乙烷的两种常见途径如下,下列说法正确的是
途径Ⅰ:
途径Ⅱ: ①
②
A.环氧乙烷的官能团为醚键
B.途径Ⅰ的反应为取代反应
C.从结构分析可知环氧乙烷的性质稳定,故可用做口罩的消毒剂
D.分子中含有氯原子,故该物质可直接与硝酸银溶液反应产生白色沉淀
13.吲哚美辛是非甾体抗炎、解热及镇痛药,结构简式如下图。下列对该有机物的说法正确的是
A.分子式为
B.在的醇溶液中加热,可发生消去反应
C.该物质可与发生加成反应
D.在苯环上的一溴代物最多有5种
14.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯()与等物质的量的Br2发生加成反应
B.2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.甲苯与酸性高锰酸钾溶液的反应
15.分子筛催化环己烯()芳构化制苯()的反应历程和过程中能垒图分别见图一和图二。
下列说法中错误的是
A.的反应为取代反应
B.决定化学反应速率的步骤为
C.环己烯芳构化制苯的化学方程式为+2H2
D.、、等产物
二、填空题
16.氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以2-氯苯甲醛为原料合成该药物的路线如下:
(1)A中官能团的名称为 ,
(2)X(C6H7BrS)的结构简式为 。
17.按要求回答下列问题:
(1)甲基戊烯的结构简式为 。
(2)等质量的四种烃在足量中燃烧,消耗最多的是 。
(3)完全燃烧甲烷和乙烯的混合气体(标准状况下),生成气体进入足量澄清石灰水中,得到沉淀。则混合气体中甲烷和乙烯的体积比为___________(填序号)
A. B. C. D.
(4)同温同压下,某烯烃蒸气的密度是密度的42倍,分子中所有碳原子一定在同一平面上,该烯烃的结构简式 ,该烯烃在一定条件下发生加聚反应的化学方程式 。
(5)化合物A和B的分子式都是,A的核磁共振氢谐如图所示,请写出B的结构简式 。
18.有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥乙烯使溴的四氯化碳溶液褪色
⑦实验室制乙烯 ⑧由甲苯制取TNT
⑨溴乙烷和氢氧化钠的乙醇溶液共热
⑩乙苯的制备:
(1)其中属于取代反应的是 ;属于氧化反应的是 ;属于加成反应的是 ;属于消去反应的是 ;属于聚合反应的是
(2)写出⑧和⑨的化学方程式:
⑧
⑨
三、实验题
19.下图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置(省去了加热装置),回答下列问题:
已知:浓硫酸与溴化钠共热时发生反应:
(1)仪器A、C的名称分别为 、 ;B的作用为 。
(2)装置A中生成溴乙烷的化学方程式为 。
(3)若选用的硫酸浓度过大,D中得到的产品则会因混入少量溴而呈棕黄色,生成这一副产物的原因为 (用化学方程式表示);为纯化产物,最好选择下列的 溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.碘化钠 D.亚硫酸钠
(4)若实验中使用了10g乙醇、20.6g溴化钠,且浓硫酸足量,经过分离、提纯、干燥后,最终得到10.9g溴乙烷,则本实验中溴乙烷的产率为 (保留3位有效数字)。
(5)检验溴乙烷中溴元素的方法为:取样, ,若产生淡黄色沉淀,则该物质中存在溴元素。
20.实验室用乙醇制备1,2-二溴乙烷的反应原理如下:①乙醇在浓硫酸的存在下制取乙烯,②乙烯与溴反应制得1,2-二溴乙烷。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
乙醇 1,2-二溴乙烷 乙醚
状态 无色液体 无色液体 无色液体
密度/g·cm-3 0.79 2.2 0.71
沸点/℃ 78.5 132 34.6
熔点/℃ -130 9 -116
回答下列问题:
(1)写出乙醇在浓硫酸的存在下制取乙烯的化学方程式 ;浓硫酸所起的作用是 。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)若产物中有少量副产物乙醚,可用 的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是 ,但又不能过度冷却(如用冰水),其原因是 。
21.实验室用如图所示装置制取溴乙烷。在试管I中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管II中加入冰水混合物,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式: 。
(2)溴乙烷的官能团为 (结构简式)。
(3)试管II中冰水混合物的作用是 。
(4)若试管II中获得的有机物呈棕黄色,除去其中的杂质最佳的试剂是 (填序号)。
a.CCl4 b.NaOH溶液 c.Na2SO3溶液 d.稀硫酸
(5)设计实验证明溴乙烷中含有溴元素(说明操作、现象和结论): 。
(6)已知溴乙烷可以与钠发生反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr。应用该反应原理,下列化合物中可以与钠反应合成环丁烷的是 (填序号)。
a.CH3CH2CH2CH2Br b.CH3CHBrCH2CH2Br
c.CH3CH2CHBrCH2Br d.CH2BrCH2CH2CH2Br
(7)写出由溴苯制备环己酮的流程: 。
(合成路线常用的表示方式为:甲乙……目标产物)
试卷第2页,共9页
参考答案:
1.B
【详解】A.(CH3)2CHCH2Cl,不含不饱和键,不能加成,卤代烃能水解,与-X相连碳的相邻碳上有氢原子,能消去,故A错误;
B.CH2=CHC(CH3)2CH2Cl含有双键,能加成,卤代烃能水解,与Cl相连碳的相邻碳上没有氢原子,不能消去,故B正确;
C.CH3CHFCH=CH2含有双键,能加成,卤代烃能水解,与F原子相连碳的相邻碳上有氢原子,能发生消去反应,故C错误;
D.CH2=CHCH2CH2Br含有双键,能加成,卤代烃能水解,与Br相连碳的相邻碳上有氢原子,能消去,故D错误;
故选B。
2.D
【详解】A.根据结构简式可以判断,该有机化合物中的碳原子数目为15,氢原子数目为18,氧原子数目为3,故分子式为C15H18O3,A项错误;
B.该有机化合物含有双键、羰基、酯基三种官能团,B项错误;
C.该有机化合物含有双键的碳六元环,不含苯环,C项错误;
D.该有机化合物含有两个碳六元环和一个碳氧环,D项正确;
故选:D。
3.C
【详解】A.苯环、碳碳双键可发生加成反应,均可发生燃烧为氧化反应,苯环及甲基可发生取代反应,则M、N和W均能发生氧化反应、加成反应和取代反应,A正确;
B.甲苯不能与溴水发生反应,但能萃取溴水中的溴,所以M不能使溴水因发生化学反应而褪色,B正确;
C.甲苯与足量的H2反应后的产物为甲基环己烷,其一氯代物有5种,C错误;
D.甲烷为正四面体结构,由于W中含有甲基,具有甲烷的结构特点,则W的所有碳原子不可能在同一平面上,D正确;
因此,本题答案为C。
【点睛】不要把甲苯的一氯代物种数和甲基环己烷的一氯代物的种数混同。
4.C
【详解】A.X的不饱和度为3,而苯的不饱和度为4,故可确定X不是苯的同系物;或者根据分子式判断:X分子式为,不符合苯的同系物通式, A错误;
B.Y和Z分子中均含有碳碳双键,均可与的溶液发生加成反应,故无法实现除杂,B错误;
C.若主链含有5个C原子,有3种,分别为、、,若主链有4个C原子,只能为,共4种,C正确;
D.Z在酸性条件下水解生成和,D错误。
故选C。
5.A
【详解】A.由结构可知,广藿香酮的分子式为,A正确;
B.手性碳原子是连有四个不同基团的碳原子;分子中无手性碳原子,B错误;
C.分子中含有碳碳双键、羟基、酯基、酮羰基四种官能团,C错误;
D.含有碳碳双键,故使溴水、酸性高锰酸钾褪色,但原理不相同,前者为加成反应,后者为氧化反应,D错误;
故选A。
6.D
【详解】A.依图示结构,该物质的分子式为,A错误;
B.该物质能使溴水褪色是碳碳双键与溴单质发生了加成反应,使酸性溶液褪色是发生了氧化还原反应,B错误;
C.1个苯环可与3个H2加成,1个碳碳双键可与1个H2加成,酯基中碳氧双键不能与H2加成,故该物质最多能和发生加成反应,C错误;
D.该物质处于不同化学环境的H有6种,一氯代物有6种,D正确;
故选D。
7.B
【详解】A.芳香烃是指含有苯环的碳氢化合物,柠檬烯中无苯环结构,所以柠檬烯不属于芳香烃,故A错误;
B.柠檬烯的化学式为:C10H16,所以相对分子质量为:136,故B正确;
C.柠檬烯中含有碳碳双键,易发生加成反应,氧化反应,含有烷基,易发生取代反应等,故C错误;
D.丁基苯分子式为:C10H14,与柠檬烯的分子式不同,不是同分异构体,故D错误;
故选B。
8.C
【详解】A.乙烷与氯气在光照条件下反应,氯原子取代乙烷分子中的H原子,C—H键发生断裂,故不选A;
B.溴乙烷在氢氧化钠乙醇溶液中加热条件下反应消去反应生成乙烯,溴乙烷分子中断裂1个C—H键、1个C—Br键,故不选B;
C.乙醇与乙酸在浓硫酸加热条件下发生酯化反应,乙醇分子断裂O—H键,乙酸分子断裂C—O键,C—H键未发生断裂,故选C;
D.苯与浓硝酸、浓硫酸在加热的条件下发生取代反应,硝基取代苯环上的1个H原子,C—H键发生断裂,故不选D;
选C。
9.B
【分析】由题中信息可知,γ-崖柏素中碳环具有类苯环的共轭体系,其分子中羟基具有类似的酚羟基的性质。此外,该分子中还有羰基可与氢气发生加成反应转化为脂环醇。
【详解】A.酚可与溴水发生取代反应,γ-崖柏素有酚的通性,且γ-崖柏素的环上有可以被取代的H,故γ-崖柏素可与溴水发生取代反应,A说法正确;
B.酚类物质不与NaHCO3溶液反应,γ-崖柏素分子中没有可与NaHCO3溶液反应的官能团,故其不可与NaHCO3溶液反应,B说法错误;
C.γ-崖柏素分子中有一个异丙基,异丙基中间的碳原子与其相连的3个碳原子不共面,故其分子中的碳原子不可能全部共平面,C说法正确;
D.γ-崖柏素与足量H2加成后转化为 ,产物分子中含手性碳原子(与羟基相连的C原子是手性碳原子),D说法正确;
综上所述,本题选B。
10.B
【详解】分子式为CnH2nO2(n为整数)的酯的相对分子质量不大于160,则14n+32<160,解得:n≤9(n为整数),在酸性条件下水解生成相对分子质量相等的饱和醇和酸,则醇分子中碳原子数比酸中碳原子数多1,满足条件的酯可能组合为:①C2H5OH和HCOOH,②C3H7OH(2种)和CH3COOH,③C4H9OH(4种)和CH3CH2COOH,④C5H11OH(8种)和C3H7COOH(两种),第①组形成的酯有1种,第②组形成的酯有2种,第③组形成的酯有4种,第④组形成的酯有8×2=16种,共有23种,B正确;
故选B。
11.D
【详解】A. X分子式为C21H22O4Br2,A错误;
B. X所含苯环和羰基均可与氢气加成、酯基不能与氢气加成,题目中没有说明X的物质的量所以不能确定氢气的物质的量。1molX最多可与7moLH2发生加成反应,B错误;
C. 酯基可以水解、X在酸性条件下水解的产物中只有乙酸可与NaHCO3溶液反应,C错误;
D. 酯基、Br均可与氢氧化溶液反应,其中直接与苯环相连的1个Br消耗2个OH-,则1molX最多消耗4molNaOH,D正确;
答案选D。
12.A
【详解】A.由结构简式可知,环氧乙烷的官能团为醚键,故A正确;
B.由方程式可知,途径Ⅰ的反应为在银做催化剂条件下,乙烯与氧气共热发生催化氧化反应生成环氧乙烷,故B错误;
C.环氧乙烷是三元环有机物,稳定性较差,但环氧乙烷对消毒物品的穿透力强,可达到物品深部,杀灭病原微生物,常用于医用口罩的消毒,故C错误;
D.是非电解质,不能电离出能与硝酸银溶液反应产生白色沉淀的氯离子,故D错误;
故选A。
13.D
【详解】A. 由结构简式,分子式为,故A错误;
B. 在的醇溶液中加热,卤原子不能发生消去反应,故B错误;
C. 羟基和酰胺键不能与氢气发生加成反应,该物质可与发生加成反应,故C错误;
D. 如图在苯环上的一溴代物最多有5种,故D正确;
故选D。
14.D
【详解】A. 异戊二烯()与等物质的量的Br2发生加成反应,可发生1,2-加成或1,4-加成,则存在同分异构体,选项A错误;
B.2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热发生消去反应可生成1-丁烯和2-丁烯,则存在同分异构体,选项B错误;
C. 甲苯中甲基的邻对位能发生取代反应,则在一定条件下发生硝化生成两种一硝基甲苯,存在同分异构体,选项C错误;
D. 甲苯与酸性高锰酸钾溶液的反应,生成苯甲酸,没有同分异构体,故D正确;
故选D。
15.B
【详解】A.观察TS1及Int1的结构简式可知TS1Int1的反应应为取代反应,A项正确;
B. 升高温度,反应速率变化最大的步骤应该是活化能最大的步骤,由题图可知,应该是R TS1的反应,B项错误;
C.根据图中的结构简式可知环己烯芳构化反应为+2H2,C项正确;
D.由环己烯芳构化的反应进程可知,经芳构化反应可能得到、,D项正确;
答案选B。
16.(1)醛基、氯原子
(2)
【分析】A发生取代反应生成B,B发生水解反应生成C,C发生酯化反应生成D,D发生取代反应生成E,根据X分子式结合E结构简式知,X为 ;E发生取代反应生成氯吡格雷。
【详解】(1)根据A结构简式 可知A中含有的含氧官能团是醛基;
(2)D( )与分子式为的X物质反应产生E: ,根据D、E结构的不同,可知X结构简式为 。
17.(1)
(2)
(3)D
(4)
(5)
【详解】(1)该分子中主链上含有5个碳原子,甲基位于3号碳原子上,碳碳双键位于2、3号碳原子之间,其结构简式为;
故答案为:;
(2)质量一定时,分析耗氧量,可利用最简式,CH4、C2H6、C3H8、C4H10四种烃的最简式分别为,在最简式中,H原子个数越多,耗氧越多,所以消耗O2最多的是CH4;
故答案为:;
(3)完全燃烧甲烷和乙烯,生成气体进入足量澄清石灰水中,得到沉淀,反应方程式为:,6g碳酸钙的物质的量= ,则燃烧后生成的二氧化碳物质的量为0.06mol,根据碳原子数守恒可知,甲烷和乙烯中含有的碳原子总物质的量为0.06mol,标准状况下甲烷和乙烯的混合气体,物质的量为,设甲烷的物质的量为xmol,乙烯的物质的量为ymol,根据碳原子数守恒可得,根据气体总物质的量关系可得,解得,相同条件下气体的体积之比等于物质的量之比,因此混合气体中甲烷和乙烯的体积之比为4:1;
故答案选:D;
(4)同温同压下,某烯烃蒸气的密度是密度的42倍,则该烯烃相对分子质量M=42×2=84,由于烯烃分子通式是CnH2n,则14n=84,所以该烯烃分子式为C6H12,若分子中所有碳原子一定在同一平面上,则该分子可看作是乙烯分子中4个H原子被甲基取代产生的物质,因此该烯烃的结构简式;该烯烃分子中有不饱和碳碳双键,在一定条件下断裂双键中较活泼的键,然后这些不饱和C原子彼此相连,形成长链,就得到高分子化合物,反应方程式为:;
故答案为:;;
(5)化合物C2H4Br2的结构有两种:有两种类型的氢原子;CH2Br-CH2Br只有一种类型的氢原子,由A的核磁共振氢谱判断A只有一种氢,所以A的结构简式为CH2Br-CH2Br,B的结构简式为
故答案为:。
18.(1) ③⑧ ①④ ②⑤⑥⑩ ⑦⑨ ⑤
(2) +3HNO3+3H2O CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
【分析】①乙烷在空气中燃烧反应属于氧化反应;
②由乙炔制氯乙烯是乙烯与HCl发生的加成反应产生的;
③甲烷与氯气在光照的条件下发生取代反应,产生一氯甲烷等氯代烃和HCl;
④乙烯使酸性高锰酸钾溶液褪色,发生的是氧化反应;
⑤由乙烯制聚乙烯发生的是加聚反应,加聚反应是特殊的加成反应;
⑥乙烯使溴的四氯化碳溶液褪色,发生的是加成反应;
⑦实验室利用浓硫酸与乙醇混合加热170℃制乙烯,发生的是消去反应;
⑧由甲苯制取TNT发生的是取代反应;
⑨溴乙烷和氢氧化钠的乙醇溶液共热发生的是消去反应;
⑩苯与乙烯制备乙苯属于加成反应。
【详解】(1)其中属于取代反应的是③⑧;属于氧化反应的是①④;属于加成反应的是②⑤⑥⑩;属于消去反应的是⑦⑨;属于聚合反应的是⑤;
(2)⑧的化学方程式是+3HNO3+3H2O ;⑨的化学方程式是:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O。
19.(1) 三颈圆底烧瓶或三颈烧瓶、三口烧瓶 恒压滴液漏斗 冷凝回流
(2)C2H5-OH+H-BrC2H5-Br+H2O
(3) D
(4)50.0%
(5)将其与氢氧化钠溶液混合加热,而后加硝酸酸化,再加入硝酸银溶液
【分析】本实验的原理是乙醇与浓氢溴酸混合加热发生取代反应,生成溴乙烷,反应的化学方程式为:,溴乙烷沸点低,用冷水冷凝收集。
【详解】(1)仪器A名称为三颈烧瓶,也称三颈圆底烧瓶或三口烧瓶,仪器C名称为恒压滴液漏斗;B为冷凝管,作用是冷凝回流;
(2)装置A中生成溴乙烷的化学方程式为;
(3)若D中得到的产品混有,是因为浓硫酸具有强氧化性,把溴化氢中的溴氧化生成,反应的化学方程式为:,为纯化产物,需要把除去,对各试剂分析如下:
A.溴乙烷与均能溶解在四氯化碳中,无法除去,A错误;
B.在水中溶解度不大,且硫酸钠与不反应,无法除去,B错误;
C.能与发生置换反应,生成的能溶解在溴乙烷中,形成新的杂质,C错误;
D.亚硫酸钠具有较强的还原性,能把还原成而除去,D正确;
故选D;
(4)根据化学方程式、,经比较得乙醇过量,按溴化钠质量计算溴乙烷理论产量:,,本实验中溴乙烷的产率为。
(5)溴乙烷中的溴需要把C-Br断开,形成才能检验,故应先进行溴乙烷的水解反应或消去反应,再用硝酸银溶液进行检验。故答案为:将其与氢氧化钠溶液混合加热,而后加硝酸酸化,再加入硝酸银溶液。
20. C2H5OHCH2=CH2↑+H2O 催化剂、脱水剂 d 蒸馏 溴在常温下易挥发,乙烯与溴反应时放热,溴易挥发,冷却可避免溴的大量挥发 产品熔点低,过度冷却而凝固而堵塞导管
【分析】装置A是乙醇在浓硫酸的存在下170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据长玻璃管中内外液面高低变化,可以判断是否发生堵塞,二氧化碳、二氧化硫能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品,由此分析。
【详解】(1)乙醇在浓硫酸的存在下170℃脱水生成乙烯,化学方程式为C2H5OHCH2=CH2↑+H2O,该反应中浓硫酸所起的作用是催化剂和脱水剂;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140℃发生副反应生成乙醚,所以要制备乙烯应尽可能快地把反应温度提高到170°C,故最主要的原因是减少副产物乙醚的生成,;
(3)该反应的产物是1,2-二溴乙烷,若产物中有少量副产物乙醚,由表格中数据可知,乙醚和1,2-二溴乙烷互溶,且沸点相差较大,可用蒸馏的方法除去;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,反应过程中应用冷水冷却装置D;但1,2-二溴乙烷的凝固点9°C较低,不能过度冷却,否则会使产品凝固而堵塞导管。
21.(1)CH3CH2OH+HBr CH3CH2Br+H2O
(2)
(3)使溴乙烷冷凝,减少其挥发
(4)c
(5)取少量除杂后的溴乙烷于试管中,加入适量NaOH溶液,振荡,加热,充分反应后,静置,液体分层,取反应后的上清液于另一试管中,加入过量稀硝酸酸化,再滴入硝酸银溶液,若有淡黄色沉淀生成,说明溶液中含有Br-,则溴乙烷中含有溴元素
(6)d
(7)
【分析】实验室用乙醇和溴化钠制取溴乙烷,在试管I中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管II中加入冰水混合物,在烧杯中注入自来水,溴乙烷在试管II中收集,以此解答。
【详解】(1)在加热的条件下,乙醇和溴化氢发生取代反应,生成溴乙烷和水,据此写出反应的化学方程式为:CH3CH2OH+HBr CH3CH2Br+H2O。
(2)溴乙烷的官能团为。
(3)试管II中冰水混合物的作用是使溴乙烷冷凝。
(4)粗制的C2H5Br呈棕黄色,说明含有单质溴,则
a.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故a不选;
b.加入NaOH溶液,会导致溴乙烷水解,故b不选;
c.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故c选;
d.溴和溴乙烷都不和稀硫酸反应,且在稀硫酸中溶解度很小,不能将二者分离,故d不选;
故选c。
(5)将溴乙烷加入氢氧化钠溶液加热,让溴乙烷水解生成溴离子,液体分层,上层是溴化钠;水解后的溴离子在上层,用硝酸酸化,为检验溴离子排除干扰,向酸化的溶液中滴加AgNO3溶液,有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素。
(6)根据题目信息:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,可知反应的原理为:碳溴键发生断裂,溴原子与钠形成氯化钠,与氯原子相连的碳相连形成新的碳碳键,若合成环丁烷,分子中一定含有两个溴原子,分子中含有4个碳原子且两个溴原子在两端,故选d。
(7)由逆向合成法分析,可由发生催化氧化得到,可由在碱性条件下水解得到,可由发生加成反应得到,合成路线为:
