3.1.铁及其化合物 课件(共47张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.铁及其化合物 课件(共47张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-29 18:57:25 | ||
图片预览









文档简介
(共47张PPT)
铁及其化合物
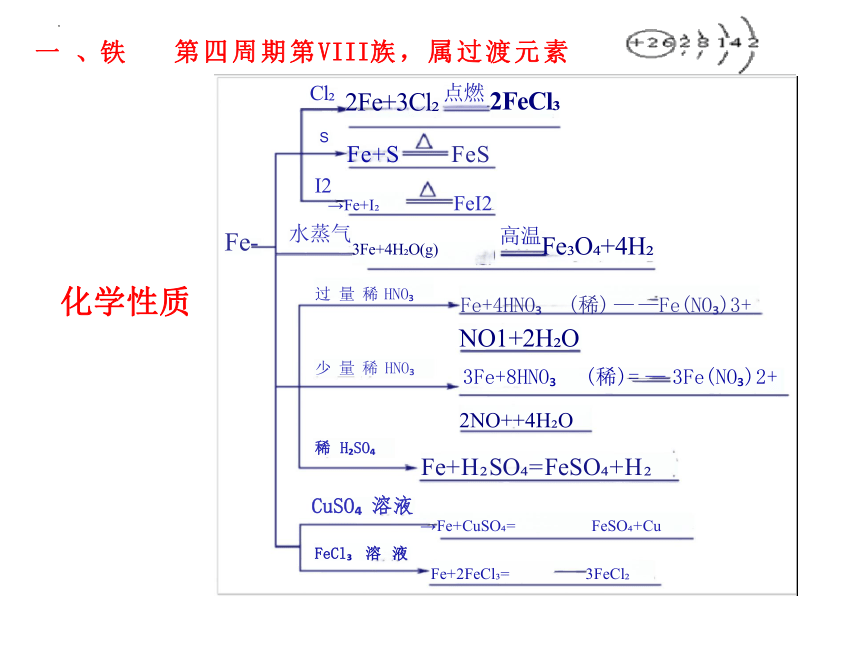
Fe- 水蒸气3Fe+4H O(g) 高温Fe O +4H
化学性质 过 量 稀 HNO Fe+4HNO (稀) — —Fe(NO )3+
NO1+2H O
少 量 稀 HNO 3Fe+8HNO (稀)= — 3Fe(NO )2+
2NO++4H O
稀 H SO
Fe+H SO =FeSO +H
CuSO 溶液
→Fe+CuSO = FeSO +Cu
FeCl 溶 液
Fe+2FeCl = 3FeCl
第四周期第VIII族,属过渡元素
Cl 2Fe+3Cl 点燃 2FeCl
S
Fe+S FeS
一 、铁
I2
→Fe+I
FeI2
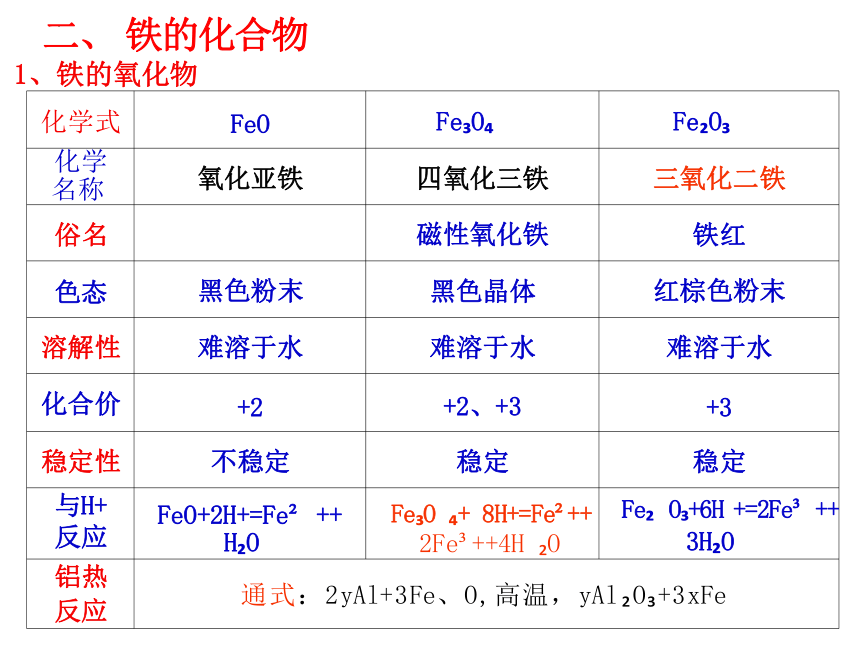
化学式 FeO Fe O
Fe O
化学 名称 氧化亚铁 四氧化三铁
三氧化二铁
俗名 磁性氧化铁
铁红
色态 黑色粉末 黑色晶体
红棕色粉末
溶解性 难溶于水 难溶于水
难溶于水
化合价 +2 +2、+3
+3
稳定性 不稳定 稳定
稳定
与H+ 反应 FeO+2H+=Fe ++ H O Fe O + 8H+=Fe ++ 2Fe ++4H O
Fe O +6H +=2Fe ++
3H O
铝热 反应 通式:2yAl+3Fe、O,高温,yAl O +3xFe
二、 铁的化合物
1、铁的氧化物
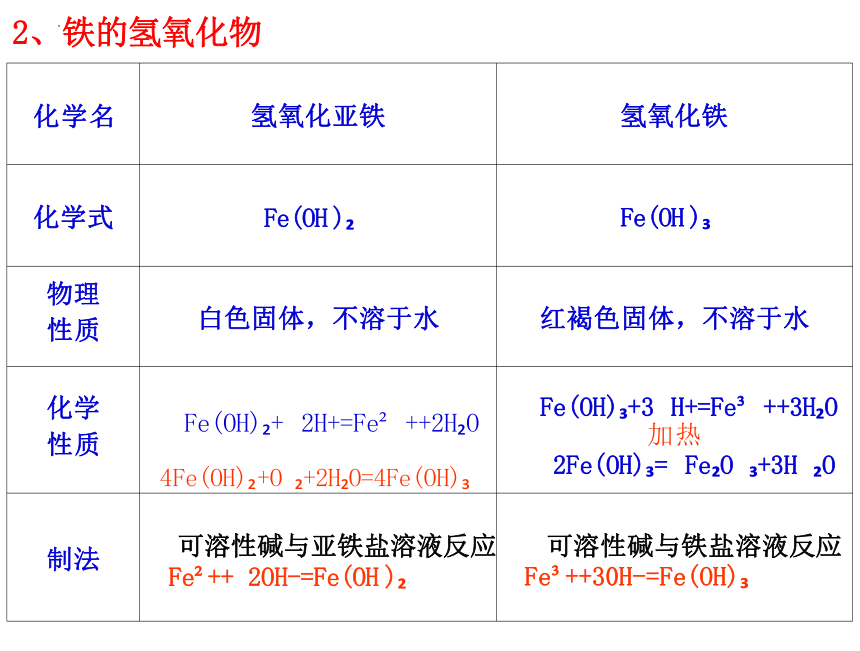
化学名 氢氧化亚铁
氢氧化铁
化学式 Fe(OH )
Fe(OH )
物理 性质 白色固体,不溶于水
红褐色固体,不溶于水
化学 性质 Fe(OH) + 2H+=Fe ++2H O 4Fe(OH) +O +2H O=4Fe(OH)
Fe(OH) +3 H+=Fe ++3H O
加热
2Fe(OH) = Fe O +3H O
制法 可溶性碱与亚铁盐溶液反应 Fe ++ 2OH-=Fe(OH )
可溶性碱与铁盐溶液反应
Fe ++30H-=Fe(OH)
2、铁的氢氧化物
3、 铁的重要盐
(1)+3价铁:呈黄色
①沉淀性:
Fe ++3OH-=Fe(OH) ↓ 红褐色沉淀用于鉴别Fe +
②水解性:
a、和CO -、HCO 、 双水解,写出方程式
b 、制氢氧化铁胶体Fe ++3H O(沸水)=Fe(OH)3+ 3H+
③络合性:
用于鉴别Fe + Fe ++3SCN-=Fe(SCN) 血红色溶液
④显色反应:加苯酚 溶液显紫色
(2)+2价铁:呈浅绿色
沉淀性: Fe ++2OH-=Fe(OH) ↓
4Fe(OH)2+2H O+O =4Fe(OH)
现象:和碱反应生成白色沉淀迅速变成灰绿色最
后变成红褐色沉淀,此现象用于鉴别Fe +。
思考:配置Fe + 和Fe(OH) 时需要注意的事项:
排除装置内的氧气(例如加热煮沸、滴加油
油封、生成气体来排除氧气)
1. 下列反应中,其产物的颜色按红、红褐、淡黄、蓝色顺
序排列的是( )
① 金属钠在纯氧中燃烧 ② FeSO 溶液中滴入NaOH溶液,并
在空气中放置一段时间 ③ FeCl,溶液中滴入KSCN 溶液
④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
【答案】 B
2、铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,
再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至 质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别 为( )
A.Fe(OH) ;Fe O B. Fe(OH) ; FeO
C.Fe(OH) 、Fe(OH) ;Fe O D.Fe O ;Fe(OH)
答案 】 A
液不反应,但加入氧化剂后Fe +被氧化成Fe +, 使KSCN变
红色。所以应先加入KSCN, 如果溶液不变色,再加入氯水, 溶液变成红色,则可证明溶液中不含Fe +含有Fe +。
【答案】 c
3. 欲证明某溶液中不含Fe +可能含有Fe +, 进行如下实
验操作时最佳顺序为( )
①加入少量氯水 ②加入少量KMnO 溶液 ③加入少量
KSCN溶液
A.①③ B.③②
C.③①
D.①②③
【解析】
Fe +与KSCN溶液反应变红色, Fe +与KSCN溶
4. 将1.12g 铁粉加入25mL2mol ·L-1 的氯化铁溶液中,充分
反应后,其结果是( )
A. 铁有剩余,溶液呈浅绿色, Cl-浓度基本不变
B. 往溶液中滴入无色KSCN 溶液,显血红色
C.Fe + 和Fe +的物质的量之比为5:1
D. 氧化产物与还原产物的物质的量之比为2:5
【答案】 B
重点突破
Fe(OH) 的制取方法
Fe(OH),具有较强的还原性,易被空气中的氧气氧
化,因此制备Fe(OH) 是高考题常见考点.实验的 关键之处是隔绝空气、避免接触O , 防止Fe(OH) 被氧化.
②除去蒸馏水中溶解的0,常采用 的方法.
③生成Fe(OH) 白色沉淀的操作是用长滴管吸取不含O 的
NaOH溶液,插入FeSO 溶液液面下,再挤出NaOH溶液.这样 操作的理由是
【答案】 (1)①稀H SO 、铁屑 ②煮沸 ③避免生成的
Fe(OH) 沉淀接触O 而被氧化
经典例题
下面是制备Fe(OH) 白色沉淀的几种方案.请回答下列各问
题:
(1)用不含Fe +的FeSO 溶液与不含O 的蒸馏水配制的NaOH
溶液反应制备.
①用硫酸亚铁晶体配制上述FeSO 溶液时还需要加入
制备.
①在试管I 里加入的试剂是
②在试管工里加入的试剂是
③为了制得Fe(OH) 白色沉淀,在试管I 和
Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实
验步骤是
【答案】(2)①稀H SO 和铁屑 ②NaOH 溶液 ③检验试管Ⅱ出口
处排出的H 的纯度,当排出的H 已经纯净时再夹紧止水夹④试管 I 中反应生成的H 充满了试管I 和试管Ⅱ,且外界O 不易进入
止水夹
(2)在如图所示的装置中,用NaOH溶液、铁屑、稀H SO 等试剂
④这样生成的Fe(OH) 沉淀能较长时间保持白色,理由是
①a 电极的材料应为 ,电极反应式 。
②电解液c可以是 (填编号).
A. 纯水 B.NaCl 溶液 C.NaOH 溶液 D.CuCl 溶液
【答案】(3)①Fe Fe-2e-=== Fe +
(3)利用电解实验可以制得纯净的Fe(OH) 白色沉淀.如图所示,
已知两电极的材料分别为石墨和铁.
BC
③d为苯,其作用是 , 在加入苯之
前对电解液c应作何简单处理
④为了在较短时间内看到白色沉淀,可采取的措施是
(填编号).
A. 改用稀H SO 作电解液 B. 适当增大电源的电压
C. 适当减小两极间的距离 D. 适当降低电解液的温度
⑤若c用Na SO 溶液,当电解一段时间后看到白色Fe(OH)
沉淀,再反接电源电解,除了电极上看到气泡外,另一明显 现象为
【答案】③隔绝空气,防止生成的Fe(OH) 被氧化 加热煮沸,
排出溶解的O ④BC ⑤白色沉淀迅速变为灰绿色,最后变成 红褐色
Br 、Cl 、HNO 、浓H SO 等
铁三角
03
Fe3+
Fe +
1、Fe只有还原性
Fe反 应后形成的产物呈何价态, 一般由下列因素来决
定:
S、I 、H+、Cu +、Fe +等
强氧化剂
Cl 、Br 、热浓H SO 、HNO 等
弱氧化剂
Fe(+2)
Fe(+3)
2.+2价铁离子 强还原性、弱氧化性
①弱氧化性: 遇强还原剂时被还原成单质铁
例: Fe ++Zn=Zn ++Fe
②强还原性:遇较强氧化剂时被氧化成三价铁的化合物
常见Fe +转化成Fe +的离子方程式:
2Fe ++Cl (Br )===2Fe ++2Cl- (Br- )
4Fe ++4H++0 ===4Fe ++2H O
3Fe ++4H++NO ===3Fe ++NO1+ 2H O
2Fe ++H O +2H+===2Fe ++2H O
5Fe ++8H++MnO ===5Fe ++Mn ++4H O
① 2Fe ++2I'=2Fe ++I
② 2Fe ++SO +2H O=2Fe ++SO +4H
③ 2Fe ++S -=2Fe ++S↓
④ 2Fe ++H S=2Fe ++Sl+2H+
⑤ 2Fe ++Cu=2Fe ++Cu +
⑥ 2Fe ++Fe=3Fe +
3.+3价铁离子 只具有氧化性
F 工 、S EBCW 穿
( 溶 液 中 )
常见Fe +转化成Fe +的离子方程式
+
Fe +
Fe +
溶液的颜色 浅绿色
棕黄色
加碱溶液 白色→灰绿色→红褐色
红褐色
加SCN- 无明显现象(通氯气)
血红色
加苯酚 不变色
紫色
淀粉碘化钾试纸 不变色
变蓝
加入铜片 不变色
变成蓝绿色
其它
4.Fe2+ 和 Fe3+的鉴别方法
思考1
亚铁盐、铁盐溶液的保存方法
亚铁盐溶液:加入少量铁屑防止氧化;加入 少量相应的酸溶液以防止Fe +的水解。
铁盐溶液:加入少量相应酸溶液以防止Fe +
的水解
思考2
如何从FeCl,和少量Cu的混合物中分离得到纯净的
FeCl 和Cu
① 加水溶解:2FeCl +Cu=2FeCl +CuCl
② 加过量的Fe并过滤: Fe+CuCl =FeCl +Cu
③ 在过滤所得沉淀物中加足量HCl,
Fe+2HCl=FeCl +H ↑ 过滤,将滤液合并,沉淀物清洗 烘干.
④ 滤液中通足量Cl :2FeCl,+Cl,=2FeCl
⑤ 通入HCl气流,蒸干FeCl 溶液:
FeCl +3H O Fe(OH) +3HCl,HCl 抑制水解
FeC]3 Cu H 0 —
CuC12
Fe 1
HC1气流
F eC1. 蒸干 3
足量Fe 沉淀:Fe、Cu
流程图
FeC 溶液
HCl 壮龄
1 1
FeC']
2
固体
Fe C13
过诊
Cl
bL
2
:
1
[典型剖析]
【例1】把铜粉和过量的铁粉加入到热的浓硝酸中,充 分反应后,溶液中大量存在的金属阳离子是 (A)
A.只有Fe + B.只有Fe +
C.有Fe +和Cu + D.有Fe +和Cu +
【例2】将6g纯铁粉加入200mLFe (SO ) 和CuSO 的
混合溶液中充分反应后得到200mL0.5mol/L 的FeSO 溶
液 .) ,生 铜多少克 2.56g
(2)加入铁粉前Fe (SO ) 物质的量浓度。 0.1mol/L
成
求:
后
体
反应
2g固
1
5
(
和
【例3】由FeO、Fe O 和Fe O 组成的混合物,测得其 中铁元素与氧元素的质量比为21:8,,则这种混合物 中FeO、Fe O 和Fe O 的物质的量之比是 (cD )。
A. 1:2:1 B. 2:1:1
C. 1:1:1 D.1:1:3
【例4】在下列所指的各溶液中,分别滴加NH SCN溶液 后,溶液不呈血红色的是 ( AB )
A.加入足量镁粉的Fe (SO ) 溶液
B.加入过量铁粉的稀硝酸溶液
C. 铁丝在足量的氯气中燃烧后, 所得产物的溶液
D.长期暴露在空气中的绿矾溶液
【例5】金属铜能被FeCl 的浓溶液腐蚀,其化学反应 是: Cu+2FeCl3=2FeCl +CuCl 。
现将有铜的印刷线路板浸入FeCl 的浓溶液中,有
9.6gCu 被腐蚀掉。取出印刷线路板,向溶液中加入
8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。 则:
(1)溶液中存在哪些离子 Fe +、Cu +、C1-
(2)离子的物质的量各是多少
Fe2+ 0.6mol Cu2+ 0.075mol C1- 1.35mol
(1)写出G和H的化学式: G , H o
(2)工业生产中D转化为C的反应条件是: 。
3)B跟E反应的离子方程式是
【答案】 (1)Fe (SO ) Na SO (2)催化剂和适当的温度
(3)Fe O +6H+===2Fe ++3H O
B
G
H O
0
U2
D 足量NaOH
5.已知: A是硫酸盐,且A和G、C和D、F和H元素组成分别相 同。G和KSCN溶液混合后溶液显红色, B、C和D均为氧化物。
反应过程中产生的水在图示中已略去。
回答下列问题:
受热分解
C
F
A H
备习题课
例题1]某元素的一种同位素R 具有微弱的放射性,其原子核内中子
数比质子数多40,其单质晶体在一 定条件下密度为6 . 78g ·c m-3
X 射 线研究该晶体发现在边长为1.00×10-7 cm 的立方体中含有
20个R 原子。 R 在化学反应中常表现为+2价和+4价,溶液中R2+
稳定。氧化物R3O4 与 Fe3O 有相似之处。请回答:
204 g ·m o 1-1
(1)R 原子的摩尔质量为
(2)此元素位于周期表第 六 周期 IV A 族。
( 3 ) 已 知Fe3O4 可写成氧化物的形式和盐的形式:
Fe0 ·Fe,O 和 Fe(FeO )z。 则 R3O 用氧化物的形
成可表示为2PbO ·PbO 用盐的形式可表示为P b,P b 。O
(4)R3O4 可与浓盐酸反应且有气体放出。写出R3O4 与浓盐
酸反应的化学方程式:
Pb3O4+8HC1 (浓)=3PbC1 +C1 +4H O
【例题2】Fe 是地壳中含量很丰富的元素,也是生物体所必需
的元素。 自然界中铁矿石主要有赤铁矿和磷铁矿,金属铁是在 高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和 生石灰。请填空: (已知铁矿石中含SiO 杂 质 )
①写出磁铁矿主要成分的化学式 Fe O
②写出赤铁矿被还原成铁的化学方程 高温
2Fe+3CO
③写出焦炭在高炉中参与反应的两个化学方程式。
高温 高温
二 二 二 2CO
④写出CaCO 所参与反应的两个化学方程式:
高温 高温
二 二 二 CaO+CO, CaO+SiO = = 三 CaSiO
C+O
[例题3]A 、B 、C 、D是四种可溶的化合物,分别由阳离子
K+、Ba +、Al +、Fe +和阴离子OH-、NO -、SO -、 CO - 两两组合而成,它们的溶液发生如下反应:
A 与B反应生成白色沉淀,再加过量A, 沉淀量减少, 但不会完全消失; C 与D 反应生成有色沉淀; B 与C 反应生 成白色沉淀。写出它们的化学式:
A: Ba(OH) B: Al (SO )
C: K CO D: Fe(NO )
A Fe ,B FeSO 7H Oc FeSO
_
4
D Fe O E SO F SO
_
或 (E.SO F.SO )
结
过滤,除杂质
金屑A
明
日
[例题4]下图表示某种盐的制备步骤:
已知:水合盐B 含有45.3%的水;无水盐C 焙烧分解, 放出两种无色刺激性气体E和F, 并生成红棕色固体D。
请写出物质的化学式或名称:
3000
无盐C
【例题5】下图中的每一个方格表示有关一种反应物或生 成物,其中饱和食盐水和F为起始反应物。
反应①
A D 十 E
电解 加入D
I
F
加 入
G
H 十 C J
加入D
请填写下列空白:
(1)物质B是 Cl, ,F 是 Fe ,J 是Fe(OH) 。
(2)反应①的离子方程式是Cl +20H-=ClO-+Cl- tH O
对Fe ++NaCIO→Fe(OH) 的变化的理解是很重要的。
饱和食盐水
沉淀
【例题6】 A 、B 、C 是中学化学中常见的三种元素A 和 B 的 单 质在 常温、常压下为气态, C单质为固态。甲乙丙为三种常见的化合物 它们各由两种元素组成。这些化合物和单质间存在如下图所示的关 系式(其中反应①③④是在溶液中进行的)。
(1)①②③④的反应中属于化合反应的是 ①② ③ 。
(2)写出下列单质和化合物的化学式:
B H 。 ;甲FeCl, ;乙 FeCl 。
化合物甲
A 的单质 化合物乙
B 的 C 的
单质 单质
C 的单质
化合物丙
化合物甲
B的单质
[例题7]A 、B 、C 是中学化学中常见的无机物,且各由两 种元素组成,甲、乙、丙是三种常见的单质,这些化合物 和单质之间存在如图39所示转化关系(这些转化都不需要 使用催化剂)。试回答以下问题:
(1)若甲作还原剂,甲是常见金属单质,乙是常见
非金属单质,则C 的化学式是 C O ,A 的电子式是
-:0::C::0: A 与甲反应的化学方程式为点燃
2Mg+CO =2Mg 0+C
单质丙(不足量)
单质乙
单质甲
化 合 物B
单质丙(过量)
化合物A
化合物C
单质乙
[例题7]A 、B 、C 是中学化学中常见的无机物,且各由两种元素
组成,甲、乙、丙是三种常见的单质,这些化合物和单质之间存在 如图39所示转化关系(这些转化都不需要使用催化剂)。试回答以 下问题:
(2)若甲作氧化剂,甲是常见的非金属单质,丙是常见金属,
且反应都是在溶液中通常条件下进行,则:
①C 的化学式是F e B r。
②化合物A与单质乙反应的离子方程式是
2Fe ++Br =2Fe ++2Br-
化合物C 单质丙(不足量)
单质乙 单质乙
单质甲
化 合 物A
化合物B
单质丙(过量)
[例题7]A 、B 、C 是中学化学中常见的无机物,且各由两 种元素组成,甲、乙、丙是三种常见的单质,这些化合物 和单质之间存在如图所示转化关系(这些转化都不需要使 用催化剂)。试回答以下问题:
③化合物C与单质丙反应的离子方程式是
化合物C
单质乙
单质甲
2Fe3++Fe=3F e 2+
④当化合物A与单质甲的物质的量之比为2:3时, A 与甲 恰好完全反应且符合如图所示的转化关系,则反应的离子 方程式是 2Fe2++4Br-+3C1,=2Fe ++2Br,+6C1-
单质丙(不足量)
化合物B
单质丙(过量)
化合物A
单质乙
[巩固练习]
1. 如图是常见物质的反应关系,其中部分产物被略去,
常温下X是固体, B和G是液体,其余为气体。根据图中关
系: 或 (NH4) CO
(1)推断化学式: X NHHCO A N H
2. BH 。Q D N O
(2)写出C→E 反应的化学方式
2C0 +2Na O =2Na CO +O
(3)写出G→F 反应的化学方式
F e+6HNO3 (浓) Fe(NO3)3+3NO 1+3H O
0H
H*
G
Fe
微热
Na O
E
5 丁
尸
2. A~L 分别表示反应中 一种常见物质, E 、 F 、 I 在通常状况
下是气体单质,其中E 为有刺激性气味的气体, X 、Y 是常见的金属 单质, H 为白色沉淀, J 为红褐色沉淀,参加反应的水以及生成的
水在图中已略去。 填写下列空白:
(1)E 是 ( 填 化 学 式 、 下 同 ) C 12 ,J 是F e(OH )3
( 2 ) 写 出D+X F+G 的离子方程式
2A1+20H-+2H O=2A1O +3H ↑
( 3 ) 写 出A+B—→C+E 的化学方程式
2HC1+NaC1O=NaC1+C1 +H O
电 解
G 溶 液
n( ) (的B量)= :1
Na O
I
+Y
E
+Y
:π
质
H 沉 淀
J沉 淀 C 溶液
K 溶 液
F
3. A 、B 是 中 学 化 学 里 常 用 的 物 质 , 其 中B 是 单质 ,A 是 化 合 物 ; 它们之间相互反应以及生成物之间的转化关系如图33所示。
已知E溶液与石炭酸的稀溶液混合时,溶液呈紫色。 请回答:
(1)B 和A 的浓溶液反应的条件是 加 热 , 而常温下难反应的 原因是浓 硝 酸 会在常温下使铁表面氧化形成
致密的氧化膜,阻止了反应进一步进行
(2)写出F和G 相互转化的化学方程式:
F→G 3N0,+H,O=2HNO3+NO
G→F 2N0+0,=2N0,
(3)L 转化成 I 的现象是 白色沉淀变成灰绿色,最终变成红褐色 有关的化学方程我e(OH) 。,+0,+2H,O=4Fe(OH) 3
工
液
K
溶 液
工
A
过
NaOH
A
G
H
D
量 的B
E
F
J+D
NaOH
溶
B
4.A~I 分别表示中学化学中常见的一种物质,它们之间相互转 化关系如图34所示(部分反应物、生成物没有列出):已知: A、
B、C、D、E、F 六种物质中均含有同一种元素; G 为主族元素
的固态氧化物。
(1)写出物质的化学式
E Fe(OH)z , F F e(OH) N a A 1O
(2)写出反应的化学方程式
① IEO ToA1 9r e T4 1 2 3
② F e 0,+ 8HC1=FeC1 +2FeC13+4H 0
NaOH 溶 液
氨水 F
I
G NaOH 溶 液
稀盐酸
电解
在O,中点燃
高温 A
电解
4A 1+3021
E
在空气中
③
2 3
5. 现有Fe 、Cu组成的合金,其中Cu 、Fe 的总物质的量 为a mol,Cu的物质的量分数为x; 研成粉末后,全部投 入含b molHNO 的稀溶液中,微热使其充分反应, 且硝 酸的还原产物只有NO, 试回答下列问题:
(1)若剩余的残渣只有Cu, 则溶液中含有的金属离子为 Fe + 或 Fe + Cu 。 (写出所有可能情况)
5. 现有Fe 、Cu 组成的合金,其中Cu 、Fe 的总物质的量 为a mol,Cu 的物质的量分数为x; 研成粉末后,全部投
入含b molHNO 的稀溶液中,微热使其充分反应,且硝 酸的还原产物只有NO, 试回答下列问题:
(2)当溶液中金属离子只有Fe +、Cu +时, 则b 的取值范
围是(用a、x表示)
3Cu+8HNO = 3Cu(NO ) +2NOT+4H O
故 总 耗HNO 量
8 ax
n(HNO )= 3
8a(1-x)
3
b
所以 8a(1-x)
8 a
8 a
3
3
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量
Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
写在最后
感谢聆听
不足之处请大家批评指导
Please Criticize And Guide The Shortcomings
结束语
XX 年 XX 月 XX 日
讲 师 :XXXXXX
铁及其化合物
Fe- 水蒸气3Fe+4H O(g) 高温Fe O +4H
化学性质 过 量 稀 HNO Fe+4HNO (稀) — —Fe(NO )3+
NO1+2H O
少 量 稀 HNO 3Fe+8HNO (稀)= — 3Fe(NO )2+
2NO++4H O
稀 H SO
Fe+H SO =FeSO +H
CuSO 溶液
→Fe+CuSO = FeSO +Cu
FeCl 溶 液
Fe+2FeCl = 3FeCl
第四周期第VIII族,属过渡元素
Cl 2Fe+3Cl 点燃 2FeCl
S
Fe+S FeS
一 、铁
I2
→Fe+I
FeI2
化学式 FeO Fe O
Fe O
化学 名称 氧化亚铁 四氧化三铁
三氧化二铁
俗名 磁性氧化铁
铁红
色态 黑色粉末 黑色晶体
红棕色粉末
溶解性 难溶于水 难溶于水
难溶于水
化合价 +2 +2、+3
+3
稳定性 不稳定 稳定
稳定
与H+ 反应 FeO+2H+=Fe ++ H O Fe O + 8H+=Fe ++ 2Fe ++4H O
Fe O +6H +=2Fe ++
3H O
铝热 反应 通式:2yAl+3Fe、O,高温,yAl O +3xFe
二、 铁的化合物
1、铁的氧化物
化学名 氢氧化亚铁
氢氧化铁
化学式 Fe(OH )
Fe(OH )
物理 性质 白色固体,不溶于水
红褐色固体,不溶于水
化学 性质 Fe(OH) + 2H+=Fe ++2H O 4Fe(OH) +O +2H O=4Fe(OH)
Fe(OH) +3 H+=Fe ++3H O
加热
2Fe(OH) = Fe O +3H O
制法 可溶性碱与亚铁盐溶液反应 Fe ++ 2OH-=Fe(OH )
可溶性碱与铁盐溶液反应
Fe ++30H-=Fe(OH)
2、铁的氢氧化物
3、 铁的重要盐
(1)+3价铁:呈黄色
①沉淀性:
Fe ++3OH-=Fe(OH) ↓ 红褐色沉淀用于鉴别Fe +
②水解性:
a、和CO -、HCO 、 双水解,写出方程式
b 、制氢氧化铁胶体Fe ++3H O(沸水)=Fe(OH)3+ 3H+
③络合性:
用于鉴别Fe + Fe ++3SCN-=Fe(SCN) 血红色溶液
④显色反应:加苯酚 溶液显紫色
(2)+2价铁:呈浅绿色
沉淀性: Fe ++2OH-=Fe(OH) ↓
4Fe(OH)2+2H O+O =4Fe(OH)
现象:和碱反应生成白色沉淀迅速变成灰绿色最
后变成红褐色沉淀,此现象用于鉴别Fe +。
思考:配置Fe + 和Fe(OH) 时需要注意的事项:
排除装置内的氧气(例如加热煮沸、滴加油
油封、生成气体来排除氧气)
1. 下列反应中,其产物的颜色按红、红褐、淡黄、蓝色顺
序排列的是( )
① 金属钠在纯氧中燃烧 ② FeSO 溶液中滴入NaOH溶液,并
在空气中放置一段时间 ③ FeCl,溶液中滴入KSCN 溶液
④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
【答案】 B
2、铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,
再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至 质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别 为( )
A.Fe(OH) ;Fe O B. Fe(OH) ; FeO
C.Fe(OH) 、Fe(OH) ;Fe O D.Fe O ;Fe(OH)
答案 】 A
液不反应,但加入氧化剂后Fe +被氧化成Fe +, 使KSCN变
红色。所以应先加入KSCN, 如果溶液不变色,再加入氯水, 溶液变成红色,则可证明溶液中不含Fe +含有Fe +。
【答案】 c
3. 欲证明某溶液中不含Fe +可能含有Fe +, 进行如下实
验操作时最佳顺序为( )
①加入少量氯水 ②加入少量KMnO 溶液 ③加入少量
KSCN溶液
A.①③ B.③②
C.③①
D.①②③
【解析】
Fe +与KSCN溶液反应变红色, Fe +与KSCN溶
4. 将1.12g 铁粉加入25mL2mol ·L-1 的氯化铁溶液中,充分
反应后,其结果是( )
A. 铁有剩余,溶液呈浅绿色, Cl-浓度基本不变
B. 往溶液中滴入无色KSCN 溶液,显血红色
C.Fe + 和Fe +的物质的量之比为5:1
D. 氧化产物与还原产物的物质的量之比为2:5
【答案】 B
重点突破
Fe(OH) 的制取方法
Fe(OH),具有较强的还原性,易被空气中的氧气氧
化,因此制备Fe(OH) 是高考题常见考点.实验的 关键之处是隔绝空气、避免接触O , 防止Fe(OH) 被氧化.
②除去蒸馏水中溶解的0,常采用 的方法.
③生成Fe(OH) 白色沉淀的操作是用长滴管吸取不含O 的
NaOH溶液,插入FeSO 溶液液面下,再挤出NaOH溶液.这样 操作的理由是
【答案】 (1)①稀H SO 、铁屑 ②煮沸 ③避免生成的
Fe(OH) 沉淀接触O 而被氧化
经典例题
下面是制备Fe(OH) 白色沉淀的几种方案.请回答下列各问
题:
(1)用不含Fe +的FeSO 溶液与不含O 的蒸馏水配制的NaOH
溶液反应制备.
①用硫酸亚铁晶体配制上述FeSO 溶液时还需要加入
制备.
①在试管I 里加入的试剂是
②在试管工里加入的试剂是
③为了制得Fe(OH) 白色沉淀,在试管I 和
Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实
验步骤是
【答案】(2)①稀H SO 和铁屑 ②NaOH 溶液 ③检验试管Ⅱ出口
处排出的H 的纯度,当排出的H 已经纯净时再夹紧止水夹④试管 I 中反应生成的H 充满了试管I 和试管Ⅱ,且外界O 不易进入
止水夹
(2)在如图所示的装置中,用NaOH溶液、铁屑、稀H SO 等试剂
④这样生成的Fe(OH) 沉淀能较长时间保持白色,理由是
①a 电极的材料应为 ,电极反应式 。
②电解液c可以是 (填编号).
A. 纯水 B.NaCl 溶液 C.NaOH 溶液 D.CuCl 溶液
【答案】(3)①Fe Fe-2e-=== Fe +
(3)利用电解实验可以制得纯净的Fe(OH) 白色沉淀.如图所示,
已知两电极的材料分别为石墨和铁.
BC
③d为苯,其作用是 , 在加入苯之
前对电解液c应作何简单处理
④为了在较短时间内看到白色沉淀,可采取的措施是
(填编号).
A. 改用稀H SO 作电解液 B. 适当增大电源的电压
C. 适当减小两极间的距离 D. 适当降低电解液的温度
⑤若c用Na SO 溶液,当电解一段时间后看到白色Fe(OH)
沉淀,再反接电源电解,除了电极上看到气泡外,另一明显 现象为
【答案】③隔绝空气,防止生成的Fe(OH) 被氧化 加热煮沸,
排出溶解的O ④BC ⑤白色沉淀迅速变为灰绿色,最后变成 红褐色
Br 、Cl 、HNO 、浓H SO 等
铁三角
03
Fe3+
Fe +
1、Fe只有还原性
Fe反 应后形成的产物呈何价态, 一般由下列因素来决
定:
S、I 、H+、Cu +、Fe +等
强氧化剂
Cl 、Br 、热浓H SO 、HNO 等
弱氧化剂
Fe(+2)
Fe(+3)
2.+2价铁离子 强还原性、弱氧化性
①弱氧化性: 遇强还原剂时被还原成单质铁
例: Fe ++Zn=Zn ++Fe
②强还原性:遇较强氧化剂时被氧化成三价铁的化合物
常见Fe +转化成Fe +的离子方程式:
2Fe ++Cl (Br )===2Fe ++2Cl- (Br- )
4Fe ++4H++0 ===4Fe ++2H O
3Fe ++4H++NO ===3Fe ++NO1+ 2H O
2Fe ++H O +2H+===2Fe ++2H O
5Fe ++8H++MnO ===5Fe ++Mn ++4H O
① 2Fe ++2I'=2Fe ++I
② 2Fe ++SO +2H O=2Fe ++SO +4H
③ 2Fe ++S -=2Fe ++S↓
④ 2Fe ++H S=2Fe ++Sl+2H+
⑤ 2Fe ++Cu=2Fe ++Cu +
⑥ 2Fe ++Fe=3Fe +
3.+3价铁离子 只具有氧化性
F 工 、S EBCW 穿
( 溶 液 中 )
常见Fe +转化成Fe +的离子方程式
+
Fe +
Fe +
溶液的颜色 浅绿色
棕黄色
加碱溶液 白色→灰绿色→红褐色
红褐色
加SCN- 无明显现象(通氯气)
血红色
加苯酚 不变色
紫色
淀粉碘化钾试纸 不变色
变蓝
加入铜片 不变色
变成蓝绿色
其它
4.Fe2+ 和 Fe3+的鉴别方法
思考1
亚铁盐、铁盐溶液的保存方法
亚铁盐溶液:加入少量铁屑防止氧化;加入 少量相应的酸溶液以防止Fe +的水解。
铁盐溶液:加入少量相应酸溶液以防止Fe +
的水解
思考2
如何从FeCl,和少量Cu的混合物中分离得到纯净的
FeCl 和Cu
① 加水溶解:2FeCl +Cu=2FeCl +CuCl
② 加过量的Fe并过滤: Fe+CuCl =FeCl +Cu
③ 在过滤所得沉淀物中加足量HCl,
Fe+2HCl=FeCl +H ↑ 过滤,将滤液合并,沉淀物清洗 烘干.
④ 滤液中通足量Cl :2FeCl,+Cl,=2FeCl
⑤ 通入HCl气流,蒸干FeCl 溶液:
FeCl +3H O Fe(OH) +3HCl,HCl 抑制水解
FeC]3 Cu H 0 —
CuC12
Fe 1
HC1气流
F eC1. 蒸干 3
足量Fe 沉淀:Fe、Cu
流程图
FeC 溶液
HCl 壮龄
1 1
FeC']
2
固体
Fe C13
过诊
Cl
bL
2
:
1
[典型剖析]
【例1】把铜粉和过量的铁粉加入到热的浓硝酸中,充 分反应后,溶液中大量存在的金属阳离子是 (A)
A.只有Fe + B.只有Fe +
C.有Fe +和Cu + D.有Fe +和Cu +
【例2】将6g纯铁粉加入200mLFe (SO ) 和CuSO 的
混合溶液中充分反应后得到200mL0.5mol/L 的FeSO 溶
液 .) ,生 铜多少克 2.56g
(2)加入铁粉前Fe (SO ) 物质的量浓度。 0.1mol/L
成
求:
后
体
反应
2g固
1
5
(
和
【例3】由FeO、Fe O 和Fe O 组成的混合物,测得其 中铁元素与氧元素的质量比为21:8,,则这种混合物 中FeO、Fe O 和Fe O 的物质的量之比是 (cD )。
A. 1:2:1 B. 2:1:1
C. 1:1:1 D.1:1:3
【例4】在下列所指的各溶液中,分别滴加NH SCN溶液 后,溶液不呈血红色的是 ( AB )
A.加入足量镁粉的Fe (SO ) 溶液
B.加入过量铁粉的稀硝酸溶液
C. 铁丝在足量的氯气中燃烧后, 所得产物的溶液
D.长期暴露在空气中的绿矾溶液
【例5】金属铜能被FeCl 的浓溶液腐蚀,其化学反应 是: Cu+2FeCl3=2FeCl +CuCl 。
现将有铜的印刷线路板浸入FeCl 的浓溶液中,有
9.6gCu 被腐蚀掉。取出印刷线路板,向溶液中加入
8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。 则:
(1)溶液中存在哪些离子 Fe +、Cu +、C1-
(2)离子的物质的量各是多少
Fe2+ 0.6mol Cu2+ 0.075mol C1- 1.35mol
(1)写出G和H的化学式: G , H o
(2)工业生产中D转化为C的反应条件是: 。
3)B跟E反应的离子方程式是
【答案】 (1)Fe (SO ) Na SO (2)催化剂和适当的温度
(3)Fe O +6H+===2Fe ++3H O
B
G
H O
0
U2
D 足量NaOH
5.已知: A是硫酸盐,且A和G、C和D、F和H元素组成分别相 同。G和KSCN溶液混合后溶液显红色, B、C和D均为氧化物。
反应过程中产生的水在图示中已略去。
回答下列问题:
受热分解
C
F
A H
备习题课
例题1]某元素的一种同位素R 具有微弱的放射性,其原子核内中子
数比质子数多40,其单质晶体在一 定条件下密度为6 . 78g ·c m-3
X 射 线研究该晶体发现在边长为1.00×10-7 cm 的立方体中含有
20个R 原子。 R 在化学反应中常表现为+2价和+4价,溶液中R2+
稳定。氧化物R3O4 与 Fe3O 有相似之处。请回答:
204 g ·m o 1-1
(1)R 原子的摩尔质量为
(2)此元素位于周期表第 六 周期 IV A 族。
( 3 ) 已 知Fe3O4 可写成氧化物的形式和盐的形式:
Fe0 ·Fe,O 和 Fe(FeO )z。 则 R3O 用氧化物的形
成可表示为2PbO ·PbO 用盐的形式可表示为P b,P b 。O
(4)R3O4 可与浓盐酸反应且有气体放出。写出R3O4 与浓盐
酸反应的化学方程式:
Pb3O4+8HC1 (浓)=3PbC1 +C1 +4H O
【例题2】Fe 是地壳中含量很丰富的元素,也是生物体所必需
的元素。 自然界中铁矿石主要有赤铁矿和磷铁矿,金属铁是在 高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和 生石灰。请填空: (已知铁矿石中含SiO 杂 质 )
①写出磁铁矿主要成分的化学式 Fe O
②写出赤铁矿被还原成铁的化学方程 高温
2Fe+3CO
③写出焦炭在高炉中参与反应的两个化学方程式。
高温 高温
二 二 二 2CO
④写出CaCO 所参与反应的两个化学方程式:
高温 高温
二 二 二 CaO+CO, CaO+SiO = = 三 CaSiO
C+O
[例题3]A 、B 、C 、D是四种可溶的化合物,分别由阳离子
K+、Ba +、Al +、Fe +和阴离子OH-、NO -、SO -、 CO - 两两组合而成,它们的溶液发生如下反应:
A 与B反应生成白色沉淀,再加过量A, 沉淀量减少, 但不会完全消失; C 与D 反应生成有色沉淀; B 与C 反应生 成白色沉淀。写出它们的化学式:
A: Ba(OH) B: Al (SO )
C: K CO D: Fe(NO )
A Fe ,B FeSO 7H Oc FeSO
_
4
D Fe O E SO F SO
_
或 (E.SO F.SO )
结
过滤,除杂质
金屑A
明
日
[例题4]下图表示某种盐的制备步骤:
已知:水合盐B 含有45.3%的水;无水盐C 焙烧分解, 放出两种无色刺激性气体E和F, 并生成红棕色固体D。
请写出物质的化学式或名称:
3000
无盐C
【例题5】下图中的每一个方格表示有关一种反应物或生 成物,其中饱和食盐水和F为起始反应物。
反应①
A D 十 E
电解 加入D
I
F
加 入
G
H 十 C J
加入D
请填写下列空白:
(1)物质B是 Cl, ,F 是 Fe ,J 是Fe(OH) 。
(2)反应①的离子方程式是Cl +20H-=ClO-+Cl- tH O
对Fe ++NaCIO→Fe(OH) 的变化的理解是很重要的。
饱和食盐水
沉淀
【例题6】 A 、B 、C 是中学化学中常见的三种元素A 和 B 的 单 质在 常温、常压下为气态, C单质为固态。甲乙丙为三种常见的化合物 它们各由两种元素组成。这些化合物和单质间存在如下图所示的关 系式(其中反应①③④是在溶液中进行的)。
(1)①②③④的反应中属于化合反应的是 ①② ③ 。
(2)写出下列单质和化合物的化学式:
B H 。 ;甲FeCl, ;乙 FeCl 。
化合物甲
A 的单质 化合物乙
B 的 C 的
单质 单质
C 的单质
化合物丙
化合物甲
B的单质
[例题7]A 、B 、C 是中学化学中常见的无机物,且各由两 种元素组成,甲、乙、丙是三种常见的单质,这些化合物 和单质之间存在如图39所示转化关系(这些转化都不需要 使用催化剂)。试回答以下问题:
(1)若甲作还原剂,甲是常见金属单质,乙是常见
非金属单质,则C 的化学式是 C O ,A 的电子式是
-:0::C::0: A 与甲反应的化学方程式为点燃
2Mg+CO =2Mg 0+C
单质丙(不足量)
单质乙
单质甲
化 合 物B
单质丙(过量)
化合物A
化合物C
单质乙
[例题7]A 、B 、C 是中学化学中常见的无机物,且各由两种元素
组成,甲、乙、丙是三种常见的单质,这些化合物和单质之间存在 如图39所示转化关系(这些转化都不需要使用催化剂)。试回答以 下问题:
(2)若甲作氧化剂,甲是常见的非金属单质,丙是常见金属,
且反应都是在溶液中通常条件下进行,则:
①C 的化学式是F e B r。
②化合物A与单质乙反应的离子方程式是
2Fe ++Br =2Fe ++2Br-
化合物C 单质丙(不足量)
单质乙 单质乙
单质甲
化 合 物A
化合物B
单质丙(过量)
[例题7]A 、B 、C 是中学化学中常见的无机物,且各由两 种元素组成,甲、乙、丙是三种常见的单质,这些化合物 和单质之间存在如图所示转化关系(这些转化都不需要使 用催化剂)。试回答以下问题:
③化合物C与单质丙反应的离子方程式是
化合物C
单质乙
单质甲
2Fe3++Fe=3F e 2+
④当化合物A与单质甲的物质的量之比为2:3时, A 与甲 恰好完全反应且符合如图所示的转化关系,则反应的离子 方程式是 2Fe2++4Br-+3C1,=2Fe ++2Br,+6C1-
单质丙(不足量)
化合物B
单质丙(过量)
化合物A
单质乙
[巩固练习]
1. 如图是常见物质的反应关系,其中部分产物被略去,
常温下X是固体, B和G是液体,其余为气体。根据图中关
系: 或 (NH4) CO
(1)推断化学式: X NHHCO A N H
2. BH 。Q D N O
(2)写出C→E 反应的化学方式
2C0 +2Na O =2Na CO +O
(3)写出G→F 反应的化学方式
F e+6HNO3 (浓) Fe(NO3)3+3NO 1+3H O
0H
H*
G
Fe
微热
Na O
E
5 丁
尸
2. A~L 分别表示反应中 一种常见物质, E 、 F 、 I 在通常状况
下是气体单质,其中E 为有刺激性气味的气体, X 、Y 是常见的金属 单质, H 为白色沉淀, J 为红褐色沉淀,参加反应的水以及生成的
水在图中已略去。 填写下列空白:
(1)E 是 ( 填 化 学 式 、 下 同 ) C 12 ,J 是F e(OH )3
( 2 ) 写 出D+X F+G 的离子方程式
2A1+20H-+2H O=2A1O +3H ↑
( 3 ) 写 出A+B—→C+E 的化学方程式
2HC1+NaC1O=NaC1+C1 +H O
电 解
G 溶 液
n( ) (的B量)= :1
Na O
I
+Y
E
+Y
:π
质
H 沉 淀
J沉 淀 C 溶液
K 溶 液
F
3. A 、B 是 中 学 化 学 里 常 用 的 物 质 , 其 中B 是 单质 ,A 是 化 合 物 ; 它们之间相互反应以及生成物之间的转化关系如图33所示。
已知E溶液与石炭酸的稀溶液混合时,溶液呈紫色。 请回答:
(1)B 和A 的浓溶液反应的条件是 加 热 , 而常温下难反应的 原因是浓 硝 酸 会在常温下使铁表面氧化形成
致密的氧化膜,阻止了反应进一步进行
(2)写出F和G 相互转化的化学方程式:
F→G 3N0,+H,O=2HNO3+NO
G→F 2N0+0,=2N0,
(3)L 转化成 I 的现象是 白色沉淀变成灰绿色,最终变成红褐色 有关的化学方程我e(OH) 。,+0,+2H,O=4Fe(OH) 3
工
液
K
溶 液
工
A
过
NaOH
A
G
H
D
量 的B
E
F
J+D
NaOH
溶
B
4.A~I 分别表示中学化学中常见的一种物质,它们之间相互转 化关系如图34所示(部分反应物、生成物没有列出):已知: A、
B、C、D、E、F 六种物质中均含有同一种元素; G 为主族元素
的固态氧化物。
(1)写出物质的化学式
E Fe(OH)z , F F e(OH) N a A 1O
(2)写出反应的化学方程式
① IEO ToA1 9r e T4 1 2 3
② F e 0,+ 8HC1=FeC1 +2FeC13+4H 0
NaOH 溶 液
氨水 F
I
G NaOH 溶 液
稀盐酸
电解
在O,中点燃
高温 A
电解
4A 1+3021
E
在空气中
③
2 3
5. 现有Fe 、Cu组成的合金,其中Cu 、Fe 的总物质的量 为a mol,Cu的物质的量分数为x; 研成粉末后,全部投 入含b molHNO 的稀溶液中,微热使其充分反应, 且硝 酸的还原产物只有NO, 试回答下列问题:
(1)若剩余的残渣只有Cu, 则溶液中含有的金属离子为 Fe + 或 Fe + Cu 。 (写出所有可能情况)
5. 现有Fe 、Cu 组成的合金,其中Cu 、Fe 的总物质的量 为a mol,Cu 的物质的量分数为x; 研成粉末后,全部投
入含b molHNO 的稀溶液中,微热使其充分反应,且硝 酸的还原产物只有NO, 试回答下列问题:
(2)当溶液中金属离子只有Fe +、Cu +时, 则b 的取值范
围是(用a、x表示)
3Cu+8HNO = 3Cu(NO ) +2NOT+4H O
故 总 耗HNO 量
8 ax
n(HNO )= 3
8a(1-x)
3
b
所以 8a(1-x)
8 a
8 a
3
3
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量
Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
写在最后
感谢聆听
不足之处请大家批评指导
Please Criticize And Guide The Shortcomings
结束语
XX 年 XX 月 XX 日
讲 师 :XXXXXX
