3.1.1铁及其化合物 课件(共27张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.1铁及其化合物 课件(共27张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-29 19:57:37 | ||
图片预览








文档简介
(共27张PPT)
铁及其化合物
铁的单质;铁的氧化物
联系实际贴近日常
生活中富含铁元素的物质
化 學 Chemistr
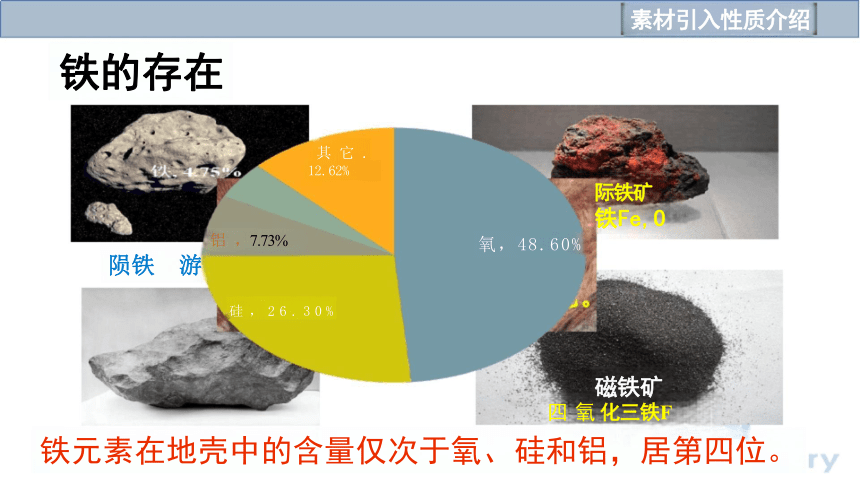
磁铁矿
四 氧 化三铁F
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
素材引入性质介绍
铁的存在
际铁矿 铁Fe,O
氧,48.60%
铝 ,7.73%
陨铁 游
其 它 . 12.62%
硅 , 2 6 . 3 0 %
素材引入性质介绍
1.铁元素的存在及使用
(1)存在:铁在自然界中既可以以 单质的形态存在,也可以以 化合物的 形态存在,其主要化合价有 +2 价 和 +3 价,地壳中铁元素的含量仅次 于 氧、 硅 和 铝 ,居第四位。
(2)使用历史:
人类最早使用的铁是 陨铁 ,我国在春秋初年掌握了冶铁技术,在战国中
期铁制工具得到了广泛使用。
(3)工业炼铁的原理是用还 原 剂把铁矿石中的铁提炼出来,如用CO 还原 Fe O 。
2.铁的物理性质
纯净的铁是光亮的 银白色金属,铁有 延展性、 导热性、 导电性,但
其导电性不如 铜 和 铝,铁还能被 磁 体吸引。其熔、沸点较 高 ,熔 点:1535℃、沸点:2750℃,密度:7.86gcm-3。
性质学习物质通性
化学性质
化学方程式举例
①Fe与非金属单质反应
②Fe与非氧化性酸反应(H SO )
Fe+H SO,=F e SO + H
③Fe与盐溶液反应(CuSO )
Fe+C uSO C u+Fe SO
Fe+2F e +==3F e2+
新旧知识建立联系
3.铁的化学性质
(1)与某些非金属单质、酸和盐溶液反应
2Fe+3C l 2FeC l
点燃
3Fe+2O Fe O
Fe+S FeS
Cl
Fe
O
S
结论: Fe 在反应中作还 原剂,遇到较强的氧 化剂(如Cl 等)生成
+3 价铁的化合物,遇到较弱的氧 化剂(如稀硫酸等)生成+2 价铁 的化合物。
【注意】
1 、与氧化性较弱(如盐酸、硫酸铜等) 的反应,铁失去两个电子,生成Fe +
2 、与氧化性较强(氯气、硝酸等) 的反应,铁失去三个电子,生成Fe +
新旧知识建立联系
【真实情景1】 在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,
模具必须进行充分的干燥处理。为什么呢
钢水注入干燥的模具
真实情景深入思考
真实情景深入思考
【真实情景2】 打铁的工艺之一: "淬火"为了增强铁器的韧性、
强度以及铁磁性。
化 学 Chemist
实验装置 湿棉花
还原铁粉
5
肥皂液
燃着的火柴
操作现象 生成黑色粉末状物质;同时生成了气体
实验结论 在高温下,铁能与水蒸气反应,化学方程式为 3Fe+4H O (g ) 高温 Fe O +4H
(2)实验探究铁粉与水蒸气的反应
实验探究探索新知
燃着的火柴
①试管中湿棉花的作用是 加热时产生水蒸气与铁粉反应
②若用火柴点燃肥皂泡,可能发生的现象是 听到爆鸣声
③该反应体现铁单质具有还 原性 。
铁与水蒸气反应
湿棉花
实验探究探索新知
【思考1】气密性如何检查
【思考2】石棉绒的作用
【思考3】无水氯化钙的作用
【思考4】加热的顺序
实验探究探索新知
铁与水蒸气反应
化 学 C
利用如图制备无水氯化铁。不正确的是
A.烧瓶B 中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D 中分别盛有饱和食盐水和浓硫酸
C.装置F 的作用是吸收尾气
D.应该先点燃E处酒精灯,再点燃B处酒精灯
习题演练练习巩固
习题演练
(1)有下列物质:①S ②CuCl 溶液 ③稀H SO ④AgNO 溶液 ⑤ Cl , 与Fe反应时生成+2价铁的化合物的是 ①②③④(填序号,下同), 生成+3价铁的化合物的是 。⑤
(2)铁与水蒸气能发生反应,日常生活中为什么可用铁壶烧水
提示 铁只能与水蒸气在高温下反应,而与冷水或热水不反应。
习题演练练习巩固
名 称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe O3 Fe O4
(FeO ·Fe O )
色态 黑色粉末 红棕色粉末 黑色晶体
俗名 铁红 磁性氧化铁
化合价 +2 +3 +2、+3
溶解性 均不溶于水
类别 碱性氧化物 碱性氧化物 非碱性氧化物
比较分析理解应用
二、 铁的氧化物
物质 FeO Fe O
Fe O
化 学 性 质 稳定性 空气里受热氧化成Fe O 6FeO+O =2Fe O 稳定
水 不反应
酸 ( 如HCI) F eO+2H+=Fe ++ H,O F e O +6H+=2 F e ++3H O Fe3O +8H+=2Fe ++Fe ++4H O
与CO等 还原剂反 应 高温时,都能与C、CO、H 反应,被还原生成Fe(炼 铁原理) F e2O + 3CO 2F e+ 3CO 高 温 Fe O +4CO=== 3Fe+4CO
比较分析理解应用
(1)Fe O 的组成可用FeO ·Fe O,表示,但不代表Fe O 是由FeO 和Fe O,组成 的混合物, Fe O 有固定的组成,是一种纯净物。
(2)由于Fe O 与非氧化性酸反应,生成铁盐和亚铁盐,故Fe O 不属于碱性 氧化物,而FeO、Fe O 属于碱性氧化物。
比较分析理解应用
实验探究探索新知
三、 铁的氢氧化物
【实验3-1】在两支试管中分别加入少量的FeCl ,溶液和FeSQ 溶 液,然 后 各
这是因为白色的氢氧化亚铁被溶解在溶液中的氧气氧化成了红褐
色的氢氧化铁, 反应的化学式如下:
FeSO +2NaOH=Fe(OH) J+Na SO
4Fe(OH) +O +2H O=4Fe(OH)
FeCT 溶 液 FeSO 溶液
【思考】为什么FeSO 溶液在加入NaOH溶液时,会有那些现象变 化呢
铁的氢氧化物
(1)铁的氢氧化物的制备
实验室制备氢氧化铁和氢氧化亚铁如图所示:
①图甲实验中观察到的现象是 有红褐色沉淀 生 成 ,反应的离子方程式是Fe3++3OH-=
Fe(OH) ↓ 。
②图乙实验中先观察到有白 色 沉 淀 生成,在空气中迅速变成 灰绿色 最后变成红 褐 色 ,有关反应的离子方程式是Fe ++2OH-=Fe(OH),↓
(白色); 4 Fe(OH) +O +2H O ===4Fe(OH)
NaOH 溶液
0
FeSO 溶液
图乙
NaOH 溶液
0
FeCl 溶液
图甲
实验探究探索新知
【思考】要想长时间观察到白色的Fe(OH) ,
过程中可以采取哪些措施
氧气会氧化Fe(OH)
除去试管和溶液中氧气;创造无氧环境
发现问题深度思考
在配制溶液和操作
实验 关键
存在 问题
改进 方案
在FeSO 溶液液面上加几滴植 物油(加保护层,隔绝空气) 胶头滴管的末端伸入FeSO 溶液 液面之下,不震荡。(避免接触O ) 改进实验装置,制造非氧环境。
植物油
深入思考创新思维
实验改进1
除去试管和溶液中氧气;创造无氧环境
用煮沸过的蒸馏水配制溶液( 除
去O )。
1
2
3
4
深入思考创新思维
实验改进2
【思考】要想长时间观察到白色的Fe(OH) ,I 、II 两只试管中分
别加入什么试剂 如何操作
【可选试剂】 Fe 、 稀硫酸、 NaOH 溶液
( 2 ) 打 开a, 使I管中反应一段时间后再夹紧止水夹a,Ⅱ 管中
观察到的现象是开始时I中有气泡,夹紧止水夹a后 ,I管溶液 Ⅱ
进入Ⅱ管,出现灰白色的沉淀;Ⅱ中发生反应的离子方程
式 为 :Fe ++2OH=Fe(OH) I 。 Fe NaOH 溶液
( 3 ) 打 开a的目的 排尽装置中的空气,提供无氧环境
止水夹a
稀H SO
③氢氧化亚铁制备注意事项
在实验室制备氢氧化亚铁时, 一定要用 新 制的亚铁盐和先加热驱赶氧 气后的
氢氧化钠 溶液,且滴管末端插入试管内的液面下,再滴加 氢氧化钠 溶液,也可 以在反应液面上滴加植物油或苯等物质进行液封,以防止氢氧化亚铁与氧气接触。
深入思考创新思维
铁的氢氧化物的制备
搜拆见须
tv.sohu.kom
化学式 Fe(OH)
Fe(OH)
物质类别 二元弱碱
三元弱碱
颜色状态 白色絮状
红褐色固体
溶解性 不溶干水
不溶干水
与非氧化性 强酸反应 e(OH ),+2H+=—Fe ++2H2O
Fe(OH )3+3H+=F e ++3H O
稳定性 Fe(O H) +O + 2H O= 4F e(O H) (还原性/不稳定/易氧化)
2Fe(OH ) Fe,O +3H O
(高温下不稳定)
(2)Fe(OH) 和Fe(OH) 性质的比较
制 备Fe(OH) 的关键是隔绝空气(O ), 可 采 取 的 措 施 有 :
(1)Fe +极易被氧化,所以FeSO 溶液要现用现配。
(2)为了防止Fe +被氧化,配制FeSO 溶液的蒸馏水和NaOH 溶液要煮沸,尽 可能除去O 。
(3)为了防止滴加NaOH 溶液时带入空气,可将吸有NaOH 溶液的长滴管伸入 FeSO 溶液的液面下,再挤出NaOH 溶液。
(4)为防止Fe +被氧化,还可以向盛有FeSO 溶液的试管中加入少量的煤油 或其他密度小于水而不溶于水的有机物,以隔绝空气。
深度思考加深理解
思考:
(1)Fe(OH);在空气中灼烧得到Fe O 固体, Fe(OH) 在空气中灼烧能得到FeO 固体吗
提示 不 能 ,Fe(OH) 易被氧化,最终得到的是Fe O 。
(2)用不含Fe +的FeSO 溶液与不含O 的蒸馏水配制的NaOH 溶液反应制备Fe(OH) 沉淀。
①用硫酸亚铁晶体配制上述FeSO 溶液时,除加硫酸防止生成Fe(OH) 外,还需加 入铁屑。
②除去蒸馏水中溶解的O,, 常采用 煮 沸的方法。
③生成白色Fe(OH) 沉淀的操作是用长滴管吸取不含O 的NaOH溶液,插入FeSO 溶 液的液面以下,再挤出NaOH 溶液。这样操作的理由是 避免生成的Fe(OH) 沉淀 接触O 转化成Fe(OH) 沉淀
铁及其化合物
铁的单质;铁的氧化物
联系实际贴近日常
生活中富含铁元素的物质
化 學 Chemistr
磁铁矿
四 氧 化三铁F
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
素材引入性质介绍
铁的存在
际铁矿 铁Fe,O
氧,48.60%
铝 ,7.73%
陨铁 游
其 它 . 12.62%
硅 , 2 6 . 3 0 %
素材引入性质介绍
1.铁元素的存在及使用
(1)存在:铁在自然界中既可以以 单质的形态存在,也可以以 化合物的 形态存在,其主要化合价有 +2 价 和 +3 价,地壳中铁元素的含量仅次 于 氧、 硅 和 铝 ,居第四位。
(2)使用历史:
人类最早使用的铁是 陨铁 ,我国在春秋初年掌握了冶铁技术,在战国中
期铁制工具得到了广泛使用。
(3)工业炼铁的原理是用还 原 剂把铁矿石中的铁提炼出来,如用CO 还原 Fe O 。
2.铁的物理性质
纯净的铁是光亮的 银白色金属,铁有 延展性、 导热性、 导电性,但
其导电性不如 铜 和 铝,铁还能被 磁 体吸引。其熔、沸点较 高 ,熔 点:1535℃、沸点:2750℃,密度:7.86gcm-3。
性质学习物质通性
化学性质
化学方程式举例
①Fe与非金属单质反应
②Fe与非氧化性酸反应(H SO )
Fe+H SO,=F e SO + H
③Fe与盐溶液反应(CuSO )
Fe+C uSO C u+Fe SO
Fe+2F e +==3F e2+
新旧知识建立联系
3.铁的化学性质
(1)与某些非金属单质、酸和盐溶液反应
2Fe+3C l 2FeC l
点燃
3Fe+2O Fe O
Fe+S FeS
Cl
Fe
O
S
结论: Fe 在反应中作还 原剂,遇到较强的氧 化剂(如Cl 等)生成
+3 价铁的化合物,遇到较弱的氧 化剂(如稀硫酸等)生成+2 价铁 的化合物。
【注意】
1 、与氧化性较弱(如盐酸、硫酸铜等) 的反应,铁失去两个电子,生成Fe +
2 、与氧化性较强(氯气、硝酸等) 的反应,铁失去三个电子,生成Fe +
新旧知识建立联系
【真实情景1】 在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,
模具必须进行充分的干燥处理。为什么呢
钢水注入干燥的模具
真实情景深入思考
真实情景深入思考
【真实情景2】 打铁的工艺之一: "淬火"为了增强铁器的韧性、
强度以及铁磁性。
化 学 Chemist
实验装置 湿棉花
还原铁粉
5
肥皂液
燃着的火柴
操作现象 生成黑色粉末状物质;同时生成了气体
实验结论 在高温下,铁能与水蒸气反应,化学方程式为 3Fe+4H O (g ) 高温 Fe O +4H
(2)实验探究铁粉与水蒸气的反应
实验探究探索新知
燃着的火柴
①试管中湿棉花的作用是 加热时产生水蒸气与铁粉反应
②若用火柴点燃肥皂泡,可能发生的现象是 听到爆鸣声
③该反应体现铁单质具有还 原性 。
铁与水蒸气反应
湿棉花
实验探究探索新知
【思考1】气密性如何检查
【思考2】石棉绒的作用
【思考3】无水氯化钙的作用
【思考4】加热的顺序
实验探究探索新知
铁与水蒸气反应
化 学 C
利用如图制备无水氯化铁。不正确的是
A.烧瓶B 中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D 中分别盛有饱和食盐水和浓硫酸
C.装置F 的作用是吸收尾气
D.应该先点燃E处酒精灯,再点燃B处酒精灯
习题演练练习巩固
习题演练
(1)有下列物质:①S ②CuCl 溶液 ③稀H SO ④AgNO 溶液 ⑤ Cl , 与Fe反应时生成+2价铁的化合物的是 ①②③④(填序号,下同), 生成+3价铁的化合物的是 。⑤
(2)铁与水蒸气能发生反应,日常生活中为什么可用铁壶烧水
提示 铁只能与水蒸气在高温下反应,而与冷水或热水不反应。
习题演练练习巩固
名 称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe O3 Fe O4
(FeO ·Fe O )
色态 黑色粉末 红棕色粉末 黑色晶体
俗名 铁红 磁性氧化铁
化合价 +2 +3 +2、+3
溶解性 均不溶于水
类别 碱性氧化物 碱性氧化物 非碱性氧化物
比较分析理解应用
二、 铁的氧化物
物质 FeO Fe O
Fe O
化 学 性 质 稳定性 空气里受热氧化成Fe O 6FeO+O =2Fe O 稳定
水 不反应
酸 ( 如HCI) F eO+2H+=Fe ++ H,O F e O +6H+=2 F e ++3H O Fe3O +8H+=2Fe ++Fe ++4H O
与CO等 还原剂反 应 高温时,都能与C、CO、H 反应,被还原生成Fe(炼 铁原理) F e2O + 3CO 2F e+ 3CO 高 温 Fe O +4CO=== 3Fe+4CO
比较分析理解应用
(1)Fe O 的组成可用FeO ·Fe O,表示,但不代表Fe O 是由FeO 和Fe O,组成 的混合物, Fe O 有固定的组成,是一种纯净物。
(2)由于Fe O 与非氧化性酸反应,生成铁盐和亚铁盐,故Fe O 不属于碱性 氧化物,而FeO、Fe O 属于碱性氧化物。
比较分析理解应用
实验探究探索新知
三、 铁的氢氧化物
【实验3-1】在两支试管中分别加入少量的FeCl ,溶液和FeSQ 溶 液,然 后 各
这是因为白色的氢氧化亚铁被溶解在溶液中的氧气氧化成了红褐
色的氢氧化铁, 反应的化学式如下:
FeSO +2NaOH=Fe(OH) J+Na SO
4Fe(OH) +O +2H O=4Fe(OH)
FeCT 溶 液 FeSO 溶液
【思考】为什么FeSO 溶液在加入NaOH溶液时,会有那些现象变 化呢
铁的氢氧化物
(1)铁的氢氧化物的制备
实验室制备氢氧化铁和氢氧化亚铁如图所示:
①图甲实验中观察到的现象是 有红褐色沉淀 生 成 ,反应的离子方程式是Fe3++3OH-=
Fe(OH) ↓ 。
②图乙实验中先观察到有白 色 沉 淀 生成,在空气中迅速变成 灰绿色 最后变成红 褐 色 ,有关反应的离子方程式是Fe ++2OH-=Fe(OH),↓
(白色); 4 Fe(OH) +O +2H O ===4Fe(OH)
NaOH 溶液
0
FeSO 溶液
图乙
NaOH 溶液
0
FeCl 溶液
图甲
实验探究探索新知
【思考】要想长时间观察到白色的Fe(OH) ,
过程中可以采取哪些措施
氧气会氧化Fe(OH)
除去试管和溶液中氧气;创造无氧环境
发现问题深度思考
在配制溶液和操作
实验 关键
存在 问题
改进 方案
在FeSO 溶液液面上加几滴植 物油(加保护层,隔绝空气) 胶头滴管的末端伸入FeSO 溶液 液面之下,不震荡。(避免接触O ) 改进实验装置,制造非氧环境。
植物油
深入思考创新思维
实验改进1
除去试管和溶液中氧气;创造无氧环境
用煮沸过的蒸馏水配制溶液( 除
去O )。
1
2
3
4
深入思考创新思维
实验改进2
【思考】要想长时间观察到白色的Fe(OH) ,I 、II 两只试管中分
别加入什么试剂 如何操作
【可选试剂】 Fe 、 稀硫酸、 NaOH 溶液
( 2 ) 打 开a, 使I管中反应一段时间后再夹紧止水夹a,Ⅱ 管中
观察到的现象是开始时I中有气泡,夹紧止水夹a后 ,I管溶液 Ⅱ
进入Ⅱ管,出现灰白色的沉淀;Ⅱ中发生反应的离子方程
式 为 :Fe ++2OH=Fe(OH) I 。 Fe NaOH 溶液
( 3 ) 打 开a的目的 排尽装置中的空气,提供无氧环境
止水夹a
稀H SO
③氢氧化亚铁制备注意事项
在实验室制备氢氧化亚铁时, 一定要用 新 制的亚铁盐和先加热驱赶氧 气后的
氢氧化钠 溶液,且滴管末端插入试管内的液面下,再滴加 氢氧化钠 溶液,也可 以在反应液面上滴加植物油或苯等物质进行液封,以防止氢氧化亚铁与氧气接触。
深入思考创新思维
铁的氢氧化物的制备
搜拆见须
tv.sohu.kom
化学式 Fe(OH)
Fe(OH)
物质类别 二元弱碱
三元弱碱
颜色状态 白色絮状
红褐色固体
溶解性 不溶干水
不溶干水
与非氧化性 强酸反应 e(OH ),+2H+=—Fe ++2H2O
Fe(OH )3+3H+=F e ++3H O
稳定性 Fe(O H) +O + 2H O= 4F e(O H) (还原性/不稳定/易氧化)
2Fe(OH ) Fe,O +3H O
(高温下不稳定)
(2)Fe(OH) 和Fe(OH) 性质的比较
制 备Fe(OH) 的关键是隔绝空气(O ), 可 采 取 的 措 施 有 :
(1)Fe +极易被氧化,所以FeSO 溶液要现用现配。
(2)为了防止Fe +被氧化,配制FeSO 溶液的蒸馏水和NaOH 溶液要煮沸,尽 可能除去O 。
(3)为了防止滴加NaOH 溶液时带入空气,可将吸有NaOH 溶液的长滴管伸入 FeSO 溶液的液面下,再挤出NaOH 溶液。
(4)为防止Fe +被氧化,还可以向盛有FeSO 溶液的试管中加入少量的煤油 或其他密度小于水而不溶于水的有机物,以隔绝空气。
深度思考加深理解
思考:
(1)Fe(OH);在空气中灼烧得到Fe O 固体, Fe(OH) 在空气中灼烧能得到FeO 固体吗
提示 不 能 ,Fe(OH) 易被氧化,最终得到的是Fe O 。
(2)用不含Fe +的FeSO 溶液与不含O 的蒸馏水配制的NaOH 溶液反应制备Fe(OH) 沉淀。
①用硫酸亚铁晶体配制上述FeSO 溶液时,除加硫酸防止生成Fe(OH) 外,还需加 入铁屑。
②除去蒸馏水中溶解的O,, 常采用 煮 沸的方法。
③生成白色Fe(OH) 沉淀的操作是用长滴管吸取不含O 的NaOH溶液,插入FeSO 溶 液的液面以下,再挤出NaOH 溶液。这样操作的理由是 避免生成的Fe(OH) 沉淀 接触O 转化成Fe(OH) 沉淀
