2014年中考化学“第三章 溶液”精选专题训练
文档属性
| 名称 | 2014年中考化学“第三章 溶液”精选专题训练 |  | |
| 格式 | zip | ||
| 文件大小 | 168.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-03-09 21:51:03 | ||
图片预览



文档简介
2014年中考化学“第三章 溶液”精选专题训练
一.选择题(共20小题)
1.(2014 青海)实验室配制100克质量分数为20%的食盐溶液,需要水的质量和取水用到的仪器是( )
A. 80克,用100mL量筒 B. 80克,用托盘天平
C. 20克,用100mL量筒 D. 20克,用托盘天平
2.(2014 邵阳)实验室配制50g溶 ( http: / / www.21cnjy.com )质质量分数为6%的NaC1溶液的操作步骤有:计算、称量、量取、溶解.该实验过程中不需要用到的仪器是( )
A. 玻璃棒 B. 烧杯 C. 漏斗 D. 量筒
3.(2014 盐城)实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是( )
A. 用托盘天平称取10.0g氯化钠 B. 用量筒量取90.0mL 的水
C. 将称取的氯化钠倒入量筒中溶解 D. 将配制的溶液装入试剂瓶中,贴上标签
4.(2014 无锡)泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是( )
①称量好的食盐倒入烧杯时,有少许洒出 ②量水的体积时,俯视量筒 ③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液.
A.②③ B. ①③④ C. ①②③ D. ①②③④
5.(2014 盘锦)用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A.玻璃棒 量筒 烧杯 胶头滴管 B. 托盘天平 量筒 烧杯 玻璃棒
C.托盘天平 玻璃棒 烧杯 胶头滴管 D. 量筒 烧杯 漏斗 玻璃棒
6.(2014 东营)下列说法不正确的是( )
A. 稀有气体在通常条件下几乎不与任何物质发生反应,化学性质比较稳定
B. 铁制品锈蚀主要是铁与空气中氧气、水蒸气发生化学反应的结果
C. 溶液具有均一性和稳定性,是因为溶液中的各种粒子都静止不动
D. 元素周期表是学习和研究化学、探索未知世界的重要工具
7.(2014 锦州)下列生活中常见的物质加入水中,能形成溶液的是( )
A.面粉 B. 蔗糖 C. 泥沙 D. 植物油
8.(2014 赤峰)下表是某同学的实验记录,以下说法不正确的是( )
溶质 碘 高锰酸钾
溶剂 水 汽油 酒精 水 汽油
溶解性 不溶 易溶 可溶 易溶 不溶
A.衣服不慎沾上碘酒,可用汽油擦洗 B. 溶液都是均一、稳定、无色的混合物
C.水、汽油、酒精都可以做溶剂 D. 同一物质在不同溶剂中溶解性不同
9.(2014 枣庄)溶液在我们生活中有着广泛的用途.下列物质不属于溶液是的( )
A.碘酒 B. 澄清的石灰水 C. 生理盐水 D. 酒精
10.(2010 安徽)下列实验操作错误的是( )
A.取用药品 B. ( http: / / www.21cnjy.com )称取药品 C. ( http: / / www.21cnjy.com )量取液体 D.搅拌溶解
11.(2014 广西)下列除垢或除污过程中利用乳化作用的是( )
A.自来水洗手 B. 食醋除水垢 C. 汽油除油污 D. 洗洁精除油污
12.(2014 烟台)下列关于溶液的叙述正确的是( )
A. 溶液一定是均一、稳定、无色、透明的液体 B. 溶液中各部分性质相同
C. 某物质的饱和溶液就是不能再溶解任何物质的溶液D. 硝酸铵固体溶于水形成溶液时仅发生扩散吸热的过程
13.(2014 汕尾)归纳法是一种非常好的学习方法.下列归纳的结论错误的是( )
A. 浓溶液不一定是饱和溶液 B. 含氧元素的物质不一定是氧化物
C. 可燃性气体点燃前不一定都要验纯 D. 只含一种元素的物质不一定是纯净物
14.(2014 宿迁)下列化学实验中能达到预期实验结果的是( )
A. 借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B. 用pH试纸测定某未知溶液的pH为5.5
C. 20℃时,配制2%的氢氧化钙溶液
D. 将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
15.(2014 贵阳)关于溶液,下列说法错误的是( )
A. 固体、液体、气体都可以作为溶质 B. 硝酸铵溶于水的过程中,溶液温度下降
C. 75%的医用酒精中,C2H3OH与H2O的质量比为3:1
D. 在25℃时,KNO3溶液蒸发5g水,析出ag晶体,再蒸发5g水,又析出bg晶体,则a与b的质量不一定相等
16.(2014 海南)20℃时,在三个各 ( http: / / www.21cnjy.com )盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示( )
物质 甲 乙 丙
未溶解固体的质量/g 5 2 0
A.所得溶液一定都是饱和溶液 B. 丙溶液一定是不饱和溶液
C.丙溶液的溶质的质量分数最大 D. 20℃,时,甲的溶解度最大
17.(2014 莱芜)20℃时,取甲、乙 ( http: / / www.21cnjy.com )、丙、丁四种物质各20g,分别加入到四个盛有50g水的烧杯中,充分溶解,情况如表(温度保持20℃),下列说法正确的是( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
A. 所得溶液一定都是饱和溶液 B. 溶质质量分数最大的是丙溶液
C. 所得四种溶液的质量关系为:甲=乙=丙=丁 D. 20℃时四种物质溶解度的关系为:丁>甲>乙>丙
18.(2014 黔东南州)下列有关溶液的说法中正确的是( )
A. 常温下将100mL饱和Ca(OH)2溶液加热到50℃,会使溶液由饱和溶液变为不饱和溶液
B. 从浓度为25%的H2SO4溶液中取出10mL,则取出的10mL H2SO4溶液浓度仍为25%
C. 20℃时,50克水中溶解了18克NaCl,则20℃时NaCl的溶解度为36克
D. 将95克KCl溶液蒸干得到5克KCl固体,则原溶液中KCl的浓度为5%
19.(2014 枣庄)如图是甲、乙、丙三种物质的溶解度曲线,下列叙述不正确的是( )
A. 在t2℃时,把甲放入50g 水中得到甲的饱和溶液,且溶液的溶质质量分数为50%
B. t1℃时三种物质的溶解度大小关系是乙>甲=丙
C. 将t2℃时等质量的三种物质的饱和溶液分别降至0℃,析出甲最多
D. 将丙的饱和溶液变为不饱和溶液,可以采用降温的方法
20.(2014 广州)将50g 98%的浓硫酸溶于450g水中,所得溶液中溶质的质量分数为( )
A. 9.8% B. 10.2% C. 10.8% D. 19.6%
二.填空题(共9小题)
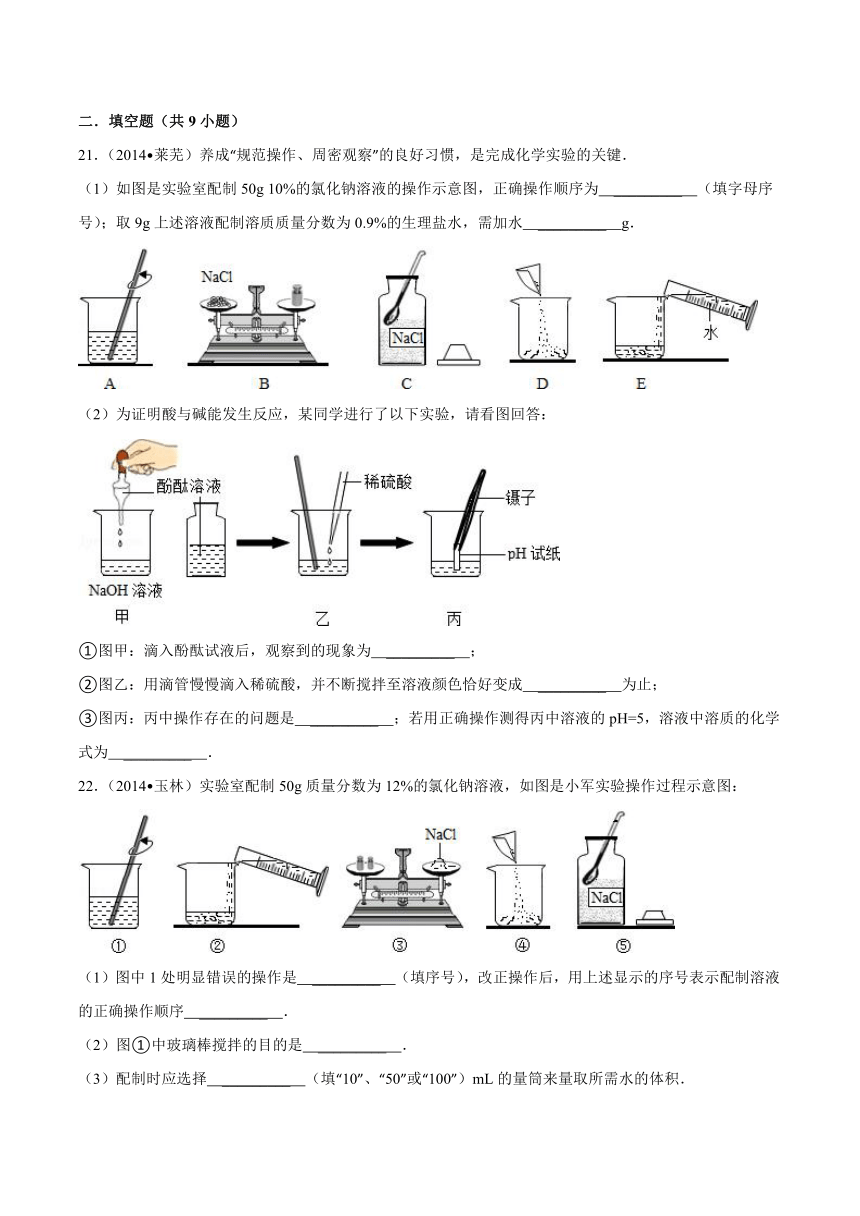
21.(2014 莱芜)养成“规范操作、周密观察”的良好习惯,是完成化学实验的关键.
(1)如图是实验室配制50g 10%的氯化钠溶液的操作示意图,正确操作顺序为 _________ (填字母序号);取9g上述溶液配制溶质质量分数为0.9%的生理盐水,需加水 _________ g. ( http: / / www.21cnjy.com )
(2)为证明酸与碱能发生反应,某同学进行了以下实验,请看图回答:
( http: / / www.21cnjy.com )
①图甲:滴入酚酞试液后,观察到的现象为 _________ ;
②图乙:用滴管慢慢滴入稀硫酸,并不断搅拌至溶液颜色恰好变成 _________ 为止;
③图丙:丙中操作存在的问题是 _________ ;若用正确操作测得丙中溶液的pH=5,溶液中溶质的化学式为 _________ .
22.(2014 玉林)实验室配制50g质量分数为12%的氯化钠溶液,如图是小军实验操作过程示意图:
( http: / / www.21cnjy.com )
(1)图中1处明显错误的操 ( http: / / www.21cnjy.com )作是 _________ (填序号),改正操作后,用上述显示的序号表示配制溶液的正确操作顺序 _________ .
(2)图①中玻璃棒搅拌的目的是 _________ .
(3)配制时应选择 _________ (填“10”、“50”或“100”)mL的量筒来量取所需水的体积.
23.(2014 梅州)20℃时,分别 ( http: / / www.21cnjy.com )向盛有10g水的A、B两支试管中加入等质量的甲、乙两种固体,充分溶解后,观察到如图1所示的现象.图2表示的甲乙两种物质的溶解度曲线.
(1)20℃时, _________ (填“A”或“B”)试管中的溶液一定是饱和溶液;
(2)图2中 _________ (填“M”或“N”),表示乙物质的溶解度曲线
(3)要使B试管中剩余的固体继续溶解可采用的方法是 _________ (答一种方法即可).
(4)将10℃时M的饱和溶液升温到20℃(假设水不蒸发),其溶质质量分数 _________ (填“增大”、“减小”或“不变”).
24.(2014 揭阳)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32 45.8 64 85.5 110 138 169 202 246
NaCl 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
(1)以上两种物质溶解度的变化受温度影响较小的是 _________ ;
(2)50℃时,KNO3的溶解度是 _________ g/100g水;
(3)KNO3溶液中含有少量NaCl时,可通过 _________ 的方法提纯;
(4)对(3)析出的晶体和剩余溶液描述正确的是 _________ (填写编号)
A.剩余溶液一定是KNO3饱和溶液 B.剩余溶液一定不含有NaCl
C.剩余的溶液一定是纯净物 D.析出的晶体中只含有KNO3.
25.(2014 山西)根据表中的数据,回答下列问题.
温度/℃ 0 20 40 60 80 100
溶解度/ NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)40℃时,NaCl的溶解度是 _________ .
(2)20℃时,称取31.6g K ( http: / / www.21cnjy.com )NO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是 _________ (填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是 _______.
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为 _________ .
(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是(填序号) _________ .
A、都是饱和溶液 B、溶剂质量:KNO3>NaCl C、溶液质量:KNO3<NaCl.
26.(2014 滨州)请根据图中A、B两种固体物质的溶解度曲线,回答下列问题.
(l)在 _________ ℃时,A、B两种物质溶解度相同.
(2)t2℃时,100g水中溶解 ( http: / / www.21cnjy.com )_________ gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为 _________ ,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 _________ g.
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是 .
27.(2014 北海)A、B、C三种固体物质的溶解度曲线如图所示,请回答下列问题.
(1)10℃时,A物质的溶解度是 _________ .
(2)30℃时,100g水中加入40gB物质,充分溶解后,所得溶液为 _________ (填“饱和溶液”或“不饱和溶液”).
(3)30℃时,分别将相同质量的A、B两种物质的饱和溶液冷却到10℃,析出晶体较少的物质是 _________ (填“A”或“B”).
(4)把C的饱和溶液从10℃升温到30℃,其 ( http: / / www.21cnjy.com )溶液的溶质质量分数 _________ (填“变大”、“变小”或“不变”);在溶液质量不变的情况下,将C的饱和溶液变成不饱和溶液的方法是 _________ .
28.(2014 通辽)(1)根据图1中a、b、c三种物质的溶解度曲线,回答下列问题.
①P点的含义是 _________ .
②t2℃时,将30g的a物质加入50g水中充分搅拌,能形成的溶液的质量为 _____ .
③将 t2℃时的a、b、c ( http: / / www.21cnjy.com )三种物质的饱和溶液降温到 t1℃时,三种溶液的溶质质量分数的顺序是 _________ (填写物质序号并用“>”或“<”连接).
(2)“五环”也能应用在化学中.如图2所示,每个环代表一种物质(环内物质不能重复),两环相切表示两种物质可以发生化学反应.回答下列问题:
①空环中物质的化学式为 _________ .(写出一种即可)
②环中物质两两反应,能生成白色沉淀的中和反应的化学方程式为 _________ .
③写出环中物质碱和盐反应的化学方程式 _________ .
29.(2014 绥化)如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 _________ .
(2)P点的含义是 _________ .
(3)若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 _________
A、溶剂的质量一定变小 B、溶质的质量可能不变
C、溶质的质量分数一定变大 D、溶液的质量变大
(4)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是 _________ .
三.解答题(共1小题)
30.(2014 厦门)实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: _________ g;
(2)称量时,氢氧化钠固 ( http: / / www.21cnjy.com )体应放于天平 _________ (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 _________ mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液 ( http: / / www.21cnjy.com ).关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 _________ 极(填“正”或“负”).用 _________ 验证b管中的气体,写出电解水的化学方程式: _________ .
(4)说明水是一种化合物的实验事实: _________ .
(5)电解后溶液的溶质质量分数 _________ 10%(填“<”、“=”或“>”).
参考答案与试题解析
一.选择题(共20小题)
1. A.2. C.3. C.4. B ( http: / / www.21cnjy.com ).5. A.6.C.7. B.8. B.9. D.10.B、C.11. D.12. B.13. C.14. A.15. C.16. C.17. B.18. B.19. A.20. A.
二.填空题(共9小题)
21.解(1)CBDEA,91;(2)①溶液变红色;②无色;③PH试纸浸入了溶液中,H2SO4,Na2SO4.
22. 解:(1)③;⑤③④②①;(2)搅拌,加快氯化钠的溶解速率;(3)50.
23.解:(1)B;(2)N;(3)升高温度;(4)不变.
24.(1)NaCl; (2)85.5; (3)降温结晶;(4)A.
25.(1)36.6g;(2)饱和;继续加KNO3固体至天平平衡;(3)降温结晶(或冷却热饱和溶液);
(4)A,C.
26.解:(1)t1;(2)25,20%,125;(3)B.
27.(1)30g;(2)不饱和溶液;(3)B;(4)变小,降温.
28.解:(1)①t1℃时,a、c的溶解度相等.②75g.③:b>a>c.
(2)①H2SO4.②Ba(OH)2+H2SO4═BaSO4↓+2H2O.③Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
29.(1)丙<乙<甲;(2)t1℃时,甲丙的溶解度相等;(3)B;(4)乙>甲>丙.
三.解答题(共1小题)
30.解:(1)所需的氢氧化钠质量为100g×10%=10g,故填:10;
(2)称量时,氢氧化钠固体应放于天平左盘,量取的水的体积为90ml,故需要选择100ml的量筒,故填:左,100;
(3)a管产生的气体较多,是氢气,说明与电源的负极相连,b管产生的是氧气,是用带火星的木条检验,电解水时生成的是氢气和氧气,故填:负,带火星的木条,2H2O2H2↑+O2↑;
(4)电解水时生成了氢气和氧气,说明水中含有氢元素和氧元素,从而说明水是化合物,故填:水分解生成了氢气和氧气;
(5)电解后水的质量减小,溶质不变,溶质质量分数增大,故填:>.
一.选择题(共20小题)
1.(2014 青海)实验室配制100克质量分数为20%的食盐溶液,需要水的质量和取水用到的仪器是( )
A. 80克,用100mL量筒 B. 80克,用托盘天平
C. 20克,用100mL量筒 D. 20克,用托盘天平
2.(2014 邵阳)实验室配制50g溶 ( http: / / www.21cnjy.com )质质量分数为6%的NaC1溶液的操作步骤有:计算、称量、量取、溶解.该实验过程中不需要用到的仪器是( )
A. 玻璃棒 B. 烧杯 C. 漏斗 D. 量筒
3.(2014 盐城)实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是( )
A. 用托盘天平称取10.0g氯化钠 B. 用量筒量取90.0mL 的水
C. 将称取的氯化钠倒入量筒中溶解 D. 将配制的溶液装入试剂瓶中,贴上标签
4.(2014 无锡)泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是( )
①称量好的食盐倒入烧杯时,有少许洒出 ②量水的体积时,俯视量筒 ③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液.
A.②③ B. ①③④ C. ①②③ D. ①②③④
5.(2014 盘锦)用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A.玻璃棒 量筒 烧杯 胶头滴管 B. 托盘天平 量筒 烧杯 玻璃棒
C.托盘天平 玻璃棒 烧杯 胶头滴管 D. 量筒 烧杯 漏斗 玻璃棒
6.(2014 东营)下列说法不正确的是( )
A. 稀有气体在通常条件下几乎不与任何物质发生反应,化学性质比较稳定
B. 铁制品锈蚀主要是铁与空气中氧气、水蒸气发生化学反应的结果
C. 溶液具有均一性和稳定性,是因为溶液中的各种粒子都静止不动
D. 元素周期表是学习和研究化学、探索未知世界的重要工具
7.(2014 锦州)下列生活中常见的物质加入水中,能形成溶液的是( )
A.面粉 B. 蔗糖 C. 泥沙 D. 植物油
8.(2014 赤峰)下表是某同学的实验记录,以下说法不正确的是( )
溶质 碘 高锰酸钾
溶剂 水 汽油 酒精 水 汽油
溶解性 不溶 易溶 可溶 易溶 不溶
A.衣服不慎沾上碘酒,可用汽油擦洗 B. 溶液都是均一、稳定、无色的混合物
C.水、汽油、酒精都可以做溶剂 D. 同一物质在不同溶剂中溶解性不同
9.(2014 枣庄)溶液在我们生活中有着广泛的用途.下列物质不属于溶液是的( )
A.碘酒 B. 澄清的石灰水 C. 生理盐水 D. 酒精
10.(2010 安徽)下列实验操作错误的是( )
A.取用药品 B. ( http: / / www.21cnjy.com )称取药品 C. ( http: / / www.21cnjy.com )量取液体 D.搅拌溶解
11.(2014 广西)下列除垢或除污过程中利用乳化作用的是( )
A.自来水洗手 B. 食醋除水垢 C. 汽油除油污 D. 洗洁精除油污
12.(2014 烟台)下列关于溶液的叙述正确的是( )
A. 溶液一定是均一、稳定、无色、透明的液体 B. 溶液中各部分性质相同
C. 某物质的饱和溶液就是不能再溶解任何物质的溶液D. 硝酸铵固体溶于水形成溶液时仅发生扩散吸热的过程
13.(2014 汕尾)归纳法是一种非常好的学习方法.下列归纳的结论错误的是( )
A. 浓溶液不一定是饱和溶液 B. 含氧元素的物质不一定是氧化物
C. 可燃性气体点燃前不一定都要验纯 D. 只含一种元素的物质不一定是纯净物
14.(2014 宿迁)下列化学实验中能达到预期实验结果的是( )
A. 借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B. 用pH试纸测定某未知溶液的pH为5.5
C. 20℃时,配制2%的氢氧化钙溶液
D. 将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
15.(2014 贵阳)关于溶液,下列说法错误的是( )
A. 固体、液体、气体都可以作为溶质 B. 硝酸铵溶于水的过程中,溶液温度下降
C. 75%的医用酒精中,C2H3OH与H2O的质量比为3:1
D. 在25℃时,KNO3溶液蒸发5g水,析出ag晶体,再蒸发5g水,又析出bg晶体,则a与b的质量不一定相等
16.(2014 海南)20℃时,在三个各 ( http: / / www.21cnjy.com )盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示( )
物质 甲 乙 丙
未溶解固体的质量/g 5 2 0
A.所得溶液一定都是饱和溶液 B. 丙溶液一定是不饱和溶液
C.丙溶液的溶质的质量分数最大 D. 20℃,时,甲的溶解度最大
17.(2014 莱芜)20℃时,取甲、乙 ( http: / / www.21cnjy.com )、丙、丁四种物质各20g,分别加入到四个盛有50g水的烧杯中,充分溶解,情况如表(温度保持20℃),下列说法正确的是( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
A. 所得溶液一定都是饱和溶液 B. 溶质质量分数最大的是丙溶液
C. 所得四种溶液的质量关系为:甲=乙=丙=丁 D. 20℃时四种物质溶解度的关系为:丁>甲>乙>丙
18.(2014 黔东南州)下列有关溶液的说法中正确的是( )
A. 常温下将100mL饱和Ca(OH)2溶液加热到50℃,会使溶液由饱和溶液变为不饱和溶液
B. 从浓度为25%的H2SO4溶液中取出10mL,则取出的10mL H2SO4溶液浓度仍为25%
C. 20℃时,50克水中溶解了18克NaCl,则20℃时NaCl的溶解度为36克
D. 将95克KCl溶液蒸干得到5克KCl固体,则原溶液中KCl的浓度为5%
19.(2014 枣庄)如图是甲、乙、丙三种物质的溶解度曲线,下列叙述不正确的是( )
A. 在t2℃时,把甲放入50g 水中得到甲的饱和溶液,且溶液的溶质质量分数为50%
B. t1℃时三种物质的溶解度大小关系是乙>甲=丙
C. 将t2℃时等质量的三种物质的饱和溶液分别降至0℃,析出甲最多
D. 将丙的饱和溶液变为不饱和溶液,可以采用降温的方法
20.(2014 广州)将50g 98%的浓硫酸溶于450g水中,所得溶液中溶质的质量分数为( )
A. 9.8% B. 10.2% C. 10.8% D. 19.6%
二.填空题(共9小题)
21.(2014 莱芜)养成“规范操作、周密观察”的良好习惯,是完成化学实验的关键.
(1)如图是实验室配制50g 10%的氯化钠溶液的操作示意图,正确操作顺序为 _________ (填字母序号);取9g上述溶液配制溶质质量分数为0.9%的生理盐水,需加水 _________ g. ( http: / / www.21cnjy.com )
(2)为证明酸与碱能发生反应,某同学进行了以下实验,请看图回答:
( http: / / www.21cnjy.com )
①图甲:滴入酚酞试液后,观察到的现象为 _________ ;
②图乙:用滴管慢慢滴入稀硫酸,并不断搅拌至溶液颜色恰好变成 _________ 为止;
③图丙:丙中操作存在的问题是 _________ ;若用正确操作测得丙中溶液的pH=5,溶液中溶质的化学式为 _________ .
22.(2014 玉林)实验室配制50g质量分数为12%的氯化钠溶液,如图是小军实验操作过程示意图:
( http: / / www.21cnjy.com )
(1)图中1处明显错误的操 ( http: / / www.21cnjy.com )作是 _________ (填序号),改正操作后,用上述显示的序号表示配制溶液的正确操作顺序 _________ .
(2)图①中玻璃棒搅拌的目的是 _________ .
(3)配制时应选择 _________ (填“10”、“50”或“100”)mL的量筒来量取所需水的体积.
23.(2014 梅州)20℃时,分别 ( http: / / www.21cnjy.com )向盛有10g水的A、B两支试管中加入等质量的甲、乙两种固体,充分溶解后,观察到如图1所示的现象.图2表示的甲乙两种物质的溶解度曲线.
(1)20℃时, _________ (填“A”或“B”)试管中的溶液一定是饱和溶液;
(2)图2中 _________ (填“M”或“N”),表示乙物质的溶解度曲线
(3)要使B试管中剩余的固体继续溶解可采用的方法是 _________ (答一种方法即可).
(4)将10℃时M的饱和溶液升温到20℃(假设水不蒸发),其溶质质量分数 _________ (填“增大”、“减小”或“不变”).
24.(2014 揭阳)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32 45.8 64 85.5 110 138 169 202 246
NaCl 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
(1)以上两种物质溶解度的变化受温度影响较小的是 _________ ;
(2)50℃时,KNO3的溶解度是 _________ g/100g水;
(3)KNO3溶液中含有少量NaCl时,可通过 _________ 的方法提纯;
(4)对(3)析出的晶体和剩余溶液描述正确的是 _________ (填写编号)
A.剩余溶液一定是KNO3饱和溶液 B.剩余溶液一定不含有NaCl
C.剩余的溶液一定是纯净物 D.析出的晶体中只含有KNO3.
25.(2014 山西)根据表中的数据,回答下列问题.
温度/℃ 0 20 40 60 80 100
溶解度/ NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)40℃时,NaCl的溶解度是 _________ .
(2)20℃时,称取31.6g K ( http: / / www.21cnjy.com )NO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是 _________ (填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是 _______.
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为 _________ .
(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是(填序号) _________ .
A、都是饱和溶液 B、溶剂质量:KNO3>NaCl C、溶液质量:KNO3<NaCl.
26.(2014 滨州)请根据图中A、B两种固体物质的溶解度曲线,回答下列问题.
(l)在 _________ ℃时,A、B两种物质溶解度相同.
(2)t2℃时,100g水中溶解 ( http: / / www.21cnjy.com )_________ gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为 _________ ,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 _________ g.
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是 .
27.(2014 北海)A、B、C三种固体物质的溶解度曲线如图所示,请回答下列问题.
(1)10℃时,A物质的溶解度是 _________ .
(2)30℃时,100g水中加入40gB物质,充分溶解后,所得溶液为 _________ (填“饱和溶液”或“不饱和溶液”).
(3)30℃时,分别将相同质量的A、B两种物质的饱和溶液冷却到10℃,析出晶体较少的物质是 _________ (填“A”或“B”).
(4)把C的饱和溶液从10℃升温到30℃,其 ( http: / / www.21cnjy.com )溶液的溶质质量分数 _________ (填“变大”、“变小”或“不变”);在溶液质量不变的情况下,将C的饱和溶液变成不饱和溶液的方法是 _________ .
28.(2014 通辽)(1)根据图1中a、b、c三种物质的溶解度曲线,回答下列问题.
①P点的含义是 _________ .
②t2℃时,将30g的a物质加入50g水中充分搅拌,能形成的溶液的质量为 _____ .
③将 t2℃时的a、b、c ( http: / / www.21cnjy.com )三种物质的饱和溶液降温到 t1℃时,三种溶液的溶质质量分数的顺序是 _________ (填写物质序号并用“>”或“<”连接).
(2)“五环”也能应用在化学中.如图2所示,每个环代表一种物质(环内物质不能重复),两环相切表示两种物质可以发生化学反应.回答下列问题:
①空环中物质的化学式为 _________ .(写出一种即可)
②环中物质两两反应,能生成白色沉淀的中和反应的化学方程式为 _________ .
③写出环中物质碱和盐反应的化学方程式 _________ .
29.(2014 绥化)如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 _________ .
(2)P点的含义是 _________ .
(3)若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 _________
A、溶剂的质量一定变小 B、溶质的质量可能不变
C、溶质的质量分数一定变大 D、溶液的质量变大
(4)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是 _________ .
三.解答题(共1小题)
30.(2014 厦门)实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: _________ g;
(2)称量时,氢氧化钠固 ( http: / / www.21cnjy.com )体应放于天平 _________ (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 _________ mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液 ( http: / / www.21cnjy.com ).关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 _________ 极(填“正”或“负”).用 _________ 验证b管中的气体,写出电解水的化学方程式: _________ .
(4)说明水是一种化合物的实验事实: _________ .
(5)电解后溶液的溶质质量分数 _________ 10%(填“<”、“=”或“>”).
参考答案与试题解析
一.选择题(共20小题)
1. A.2. C.3. C.4. B ( http: / / www.21cnjy.com ).5. A.6.C.7. B.8. B.9. D.10.B、C.11. D.12. B.13. C.14. A.15. C.16. C.17. B.18. B.19. A.20. A.
二.填空题(共9小题)
21.解(1)CBDEA,91;(2)①溶液变红色;②无色;③PH试纸浸入了溶液中,H2SO4,Na2SO4.
22. 解:(1)③;⑤③④②①;(2)搅拌,加快氯化钠的溶解速率;(3)50.
23.解:(1)B;(2)N;(3)升高温度;(4)不变.
24.(1)NaCl; (2)85.5; (3)降温结晶;(4)A.
25.(1)36.6g;(2)饱和;继续加KNO3固体至天平平衡;(3)降温结晶(或冷却热饱和溶液);
(4)A,C.
26.解:(1)t1;(2)25,20%,125;(3)B.
27.(1)30g;(2)不饱和溶液;(3)B;(4)变小,降温.
28.解:(1)①t1℃时,a、c的溶解度相等.②75g.③:b>a>c.
(2)①H2SO4.②Ba(OH)2+H2SO4═BaSO4↓+2H2O.③Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
29.(1)丙<乙<甲;(2)t1℃时,甲丙的溶解度相等;(3)B;(4)乙>甲>丙.
三.解答题(共1小题)
30.解:(1)所需的氢氧化钠质量为100g×10%=10g,故填:10;
(2)称量时,氢氧化钠固体应放于天平左盘,量取的水的体积为90ml,故需要选择100ml的量筒,故填:左,100;
(3)a管产生的气体较多,是氢气,说明与电源的负极相连,b管产生的是氧气,是用带火星的木条检验,电解水时生成的是氢气和氧气,故填:负,带火星的木条,2H2O2H2↑+O2↑;
(4)电解水时生成了氢气和氧气,说明水中含有氢元素和氧元素,从而说明水是化合物,故填:水分解生成了氢气和氧气;
(5)电解后水的质量减小,溶质不变,溶质质量分数增大,故填:>.
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
