2024年高三化学专题复习 高考试题分析与备考策略——化学实验综合题 课件(共20张PPT)
文档属性
| 名称 | 2024年高三化学专题复习 高考试题分析与备考策略——化学实验综合题 课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 09:26:19 | ||
图片预览


文档简介
(共20张PPT)
高考试题分析与备考策略
——化学实验综合题
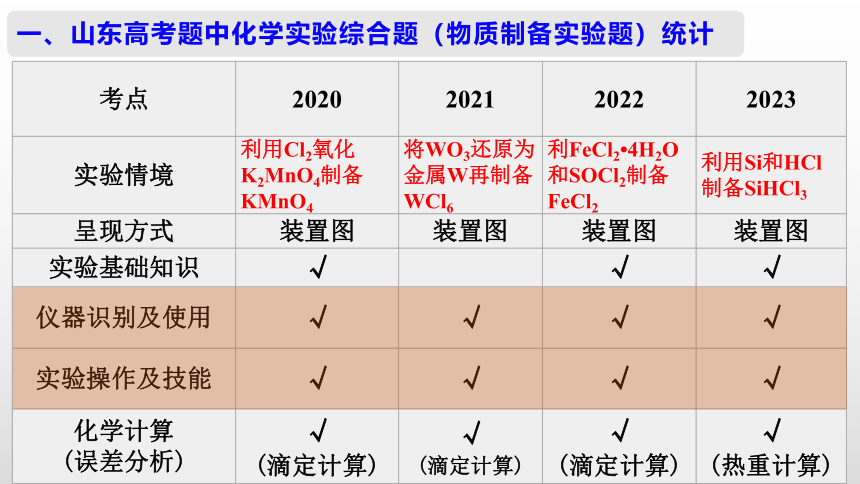
考点 2020 2021 2022 2023
实验情境 利用Cl2氧化K2MnO4制备KMnO4 将WO3还原为金属W再制备WCl6 利FeCl2 4H2O和SOCl2制备FeCl2 利用Si和HCl制备SiHCl3
呈现方式 装置图 装置图 装置图 装置图
实验基础知识 √ √ √
仪器识别及使用 √ √ √ √
实验操作及技能 √ √ √ √
化学计算 (误差分析) √ (滴定计算) √ (滴定计算) √ (滴定计算) √
(热重计算)
一、山东高考题中化学实验综合题(物质制备实验题)统计
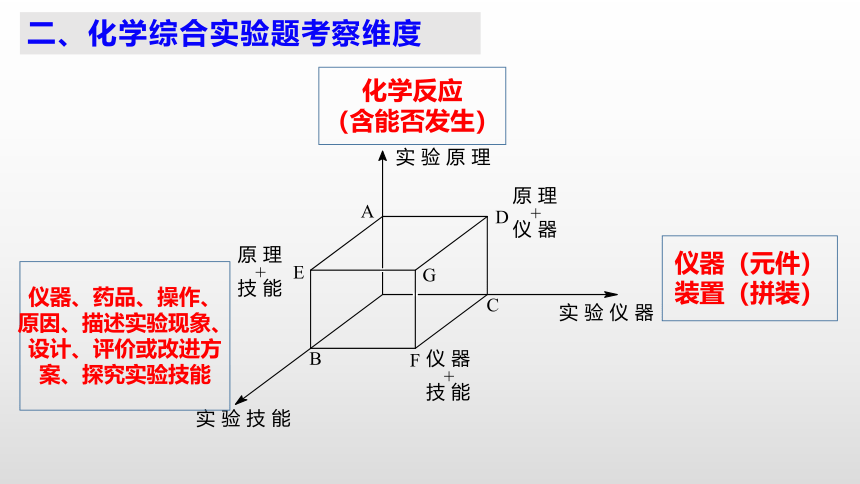
二、化学综合实验题考察维度
化学反应
(含能否发生)
仪器(元件)
装置(拼装)
仪器、药品、操作、原因、描述实验现象、设计、评价或改进方案、探究实验技能
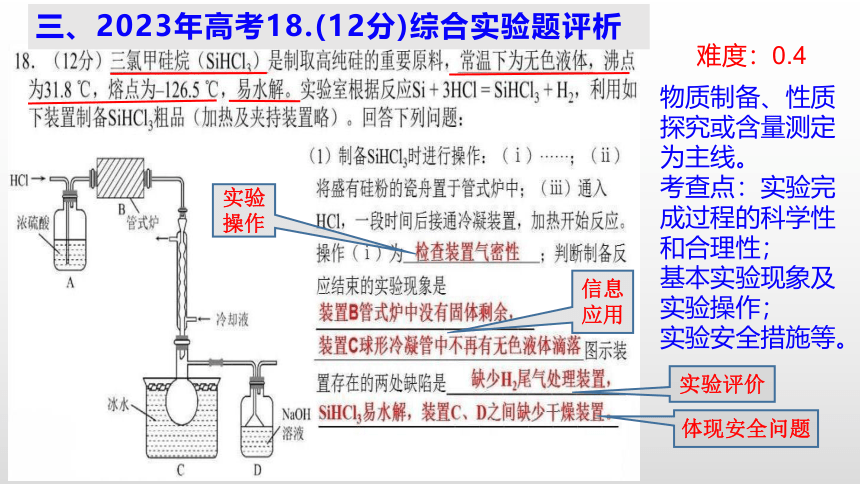
难度:0.4
物质制备、性质探究或含量测定为主线。
考查点:实验完成过程的科学性和合理性;
基本实验现象及实验操作;
实验安全措施等。
三、2023年高考18.(12分)综合实验题评析
实验操作
信息应用
实验评价
体现安全问题
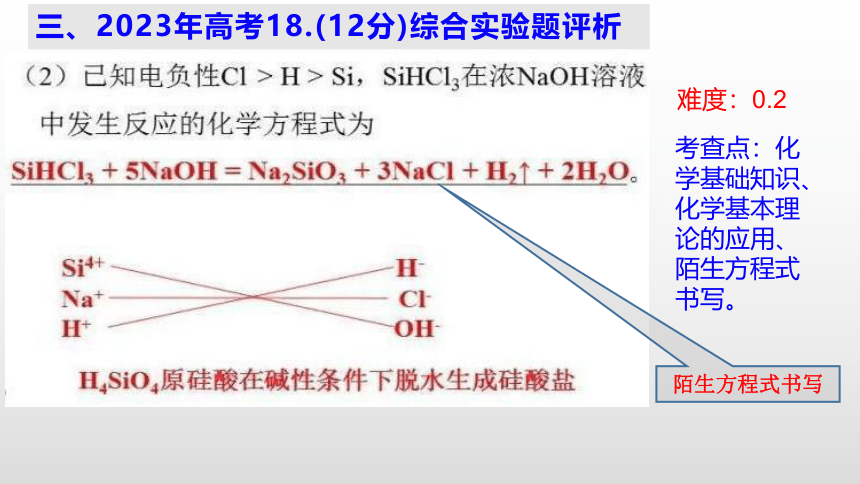
难度:0.2
考查点:化学基础知识、化学基本理论的应用、陌生方程式书写。
陌生方程式书写
三、2023年高考18.(12分)综合实验题评析
难度:0.2
考查点:实验基本操作;
仪器识别及使用;产品纯度的计算。
实验操作
仪器及使用
计算产品纯度
三、2023年高考18.(12分)综合实验题评析
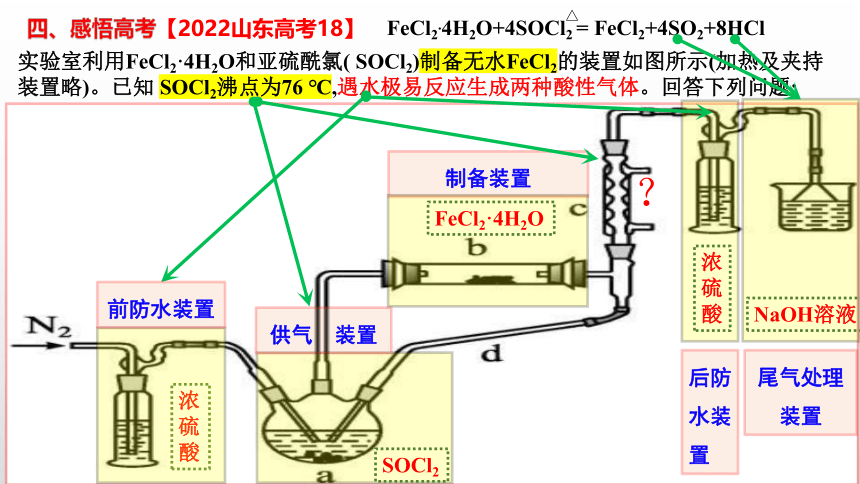
四、感悟高考【2022山东高考18】
实验室利用FeCl2·4H2O和亚硫酰氯( SOCl2)制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知 SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。回答下列问题:
供气 装置
浓硫酸
SOCl2
制备装置
后防水装置
尾气处理装置
FeCl2.4H2O+4SOCl2 = FeCl2+4SO2+8HCl
FeCl2·4H2O
浓硫酸
NaOH溶液
?
△
前防水装置
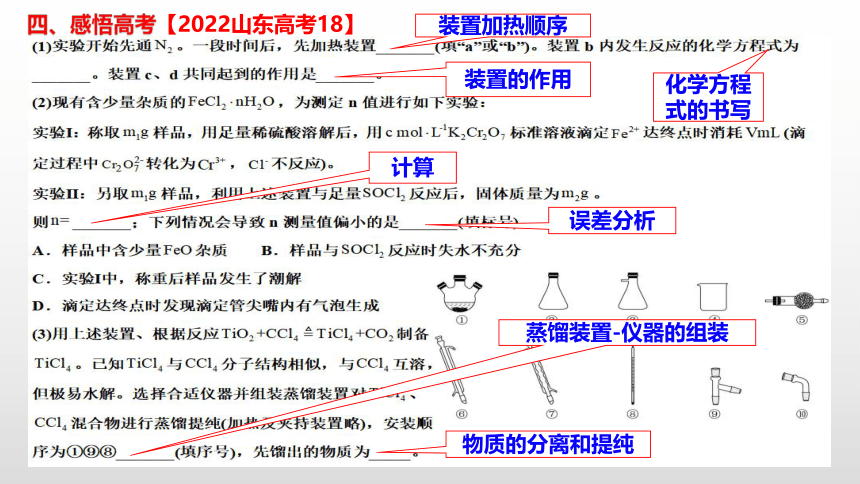
四、感悟高考【2022山东高考18】
装置加热顺序
化学方程式的书写
装置的作用
计算
误差分析
蒸馏装置-仪器的组装
物质的分离和提纯
(1)检查装置气密性并加入WO3。先通N2,其目的是_______________;一段时间后,加热管式炉,改通H2,对B处逸出的H2进行后续处理。仪器A的名称为_________,证明WO3已被完全还原的现象是_________。
(2)WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是___;操作④是_____,目的是_____________。
操作目的
仪器识别
实验现象
实验设计
操作目的
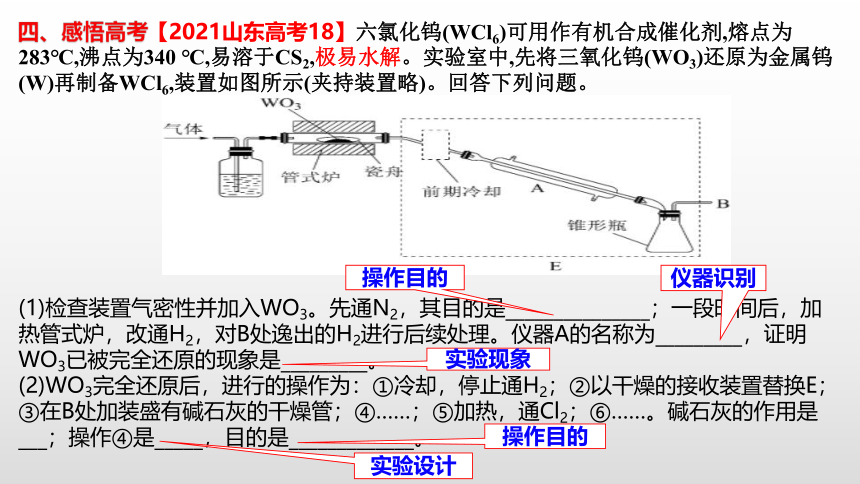
四、感悟高考【2021山东高考18】六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340 ℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题。
(3)利用碘量法测定WCl6产品纯度,实验如下:
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为___g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4,通过IO-离子交换柱发生反应:WO42-+Ba(IO3)2=BaWO4+2IO3-;交换结束后,向所得含IO3-的溶液中加入适量酸化的KI溶液,发生反应:IO3-+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-。滴定达终点时消耗cmol L-1的Na2S2O3溶液VmL,则样品WCl6(摩尔质量为Mg mol-1)的质量分数为___。
称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将___(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将___(填“偏大”“偏小”或“不变”)。
误差分析
计算
计算
四、感悟高考【2021山东高考 18】
误差分析
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00mL
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
仪器的使用
实验设计
装置的作用
仪器的选择
试剂的选择
化学方程式的书写
四、感悟高考【2020山东高考 20】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略)已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
(4)某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含H2C2O4·2H2O(M=126g mol-1)的质量分数表达式为 。下列关于样品组成分析的说法,正确的是 (填标号)。
A. V1/V2=3时,样品中一定不含杂质
B. V1/V2越大,样品中H2C2O4·2H2O含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
计算
误差分析
四、感悟高考【2020山东高考 20】
五、实 验 综 合 题 解 题 模 板
归纳总结:反应前通入X2排空气作用:
归纳总结:反应中鼓入某气,
归纳总结:反应后鼓入某气,
通入气体操作
排出装置内空气,防止空气中O2、CO2、H2O对实验的影响。
1.Cl2等带颜色的气体:整套装置内充满黄绿色气体
2.H2等易燃气体:收集末端气体验纯
3.CO2等:末端通入澄清石灰水中,产生白色沉淀
4.N2等:一段时间后,导气管末端出现连续稳定的气泡
目的是为了将反应中产生的气体,全部转入后续装置并完全吸收。
1.鼓入“难溶”气体“稀释”溶解度较大的气体,
2.鼓入“某气”气体“稀释”浓度较大时易爆的气体(ClO2),
目的是:
1.为了将反应中产生的有害气体或者有害反应物(如Br2、Cl2、SO2等),全部转入尾气吸收装置完全吸收,
2.冷却固体。
防止吸收该气体时产生倒吸。
防止产品爆炸。
消除拆卸装置时可能造成的污染。
六、实 验 综 合 题 思 维 建 模(1)——通气作用
控制条件
前后都加气体净化/干燥装置
增加防氧化装置
控制温度装置
调控洗涤剂(醇洗)
装置原理
题目信息
苯
决定
易水解
有杂质
易氧化
易分解
易挥发
反应能量变化
溶解性
决定
决定
决定
六、实 验 综 合 题 思 维 建 模(2)——装置作用
装置缺陷
在XX装置之间,
添加一个装有XX试剂的XX装置(干燥管,洗气瓶等)
解决方案
切入点:产品纯度,安全,产率
1. ,有副反应
2. ,污染环境
5. ,氧化产品等
3. ,安全
4. ,产品发生反应
未除杂或干燥
未吸收尾气
未防倒吸或未防止爆炸
未防空气中的水蒸汽等进入装置
未屏蔽氧气
六、实 验 综 合 题 思 维 建 模(3)——装置缺陷
原料提供装置
缓冲安全装置
净化除杂装置
中心反应装置
后防水、空气装置
尾气处理装置
实验目的
实验原理
化学反应
1.题目信息
2.物质性质
收集装置
实验操作
信息利用
实验评价
体现产品纯度,实验安全,实验效率的综合化学素养。
实验评价---实验装置的缺陷
一条主线
三个应用
七、实 验 综 合 题 知 识 整 合
八、高考化学实验题给我们的备考启示:
突出学科特点,重视化学实验
1、常见实验仪器的识别及其使用
2、化学实验的基本操作
3、物质的分离与提纯、物质的检验、物质的制备
4、化学实验原理的分析、化学实验成败分析、
5、实验现象的观察与描述及其对实验数据的分析和处理
6、实验装置的原理分析
7、课本上的科学实验探究
8、化学实验方案的设计与评价
9、化学定量实验问题(中和滴定、氧化还原滴定、沉淀分析)
九、重视实验教学:问题意识
实验复习的内容要任务化设计
(1)试剂选择、 (2)用量控制、
(3)试剂添加 (4)现象观察与表述、
(5)结论、 (6)反思评价与拓展延伸
十、帮助学生建立化学实验复习思维导图(供参考)
高考试题分析与备考策略
——化学实验综合题
考点 2020 2021 2022 2023
实验情境 利用Cl2氧化K2MnO4制备KMnO4 将WO3还原为金属W再制备WCl6 利FeCl2 4H2O和SOCl2制备FeCl2 利用Si和HCl制备SiHCl3
呈现方式 装置图 装置图 装置图 装置图
实验基础知识 √ √ √
仪器识别及使用 √ √ √ √
实验操作及技能 √ √ √ √
化学计算 (误差分析) √ (滴定计算) √ (滴定计算) √ (滴定计算) √
(热重计算)
一、山东高考题中化学实验综合题(物质制备实验题)统计
二、化学综合实验题考察维度
化学反应
(含能否发生)
仪器(元件)
装置(拼装)
仪器、药品、操作、原因、描述实验现象、设计、评价或改进方案、探究实验技能
难度:0.4
物质制备、性质探究或含量测定为主线。
考查点:实验完成过程的科学性和合理性;
基本实验现象及实验操作;
实验安全措施等。
三、2023年高考18.(12分)综合实验题评析
实验操作
信息应用
实验评价
体现安全问题
难度:0.2
考查点:化学基础知识、化学基本理论的应用、陌生方程式书写。
陌生方程式书写
三、2023年高考18.(12分)综合实验题评析
难度:0.2
考查点:实验基本操作;
仪器识别及使用;产品纯度的计算。
实验操作
仪器及使用
计算产品纯度
三、2023年高考18.(12分)综合实验题评析
四、感悟高考【2022山东高考18】
实验室利用FeCl2·4H2O和亚硫酰氯( SOCl2)制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知 SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。回答下列问题:
供气 装置
浓硫酸
SOCl2
制备装置
后防水装置
尾气处理装置
FeCl2.4H2O+4SOCl2 = FeCl2+4SO2+8HCl
FeCl2·4H2O
浓硫酸
NaOH溶液
?
△
前防水装置
四、感悟高考【2022山东高考18】
装置加热顺序
化学方程式的书写
装置的作用
计算
误差分析
蒸馏装置-仪器的组装
物质的分离和提纯
(1)检查装置气密性并加入WO3。先通N2,其目的是_______________;一段时间后,加热管式炉,改通H2,对B处逸出的H2进行后续处理。仪器A的名称为_________,证明WO3已被完全还原的现象是_________。
(2)WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是___;操作④是_____,目的是_____________。
操作目的
仪器识别
实验现象
实验设计
操作目的
四、感悟高考【2021山东高考18】六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340 ℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题。
(3)利用碘量法测定WCl6产品纯度,实验如下:
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为___g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4,通过IO-离子交换柱发生反应:WO42-+Ba(IO3)2=BaWO4+2IO3-;交换结束后,向所得含IO3-的溶液中加入适量酸化的KI溶液,发生反应:IO3-+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-。滴定达终点时消耗cmol L-1的Na2S2O3溶液VmL,则样品WCl6(摩尔质量为Mg mol-1)的质量分数为___。
称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将___(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将___(填“偏大”“偏小”或“不变”)。
误差分析
计算
计算
四、感悟高考【2021山东高考 18】
误差分析
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00mL
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
仪器的使用
实验设计
装置的作用
仪器的选择
试剂的选择
化学方程式的书写
四、感悟高考【2020山东高考 20】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略)已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
(4)某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含H2C2O4·2H2O(M=126g mol-1)的质量分数表达式为 。下列关于样品组成分析的说法,正确的是 (填标号)。
A. V1/V2=3时,样品中一定不含杂质
B. V1/V2越大,样品中H2C2O4·2H2O含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
计算
误差分析
四、感悟高考【2020山东高考 20】
五、实 验 综 合 题 解 题 模 板
归纳总结:反应前通入X2排空气作用:
归纳总结:反应中鼓入某气,
归纳总结:反应后鼓入某气,
通入气体操作
排出装置内空气,防止空气中O2、CO2、H2O对实验的影响。
1.Cl2等带颜色的气体:整套装置内充满黄绿色气体
2.H2等易燃气体:收集末端气体验纯
3.CO2等:末端通入澄清石灰水中,产生白色沉淀
4.N2等:一段时间后,导气管末端出现连续稳定的气泡
目的是为了将反应中产生的气体,全部转入后续装置并完全吸收。
1.鼓入“难溶”气体“稀释”溶解度较大的气体,
2.鼓入“某气”气体“稀释”浓度较大时易爆的气体(ClO2),
目的是:
1.为了将反应中产生的有害气体或者有害反应物(如Br2、Cl2、SO2等),全部转入尾气吸收装置完全吸收,
2.冷却固体。
防止吸收该气体时产生倒吸。
防止产品爆炸。
消除拆卸装置时可能造成的污染。
六、实 验 综 合 题 思 维 建 模(1)——通气作用
控制条件
前后都加气体净化/干燥装置
增加防氧化装置
控制温度装置
调控洗涤剂(醇洗)
装置原理
题目信息
苯
决定
易水解
有杂质
易氧化
易分解
易挥发
反应能量变化
溶解性
决定
决定
决定
六、实 验 综 合 题 思 维 建 模(2)——装置作用
装置缺陷
在XX装置之间,
添加一个装有XX试剂的XX装置(干燥管,洗气瓶等)
解决方案
切入点:产品纯度,安全,产率
1. ,有副反应
2. ,污染环境
5. ,氧化产品等
3. ,安全
4. ,产品发生反应
未除杂或干燥
未吸收尾气
未防倒吸或未防止爆炸
未防空气中的水蒸汽等进入装置
未屏蔽氧气
六、实 验 综 合 题 思 维 建 模(3)——装置缺陷
原料提供装置
缓冲安全装置
净化除杂装置
中心反应装置
后防水、空气装置
尾气处理装置
实验目的
实验原理
化学反应
1.题目信息
2.物质性质
收集装置
实验操作
信息利用
实验评价
体现产品纯度,实验安全,实验效率的综合化学素养。
实验评价---实验装置的缺陷
一条主线
三个应用
七、实 验 综 合 题 知 识 整 合
八、高考化学实验题给我们的备考启示:
突出学科特点,重视化学实验
1、常见实验仪器的识别及其使用
2、化学实验的基本操作
3、物质的分离与提纯、物质的检验、物质的制备
4、化学实验原理的分析、化学实验成败分析、
5、实验现象的观察与描述及其对实验数据的分析和处理
6、实验装置的原理分析
7、课本上的科学实验探究
8、化学实验方案的设计与评价
9、化学定量实验问题(中和滴定、氧化还原滴定、沉淀分析)
九、重视实验教学:问题意识
实验复习的内容要任务化设计
(1)试剂选择、 (2)用量控制、
(3)试剂添加 (4)现象观察与表述、
(5)结论、 (6)反思评价与拓展延伸
十、帮助学生建立化学实验复习思维导图(供参考)
同课章节目录
