2.4化学反应的调控(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 855.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 12:31:12 | ||
图片预览




文档简介
一、选择题
1.将4mol A和2mol B在2L的恒容密闭容器中发生反应:,,反应2s后测得C的浓度为0.6 mol L 1。下列说法正确的是
A.2s后物质A的转化率为15%
B.当υ(C)=2υ(B)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,平衡正向移动,C的体积分数升高
D.达到平衡状态时,升高温度,平衡逆向移动,υ正增大
2.德国化学家哈伯发明了以低成本制造氨的方法,大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料平衡转化率而采取的措施是
A.①②③④ B.②③④ C.②④⑤ D.②⑤
3.一定温度下,向2.0L恒容密闭容器中充入,发生反应:。反应中测得的部分数据见下表:
t/s 0 50 150 250 350
0 0.16 0.19 0.20 0.20
下列说法错误的是
A.0s时,正反应速率最大,逆反应速率为0
B.0~50s内,用表示的平均反应速率
C.250s时,反应已达到平衡,的平衡转化率为20%
D.当时,反应处于停止状态
4.煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。现将物质的量均为和充入2L密闭容器中,发生如下反应:。下列说法正确的是
温度/℃ 400 500 800
平衡常数/K 9.94 9 1
A.该反应的正反应方向是吸热反应
B.若在500℃时进行,CO的平衡转化率为75%
C.保持800℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应向正向进行
D.将该反应置于恒容绝热条件下,更利于氢气产率的提高
5.2021年9月24日,中国科学院天津工业生物技术研究所完成不依赖植物光合作用,直接使用二氧化碳与氢气作为材料合成淀粉。这是继上世纪60年代在世界上首次人工合成结晶牛胰岛素之后,中国科学家又在人工合成淀粉方面取得了重大颠覆性、原创性突破!下列关于淀粉说法错误的是
A.淀粉是重要的工业原料,也是人类重要的能量来源
B.淀粉是一种多糖,水解可以得到葡萄糖
C.科学家利用催化剂使CO2与H2合成淀粉,若改良催化剂可以提高合成转化率
D.淀粉和纤维素化学式都是(C6H10O5)n,但二者不是同分异构体
6.将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经2s后测得SO3的浓度为0.6mol·L-1,下列说法中正确的是
①用O2表示的反应的平均速率为0.6mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为15%
④2s时O2的浓度为0.7mol·L-1
A.①③ B.①④ C.②③ D.②④
7.一定条件下,在催化剂作用下发生反应 。调整和的初始投料比,测得在一定投料比和一定温度下,该反应的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。下列说法不正确的是
[已知反应速率,、分别为正、逆反应速率常数,x为物质的量分数。]
A.B点中,和的物质的量之比为1∶3
B.C点中,更换高效催化剂,的平衡转化率仍等于75%
C.若A、B两点起始浓度相同,则
D.E点时
8.在密闭容器中,一定条件下,进行如下反应,达到平衡后,为提高该反应的速率和NO的转化率,采取最好的措施是
A.增大压强同时加催化剂 B.加催化剂同时升高温度
C.充入同时升高温度 D.升高温度同时增大压强
9.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,马上泛起大量泡沫
B.合成氨工厂通常铁触媒做催化剂加快反应速率
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
10.某温度下,在1L恒容密闭容器中投入10molX,发生反应,有关数据如表所示,下列说法正确的是
时间段/s 产物Z的平均生成速率
0~10 0.4
0~20 0.3
0~30 0.2
A.5s时,Y的浓度为
B.20s时,体系中存在
C.25s时,X的转化率为30%
D.30s时,再加入2molX,达平衡时,X的体积分数变小
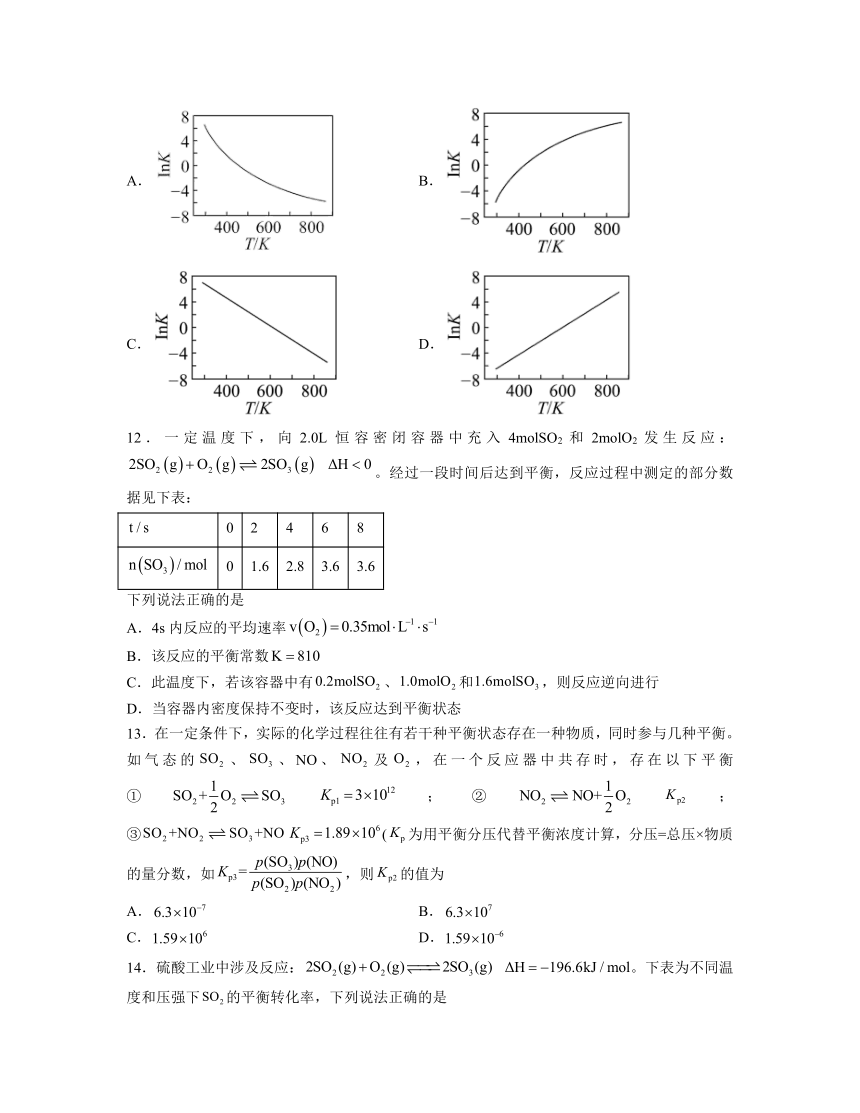
11.图中可以示意合成氨反应的平衡常数K随温度T变化趋势的是
A. B.
C. D.
12.一定温度下,向2.0L恒容密闭容器中充入4molSO2和2molO2发生反应:。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
0 2 4 6 8
0 1.6 2.8 3.6 3.6
下列说法正确的是
A.4s内反应的平均速率
B.该反应的平衡常数
C.此温度下,若该容器中有、和,则反应逆向进行
D.当容器内密度保持不变时,该反应达到平衡状态
13.在一定条件下,实际的化学过程往往有若干种平衡状态存在一种物质,同时参与几种平衡。如气态的、、NO、及,在一个反应器中共存时,存在以下平衡①;②;③(为用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,如,则的值为
A. B.
C. D.
14.硫酸工业中涉及反应: 。下表为不同温度和压强下的平衡转化率,下列说法正确的是
温度/℃ 的平衡转化率/%
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
A.工业上通入过量空气的主要目的是加快反应速率
B.回收尾气中的仅为了防止空气污染
C.采用常压生产是因为平衡时的转化率已足够高,增大压强会增加设备成本
D.选择的较高温度既提高反应速率也提高平衡转化率
15.HI常用作有机反应中的还原剂,受热发生反应:。一定温度时,向1L密闭容器中充入1molHI,体系中c(HI)与反应时间t的关系如图。下列说法中不正确的是
A.20min时,有91%的HI发生分解
B.40min时,
C.120min时,反应达到了平衡状态
D.HI的还原性与-1价碘元素有关
二、填空题
16.在密闭容器中,一氧化碳与水蒸气发生如下反应:,该反应在800℃时的平衡常数为1.0。如果反应开始时,一氧化碳和水蒸气的浓度都是,计算一氧化碳在此条件下的平衡转化率_______。
17.氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。
(1)在密闭容器中,使和在一定条件下发生反应:。
①平衡后,和的转化率的比值_______1(填“>”“<”成“=”)。
②当达到平衡时,保持恒温,压缩容器体积,平衡_______(填“正向”“逆向”或“不”)移动,化学平衡常数K_______(填“增大”“减小”或“不变”)。
(2)水煤气在一定条件下可合成甲醇:。将和充入恒容密闭容器中,在一定条件下合成甲醇,反应相同时间时测得不同温度下的转化率如图所示:
①温度在下,从反应开始至末,这段时间内的反应速率_______。
②由图可知,在温度低于时,CO的转化率随温度的升高而增大,原因是_______。
③已知c点时容器内气体的压强为p,则在下该反应的压强平衡常数为_______ (用含p的代数式表示,是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
18.美国Bay工厂使用石油热裂解的副产物甲烷来制取氢气,其过程分两步进行;
第一步:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0
第二步:CO(g)+H2O(g)H2(g)+CO2(g)
(1)其他条件相同时、第Ⅰ步反应中CH4的平衡转化率随压强和温度的变化如图所示。
图中L表示____(填“温度”或“压强”)。其另外一个物理量X1____X2(填“>”或“<”)。
(2)反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数K随湿度的变化如表所示。
温度/℃ 400 500 830 1000
平衡常数K 10 9 1 0.6
①从表中数据可以推断,此反应的正反应为____(填“吸热”或“放热”)反应。
②500℃时,向恒容密闭容器中充入CO(g)和H2O(g)各3mol,达到平衡后CO(g)的转化率为____;若该反应在绝热容器(与外界环境没有热交换)中进行,达到平衡后CO(g)的转化率将____(填“增大”、“减小”或“不变”)。
③在830℃时,向恒容密闭容器中充入2molCO(g),5molH2O(g),4molH2(g)和3molCO2(g),此时v正____v逆(填“>”、“<”或“=”)。
19.250℃和100kPa下密闭容器中发生反应:PCl5(g)PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
(1)PCl5的分压是___ kPa。(保留三位有效数字)
(2)250℃时用分压表达的平衡常数Kp=___kPa。(保留三位有效数字)
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是___,理由是___。
20.(1)反应mA+nBpC在某温度下达到平衡。
①若A、B、C都是气体,加压后正反应速率小于逆反应速率,则m、n、p的关系___。
②若A、B、C都是气体,且m+ n>p,而加压或升温平衡移动方向相同,则△H___0。
(2)一定条件下,将2molSO2和1molO2充入容积为2L的密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),2分钟后反应达平衡,此时SO2的浓度为0.2mol/L,完成:
①SO2的转化率为___。
②用O2表示的化学反应速率为__。
③平衡常数为__。
21.生物柴油是一种用植物油、动物油或废弃油脂等为原料加工而成的清洁燃料,主要成分为高级脂肪酸甲酯。一种用菜籽油等为原料制备生物柴油的实验步骤如下:
①向右图所示的三口烧瓶中加入3.2 g CH3OH、0.2 g NaOH,溶解后向其中加入20 g(0.021~0.023 mol)菜籽油及60 mL正己烷。
②加热至60~65 ℃,搅拌2.5~3 h,静置。上层为生物柴油、正己烷及甲醇,下层主要为甘油。
③分液、水洗。
④蒸馏,保持120℃时至无液体流出,剩余物为生物柴油。
(1)步骤①中控制n(CH3OH)/n(油脂)>3的目的是________;正己烷的作用是________。
(2)步骤②适宜的加热方式是________;菜籽油的成分之一油酸甘油酯(结构简式如右图)与甲醇反应的化学方程式为________________________________________________。
(3)步骤③用分液漏斗分离时,获取上层液体的方法是________;用水洗涤上层液体时,说明已洗涤干净的依据是__________________________________。
【参考答案】
一、选择题
1.D
解析:A.反应2s后测得C的浓度为,则2s后n(C)=1.2mol,则A的改变量为1.2mol,2s后物质A的转化率为,故A错误;
B.当υ(C)=2υ(B)时,没有正、逆反应速率,不能判断正逆反应速率的关系,因此不能判断该反应是否达到了平衡状态,故B错误;
C.增加A的物质的量,平衡正向移动,但C的百分含量减小,故C错误;
D.该反应为放热反应,升高温度,平衡逆向移动,υ正增大,故D正确。
综上所述,答案为D。
2.C
解析:合成氨的反应是气体体积减小的、放热的可逆反应。净化干燥的目的是提高产物纯度,不能提高转化率,①不符合;催化剂只改变反应速率,不影响平衡状态,不能提高转化率,③不符合;而②④⑤操作均使合成氨反应平衡向正反应方向移动,均能提高反应转化率;故选C。
3.D
解析:A.时,只有正向反应,所以正反应速率最大,逆反应速率为0,A项正确;
B.,B项正确;
C.250s时,反应已达到平衡,,则转化了0.20mol,因此的平衡较化率为20%,C项正确;
D.可逆反应达到平衜时,反应并未停止,D项错误。
故选D。
4.B
解析:A.根据表中数据,随着温度升高,化学平衡常数减小,说明该反应的正反应方向是放热反应,故A错误;
B.令达到平衡时,消耗CO的物质的量为xmol,则此时消耗H2O的物质的量xmol,生成H2和CO2的物质的量均为xmol,达到平衡时CO、H2O的物质的量为(0.04-x)mol,500℃K==9,解得x=0.03mol,CO转化率为=75%,故B正确;
C.此时Q==1=K,平衡不移动,故C错误;
D.恒容绝热容器中,随反应进行,温度升高,平衡向逆反应方向进行,氢气产率降低,故D错误;
答案为B。
5.C
解析:A.淀粉水解的最终产物是葡萄糖,葡萄糖是人类重要的能源,葡萄糖发酵生成酒精,因此淀粉是重要的工业原料,A正确;
B.淀粉属于天然高分子化合物,淀粉是一种多糖,在酶或酸催化下最终水解可以得到葡萄糖,B正确;
C. 科学家利用催化剂使CO2与H2合成淀粉,若改良催化剂可以提供转化速率、但催化剂不影响平衡、故不可以提高合成转化率,C错误;
D. 淀粉和纤维素化学式都是(C6H10O5)n,但n不同、相对分子质量也不同、故二者不是同分异构体,D正确;
答案选C。
6.D
解析:2SO2+O2 2SO3
起始浓度 2 1 0
转化浓度 0.6 0.3 0.6
平衡浓度 1.4 0.7 0.6
①用O2表示的反应的平均速率为0.15mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为30%
④2s时O2的浓度为0.7mol·L-1
②、④正确,故选D
7.C
解析:A.对于反应,在B点,假设反应开始时,,反应达到平衡时的平衡转化率为50%,则平衡时,,和的物质的量之比为1∶3,A正确;
B.催化剂不能改变平衡转化率,因此的平衡转化率不变,B正确;
C.A点和B点和的初始投料比相同,若A、B两点起始浓度相同时,升温平衡正向移动,的平衡转化率增大,则A点温度高于B点,则,C错误;
D.,,E点时,D正确;
答案选C。
8.A
解析:A.加催化剂、增大压强均加快反应速率,且增大压强平衡正向移动,NO的转化率增大,A正确;
B.正反应放热,升高温度平衡逆向移动,NO的转化率减小,B错误;
C.升高温度同时充入N2,均使平衡逆向移动,NO的转化率减小,C错误;
D.升高温度同时增大压强均加快反应的速率,但升高温度平衡逆向移动,增大压强平衡正向移动,无法判断NO的转化率增大还是减小,D错误;
故答案选A。
9.B
解析:A.汽水瓶中存在平衡H2CO3H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,A正确;
B.催化剂加快反应速率,化学平衡不移动,不能用勒夏特列原理解释,B错误;
C.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2OHClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,C正确;
D.工业上生产硫酸存在平衡2SO2+O22SO3,使用过量的空气,增大氧气的浓度,平衡向正反应移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,D正确;
答案选B。
10.C
解析:A.由题给数据可知,0~10s时,,按平均速率计算,5s时Y的浓度是,但化学反应速率是前10s的平均值,瞬时反应速率随着反应进行会逐渐降低,所以前5s时Y的平均生成速率大于,5s时Y的浓度大于,A错误;
B.根据表中数据,20s时,30s时,可判断20s时,反应已达到平衡,,B错误;
C.20s时,反应已达到平衡,,,C正确;
D.恒温恒容再投入X,相当于增大压强,该反应反应后气体分子数增大,增大压强平衡逆向移动,再达到平衡后X的体积分数变大,D错误;
故选C。
11.A
解析:合成氨的反应是放热反应,升高温度,平衡向左移动,平衡常数变小,B、D错误,对K求对数不是直线,C错误,故A项正确。
12.B
【分析】一定温度下,向2.0L恒容密闭容器中充入4molSO2和2molO2发生反应:。8s时反应达平衡,此时生成SO3的物质的量为3.6mol,则可建立如下三段式:
解析:A.4s内SO3的物质的量为2.8mol,则消耗O2的物质的量为1.4mol,反应的平均速率,A不正确;
B.该反应的平衡常数K==810,B正确;
C.此温度下,若该容器中有、和,则浓度商Q==128<810,反应正向进行,C不正确;
D.容器的体积始终不变,混合气的质量始终不变,则容器内气体的密度始终不变,当容器内密度保持不变时,该反应不一定达到平衡状态,D不正确;
故选B。
13.A
解析:根据为用平衡分压代替平衡浓度计算,,结合、表达式可知,故选A。
14.C
解析:A.工业上通入过量空气的主要目的是为了增大二氧化硫的转化率,A错误;
B.回收尾气中的除了防止空气污染还可以提高原料的利用率,B错误;
C.由表格可知常压生产平衡时的转化率已足够高,增大压强会增加设备成本,C正确;
D.选择的较高温度可提高反应速率但不能提高平衡转化率,D错误;
故选C。
15.A
解析:A.20min时c(HI)=0.91mol/L,则变化量为0.09mol/L,分解了为9%,A项错误;
B.如图40min时为c(HI)=0.85mol/L,n=cV=0.85mol,B项正确;
C.120min及以后HI浓度不再变化,则达平衡了,C项正确;
D.-1价的碘为最低价具有强还原性,D项正确;
故选A。
二、填空题
16.
解析:根据三段式:
,解得x=0.5,所以的转化率为:
17.(1) > 正向 不变
(2) 温度低于时,反应未达到平衡状态,随温度的升高,反应速率加快,相同时间内的转化率增大
解析:(1)①根据加入量之比等于计量系数之比,则平衡转化率相等,先加入和,可以理解为先加入和,平衡后两者转化率相等,再加入1mol氢气,氢气转化率减小,因此平衡后,和的转化率的比值>1;故答案为:>。
②当达到平衡时,保持恒温,压缩容器体积,压强增大,平衡向体积减小的方向移动即平衡正向移动,由于温度不变,则化学平衡常数K不变;故答案为:正向;不变。
(2)①温度在下,CO改变量为0.5mol,则从反应开始至末,氢气消耗了1mol,这段时间内的反应速率;故答案为:。
②由图可知,在温度低于时,反应未达到平衡状态,随温度的升高,反应速率加快,相同时间内的转化率增大;故答案为: 温度低于时,反应未达到平衡状态,随温度的升高,反应速率加快,相同时间内的转化率增大。
③已知c点时容器内气体的压强为pKPa,则在下建立三段式,该反应的压强平衡常数;故答案为:。
18.(1) 温度 <
(2) 放热 75% 减小 <
解析:(1)第Ⅰ步反应焓变大于零,为气体分子数增加的吸热反应,增加压强,平衡逆向移动,甲烷的转化率下降;升高温度,平衡正向移动,甲烷的转化率升高;由图象可知,曲线随L变大而变大,L为温度;图示为其他条件相同时、第Ⅰ步反应中CH4的平衡转化率随压强和温度的变化图象,温度相同时,压强越大,甲烷转化率越低,则X1
②500℃时,反应的平衡常数为9;设反应CO的物质的量为x
,解得x=
达到平衡后CO(g)的转化率为;
若该反应在绝热容器(与外界环境没有热交换)中进行,反应为放热反应,相当于升高温度,导致平衡逆向移动,使得达到平衡后CO(g)的转化率将减小。
③在830℃时,K=1;向恒容密闭容器中充入2molCO(g),5molH2O(g),4molH2(g)和3molCO2(g),此时,平衡逆向移动,则此时v正
(2)平衡时p(PCl5)== kPa,同理可得p(PCl3)=p(Cl2)=kPa,所以Kp==1.78×102或178 kPa;
(3)密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,则p(PCl5)== 12.5kPa,p(PCl3)=62.5kPa,p(Cl2)=25kPa,则此时Qp==125kPa< Kp,所以平衡向右进行。
20. m+n
0 80% 0.2mol/(L·min) 160
【分析】(1)根据影响平衡的因素及平衡移动方向进行判断
(2)根据三行式求解,并分析解答。
解析:(1)①若A、B、C都是气体,加压后正反应速率小于逆反应速率,即增大压强时平衡向逆反应方向移动,逆反应是气体分子总数减小的方向,正反应是气体分子总数增大的方向,所以m+n
(2). 2SO2(g)+O2(g)2SO3(g),
初起量:1mol/L 0.5mol /L 0
变化量:0.8mol/L 0.4mol/L 0.8mol/L
平衡量:0.2mol/L 0.1mol/L 0.8mol/L
①平衡时SO2的转化率:0.8mol/L/1mol/L×100%=80%,平衡时SO2的转化率为80%;
②2min内用O2表示该反应的平均反应速率为:0.4mol/L/2min=0.2mol/(L·min)
③平衡常数K=,故答案为:160。
21. 提高酯交换时油脂的转化率 溶剂 水浴加热 先分离出下层液体然后关闭活塞,从分液漏斗上口倒出上层液体 用pH试纸检验,水相呈中性
解析:(1)根据题意生物柴油主要成分为高级脂肪酸甲酯,菜籽油的主要成分为高级脂肪酸甘油酯,所以加入甲醇在NaOH和正己烷共同作用下,发生酯交换反应,因此增大反应物CH3OH的用量可提高油脂的转化率;其中正己烷作为溶济,溶解菜籽油促进反应进行;
(2) 加热温度为60~65℃,所以适宜的加热方法是水浴;油酸甘油酯与甲醇反应的化学方程式为;
(3) 用分液漏斗分液时,获取上层液体的方法是先分离出下层液体然后关闭活塞,从分液漏斗上口倒出上层液体;上层液体为生物柴油、正己烷及甲醇,可能含有少量的NaOH溶液,用水洗涤时,可用pH试纸检验,水呈中性时,表明已洗涤干净
