第2章 化学反应的方向、限度与速率 测试题(含解析)2023-2024学年高二上学期鲁科版(2019)化学选择性必修1
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率 测试题(含解析)2023-2024学年高二上学期鲁科版(2019)化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 701.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 14:40:37 | ||
图片预览




文档简介
第2章 化学反应的方向、限度与速率 测试题
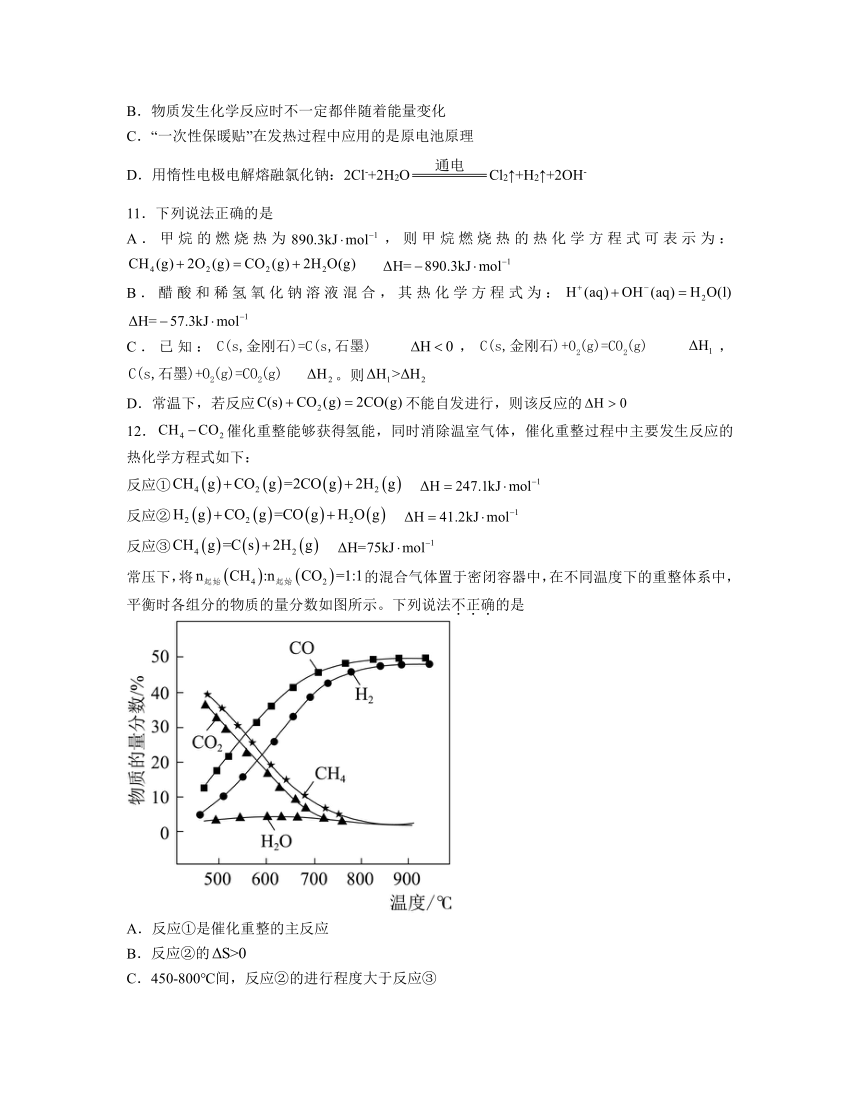
一、选择题
1.下列化工生产中,所采取的条件或操作不能用勒夏特列原理解释的是
A.工业制盐酸:向合成塔中通入过量氢气 B.合成氨:采用20-50MPa压强
C.工业制硫酸:向接触室中通入过量空气 D.联合制碱工业:向母液中加入食盐
2.科学家研究出一种新的催化剂能有效处理汽车尾气,其反应的化学方程式为 ,若反应在恒容密闭容器中进行,由该反应相关图像作出的判断正确的是
A.图甲中改变的反应条件为加入等量的NO和CO
B.图乙中纵坐标可代表NO的百分含量
C.图丙中纵坐标可代表CO的百分含量
D.图丁中a、b、c三点均已达到化学平衡状态
3.对可逆反应,下列叙述正确的是
A.达到化学平衡时
B.若单位时间内生成的同时,消耗,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
4.2SO2+O22SO3△H<0是工业上接触法制硫酸的重要反应。下列关于该反应的说法不正确的是
A.增加O2的浓度提高SO2的转化率
B.利用该反应放出的热量对SO2、O2预热
C.升高体系温度能提高SO3的平衡产率
D.即使增大压强也不能使SO2全部转化为SO3
5.对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法不正确的是
A.上述反应的平衡常数表达式K=
B.适当提高NH3的浓度,可以加快反应速率,提高NH3的转化率
C.1molN—H断裂同时有1molO—H断裂,说明达该条件下的平衡状态
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
6.反应,在不同情况下测得的反应速率,其中反应速率最慢的是
A. B.
C. D.
7.在不同条件下,按投料比进行反应: ,并测定实验数据。
一定条件下,CO2转化率为13.68%,CH3OH产率(甲醇的物质的量/起始CO2物质的量)为4.12%。
②一定压强下,相同时间,CH3OH产率随温度变化的数据图如下。
下列说法不正确的是
A.与①相同条件下,提高与的比例,可以提高的转化率
B.由①可推测,制取过程中无副反应发生
C.由②可推测,480~520K,温度升高,速率加快是产率升高的原因
D.由②可推测,温度升高产率降低的可能原因是平衡逆向移动
8.在一密闭容器中发生反应: ,达到平衡时采取下列措施,可以使正反应速率增大、D的物质的量浓度增大的是
A.移走少量C B.升高温度
C.缩小容器容积,增大压强 D.压强不变,充入稀有气体
9.已知2A(g) 3B(s)+C(g) ΔH<0, 假设ΔH和ΔS不随温度而改变,下列说法中正确的是
A.低温下能自发进行
B.高温下能自发进行
C.任何温度下都能自发进行
D.任何温度下都不能自发进行
10.下列说法正确的是
A.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH>0,该反应低温能自发进行
B.物质发生化学反应时不一定都伴随着能量变化
C.“一次性保暖贴”在发热过程中应用的是原电池原理
D.用惰性电极电解熔融氯化钠:2Cl-+2H2OCl2↑+H2↑+2OH-
11.下列说法正确的是
A.甲烷的燃烧热为,则甲烷燃烧热的热化学方程式可表示为:
B.醋酸和稀氢氧化钠溶液混合,其热化学方程式为:
C.已知: , , 。则
D.常温下,若反应不能自发进行,则该反应的
12.催化重整能够获得氢能,同时消除温室气体,催化重整过程中主要发生反应的热化学方程式如下:
反应①
反应②
反应③
常压下,将的混合气体置于密闭容器中,在不同温度下的重整体系中,平衡时各组分的物质的量分数如图所示。下列说法不正确的是
A.反应①是催化重整的主反应
B.反应②的
C.450-800℃间,反应②的进行程度大于反应③
D.为提高平衡时的产率,应研发更合适的催化剂
13.对于反应A(g) + 2B(g)=3C(g)+ 2D(g)来说,下列反应速率最快的是
A.v(A)=0.32mol/(L·min) B.v(B)=0.55 mol/(L·min)
C.v(C)=0.02 mol/(L·s) D.v(D)=0.01 mol/(L·s)
14.对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③ B.②③④⑥ C.②④ D.②④⑤
15.一定温度下,可通反应2NO2N2O4在固定体积的绝热密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolN2O4的同时生成2nmolNO2
②用NO2、N2O4表示的反应速率之比为2:1的状态
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥容器内温度不变
A.①③④⑥ B.②③④⑤ C.①③④⑤ D.②③⑤⑥
二、填空题
16.一定条件下,用或作催化剂对燃煤烟气回收。反应为。
(1)其他条件相同、催化剂不同,的转化率随反应温度的变化如图1,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是 。
(2)某科研小组用作催化剂,在时,分别研究了为1∶1、3∶1时转化率的变化情况(图2)。则图2中表示的变化曲线为 (填“a”或“b”)。
17.一定温度下,反应在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
(1)缩小体积使压强增大: ,原因是 。
(2)恒容充入: 。
(3)恒容充入: ,原因是 。
(4)恒压充入: 。
18.某温度下,在2L密闭容器中,x、y、z三种物质的物质的量随时间变化曲线如图所示,由图分析:
(1)该反应的化学方程式是 。
(2)3min末,用y的浓度变化表示的反应速率V(y)为 。
(3)反应是由 开始的反应。
A.正反应 B.逆反应 C.正、逆反应同时
19.300℃ 时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)2C(g)+2D(g) ,2min末反应达到平衡,生成0.8mol D。
(1)在2min末,A的平衡浓度为 ,B的转化率为 ;C的体积分数为 。
(2)300℃ 时,将该反应容器体积压缩为1L,则A的转化率 (填“增大”“减小”或"不变"),原因是 。若该条件下平衡常数为K3,则K3 (填“>”,"<"或“=”)K1,原因是 。
(3)判断该反应是否达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(A)不变 C.v(A)=v(C) D.混合气体密度不变
20.一定温度下,向恒容容器中充入和,发生反应,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
(1)前的平均反应速率 ,达平衡时的平衡体积分数为 。
(2)由表中数据计算该温度下该反应的平衡常数为 ,随着反应温度升高,该反应的平衡常数 (选填“增大”、“减小”或“不变”)。
(3)保持温度不变,起始时向容器中充入,达平衡时,的转化率为 。
21.O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中n(Cl2)的数据如下,则2.0~6.0min内以HCl的物质的量变化表示的反应速率为 (以mol·min-1为单位)。
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10-3mol 0 1.8 3.7 5.4 7.2
22.CO和可合成甲醇,反应为 。回答下列问题:
(1)恒温恒压条件下,向密闭容器1通入10 mol CO(g)和20 mol ,达平衡时,体系向环境放热360 kJ,向密闭容器Ⅱ中通入10 mol ,达平衡时,体系从环境吸热540 kJ,则容器Ⅰ中CO平衡转化率为 , kJ·mol。
(2)一定温度下2.0 L密闭容器中,通入0.10 mol CO和0.20 mol ,压强为Pa,10 min时,达到平衡的压强为Pa,该温度下的平衡常数 pa。
(3)恒温恒容条件下,要提高CO的转化率,可以采取的措施是 (填标号)。
a.增加CO的浓度 b.加入 c.分离出甲醇 d.加入催化剂 e.加入惰性气体 f.升高温度
(4)Arrhenius经验公式为(为活化能,k为速率常数,R和C为常数),反应的实验数据如图中曲线m所示。则该反应的活化能 kJ·mol,改变外界条件实验数据如曲线n所示,则可能改变的反应条件是 。
23.实验一:检验的存在,可向溶液中加入溶液,发生反应如下:
(1)改变下列条件能使该可逆反应发生平衡移动的是 。
①加入固体 ②加入粉 ③加入固体
上述条件不能使平衡发生移动的是 ,原因是 。
实验二:已知,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
实验编号 室温下,试管中所加试剂及其用量 室温下溶液颜色褪至无色所需时间
溶液 稀硫酸 溶液
1 3.0 2.0 2.0 3.0 1.5
2 2.0 3.0 2.0 2.7
3 1.0 2.0 3.0 3.9
(2)在硫酸酸化的与反应中,该反应的离子方程式为: 。
(3)表中 ,
(4)利用实验1中数据计算,若用的浓度变化表示的反应速率为: 。
(5)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色。反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是 的影响。
(6)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入___________。(填字母序号)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
【参考答案】
一、选择题
1.A
解析:A.氢气和氯气的反应不是可逆反应,不能用勒夏特列原理解释,故A符合题意;
B.生成氨气的反应为气体分子数减小的反应,增大压强利于平衡正向减小,利于氨气的生成,用勒夏特列原理解释,故B不符合题意;
C.向接触室中通入过量空气,促使二氧化硫和氧气反应转化为三氧化硫,能用勒夏特列原理解释,故C不符合题意;
D.联合制碱工业中向母液中加入食盐,提高氯离子浓度,利于氯化铵结晶析出,能用勒夏特列原理解释,故D不符合题意;
故选A。
2.D
解析:A.加入等量的NO和CO相当于增大压强,正逆反应速率都增大,平衡正向移动,速率是,故A错误;
B.按照先拐先平数值大,温度是T2>T1,反应是放热反应,温度升高平衡逆向移动,NO的百分含量应该增大,和图示不符合,故B错误;
C.按照先拐先平数值大,压强是p2>p1,压强大平衡应该是正向移动,CO含量应该减少,和图示不符合,故C错误;
D.abc三点都在平衡常数与温度关系的曲线上,都处于平衡状态,故D正确;
答案选D。
3.A
解析:A.4v正(O2)=5v逆(NO)时,说明正逆反应速率相等,反应达到平衡状态,故A正确;
B.单位时间内生成x mol NO的同时,消耗x mol NH3,都表示反应向正反应方向进行,不能说明反应达到平衡状态,故B错误;
C.增加容器体积,各气体的浓度都减小,正、逆反应速率都减小,故C错误;
D.达到化学平衡时,若升高温度,正、逆反应速率都增大,故D错误;
答案选A。
4.C
解析:A.增加O2的浓度,平衡正向移动,SO2的转化率增大,A正确;
B.该反应放热,利用放出的热量对SO2、O2预热,可增大反应速率,B正确;
C.正反应放热,升高温度平衡逆向移动,二氧化硫平衡产率下降,C错误;
D.该反应为可逆反应,反应物不可能完全转化,D正确;
故选C。
5.B
解析:A.由方程式可知,反应的平衡常数表达式K=,故A正确;
B.适当提高氨气的浓度,反应速率加快,平衡向正反应方向移动,但氨气的转化率减小,故B错误;
C.由方程式可知,1molN—H断裂同时有1molO—H断裂说明正逆反应速率相等,反应已达到平衡,故C正确;
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数,加快反应速率,故D正确;
故选B。
6.A
【分析】化学反应速率之比等于化学计量数之比,比较化学反应速率,需转化为同一种物质去比较,且单位相同,本题全部转化为A的反应速率去比较。
解析:A.;
B.;
C.;
D.;
所以反应速率最慢的是A;
答案选A。
7.B
解析:A.与①相同条件下,提高与的比例,即增大H2的用量,化学平衡正向移动, 的转化率增大,H2的转化率减小,A正确;
B.由①可推测,一定条件下,转化率为13.68%,产率(甲醇的物质的量/起始物质的量)为4.12%,根据碳原子守恒可知,制取过程中有副反应发生,B错误;
C.由图示信息可知, 480~520K,温度升高,相同时间内的CH3OH产率升高,主要是由于速率的加快,C正确;
D.由题干信息可知, 正反应是一个放热反应,则由②可推测,温度升高产率降低的可能原因是平衡逆向移动,D正确;
故答案为:B。
8.C
解析:A.C是固体,移走少量C,C的浓度不变,正反应速率不变,平衡不移动,D的物质的量浓度不变,故不选A;
B.正反应放热,升高温度,平衡逆向移动,D的物质的量浓度减小,故不选B;
C.正反应气体系数和减小,缩小容器容积,增大压强,平衡正向移动,反应物浓度增大,反应速率加快,故选C;
D.压强不变,充入稀有气体,容器体积增大,相当于减压,正反应速率减小,平衡逆向移动,D的物质的量浓度减小,故不选D;
选C。
9.A
解析:2A(g) 3B(s)+C(g) ΔH<0,正反应是气体体积减小的放热反应,ΔS<0,要使△H-T △S<0,则T为低温,所以该反应在低温下能自发进行,故选:A。
10.C
解析:A.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH>0,ΔS>0,ΔG=ΔH-TΔS<0可以自发进行,该反应高温能自发进行,A错误;
B.物质发生化学反应时一定都伴随着能量变化,B错误;
C.“一次性保暖贴”在发热过程中应用的是原电池原理,负极为:Fe-2e-=Fe2+,C正确;
D.熔融氯化钠中没有水,用惰性电极电解熔融氯化钠:2Cl-+2Na+Cl2↑+2Na,D错误;
答案选C。
11.D
解析:A.燃烧热是生成稳定氧化物,故应该是生成液体水而不是气态水,A错误;
B.醋酸是弱酸,反应中以分子形式参与反应,B错误;
C.碳单质燃烧放热,因为 ,则金刚石燃烧放热更多,焓变数值更小,C错误;
D.该反应为熵增反应,不能自发进行,则该反应的,D正确。
故选D。
12.D
解析:A.随温度升高,CO、H2的物质的量分数变化趋势基本相同,可知反应①是催化重整的主反应,故A正确;
B.反应②,反应②能自主发生,,可知反应②的,故B正确;
C.反应①中CO、H2是反应产物,且物质的量比1:1,CO是反应②的产物,氢气是反应②的反应物,氢气是反应③的生成物,450-800℃间,CO的量始终大于氢气,反应②消耗氢气的量大于反应③生成氢气的量,所以反应②的进行程度大于反应③,故C正确;
D.催化剂不能使平衡移动,选用更合适的催化剂不能提高平衡时的产率,故D错误;
选D。
13.C
【分析】同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,可根据速率之比是相应的化学计量数之比先换算成用同一种物质(固体及纯液体除外)表示,然后比较速率数值,注意换算时单位要统一。
解析:A.v(A)=0.32mol/(L·min)
B.;
C. ;
D.;
综上所述反应速率最快的是C;
故选C。
14.D
解析:①反应有气体参加,则扩大容器的容积,速率减小,故不选;
②使用催化剂,降低反应需要的活化能,反应速率加快,故选;
③增加反应物的物质的量,若为固体,浓度不变,反应速率不变,故不选;
④升高温度,反应速率加快,故选;
⑤缩小容积,则浓度增大,反应速率加快,故选;
⑥增大容器内的压强,若恒容充入稀有气体,反应速率不变,故不选;
故答案选D。
【点睛】本题考查影响化学反应速率的因素,为高频考点,把握影响反应速率的因素为解答的关键,侧重常见外因对反应速率影响的考查,注意①反应为有气体参加的反应,扩大容器容积会使反应速率减小。②若反应物为固体,则增加反应物的物质的量时浓度不变。
15.A
解析:①单位时间内生成nmolN2O4是正反应速率,同时生成2nmolNO2是逆反应速率,且N2O4 与NO2的系数比为1:2,故反应正、逆反应速率相等,达到平衡,①符合题意;
②用NO2、N2O4表示的反应速率之比为2:1的状态,未指明正、逆反应速率,无法判断达到平衡,②不合题意;
③混合气体的平均相对分子质量等于气体的总质量除以总的物质的量,该反应中气体的总质量不变,总物质的量一直在改变,故混合气体的平均相对分子质量不再改变的状态,说明达到平衡,③符合题意;
④反应中NO2为红棕色气体,N2O4为无色气体,故混合气体的颜色不再改变的状态,说明达到平衡,④符合题意;
⑤混合气体的密度等于气体的总质量除以容器的体积,故密度一直未改变,故混合气体的密度不再改变的状态,不能说明达到平衡,⑤不合题意;
⑥由于该容器是一个绝热容器,故容器内温度不变,能说明达到平衡,⑥符合题意;
综上所述可知,①③④⑥符合题意,故答案为:A。
二、填空题
16.(1)作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源
(2)a
解析:(1)根据图1可知,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源。
(2)在其他条件不变时,增大的浓度,可以提高的平衡转化率。由图2可知转化率:,所以曲线a表示的变化曲线,曲线b表示的变化曲线。
17.(1) 增大 单位体积内,活化分子数目增加,有效碰撞的次数增多
(2)增大
(3)不变 单位体积内活化分子数不变
(4)减小
解析:(1)缩小容器体积可使参加反应的物质的浓度增大,单位体积内活化分子数目增加,有效碰撞的次数增多,化学反应速率增大;
(2)恒容条件下充入N2,增大了N2的浓度,化学反应速率增大;
(3)恒容条件下充入He,没有改变反应物和生成物的浓度,单位体积内活化分子数不变,化学反应速率不变;
(4)恒压条件下充入He,容器体积增大,反应物和生成物的浓度减小,化学反应速率减小。
18.x+3y2z 0.25mol/(L·min) C
【分析】根据反应物减少,生成物增加,分析该反应,且根据该变量的比等于化学计量数比分析。
解析:(1)反应到3分钟时,x减少了4-3.5=0.5mol,y减小了4-2.5=1.5mol,所以x、y为反应物,z增加了2.0-1.0=1.0mol,z为生成物,根据物质的量的变化量比等于化学计量数比分析,该反应的化学方程式是x+3y2z。
(2)3min末,用y的浓度变化表示的反应速率V(y)为=0.25mol/(L·min)。
(3)起始反应物和生成物都有,所以反应是由正、逆反应同时开始的反应。
19.4mol/L 20% 20% 不变 反应前后气体体积不变,压强不影响平衡移动 = 平衡常数只受温度影响,温度相同,则平衡常数相同 B
【分析】
根据题意列三段式有:
,据此分析。
解析:(1)2minΔn(D)=0.8mol,根据方程式可知Δn(A)=1.2mol,所以平衡时n(A)=2mol-1.2mol=0.8mol,容器体积为2L,则c(A)=0.4mol/L;Δn(B)=0.4mol,则=20%;n(C)=0.8mol,则C的体积分数为=20%;
(2)该反应前后气体系数之和相等,所以压强对平衡没有影响,则将该反应容器体积压缩为1L,平衡不移动,A的转化率不变;平衡常数只与温度有关,温度不变则平衡常数不变,所以K3=K1;
(3)A.该反应前后气体系数之和相等,所以无论是否平衡,压强均不发生变化,压强不变不能说明反应平衡,故A不符合题意;
B.平衡时正逆反应速率相等,各物质的浓度不再改变,所以A的浓度不变可以说明反应平衡,故B符合题意;
C.平衡时v正(A)=v逆(A),2v逆(A)=3v逆(C),选项既没有注明正逆,比例关系也不对,所以不能说明反应平衡,故C不符合题意;
D.该反应中反应物和生成物均为气体,所以气体的质量不变,容器恒容则体积不变,所以无论是否平衡密度都不变,故D不符合题意;
综上所述答案为B。
20. 减小
解析:(1)前,消耗A的物质的量为1mol-0.85mol=0.15mol,则平均反应速率;由表格数据可知,达平衡时,A剩余0.8mol,消耗A的物质的量为1mol-0.8mol=0.2mol,则生成C为0.2mol,B为固体,由化学计量数可知,反应前后气体物质的量不变,始终为1mol,则的平衡体积分数为;
(2)由(1)知,平衡时,c(A)=0.4mol/L,c(C)=0.1mol/L,则该温度下该反应的平衡常数为;该反应为放热反应,则随着反应温度升高,平衡逆向移动,该反应的平衡常数减小;
(3)保持温度不变,则平衡常数不变,设C的转化量为x mol/L,则可列出三段式(mol/L):,,解得x=0.8mol,则达平衡时,的转化率为。
21.8×10-3mol·min-1
解析:设2.0~6.0min内,HCl转化的物质的量为n,则:
解得n=7.2×10-3mol,则v(HCl)==1.8×10-3mol·min-1。
22.(1) 40% 90
(2)
(3)bc
(4) 加入催化剂
解析:(1)CO和可合成甲醇,反应为 ,恒温恒压条件下,向密闭容器1通入10 mol CO(g)和20 mol ,达平衡时,体系向环境放热360 kJ,向密闭容器Ⅱ中通入10 mol ,达平衡时,体系从环境吸热540 kJ,达到平衡时,两者等效,则10 mol CO(g)和20 mol 完全反应完放出900kJ的热量,而反应方程式是1 mol CO(g)和2 mol 完全反应完放出90kJ的热量,则容器Ⅰ中CO消耗的物质的量为,其平衡转化率为, 90kJ·mol;故答案为:40%; 90。
(2)一定温度下2.0 L密闭容器中,通入0.10 mol CO和0.20 mol ,压强为Pa,10 min时,达到平衡的压强为Pa,则气体物质的量为,,,解得x=0.05,该温度下的平衡常数;故答案为:。
(3)a.增加CO的浓度,平衡正向移动,消耗的量增大,总的量增大,总的量增大占主要,转化率降低,故a不符合题意;b.加入,平衡正向移动,CO消耗量增大,转化率增大,故b符合题意;c.分离出甲醇,平衡正向移动,CO消耗量增大,转化率增大,故c符合题意;d.加入催化剂,反应速率加快,平衡不移动,转化率不变,故d不符合题意;e.加入惰性气体,压强增大,但反应物浓度不变,速率不变,平衡不移动,转化率不变,故e不符合题意;f.升高温度,平衡逆向移动,CO转化率降低,故f不符合题意;综上所述,答案为:bc。
(4)Arrhenius经验公式为(为活化能,k为速率常数,R和C为常数),反应的实验数据如图中曲线m所示,则有,,两者相减得到该反应的活化能kJ·mol,改变外界条件实验数据如曲线n所示,纵坐标改变量相同时,则横坐标改变量增大,即活化能减小,因此可能改变的反应条件是加入催化剂;故答案为:;加入催化剂。
23.(1) ② ① K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响
(2)+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑
(3)3.0 4.0
(4)0.01 mol/(L min)
(5)反应生成的Mn2+起催化作用
(6)B
解析:(1)该可逆反应的本质是Fe3+与SCN-反应,对应离子方程式为:Fe3++3SCN-Fe(SCN)3,①由于K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响,②加入Fe粉,引发反应Fe+2Fe3+=3Fe2+,导致溶液中c(Fe3+)减小,平衡逆向移动,③加入FeCl3,引发反导致溶液中c(Fe3+)增大,平衡正向移动,故此题依次填:②;①;K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响;
(2)已知方程式中KMnO4、H2SO4、K2SO4、MnSO4可拆写成离子形式,删去K+、得该反应的离子方程式为:+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑;
(3)实验1可知总体积为(3.0+2.0+2.0+3.0) mL=10.0 mL,则实验2、3中总体积为10.0 mL,所以表中V1=10.0-7.0=3.0,V2=10.0-6.0=4.0;
(4)由实验1中数据可知,用KMnO4的浓度变化表示的反应速率为υ(KMnO4)==0.01 mol/(L min);
(5)该反应在溶液中进行,所以温度升高、浓度变大、加入催化剂会使反应速率加快,反应过程中反应物的浓度是不断减小的,所以一定不是浓度的影响,题目给的猜想是温度的影响,所以原因还可能是催化剂,而开始时反应速率小,不久后加快,说明催化剂是反应过程中生成的,所以速率加快的原因是反应生成的Mn2+起催化作用;
(6)因为猜想是Mn2+的催化作用,且不能再引入新的离子,所以可以在反应一开始时加入硫酸锰,所以选B
一、选择题
1.下列化工生产中,所采取的条件或操作不能用勒夏特列原理解释的是
A.工业制盐酸:向合成塔中通入过量氢气 B.合成氨:采用20-50MPa压强
C.工业制硫酸:向接触室中通入过量空气 D.联合制碱工业:向母液中加入食盐
2.科学家研究出一种新的催化剂能有效处理汽车尾气,其反应的化学方程式为 ,若反应在恒容密闭容器中进行,由该反应相关图像作出的判断正确的是
A.图甲中改变的反应条件为加入等量的NO和CO
B.图乙中纵坐标可代表NO的百分含量
C.图丙中纵坐标可代表CO的百分含量
D.图丁中a、b、c三点均已达到化学平衡状态
3.对可逆反应,下列叙述正确的是
A.达到化学平衡时
B.若单位时间内生成的同时,消耗,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
4.2SO2+O22SO3△H<0是工业上接触法制硫酸的重要反应。下列关于该反应的说法不正确的是
A.增加O2的浓度提高SO2的转化率
B.利用该反应放出的热量对SO2、O2预热
C.升高体系温度能提高SO3的平衡产率
D.即使增大压强也不能使SO2全部转化为SO3
5.对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法不正确的是
A.上述反应的平衡常数表达式K=
B.适当提高NH3的浓度,可以加快反应速率,提高NH3的转化率
C.1molN—H断裂同时有1molO—H断裂,说明达该条件下的平衡状态
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
6.反应,在不同情况下测得的反应速率,其中反应速率最慢的是
A. B.
C. D.
7.在不同条件下,按投料比进行反应: ,并测定实验数据。
一定条件下,CO2转化率为13.68%,CH3OH产率(甲醇的物质的量/起始CO2物质的量)为4.12%。
②一定压强下,相同时间,CH3OH产率随温度变化的数据图如下。
下列说法不正确的是
A.与①相同条件下,提高与的比例,可以提高的转化率
B.由①可推测,制取过程中无副反应发生
C.由②可推测,480~520K,温度升高,速率加快是产率升高的原因
D.由②可推测,温度升高产率降低的可能原因是平衡逆向移动
8.在一密闭容器中发生反应: ,达到平衡时采取下列措施,可以使正反应速率增大、D的物质的量浓度增大的是
A.移走少量C B.升高温度
C.缩小容器容积,增大压强 D.压强不变,充入稀有气体
9.已知2A(g) 3B(s)+C(g) ΔH<0, 假设ΔH和ΔS不随温度而改变,下列说法中正确的是
A.低温下能自发进行
B.高温下能自发进行
C.任何温度下都能自发进行
D.任何温度下都不能自发进行
10.下列说法正确的是
A.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH>0,该反应低温能自发进行
B.物质发生化学反应时不一定都伴随着能量变化
C.“一次性保暖贴”在发热过程中应用的是原电池原理
D.用惰性电极电解熔融氯化钠:2Cl-+2H2OCl2↑+H2↑+2OH-
11.下列说法正确的是
A.甲烷的燃烧热为,则甲烷燃烧热的热化学方程式可表示为:
B.醋酸和稀氢氧化钠溶液混合,其热化学方程式为:
C.已知: , , 。则
D.常温下,若反应不能自发进行,则该反应的
12.催化重整能够获得氢能,同时消除温室气体,催化重整过程中主要发生反应的热化学方程式如下:
反应①
反应②
反应③
常压下,将的混合气体置于密闭容器中,在不同温度下的重整体系中,平衡时各组分的物质的量分数如图所示。下列说法不正确的是
A.反应①是催化重整的主反应
B.反应②的
C.450-800℃间,反应②的进行程度大于反应③
D.为提高平衡时的产率,应研发更合适的催化剂
13.对于反应A(g) + 2B(g)=3C(g)+ 2D(g)来说,下列反应速率最快的是
A.v(A)=0.32mol/(L·min) B.v(B)=0.55 mol/(L·min)
C.v(C)=0.02 mol/(L·s) D.v(D)=0.01 mol/(L·s)
14.对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③ B.②③④⑥ C.②④ D.②④⑤
15.一定温度下,可通反应2NO2N2O4在固定体积的绝热密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolN2O4的同时生成2nmolNO2
②用NO2、N2O4表示的反应速率之比为2:1的状态
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥容器内温度不变
A.①③④⑥ B.②③④⑤ C.①③④⑤ D.②③⑤⑥
二、填空题
16.一定条件下,用或作催化剂对燃煤烟气回收。反应为。
(1)其他条件相同、催化剂不同,的转化率随反应温度的变化如图1,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是 。
(2)某科研小组用作催化剂,在时,分别研究了为1∶1、3∶1时转化率的变化情况(图2)。则图2中表示的变化曲线为 (填“a”或“b”)。
17.一定温度下,反应在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
(1)缩小体积使压强增大: ,原因是 。
(2)恒容充入: 。
(3)恒容充入: ,原因是 。
(4)恒压充入: 。
18.某温度下,在2L密闭容器中,x、y、z三种物质的物质的量随时间变化曲线如图所示,由图分析:
(1)该反应的化学方程式是 。
(2)3min末,用y的浓度变化表示的反应速率V(y)为 。
(3)反应是由 开始的反应。
A.正反应 B.逆反应 C.正、逆反应同时
19.300℃ 时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)2C(g)+2D(g) ,2min末反应达到平衡,生成0.8mol D。
(1)在2min末,A的平衡浓度为 ,B的转化率为 ;C的体积分数为 。
(2)300℃ 时,将该反应容器体积压缩为1L,则A的转化率 (填“增大”“减小”或"不变"),原因是 。若该条件下平衡常数为K3,则K3 (填“>”,"<"或“=”)K1,原因是 。
(3)判断该反应是否达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(A)不变 C.v(A)=v(C) D.混合气体密度不变
20.一定温度下,向恒容容器中充入和,发生反应,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
(1)前的平均反应速率 ,达平衡时的平衡体积分数为 。
(2)由表中数据计算该温度下该反应的平衡常数为 ,随着反应温度升高,该反应的平衡常数 (选填“增大”、“减小”或“不变”)。
(3)保持温度不变,起始时向容器中充入,达平衡时,的转化率为 。
21.O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中n(Cl2)的数据如下,则2.0~6.0min内以HCl的物质的量变化表示的反应速率为 (以mol·min-1为单位)。
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10-3mol 0 1.8 3.7 5.4 7.2
22.CO和可合成甲醇,反应为 。回答下列问题:
(1)恒温恒压条件下,向密闭容器1通入10 mol CO(g)和20 mol ,达平衡时,体系向环境放热360 kJ,向密闭容器Ⅱ中通入10 mol ,达平衡时,体系从环境吸热540 kJ,则容器Ⅰ中CO平衡转化率为 , kJ·mol。
(2)一定温度下2.0 L密闭容器中,通入0.10 mol CO和0.20 mol ,压强为Pa,10 min时,达到平衡的压强为Pa,该温度下的平衡常数 pa。
(3)恒温恒容条件下,要提高CO的转化率,可以采取的措施是 (填标号)。
a.增加CO的浓度 b.加入 c.分离出甲醇 d.加入催化剂 e.加入惰性气体 f.升高温度
(4)Arrhenius经验公式为(为活化能,k为速率常数,R和C为常数),反应的实验数据如图中曲线m所示。则该反应的活化能 kJ·mol,改变外界条件实验数据如曲线n所示,则可能改变的反应条件是 。
23.实验一:检验的存在,可向溶液中加入溶液,发生反应如下:
(1)改变下列条件能使该可逆反应发生平衡移动的是 。
①加入固体 ②加入粉 ③加入固体
上述条件不能使平衡发生移动的是 ,原因是 。
实验二:已知,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
实验编号 室温下,试管中所加试剂及其用量 室温下溶液颜色褪至无色所需时间
溶液 稀硫酸 溶液
1 3.0 2.0 2.0 3.0 1.5
2 2.0 3.0 2.0 2.7
3 1.0 2.0 3.0 3.9
(2)在硫酸酸化的与反应中,该反应的离子方程式为: 。
(3)表中 ,
(4)利用实验1中数据计算,若用的浓度变化表示的反应速率为: 。
(5)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色。反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是 的影响。
(6)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入___________。(填字母序号)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
【参考答案】
一、选择题
1.A
解析:A.氢气和氯气的反应不是可逆反应,不能用勒夏特列原理解释,故A符合题意;
B.生成氨气的反应为气体分子数减小的反应,增大压强利于平衡正向减小,利于氨气的生成,用勒夏特列原理解释,故B不符合题意;
C.向接触室中通入过量空气,促使二氧化硫和氧气反应转化为三氧化硫,能用勒夏特列原理解释,故C不符合题意;
D.联合制碱工业中向母液中加入食盐,提高氯离子浓度,利于氯化铵结晶析出,能用勒夏特列原理解释,故D不符合题意;
故选A。
2.D
解析:A.加入等量的NO和CO相当于增大压强,正逆反应速率都增大,平衡正向移动,速率是,故A错误;
B.按照先拐先平数值大,温度是T2>T1,反应是放热反应,温度升高平衡逆向移动,NO的百分含量应该增大,和图示不符合,故B错误;
C.按照先拐先平数值大,压强是p2>p1,压强大平衡应该是正向移动,CO含量应该减少,和图示不符合,故C错误;
D.abc三点都在平衡常数与温度关系的曲线上,都处于平衡状态,故D正确;
答案选D。
3.A
解析:A.4v正(O2)=5v逆(NO)时,说明正逆反应速率相等,反应达到平衡状态,故A正确;
B.单位时间内生成x mol NO的同时,消耗x mol NH3,都表示反应向正反应方向进行,不能说明反应达到平衡状态,故B错误;
C.增加容器体积,各气体的浓度都减小,正、逆反应速率都减小,故C错误;
D.达到化学平衡时,若升高温度,正、逆反应速率都增大,故D错误;
答案选A。
4.C
解析:A.增加O2的浓度,平衡正向移动,SO2的转化率增大,A正确;
B.该反应放热,利用放出的热量对SO2、O2预热,可增大反应速率,B正确;
C.正反应放热,升高温度平衡逆向移动,二氧化硫平衡产率下降,C错误;
D.该反应为可逆反应,反应物不可能完全转化,D正确;
故选C。
5.B
解析:A.由方程式可知,反应的平衡常数表达式K=,故A正确;
B.适当提高氨气的浓度,反应速率加快,平衡向正反应方向移动,但氨气的转化率减小,故B错误;
C.由方程式可知,1molN—H断裂同时有1molO—H断裂说明正逆反应速率相等,反应已达到平衡,故C正确;
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数,加快反应速率,故D正确;
故选B。
6.A
【分析】化学反应速率之比等于化学计量数之比,比较化学反应速率,需转化为同一种物质去比较,且单位相同,本题全部转化为A的反应速率去比较。
解析:A.;
B.;
C.;
D.;
所以反应速率最慢的是A;
答案选A。
7.B
解析:A.与①相同条件下,提高与的比例,即增大H2的用量,化学平衡正向移动, 的转化率增大,H2的转化率减小,A正确;
B.由①可推测,一定条件下,转化率为13.68%,产率(甲醇的物质的量/起始物质的量)为4.12%,根据碳原子守恒可知,制取过程中有副反应发生,B错误;
C.由图示信息可知, 480~520K,温度升高,相同时间内的CH3OH产率升高,主要是由于速率的加快,C正确;
D.由题干信息可知, 正反应是一个放热反应,则由②可推测,温度升高产率降低的可能原因是平衡逆向移动,D正确;
故答案为:B。
8.C
解析:A.C是固体,移走少量C,C的浓度不变,正反应速率不变,平衡不移动,D的物质的量浓度不变,故不选A;
B.正反应放热,升高温度,平衡逆向移动,D的物质的量浓度减小,故不选B;
C.正反应气体系数和减小,缩小容器容积,增大压强,平衡正向移动,反应物浓度增大,反应速率加快,故选C;
D.压强不变,充入稀有气体,容器体积增大,相当于减压,正反应速率减小,平衡逆向移动,D的物质的量浓度减小,故不选D;
选C。
9.A
解析:2A(g) 3B(s)+C(g) ΔH<0,正反应是气体体积减小的放热反应,ΔS<0,要使△H-T △S<0,则T为低温,所以该反应在低温下能自发进行,故选:A。
10.C
解析:A.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH>0,ΔS>0,ΔG=ΔH-TΔS<0可以自发进行,该反应高温能自发进行,A错误;
B.物质发生化学反应时一定都伴随着能量变化,B错误;
C.“一次性保暖贴”在发热过程中应用的是原电池原理,负极为:Fe-2e-=Fe2+,C正确;
D.熔融氯化钠中没有水,用惰性电极电解熔融氯化钠:2Cl-+2Na+Cl2↑+2Na,D错误;
答案选C。
11.D
解析:A.燃烧热是生成稳定氧化物,故应该是生成液体水而不是气态水,A错误;
B.醋酸是弱酸,反应中以分子形式参与反应,B错误;
C.碳单质燃烧放热,因为 ,则金刚石燃烧放热更多,焓变数值更小,C错误;
D.该反应为熵增反应,不能自发进行,则该反应的,D正确。
故选D。
12.D
解析:A.随温度升高,CO、H2的物质的量分数变化趋势基本相同,可知反应①是催化重整的主反应,故A正确;
B.反应②,反应②能自主发生,,可知反应②的,故B正确;
C.反应①中CO、H2是反应产物,且物质的量比1:1,CO是反应②的产物,氢气是反应②的反应物,氢气是反应③的生成物,450-800℃间,CO的量始终大于氢气,反应②消耗氢气的量大于反应③生成氢气的量,所以反应②的进行程度大于反应③,故C正确;
D.催化剂不能使平衡移动,选用更合适的催化剂不能提高平衡时的产率,故D错误;
选D。
13.C
【分析】同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,可根据速率之比是相应的化学计量数之比先换算成用同一种物质(固体及纯液体除外)表示,然后比较速率数值,注意换算时单位要统一。
解析:A.v(A)=0.32mol/(L·min)
B.;
C. ;
D.;
综上所述反应速率最快的是C;
故选C。
14.D
解析:①反应有气体参加,则扩大容器的容积,速率减小,故不选;
②使用催化剂,降低反应需要的活化能,反应速率加快,故选;
③增加反应物的物质的量,若为固体,浓度不变,反应速率不变,故不选;
④升高温度,反应速率加快,故选;
⑤缩小容积,则浓度增大,反应速率加快,故选;
⑥增大容器内的压强,若恒容充入稀有气体,反应速率不变,故不选;
故答案选D。
【点睛】本题考查影响化学反应速率的因素,为高频考点,把握影响反应速率的因素为解答的关键,侧重常见外因对反应速率影响的考查,注意①反应为有气体参加的反应,扩大容器容积会使反应速率减小。②若反应物为固体,则增加反应物的物质的量时浓度不变。
15.A
解析:①单位时间内生成nmolN2O4是正反应速率,同时生成2nmolNO2是逆反应速率,且N2O4 与NO2的系数比为1:2,故反应正、逆反应速率相等,达到平衡,①符合题意;
②用NO2、N2O4表示的反应速率之比为2:1的状态,未指明正、逆反应速率,无法判断达到平衡,②不合题意;
③混合气体的平均相对分子质量等于气体的总质量除以总的物质的量,该反应中气体的总质量不变,总物质的量一直在改变,故混合气体的平均相对分子质量不再改变的状态,说明达到平衡,③符合题意;
④反应中NO2为红棕色气体,N2O4为无色气体,故混合气体的颜色不再改变的状态,说明达到平衡,④符合题意;
⑤混合气体的密度等于气体的总质量除以容器的体积,故密度一直未改变,故混合气体的密度不再改变的状态,不能说明达到平衡,⑤不合题意;
⑥由于该容器是一个绝热容器,故容器内温度不变,能说明达到平衡,⑥符合题意;
综上所述可知,①③④⑥符合题意,故答案为:A。
二、填空题
16.(1)作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源
(2)a
解析:(1)根据图1可知,和作催化剂均能使的转化率达到最高,不考虑催化剂价格因素,选择的主要优点是作催化剂时,在相对较低温度可获得较高的转化率,从而节约能源。
(2)在其他条件不变时,增大的浓度,可以提高的平衡转化率。由图2可知转化率:,所以曲线a表示的变化曲线,曲线b表示的变化曲线。
17.(1) 增大 单位体积内,活化分子数目增加,有效碰撞的次数增多
(2)增大
(3)不变 单位体积内活化分子数不变
(4)减小
解析:(1)缩小容器体积可使参加反应的物质的浓度增大,单位体积内活化分子数目增加,有效碰撞的次数增多,化学反应速率增大;
(2)恒容条件下充入N2,增大了N2的浓度,化学反应速率增大;
(3)恒容条件下充入He,没有改变反应物和生成物的浓度,单位体积内活化分子数不变,化学反应速率不变;
(4)恒压条件下充入He,容器体积增大,反应物和生成物的浓度减小,化学反应速率减小。
18.x+3y2z 0.25mol/(L·min) C
【分析】根据反应物减少,生成物增加,分析该反应,且根据该变量的比等于化学计量数比分析。
解析:(1)反应到3分钟时,x减少了4-3.5=0.5mol,y减小了4-2.5=1.5mol,所以x、y为反应物,z增加了2.0-1.0=1.0mol,z为生成物,根据物质的量的变化量比等于化学计量数比分析,该反应的化学方程式是x+3y2z。
(2)3min末,用y的浓度变化表示的反应速率V(y)为=0.25mol/(L·min)。
(3)起始反应物和生成物都有,所以反应是由正、逆反应同时开始的反应。
19.4mol/L 20% 20% 不变 反应前后气体体积不变,压强不影响平衡移动 = 平衡常数只受温度影响,温度相同,则平衡常数相同 B
【分析】
根据题意列三段式有:
,据此分析。
解析:(1)2minΔn(D)=0.8mol,根据方程式可知Δn(A)=1.2mol,所以平衡时n(A)=2mol-1.2mol=0.8mol,容器体积为2L,则c(A)=0.4mol/L;Δn(B)=0.4mol,则=20%;n(C)=0.8mol,则C的体积分数为=20%;
(2)该反应前后气体系数之和相等,所以压强对平衡没有影响,则将该反应容器体积压缩为1L,平衡不移动,A的转化率不变;平衡常数只与温度有关,温度不变则平衡常数不变,所以K3=K1;
(3)A.该反应前后气体系数之和相等,所以无论是否平衡,压强均不发生变化,压强不变不能说明反应平衡,故A不符合题意;
B.平衡时正逆反应速率相等,各物质的浓度不再改变,所以A的浓度不变可以说明反应平衡,故B符合题意;
C.平衡时v正(A)=v逆(A),2v逆(A)=3v逆(C),选项既没有注明正逆,比例关系也不对,所以不能说明反应平衡,故C不符合题意;
D.该反应中反应物和生成物均为气体,所以气体的质量不变,容器恒容则体积不变,所以无论是否平衡密度都不变,故D不符合题意;
综上所述答案为B。
20. 减小
解析:(1)前,消耗A的物质的量为1mol-0.85mol=0.15mol,则平均反应速率;由表格数据可知,达平衡时,A剩余0.8mol,消耗A的物质的量为1mol-0.8mol=0.2mol,则生成C为0.2mol,B为固体,由化学计量数可知,反应前后气体物质的量不变,始终为1mol,则的平衡体积分数为;
(2)由(1)知,平衡时,c(A)=0.4mol/L,c(C)=0.1mol/L,则该温度下该反应的平衡常数为;该反应为放热反应,则随着反应温度升高,平衡逆向移动,该反应的平衡常数减小;
(3)保持温度不变,则平衡常数不变,设C的转化量为x mol/L,则可列出三段式(mol/L):,,解得x=0.8mol,则达平衡时,的转化率为。
21.8×10-3mol·min-1
解析:设2.0~6.0min内,HCl转化的物质的量为n,则:
解得n=7.2×10-3mol,则v(HCl)==1.8×10-3mol·min-1。
22.(1) 40% 90
(2)
(3)bc
(4) 加入催化剂
解析:(1)CO和可合成甲醇,反应为 ,恒温恒压条件下,向密闭容器1通入10 mol CO(g)和20 mol ,达平衡时,体系向环境放热360 kJ,向密闭容器Ⅱ中通入10 mol ,达平衡时,体系从环境吸热540 kJ,达到平衡时,两者等效,则10 mol CO(g)和20 mol 完全反应完放出900kJ的热量,而反应方程式是1 mol CO(g)和2 mol 完全反应完放出90kJ的热量,则容器Ⅰ中CO消耗的物质的量为,其平衡转化率为, 90kJ·mol;故答案为:40%; 90。
(2)一定温度下2.0 L密闭容器中,通入0.10 mol CO和0.20 mol ,压强为Pa,10 min时,达到平衡的压强为Pa,则气体物质的量为,,,解得x=0.05,该温度下的平衡常数;故答案为:。
(3)a.增加CO的浓度,平衡正向移动,消耗的量增大,总的量增大,总的量增大占主要,转化率降低,故a不符合题意;b.加入,平衡正向移动,CO消耗量增大,转化率增大,故b符合题意;c.分离出甲醇,平衡正向移动,CO消耗量增大,转化率增大,故c符合题意;d.加入催化剂,反应速率加快,平衡不移动,转化率不变,故d不符合题意;e.加入惰性气体,压强增大,但反应物浓度不变,速率不变,平衡不移动,转化率不变,故e不符合题意;f.升高温度,平衡逆向移动,CO转化率降低,故f不符合题意;综上所述,答案为:bc。
(4)Arrhenius经验公式为(为活化能,k为速率常数,R和C为常数),反应的实验数据如图中曲线m所示,则有,,两者相减得到该反应的活化能kJ·mol,改变外界条件实验数据如曲线n所示,纵坐标改变量相同时,则横坐标改变量增大,即活化能减小,因此可能改变的反应条件是加入催化剂;故答案为:;加入催化剂。
23.(1) ② ① K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响
(2)+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑
(3)3.0 4.0
(4)0.01 mol/(L min)
(5)反应生成的Mn2+起催化作用
(6)B
解析:(1)该可逆反应的本质是Fe3+与SCN-反应,对应离子方程式为:Fe3++3SCN-Fe(SCN)3,①由于K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响,②加入Fe粉,引发反应Fe+2Fe3+=3Fe2+,导致溶液中c(Fe3+)减小,平衡逆向移动,③加入FeCl3,引发反导致溶液中c(Fe3+)增大,平衡正向移动,故此题依次填:②;①;K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响;
(2)已知方程式中KMnO4、H2SO4、K2SO4、MnSO4可拆写成离子形式,删去K+、得该反应的离子方程式为:+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑;
(3)实验1可知总体积为(3.0+2.0+2.0+3.0) mL=10.0 mL,则实验2、3中总体积为10.0 mL,所以表中V1=10.0-7.0=3.0,V2=10.0-6.0=4.0;
(4)由实验1中数据可知,用KMnO4的浓度变化表示的反应速率为υ(KMnO4)==0.01 mol/(L min);
(5)该反应在溶液中进行,所以温度升高、浓度变大、加入催化剂会使反应速率加快,反应过程中反应物的浓度是不断减小的,所以一定不是浓度的影响,题目给的猜想是温度的影响,所以原因还可能是催化剂,而开始时反应速率小,不久后加快,说明催化剂是反应过程中生成的,所以速率加快的原因是反应生成的Mn2+起催化作用;
(6)因为猜想是Mn2+的催化作用,且不能再引入新的离子,所以可以在反应一开始时加入硫酸锰,所以选B
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
