1.1物质极其反应的分类课堂同步练(含解析)-苏教版高中化学必修第一册
文档属性
| 名称 | 1.1物质极其反应的分类课堂同步练(含解析)-苏教版高中化学必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 756.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 14:53:36 | ||
图片预览




文档简介
1.1物质极其反应的分类课堂同步练-苏教版高中化学必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.改变反应物用量,下列反应能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应;
②Si与烧碱溶液反应;
③H2S与NaOH溶液反应;
④Fe与稀硝酸反应;
⑤S在O2中燃烧;
⑥N2与O2的反应。
A.②⑤⑥ B.①②⑤ C.①③④ D.③④⑥
2.中华文明源远流长,现代科技也迅猛发展。下列有关我国文明和科技的说法中不涉及化学变化的是
A.青铜器皿除锈 B.节日燃放烟花 C.利用核反应发电 D.制造“蛟龙”号潜水器
A.A B.B C.C D.D
3.下列各组物质按照单质、化合物、混合物顺序排列的是
A.石墨、Fe(OH)3胶体、澄清石灰水 B.氮气、干冰、冰水混合物
C.液态氧、CuSO4·5H2O、浓盐酸 D.硫粉、碘酒、含氧40%的氧化镁
4.下列物质属于纯净物的是
A.蒸馏水 B.氯水 C.海水 D.氨水
5.下列有关物质分类不正确的是
A.KNO3是钾盐、硝酸盐,也是正盐
B.铝土矿、水玻璃、碱石灰都是混合物
C.有机玻璃、氮化硅都是有机高分子材料
D.BaSO4、Na3AlF6、NH4F都是强电解质
6.下列物质属于纯净物的是
A.玻璃 B.蒸馏水 C.漂白粉 D.空气
7.下列物质归类正确的是
A.电解质:小苏打、蔗糖
B.化合物:浓硫酸、干冰
C.混合物:磁性氧化铁、“84”消毒液
D.胶体:豆浆、血液
8.下列各组物质的溶液,不能发生复分解反应的是 ( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4
C.AgNO3和BaCl2 D.KCl和CuSO4
9.甲、乙、丙、丁、戊是中学常见的无机物,其中甲为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲为常见金属单质,乙为常见非金属氧化物,且二者发生置换反应,则丙一定是碱性氧化物
10.金味营养麦片含有多种成分,其中属于无机物是。
A.玉米 B.大豆粉 C.碳酸钠 D.白砂糖
二、填空题
11.有A、B、C、D四种物质,暗紫色的固体A受热会产生一种使带火星的木条复燃的气体B,暗红色固体C在B中燃烧,产生大量白烟,生成产物D。
写出各物质的化学式:A ,D 。
12.现有下列5种物质,根据要求将对应物质的序号字母填入相应空格内。
A. B. C. D. E.
(1)属于单质的是 ,属于氧化物的是 ,属于盐的是 。
(2)能与氢氧化钠()发生中和反应的是 。
(3)实验室常用 的水溶液检验气体。
13.对下列物质分类,并完善表格内容
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
物质 分类依据 物质类型 实例
酸 根据酸根离子是否含有氧元素 含氧酸
无氧酸
根据一定条件下能电离出的数目 一元酸
二元酸
三元酸
根据电离程度 强酸
弱酸
根据沸点高低 高沸点酸
低沸点酸
盐 根据生成盐时酸、碱中和反应进行的程度 正盐
酸式盐
碱式盐
根据生成盐的酸或碱的强弱 强酸强碱盐
强酸弱碱盐
弱酸强碱盐
根据溶解性 易溶性盐
难溶性盐
14.非金属氧化物一定是酸性氧化物。 ;理由是
15.回答下列问题:
(1)现有以下物质:①NaOH固体②盐酸③固体④熔融⑤蔗糖⑥铜⑦⑧液态的,以上物质中能导电的是 ;(填序号,下同);以上物质中属于电解质的是 。
(2)CaO、、、CuO四种物质中有一种物质的类别与其它三种不同,它是 (填化学式);它与水反应生成的化合物是 (从“强电解质、弱电解质、非电解质”中选择填入)。
16.按要求对以下常见物质进行分类:铁红、胆矾、氢氧化钾、醋酸、酒精、金刚石.请按要求写出有关物质的化学式.
(1)属于单质的是 ;属于盐的是 ;属于酸的是 。
(2)Fe2O3俗称铁红,氧化物类型属于 。将其加入适量盐酸,反应的化学方程式: 。
17.无机化合物可根据其组成和性质进行分类。
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
物质类别 酸 碱 盐 氧化物
化学式 ①HCl ② ③ ④Ba(OH)2 ⑤Na2CO3 ⑥ ⑦CO2 ⑧Na2O
(2)写出⑦转化为⑤的化学方程式: 。
(3)实验室制备⑦常用 和 反应,检验该气体的方法是 。
18.现有下列10种物质:①冰水混合物、②空气、③Mg、④CaO、⑤H2SO4、⑥Ca(OH)2、⑦CuSO4·H2O、⑧液氧、⑨NaHCO3.其中,属于混合物的是 (填序号,下同)属于氧化物的是 ;属于酸的是 ;属于碱的是 ;属于盐的是 ;属于单质的是 。
19.营养强化剂
(1)作用:食品中加入营养强化剂是为了 食品中缺乏的营养成分或 。
(2)种类
①食盐中加 。 ②酱油中加 。
③粮食制品中加 。 ④食品中加 或钙、硒、锗等。
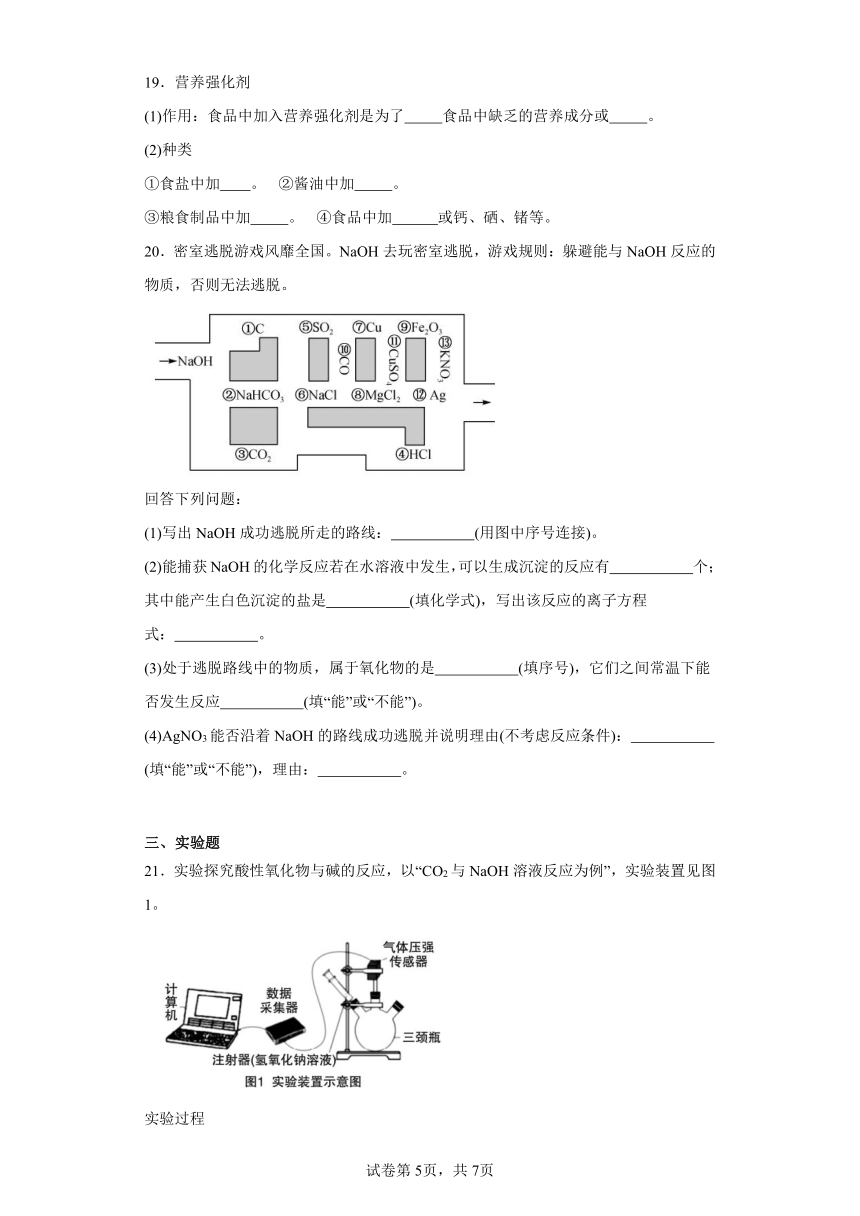
20.密室逃脱游戏风靡全国。NaOH去玩密室逃脱,游戏规则:躲避能与NaOH反应的物质,否则无法逃脱。
回答下列问题:
(1)写出NaOH成功逃脱所走的路线: (用图中序号连接)。
(2)能捕获NaOH的化学反应若在水溶液中发生,可以生成沉淀的反应有 个;其中能产生白色沉淀的盐是 (填化学式),写出该反应的离子方程式: 。
(3)处于逃脱路线中的物质,属于氧化物的是 (填序号),它们之间常温下能否发生反应 (填“能”或“不能”)。
(4)AgNO3能否沿着NaOH的路线成功逃脱并说明理由(不考虑反应条件): (填“能”或“不能”),理由: 。
三、实验题
21.实验探究酸性氧化物与碱的反应,以“CO2与NaOH溶液反应为例”,实验装置见图1。
实验过程
【方案1】CO2溶于水
①用三颈烧瓶收集满CO2。
②用注射器取4mL蒸馏水注入三颈烧瓶。
③通过气体压强传感器获得三颈烧瓶内气体的压强变化如图2中所示曲线。
【方案2】CO2与NaOH溶液反应
用NaOH溶液替换蒸馏水,重复上述方案1中的步骤,观察到三颈烧瓶内压强如图2中所示曲线。
根据上述实验,请回答下列问题:
(1)CO2与足量NaOH溶液反应的化学方程式: 。
(2)CO2溶于水的压强变化曲线: (写编号)。
(3)曲线②先升高后下降的原因: 。
22.对牙膏的探究要用到许多化学知识。
(1)下表列出了两种牙膏中的摩擦剂,请在表中填写两种摩擦剂所属的物质类别。
牙膏 A牙膏 B牙膏
摩擦剂 碳酸钙 二氧化硅
摩擦剂的物质类别
(2)根据你的推测,牙膏摩擦剂的溶解性是 (填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。甲同学设计了一种实验室制备碳酸钙的实验方案,其流程图为:
请写出上述方案中步骤3的化学方程式: 。
(4)乙同学的实验方案如图,其优点为 。
23.下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器,某化学小组的同学利用其进行下列化学实验。
试回答下列问题:
(1)以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求设计实验装置,连接仪器,检查装置的气密性,进行实验。(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为 (从左到右填写仪器序号字母)。
②上述制二氧化碳的化学方程式为 。
(2)该小组的同学用一氧化碳气体(含少量水蒸气、二氧化碳)测定某铜粉和氧化铜混合物中的元素组成。所选仪器按“不纯一氧化碳气体→B→E→C”的顺序连接,检查装置的气密性,然后进行实验。实验结束后,同学们记录的实验数据如下表所示(假设发生的化学反应都充分反应;)。
测量物质 B中浓硫酸 E中玻璃管内固体 C中氢氧化钠溶液
反应前质量/g 120.0 10.0 100.0
反应后质量/g 120.2 9.2 104.4
①该铜粉和氧化铜的混合物中氧化铜的质量为 g。
②从环保角度考虑,该套实验装置还存在明显的不足之处,你的改进建议是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】①CO2少量时,发生反应:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓;CO2过量时发生反应:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,所以不能用同一方程式表示,故不选;
②Si与烧碱溶液反应生成硅酸钠和氢气,与反应物用量无关,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,可以用同一方程式表示,故选;
③NaOH少量时,发生反应:H2S+NaOH=NaHS+H2O,NaOH过量时发生反应:H2S+2NaOH=Na2S+2H2O,所以不能用同一方程式表示,故不选;
④Fe与稀硝酸反应,Fe不足生成Fe3+,离子方程式为:4H++NO3-+Fe=Fe3++NO↑+2H2O;Fe过量生成Fe2+,离子方程式为:8H++2NO3-+3Fe=3Fe2++2NO↑+4H2O,所以不能用同一个离子方程式来表示,故不选;
⑤S在O2中燃烧,不论氧气过量还是少量都生成二氧化硫,故能用同一个化学方程式来表示,故选;
⑥N2与O2的在放电的条件下反应生成一氧化氮,与量无关,故能用同一个化学方程式来表示,故选;
故②⑤⑥符合。答案选A。
2.C
【详解】A.青铜器皿除锈过程中生成新物质,是化学变化,A错误;
B.燃放烟花涉及燃烧,生成新物质,是化学变化,B错误;
C.核反应属于核变化,核变化不是化学变化,C正确;
D.制造“蛟龙”号潜水器涉及新材料的制造,是化学变化,D错误;
故选D。
3.C
【详解】A.Fe(OH)3胶体属于混合物,不属于化合物,A错误;
B.冰水混合物属于纯净物,不属于混合物,B错误;
C.液态氧、CuSO4·5H2O、浓盐酸分别属于单质、化合物、混合物,C正确;
D.碘酒属于混合物,含氧40%的氧化镁属于纯净物,D错误;
故选C。
4.A
【详解】A.蒸馏水只含有水分子,只有一种物质,属于纯净物,故A正确;
B.氯水是将氯气通入水中,含有氯化氢,次氯酸等多种物质,属于混合物,故B错误;
C.海水中含有水分子,无机盐等多种物质,属于混合物,故C错误;
D.氨水是将氨气通入水中,含有一水合氨,水分子等多种物质,属于混合物,故D错误;
故选A。
5.C
【详解】A.KNO3含有钾元素、硝酸根,所以是钾盐、硝酸盐,也是正盐,故A正确;
B.铝土矿含有氧化铝、氧化铁、二氧化硅等物质;水玻璃是硅酸钠的水溶液;碱石灰是氧化钙和氢氧化钠的混合物,都是混合物,故B正确;
C.氮化硅不含碳元素,不属于有机材料,故C错误;
D.BaSO4、Na3AlF6、NH4F能完全电离,都是强电解质,故D正确。
6.B
【详解】A.玻璃是由纯碱、石灰石、和石英经混合粉碎熔融制得的,主要成分是硅酸钠,属于混合物,错误;
B.蒸馏水的成分就是水,是纯净物,正确;
C.漂白粉是氯化钙、次氯酸钙的混合物,错误;
D.空气是氮气、氧气、二氧化碳、水蒸气以及少量稀有气体的混合物,错误,
答案选B。
7.D
【详解】A.蔗糖的水溶液不导电,蔗糖属于非电解质,A错误;
B.浓硫酸属于混合物,不是化合物,B错误;
C.磁性氧化铁为四氧化三铁,为纯净物,C错误;
D.豆浆、血液均为胶体,D正确。
故答案选D。
8.D
【详解】A. HCl和Ca(OH)2可以发生复分解反应:Ca(OH)2+2HCl= CaCl2 +2H2O,不选A;
B. Na2CO3和H2SO4可以发生复分解反应:Na2CO3+ H2SO4= Na2SO4+ CO2↑+ H2O,不选B;
C. AgNO3和BaCl2可以发生复分解反应:2AgNO3+ BaCl2=Ba(NO3)2+2AgCl↓,不选C;
D. KCl和CuSO4不反应,选D;
答案为D。
9.D
【详解】A.甲为单质,既能与盐酸反应又能与NaOH溶液反应,则甲为Al,乙为氧气,二者反应生成丙为氧化铝,氧化铝属于两性氧化物,A正确;
B.若甲、丙、戊含有同一种元素,当甲为S,乙为O2,丙为SO2,丁为HClO等具有强氧化性的物质,戊为H2SO4,则含S元素的化合价由低到高的顺序为:甲<丙<戊,B正确;
C.丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则丙为HCl,丁为NH3,二者混合产生的白烟物质是NH4Cl,若乙为Cl2,其水溶液中含有HClO,具有漂白作用,C正确;
D.若甲为常见金属单质,乙为常见非金属氧化物,且二者发生置换反应,可能是Fe与H2O在高温下反应产生Fe3O4、H2,Fe3O4是氧化物,而不是碱性氧化物,D错误;
故合理选项是D。
10.C
【分析】有机物是指含有碳元素的化合物.无机物是指不含有碳元素的化合物;一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物。
【详解】A.玉米粉的主要成分是淀粉,属于有机物,A错误;
B.大豆粉的主要成分是蛋白质,属于有机物,B错误;
C.碳酸钠为盐属于无机物,C正确;
D.白砂糖的主要成分是蔗糖,属于有机物,D错误。
故选C。
11. KMnO4 P2O5
【详解】暗紫色的固体A受热会产生一种使带火星的木条复燃的气体B,说明B能支持燃烧,B为氧气,紫色固体A分解产生氧气,则A应为高锰酸钾;暗红色固体C为红磷,红磷在氧气燃烧产生的白色固体为五氧化二磷,故答案为:KMnO4;P2O5。
12. A B E C D
【详解】(1)由一种元素组成的纯净物属于单质,所以Na属于单质,故选A;由两种元素组成,其中一种元素是氧元素的化合物属于氧化物,所以SiO2是氧化物,故选B;由金属与酸根构成的化合物属于盐,所以NH4Cl是盐,故选E。答案为:A;B;E;
(2)能与氢氧化钠()发生中和反应的物质是酸,H2SO4是酸,故选C。答案为:C;
(3)实验室常用于检验气体的试剂是澄清石灰水,故选D。答案为:D。
13. ②③⑤ ①④⑥ ①②⑥ ③④ ⑤ ①②③ ④⑤⑥ ③⑤ ①②④⑥ ⑦⑩ ⑧ ⑨ ⑦ ⑩ ⑧ ⑧⑩ ⑦⑨
【详解】电离出的阳离子全部为氢离子的化合物属于酸,故属于酸的物质有:① ② ③ ④ ⑤ ⑥;
根据酸根离子是否含有氧元素可以将酸分为两类,含氧酸:②③⑤;无氧酸:①④⑥;
根据一定条件下能电离出的数目,可以将酸分为:一元酸:①②⑥;二元酸:③④;三元酸:⑤;
根据电离程度可以将酸分为两类,强酸:①②③;弱酸:④⑤⑥;
根据沸点高低,可以将酸分为两类,高沸点酸:③⑤;低沸点酸:①②④⑥;
阳离子含有金属阳离子或铵根离子的化合物属于盐,属于盐的物质有:⑦ ⑧ ⑨ ⑩;
根据生成盐时酸、碱中和反应进行的程度,可以将盐分为:正盐:⑦⑩;酸式盐:⑧;碱式盐:⑨;
根据生成盐的酸或碱的强弱,可以将盐分为:强酸强碱盐:⑦;强酸弱碱盐:⑩;弱酸强碱盐:⑧;
根据溶解性,可以将盐分为:易溶性盐:⑧⑩;难溶性盐:⑦⑨。
14. 错误 CO、NO是不成盐氧化物
【详解】非金属氧化物不一定是酸性氧化物,如CO、NO是不成盐氧化物。
15.(1) ②④⑥ ①③④⑧
(2) 弱电解质
【解析】(1)
②盐酸、④熔融KCl、⑥铜中存在自由移动的离子或电子,它们能够导电;①NaOH固体、③CaCO3固体、④熔融 KCl、⑧液态的在水溶液里或熔融状态下能导电,并且属于化合物,属于电解质;
(2)
CaO、、、CuO三种物质都是金属氧化物,是非金属氧化物;与水反应生成碳酸,碳酸能够部分电离出阴阳离子,属于弱电解质。
16. 金刚石 胆矾 醋酸 碱性氧化物 Fe2O3+6HCl═2FeCl3+3H2O
【分析】单质是由同种元素组成的纯净物,酸是指在水溶液中电离时生成的阳离子全部是氢离子的化合物,碱是指在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,氧化物是由两种元素组成的化合物,其中一种是氧元素,盐是在水溶液中电离出金属离子或铵根离子和酸根离子的化合物。
【详解】铁红的主要成分是氧化铁,属于碱性氧化物;
胆矾的主要成分是五水硫酸铜,在水溶液中电离出铜离子和硫酸根离子,属于盐;
氢氧化钾在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,属于碱;
醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸;
金刚石是由碳元素组成的非金属单质;
(1)金刚石是由碳元素组成的非金属单质,则属于单质的是金刚石;胆矾在水溶液中电离出铜离子和硫酸根离子,属于盐,则属于盐的是胆矾;醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸,则属于酸的是醋酸,故答案为金刚石;胆矾;醋酸;
(2)氧化铁与盐酸反应生成氯化铁和水,属于碱性氧化物,反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,故答案为碱性氧化物;Fe2O3+6HCl═2FeCl3+3H2O。
17. H2SO4(或HNO3等) NaOH(或KOH等) Na2SO4(或K2CO3或Na2SO3或NaNO3等) 2NaOH+CO2 =Na2CO3+H2O 稀盐酸 碳酸钙 将气体通入澄清石灰水中,若变浑浊,即证明是CO2
【详解】(1)酸可以填写H2S、H2SO4、HNO3、H2CO3等,碱可以填写KOH或NaOH等;盐可填写K2CO3、Na2SO4、NaNO3、KNO3、K2SO4等。故答案为:H2SO4(或HNO3等);NaOH(或KOH等);Na2SO4(或K2CO3或Na2SO3或NaNO3等);
(2)CO2是酸性氧化物,可与NaOH反应生成Na2CO3和H2O,⑦转化为⑤的化学方程式:2NaOH+CO2 =Na2CO3+H2O。故答案为:2NaOH+CO2 =Na2CO3+H2O;
(3)实验室常用CaCO3和稀盐酸反应制取CO2,产生的CO2气体可用澄清石灰水来检验。故答案为:稀盐酸;碳酸钙;将气体通入澄清石灰水中,若变浑浊,即证明是CO2。
18. ② ①④ ⑤ ⑥ ⑦⑨ ③⑧
【分析】①冰水混合物的主要成分是水,属于纯净物,水是非金属氧化物;
②空气主要成分有氧气、氮气、二氧化碳等,属于混合物;
③Mg是金属单质,属于纯净物;
④CaO是金属氧化物,属于纯净物;
⑤H2SO4是酸,属于纯净物;
⑥Ca(OH)2是碱,属于纯净物;
⑦CuSO4·H2O是带有结晶水的盐,属于纯净物;
⑧液氧是液态氧气,是非金属单质,属于纯净物;
⑨NaHCO3.是盐,属于纯净物。
【详解】由分析可知,属于混合物的是②,属于氧化物的是①④,属于酸的是⑤,属于碱的是⑥,属于盐的是⑦⑨,属于单质的是③⑧,故答案为:②;①④;⑤;⑥;⑦⑨;③⑧。
19.(1) 补充 微量元素
(2) 碘 铁 赖氨酸 维生素
【详解】(1)食品中加入营养强化剂是为了补充食品中缺乏的营养成分或微量元素;
(2)①食盐中加碘,防止缺碘。
②酱油中加铁,预防缺铁性贫血。
③粮食制品中加赖氨酸。
④食品中加维生素或钙、硒、锗等。
20.(1)①→⑥→⑩→⑦→⑨→
(2) 2 MgCl2
(3) ⑨⑩ 不能
(4) 不能 因为AgNO3遇到NaCl、Cu等物质会反生反应
【分析】(1)
躲避与氢氧化钠反应的物质,所以逃脱路线中的物质不能与氢氧化钠反应,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,故不能选择②,氢氧化钠与二氧化碳发生反应生成碳酸钠和水,故不能选择③,氢氧化钠不与碳单质反应,故可以选择①;氢氧化钠与二氧化硫发生反应生成亚硫酸钠和水,故不能选择路线⑤,氢氧化钠不与氯化钠发生反应,故可以选择路线⑥;氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,而与一氧化碳不反应,故不能选择路线⑧,可以选择路线⑩;氢氧化钠与铜单质不反应,故可以选择路线⑦;氢氧化钠会与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,故不能选择路线 ,因其不与三氧化二铁和硝酸钾发生反应,故可以选择路线⑨和 ,故答案为:①→⑥→⑩→⑦→⑨→
(2)
氢氧化钠溶液与氯化镁溶液、硫酸铜溶液发生反应会生成沉淀,反应的化学方程式分别为:、,其中氢氧化镁为白色沉淀,氢氧化铜为蓝色沉淀,所以能捕获NaOH的化学反应若在水溶液中发生,可以生成沉淀的反应有2个,其中能产生白色沉淀的盐是氯化镁,故答案为:2;MgCl2;
(3)
由两种元素组成,其中一种元素是氧元素的化合物叫做氧化物,处于逃脱路线中的物质,属于氧化物的是一氧化碳和三氧化二铁,一氧化碳和三氧化二铁在高温下能发生反应,常温下不能,故答案为:⑨⑩;不能
(4)
AgNO3会与路线中的NaCl、Cu等物质发生反应,所以其不能沿着NaOH的路线成功逃脱,故答案为:不能;因为AgNO3遇到NaCl、Cu等物质会反生反应
21.(1)2NaOH+CO2=Na2CO3+H2O
(2)①
(3)注射器中4mLNaOH溶液注入三颈烧瓶中,溶液增加的体积大于二氧化碳被吸收的体积,三颈烧瓶内的压强增大,曲线上升;随后氢氧化钠溶液吸收大量的二氧化碳,压强下降,曲线下降
【解析】(1)
CO2与足量NaOH溶液反应生成碳酸钠和水,反应的化学方程式是2NaOH+CO2=Na2CO3+H2O;
(2)
用注射器取4mL蒸馏水注入三颈烧瓶,烧瓶内气体体积缩小,压强增大,后有少量CO2溶于水,气体压强略微下降,所以CO2溶于水的压强变化曲线是①;
(3)
注射器中4mLNaOH溶液注入三颈烧瓶中,溶液增加的体积大于二氧化碳被吸收的体积,三颈烧瓶内的压强增大,曲线上升;随后氢氧化钠溶液吸收大量的二氧化碳,压强下降,曲线下降。
22. 盐 氧化物 难溶 Ca(OH)2+Na2CO3= CaCO3↓+2NaOH 步骤少,能耗低
【详解】(1)由物质的组成和性质可知,碳酸钙属于盐,二氧化硅属于氧化物,故答案为:盐;氧化物;
(2)由碳酸钙和二氧化硅均不溶于水可知,牙膏摩擦剂的溶解性是难溶,故答案为:难溶;
(3)由实验方案可知,步骤3的反应为石灰水与碳酸钠溶液反应生成碳酸钙和氢氧化钠,反应的化学方程式为Ca(OH)2+Na2CO3= CaCO3↓+2NaOH,故答案为:Ca(OH)2+Na2CO3= CaCO3↓+2NaOH;
(4)对比甲乙同学制备碳酸钙的实验方案可知,乙同学的实验方案操作步骤少,不需要高温煅烧,能耗少能节省能源,故答案为:步骤少,能耗低。
23.(1) ADBF CaCO3+2HCl=CaCl2+CO2↑+H2O
(2) 4 增加一个尾气处理装置
【分析】以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,A中碳酸钙和稀盐酸生成二氧化碳气体,通过D除去挥发的氯化氢气体,通过B干燥后二氧化碳进入F收集;
【详解】(1)①由分析可知,所选仪器的连接顺序为ADBF。
②碳酸钙和稀盐酸生成二氧化碳气体、水和氯化钙,CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)①装置E中氧化铜和一氧化碳加热生成二氧化碳和铜,装置E减少的质量为氧化铜铜元素质量10.0g-9.2g=0.8g,结合氧化铜化学式可知,该铜粉和氧化铜的混合物中氧化铜的质量为。
②一氧化碳有毒,从环保角度考虑,该套实验装置应该增加一个尾气处理装置。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.改变反应物用量,下列反应能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应;
②Si与烧碱溶液反应;
③H2S与NaOH溶液反应;
④Fe与稀硝酸反应;
⑤S在O2中燃烧;
⑥N2与O2的反应。
A.②⑤⑥ B.①②⑤ C.①③④ D.③④⑥
2.中华文明源远流长,现代科技也迅猛发展。下列有关我国文明和科技的说法中不涉及化学变化的是
A.青铜器皿除锈 B.节日燃放烟花 C.利用核反应发电 D.制造“蛟龙”号潜水器
A.A B.B C.C D.D
3.下列各组物质按照单质、化合物、混合物顺序排列的是
A.石墨、Fe(OH)3胶体、澄清石灰水 B.氮气、干冰、冰水混合物
C.液态氧、CuSO4·5H2O、浓盐酸 D.硫粉、碘酒、含氧40%的氧化镁
4.下列物质属于纯净物的是
A.蒸馏水 B.氯水 C.海水 D.氨水
5.下列有关物质分类不正确的是
A.KNO3是钾盐、硝酸盐,也是正盐
B.铝土矿、水玻璃、碱石灰都是混合物
C.有机玻璃、氮化硅都是有机高分子材料
D.BaSO4、Na3AlF6、NH4F都是强电解质
6.下列物质属于纯净物的是
A.玻璃 B.蒸馏水 C.漂白粉 D.空气
7.下列物质归类正确的是
A.电解质:小苏打、蔗糖
B.化合物:浓硫酸、干冰
C.混合物:磁性氧化铁、“84”消毒液
D.胶体:豆浆、血液
8.下列各组物质的溶液,不能发生复分解反应的是 ( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4
C.AgNO3和BaCl2 D.KCl和CuSO4
9.甲、乙、丙、丁、戊是中学常见的无机物,其中甲为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲为常见金属单质,乙为常见非金属氧化物,且二者发生置换反应,则丙一定是碱性氧化物
10.金味营养麦片含有多种成分,其中属于无机物是。
A.玉米 B.大豆粉 C.碳酸钠 D.白砂糖
二、填空题
11.有A、B、C、D四种物质,暗紫色的固体A受热会产生一种使带火星的木条复燃的气体B,暗红色固体C在B中燃烧,产生大量白烟,生成产物D。
写出各物质的化学式:A ,D 。
12.现有下列5种物质,根据要求将对应物质的序号字母填入相应空格内。
A. B. C. D. E.
(1)属于单质的是 ,属于氧化物的是 ,属于盐的是 。
(2)能与氢氧化钠()发生中和反应的是 。
(3)实验室常用 的水溶液检验气体。
13.对下列物质分类,并完善表格内容
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
物质 分类依据 物质类型 实例
酸 根据酸根离子是否含有氧元素 含氧酸
无氧酸
根据一定条件下能电离出的数目 一元酸
二元酸
三元酸
根据电离程度 强酸
弱酸
根据沸点高低 高沸点酸
低沸点酸
盐 根据生成盐时酸、碱中和反应进行的程度 正盐
酸式盐
碱式盐
根据生成盐的酸或碱的强弱 强酸强碱盐
强酸弱碱盐
弱酸强碱盐
根据溶解性 易溶性盐
难溶性盐
14.非金属氧化物一定是酸性氧化物。 ;理由是
15.回答下列问题:
(1)现有以下物质:①NaOH固体②盐酸③固体④熔融⑤蔗糖⑥铜⑦⑧液态的,以上物质中能导电的是 ;(填序号,下同);以上物质中属于电解质的是 。
(2)CaO、、、CuO四种物质中有一种物质的类别与其它三种不同,它是 (填化学式);它与水反应生成的化合物是 (从“强电解质、弱电解质、非电解质”中选择填入)。
16.按要求对以下常见物质进行分类:铁红、胆矾、氢氧化钾、醋酸、酒精、金刚石.请按要求写出有关物质的化学式.
(1)属于单质的是 ;属于盐的是 ;属于酸的是 。
(2)Fe2O3俗称铁红,氧化物类型属于 。将其加入适量盐酸,反应的化学方程式: 。
17.无机化合物可根据其组成和性质进行分类。
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
物质类别 酸 碱 盐 氧化物
化学式 ①HCl ② ③ ④Ba(OH)2 ⑤Na2CO3 ⑥ ⑦CO2 ⑧Na2O
(2)写出⑦转化为⑤的化学方程式: 。
(3)实验室制备⑦常用 和 反应,检验该气体的方法是 。
18.现有下列10种物质:①冰水混合物、②空气、③Mg、④CaO、⑤H2SO4、⑥Ca(OH)2、⑦CuSO4·H2O、⑧液氧、⑨NaHCO3.其中,属于混合物的是 (填序号,下同)属于氧化物的是 ;属于酸的是 ;属于碱的是 ;属于盐的是 ;属于单质的是 。
19.营养强化剂
(1)作用:食品中加入营养强化剂是为了 食品中缺乏的营养成分或 。
(2)种类
①食盐中加 。 ②酱油中加 。
③粮食制品中加 。 ④食品中加 或钙、硒、锗等。
20.密室逃脱游戏风靡全国。NaOH去玩密室逃脱,游戏规则:躲避能与NaOH反应的物质,否则无法逃脱。
回答下列问题:
(1)写出NaOH成功逃脱所走的路线: (用图中序号连接)。
(2)能捕获NaOH的化学反应若在水溶液中发生,可以生成沉淀的反应有 个;其中能产生白色沉淀的盐是 (填化学式),写出该反应的离子方程式: 。
(3)处于逃脱路线中的物质,属于氧化物的是 (填序号),它们之间常温下能否发生反应 (填“能”或“不能”)。
(4)AgNO3能否沿着NaOH的路线成功逃脱并说明理由(不考虑反应条件): (填“能”或“不能”),理由: 。
三、实验题
21.实验探究酸性氧化物与碱的反应,以“CO2与NaOH溶液反应为例”,实验装置见图1。
实验过程
【方案1】CO2溶于水
①用三颈烧瓶收集满CO2。
②用注射器取4mL蒸馏水注入三颈烧瓶。
③通过气体压强传感器获得三颈烧瓶内气体的压强变化如图2中所示曲线。
【方案2】CO2与NaOH溶液反应
用NaOH溶液替换蒸馏水,重复上述方案1中的步骤,观察到三颈烧瓶内压强如图2中所示曲线。
根据上述实验,请回答下列问题:
(1)CO2与足量NaOH溶液反应的化学方程式: 。
(2)CO2溶于水的压强变化曲线: (写编号)。
(3)曲线②先升高后下降的原因: 。
22.对牙膏的探究要用到许多化学知识。
(1)下表列出了两种牙膏中的摩擦剂,请在表中填写两种摩擦剂所属的物质类别。
牙膏 A牙膏 B牙膏
摩擦剂 碳酸钙 二氧化硅
摩擦剂的物质类别
(2)根据你的推测,牙膏摩擦剂的溶解性是 (填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。甲同学设计了一种实验室制备碳酸钙的实验方案,其流程图为:
请写出上述方案中步骤3的化学方程式: 。
(4)乙同学的实验方案如图,其优点为 。
23.下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器,某化学小组的同学利用其进行下列化学实验。
试回答下列问题:
(1)以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求设计实验装置,连接仪器,检查装置的气密性,进行实验。(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为 (从左到右填写仪器序号字母)。
②上述制二氧化碳的化学方程式为 。
(2)该小组的同学用一氧化碳气体(含少量水蒸气、二氧化碳)测定某铜粉和氧化铜混合物中的元素组成。所选仪器按“不纯一氧化碳气体→B→E→C”的顺序连接,检查装置的气密性,然后进行实验。实验结束后,同学们记录的实验数据如下表所示(假设发生的化学反应都充分反应;)。
测量物质 B中浓硫酸 E中玻璃管内固体 C中氢氧化钠溶液
反应前质量/g 120.0 10.0 100.0
反应后质量/g 120.2 9.2 104.4
①该铜粉和氧化铜的混合物中氧化铜的质量为 g。
②从环保角度考虑,该套实验装置还存在明显的不足之处,你的改进建议是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】①CO2少量时,发生反应:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓;CO2过量时发生反应:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,所以不能用同一方程式表示,故不选;
②Si与烧碱溶液反应生成硅酸钠和氢气,与反应物用量无关,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,可以用同一方程式表示,故选;
③NaOH少量时,发生反应:H2S+NaOH=NaHS+H2O,NaOH过量时发生反应:H2S+2NaOH=Na2S+2H2O,所以不能用同一方程式表示,故不选;
④Fe与稀硝酸反应,Fe不足生成Fe3+,离子方程式为:4H++NO3-+Fe=Fe3++NO↑+2H2O;Fe过量生成Fe2+,离子方程式为:8H++2NO3-+3Fe=3Fe2++2NO↑+4H2O,所以不能用同一个离子方程式来表示,故不选;
⑤S在O2中燃烧,不论氧气过量还是少量都生成二氧化硫,故能用同一个化学方程式来表示,故选;
⑥N2与O2的在放电的条件下反应生成一氧化氮,与量无关,故能用同一个化学方程式来表示,故选;
故②⑤⑥符合。答案选A。
2.C
【详解】A.青铜器皿除锈过程中生成新物质,是化学变化,A错误;
B.燃放烟花涉及燃烧,生成新物质,是化学变化,B错误;
C.核反应属于核变化,核变化不是化学变化,C正确;
D.制造“蛟龙”号潜水器涉及新材料的制造,是化学变化,D错误;
故选D。
3.C
【详解】A.Fe(OH)3胶体属于混合物,不属于化合物,A错误;
B.冰水混合物属于纯净物,不属于混合物,B错误;
C.液态氧、CuSO4·5H2O、浓盐酸分别属于单质、化合物、混合物,C正确;
D.碘酒属于混合物,含氧40%的氧化镁属于纯净物,D错误;
故选C。
4.A
【详解】A.蒸馏水只含有水分子,只有一种物质,属于纯净物,故A正确;
B.氯水是将氯气通入水中,含有氯化氢,次氯酸等多种物质,属于混合物,故B错误;
C.海水中含有水分子,无机盐等多种物质,属于混合物,故C错误;
D.氨水是将氨气通入水中,含有一水合氨,水分子等多种物质,属于混合物,故D错误;
故选A。
5.C
【详解】A.KNO3含有钾元素、硝酸根,所以是钾盐、硝酸盐,也是正盐,故A正确;
B.铝土矿含有氧化铝、氧化铁、二氧化硅等物质;水玻璃是硅酸钠的水溶液;碱石灰是氧化钙和氢氧化钠的混合物,都是混合物,故B正确;
C.氮化硅不含碳元素,不属于有机材料,故C错误;
D.BaSO4、Na3AlF6、NH4F能完全电离,都是强电解质,故D正确。
6.B
【详解】A.玻璃是由纯碱、石灰石、和石英经混合粉碎熔融制得的,主要成分是硅酸钠,属于混合物,错误;
B.蒸馏水的成分就是水,是纯净物,正确;
C.漂白粉是氯化钙、次氯酸钙的混合物,错误;
D.空气是氮气、氧气、二氧化碳、水蒸气以及少量稀有气体的混合物,错误,
答案选B。
7.D
【详解】A.蔗糖的水溶液不导电,蔗糖属于非电解质,A错误;
B.浓硫酸属于混合物,不是化合物,B错误;
C.磁性氧化铁为四氧化三铁,为纯净物,C错误;
D.豆浆、血液均为胶体,D正确。
故答案选D。
8.D
【详解】A. HCl和Ca(OH)2可以发生复分解反应:Ca(OH)2+2HCl= CaCl2 +2H2O,不选A;
B. Na2CO3和H2SO4可以发生复分解反应:Na2CO3+ H2SO4= Na2SO4+ CO2↑+ H2O,不选B;
C. AgNO3和BaCl2可以发生复分解反应:2AgNO3+ BaCl2=Ba(NO3)2+2AgCl↓,不选C;
D. KCl和CuSO4不反应,选D;
答案为D。
9.D
【详解】A.甲为单质,既能与盐酸反应又能与NaOH溶液反应,则甲为Al,乙为氧气,二者反应生成丙为氧化铝,氧化铝属于两性氧化物,A正确;
B.若甲、丙、戊含有同一种元素,当甲为S,乙为O2,丙为SO2,丁为HClO等具有强氧化性的物质,戊为H2SO4,则含S元素的化合价由低到高的顺序为:甲<丙<戊,B正确;
C.丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则丙为HCl,丁为NH3,二者混合产生的白烟物质是NH4Cl,若乙为Cl2,其水溶液中含有HClO,具有漂白作用,C正确;
D.若甲为常见金属单质,乙为常见非金属氧化物,且二者发生置换反应,可能是Fe与H2O在高温下反应产生Fe3O4、H2,Fe3O4是氧化物,而不是碱性氧化物,D错误;
故合理选项是D。
10.C
【分析】有机物是指含有碳元素的化合物.无机物是指不含有碳元素的化合物;一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物。
【详解】A.玉米粉的主要成分是淀粉,属于有机物,A错误;
B.大豆粉的主要成分是蛋白质,属于有机物,B错误;
C.碳酸钠为盐属于无机物,C正确;
D.白砂糖的主要成分是蔗糖,属于有机物,D错误。
故选C。
11. KMnO4 P2O5
【详解】暗紫色的固体A受热会产生一种使带火星的木条复燃的气体B,说明B能支持燃烧,B为氧气,紫色固体A分解产生氧气,则A应为高锰酸钾;暗红色固体C为红磷,红磷在氧气燃烧产生的白色固体为五氧化二磷,故答案为:KMnO4;P2O5。
12. A B E C D
【详解】(1)由一种元素组成的纯净物属于单质,所以Na属于单质,故选A;由两种元素组成,其中一种元素是氧元素的化合物属于氧化物,所以SiO2是氧化物,故选B;由金属与酸根构成的化合物属于盐,所以NH4Cl是盐,故选E。答案为:A;B;E;
(2)能与氢氧化钠()发生中和反应的物质是酸,H2SO4是酸,故选C。答案为:C;
(3)实验室常用于检验气体的试剂是澄清石灰水,故选D。答案为:D。
13. ②③⑤ ①④⑥ ①②⑥ ③④ ⑤ ①②③ ④⑤⑥ ③⑤ ①②④⑥ ⑦⑩ ⑧ ⑨ ⑦ ⑩ ⑧ ⑧⑩ ⑦⑨
【详解】电离出的阳离子全部为氢离子的化合物属于酸,故属于酸的物质有:① ② ③ ④ ⑤ ⑥;
根据酸根离子是否含有氧元素可以将酸分为两类,含氧酸:②③⑤;无氧酸:①④⑥;
根据一定条件下能电离出的数目,可以将酸分为:一元酸:①②⑥;二元酸:③④;三元酸:⑤;
根据电离程度可以将酸分为两类,强酸:①②③;弱酸:④⑤⑥;
根据沸点高低,可以将酸分为两类,高沸点酸:③⑤;低沸点酸:①②④⑥;
阳离子含有金属阳离子或铵根离子的化合物属于盐,属于盐的物质有:⑦ ⑧ ⑨ ⑩;
根据生成盐时酸、碱中和反应进行的程度,可以将盐分为:正盐:⑦⑩;酸式盐:⑧;碱式盐:⑨;
根据生成盐的酸或碱的强弱,可以将盐分为:强酸强碱盐:⑦;强酸弱碱盐:⑩;弱酸强碱盐:⑧;
根据溶解性,可以将盐分为:易溶性盐:⑧⑩;难溶性盐:⑦⑨。
14. 错误 CO、NO是不成盐氧化物
【详解】非金属氧化物不一定是酸性氧化物,如CO、NO是不成盐氧化物。
15.(1) ②④⑥ ①③④⑧
(2) 弱电解质
【解析】(1)
②盐酸、④熔融KCl、⑥铜中存在自由移动的离子或电子,它们能够导电;①NaOH固体、③CaCO3固体、④熔融 KCl、⑧液态的在水溶液里或熔融状态下能导电,并且属于化合物,属于电解质;
(2)
CaO、、、CuO三种物质都是金属氧化物,是非金属氧化物;与水反应生成碳酸,碳酸能够部分电离出阴阳离子,属于弱电解质。
16. 金刚石 胆矾 醋酸 碱性氧化物 Fe2O3+6HCl═2FeCl3+3H2O
【分析】单质是由同种元素组成的纯净物,酸是指在水溶液中电离时生成的阳离子全部是氢离子的化合物,碱是指在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,氧化物是由两种元素组成的化合物,其中一种是氧元素,盐是在水溶液中电离出金属离子或铵根离子和酸根离子的化合物。
【详解】铁红的主要成分是氧化铁,属于碱性氧化物;
胆矾的主要成分是五水硫酸铜,在水溶液中电离出铜离子和硫酸根离子,属于盐;
氢氧化钾在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,属于碱;
醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸;
金刚石是由碳元素组成的非金属单质;
(1)金刚石是由碳元素组成的非金属单质,则属于单质的是金刚石;胆矾在水溶液中电离出铜离子和硫酸根离子,属于盐,则属于盐的是胆矾;醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸,则属于酸的是醋酸,故答案为金刚石;胆矾;醋酸;
(2)氧化铁与盐酸反应生成氯化铁和水,属于碱性氧化物,反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,故答案为碱性氧化物;Fe2O3+6HCl═2FeCl3+3H2O。
17. H2SO4(或HNO3等) NaOH(或KOH等) Na2SO4(或K2CO3或Na2SO3或NaNO3等) 2NaOH+CO2 =Na2CO3+H2O 稀盐酸 碳酸钙 将气体通入澄清石灰水中,若变浑浊,即证明是CO2
【详解】(1)酸可以填写H2S、H2SO4、HNO3、H2CO3等,碱可以填写KOH或NaOH等;盐可填写K2CO3、Na2SO4、NaNO3、KNO3、K2SO4等。故答案为:H2SO4(或HNO3等);NaOH(或KOH等);Na2SO4(或K2CO3或Na2SO3或NaNO3等);
(2)CO2是酸性氧化物,可与NaOH反应生成Na2CO3和H2O,⑦转化为⑤的化学方程式:2NaOH+CO2 =Na2CO3+H2O。故答案为:2NaOH+CO2 =Na2CO3+H2O;
(3)实验室常用CaCO3和稀盐酸反应制取CO2,产生的CO2气体可用澄清石灰水来检验。故答案为:稀盐酸;碳酸钙;将气体通入澄清石灰水中,若变浑浊,即证明是CO2。
18. ② ①④ ⑤ ⑥ ⑦⑨ ③⑧
【分析】①冰水混合物的主要成分是水,属于纯净物,水是非金属氧化物;
②空气主要成分有氧气、氮气、二氧化碳等,属于混合物;
③Mg是金属单质,属于纯净物;
④CaO是金属氧化物,属于纯净物;
⑤H2SO4是酸,属于纯净物;
⑥Ca(OH)2是碱,属于纯净物;
⑦CuSO4·H2O是带有结晶水的盐,属于纯净物;
⑧液氧是液态氧气,是非金属单质,属于纯净物;
⑨NaHCO3.是盐,属于纯净物。
【详解】由分析可知,属于混合物的是②,属于氧化物的是①④,属于酸的是⑤,属于碱的是⑥,属于盐的是⑦⑨,属于单质的是③⑧,故答案为:②;①④;⑤;⑥;⑦⑨;③⑧。
19.(1) 补充 微量元素
(2) 碘 铁 赖氨酸 维生素
【详解】(1)食品中加入营养强化剂是为了补充食品中缺乏的营养成分或微量元素;
(2)①食盐中加碘,防止缺碘。
②酱油中加铁,预防缺铁性贫血。
③粮食制品中加赖氨酸。
④食品中加维生素或钙、硒、锗等。
20.(1)①→⑥→⑩→⑦→⑨→
(2) 2 MgCl2
(3) ⑨⑩ 不能
(4) 不能 因为AgNO3遇到NaCl、Cu等物质会反生反应
【分析】(1)
躲避与氢氧化钠反应的物质,所以逃脱路线中的物质不能与氢氧化钠反应,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,故不能选择②,氢氧化钠与二氧化碳发生反应生成碳酸钠和水,故不能选择③,氢氧化钠不与碳单质反应,故可以选择①;氢氧化钠与二氧化硫发生反应生成亚硫酸钠和水,故不能选择路线⑤,氢氧化钠不与氯化钠发生反应,故可以选择路线⑥;氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,而与一氧化碳不反应,故不能选择路线⑧,可以选择路线⑩;氢氧化钠与铜单质不反应,故可以选择路线⑦;氢氧化钠会与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,故不能选择路线 ,因其不与三氧化二铁和硝酸钾发生反应,故可以选择路线⑨和 ,故答案为:①→⑥→⑩→⑦→⑨→
(2)
氢氧化钠溶液与氯化镁溶液、硫酸铜溶液发生反应会生成沉淀,反应的化学方程式分别为:、,其中氢氧化镁为白色沉淀,氢氧化铜为蓝色沉淀,所以能捕获NaOH的化学反应若在水溶液中发生,可以生成沉淀的反应有2个,其中能产生白色沉淀的盐是氯化镁,故答案为:2;MgCl2;
(3)
由两种元素组成,其中一种元素是氧元素的化合物叫做氧化物,处于逃脱路线中的物质,属于氧化物的是一氧化碳和三氧化二铁,一氧化碳和三氧化二铁在高温下能发生反应,常温下不能,故答案为:⑨⑩;不能
(4)
AgNO3会与路线中的NaCl、Cu等物质发生反应,所以其不能沿着NaOH的路线成功逃脱,故答案为:不能;因为AgNO3遇到NaCl、Cu等物质会反生反应
21.(1)2NaOH+CO2=Na2CO3+H2O
(2)①
(3)注射器中4mLNaOH溶液注入三颈烧瓶中,溶液增加的体积大于二氧化碳被吸收的体积,三颈烧瓶内的压强增大,曲线上升;随后氢氧化钠溶液吸收大量的二氧化碳,压强下降,曲线下降
【解析】(1)
CO2与足量NaOH溶液反应生成碳酸钠和水,反应的化学方程式是2NaOH+CO2=Na2CO3+H2O;
(2)
用注射器取4mL蒸馏水注入三颈烧瓶,烧瓶内气体体积缩小,压强增大,后有少量CO2溶于水,气体压强略微下降,所以CO2溶于水的压强变化曲线是①;
(3)
注射器中4mLNaOH溶液注入三颈烧瓶中,溶液增加的体积大于二氧化碳被吸收的体积,三颈烧瓶内的压强增大,曲线上升;随后氢氧化钠溶液吸收大量的二氧化碳,压强下降,曲线下降。
22. 盐 氧化物 难溶 Ca(OH)2+Na2CO3= CaCO3↓+2NaOH 步骤少,能耗低
【详解】(1)由物质的组成和性质可知,碳酸钙属于盐,二氧化硅属于氧化物,故答案为:盐;氧化物;
(2)由碳酸钙和二氧化硅均不溶于水可知,牙膏摩擦剂的溶解性是难溶,故答案为:难溶;
(3)由实验方案可知,步骤3的反应为石灰水与碳酸钠溶液反应生成碳酸钙和氢氧化钠,反应的化学方程式为Ca(OH)2+Na2CO3= CaCO3↓+2NaOH,故答案为:Ca(OH)2+Na2CO3= CaCO3↓+2NaOH;
(4)对比甲乙同学制备碳酸钙的实验方案可知,乙同学的实验方案操作步骤少,不需要高温煅烧,能耗少能节省能源,故答案为:步骤少,能耗低。
23.(1) ADBF CaCO3+2HCl=CaCl2+CO2↑+H2O
(2) 4 增加一个尾气处理装置
【分析】以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,A中碳酸钙和稀盐酸生成二氧化碳气体,通过D除去挥发的氯化氢气体,通过B干燥后二氧化碳进入F收集;
【详解】(1)①由分析可知,所选仪器的连接顺序为ADBF。
②碳酸钙和稀盐酸生成二氧化碳气体、水和氯化钙,CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)①装置E中氧化铜和一氧化碳加热生成二氧化碳和铜,装置E减少的质量为氧化铜铜元素质量10.0g-9.2g=0.8g,结合氧化铜化学式可知,该铜粉和氧化铜的混合物中氧化铜的质量为。
②一氧化碳有毒,从环保角度考虑,该套实验装置应该增加一个尾气处理装置。
答案第1页,共2页
答案第1页,共2页
