2.1 钠及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1 钠及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 333.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 18:08:12 | ||
图片预览



文档简介
2.1 钠及其化合物 同步练习题
一、选择题
1.工业上常用芒硝和煤粉在高温下生成硫化钠,其化学方程式为,下列说法错误的是
A.该反应中,是氧化剂
B.由该反应可知还原性:
C.鉴别芒硝和硫酸钾可用焰色试验法
D.该反应每有生成转移电子数为(为阿伏加德罗常数的值)
2.下列关于钠及其化合物的叙述中,正确的是
A.钠元素在自然界中都以化合物的形式存在,是因为金属钠具有很强的氧化性
B.过氧化钠要密封保存,是因为过氧化钠露置于空气中会发生反应变质
C.金属钠保存在煤油中,是因为钠的密度比煤油的密度小
D.钠可与硫酸铜溶液反应得到铜,是因为钠的性质比铜活泼
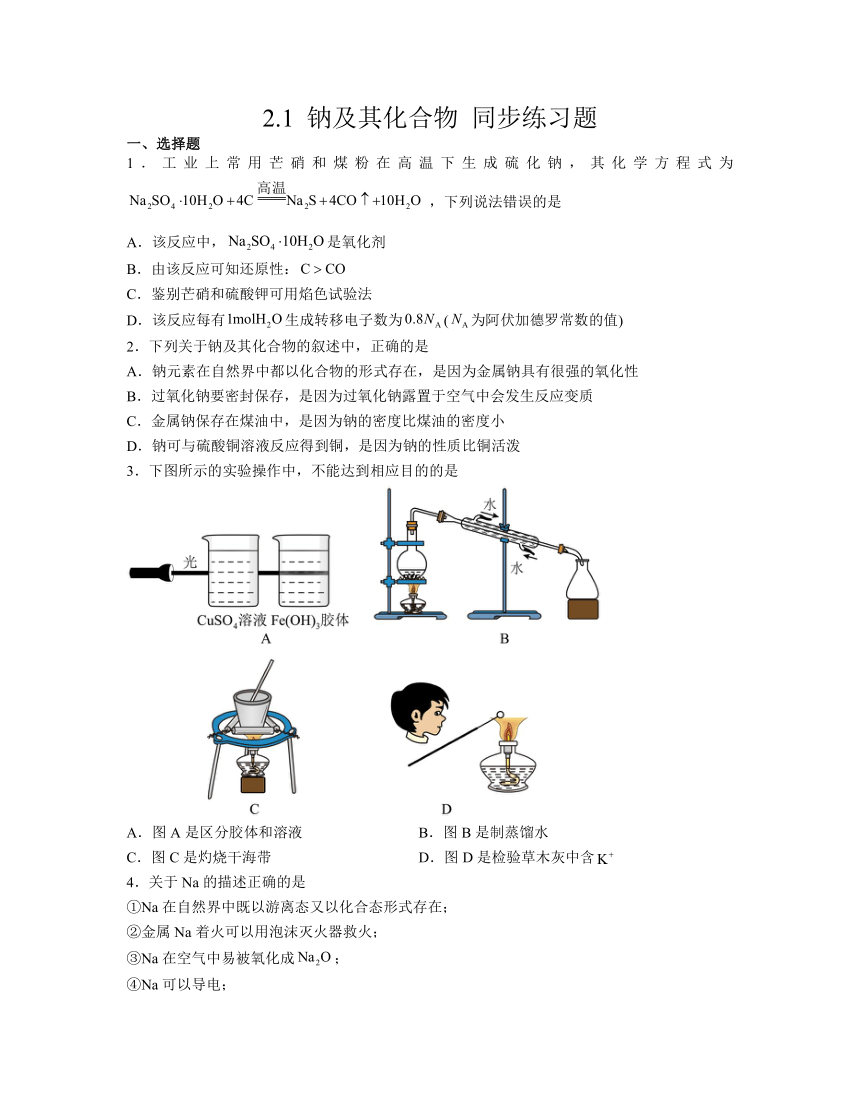
3.下图所示的实验操作中,不能达到相应目的的是
A.图A是区分胶体和溶液 B.图B是制蒸馏水
C.图C是灼烧干海带 D.图D是检验草木灰中含
4.关于Na的描述正确的是
①Na在自然界中既以游离态又以化合态形式存在;
②金属Na着火可以用泡沫灭火器救火;
③Na在空气中易被氧化成;
④Na可以导电;
⑤Na比Cu活泼,因而Na可以从溶液中置换出Cu;
⑥Na在空气中燃烧,产物是。
A.①③④⑤⑥ B.③④⑥ C.③④ D.全部
5.往盛水的烧杯中(如图所示)加入下列某固体物质,充分溶解后可使溶液的温度降低的是
A. B.NaOH C. D.CaO
6.下列判断正确的是
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.可利用在空气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
7.灼烧粉末,透过蓝色钴玻璃观察其火焰颜色为
A.绿色 B.紫色 C.黄色 D.砖红色
8.某物质焰色反应呈紫色(透过蓝色钴玻璃)则说明该物质中
A.含有钾元素 B.钾的化合物 C.钾的单质 D.含有钾离子
二、非选择题
9.下列三组物质中,均有一种物质的类别与其它三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)这三种物质依次是(填化学式)
①___;②___;③___。
(2)这三种物质相互作用可生成一种新的物质NaHCO3,该反应的化学方程式是___。
(3)写出物质③与足量稀硫酸反应的离子方程式___。
10.利用化学的知识,可解释生活中的现象
(1)用活性炭可以除去冰箱中的异味,因为活性炭具有_______性;
(2)氧化钙可作干燥剂,因为____________________(用化学方程式回答);
(3)使用铁锅炒菜时,适当添加一些醋,有利于生成人体易吸收的亚铁离子,可有效防治的疾病是________;
(4)茶杯中的纱网可将茶水和茶叶分离而便于饮用,该设计应用的化学原理是________;
(5)用小苏打治疗胃酸过多,其反应化学方程式是____________________
11.为了求某NaHCO3、Na2CO3混合物中NaHCO3的质量分数,现将m1g样品加热,至质量恒定时停止加热,此时质量为m2g。已知加热时发生的反应为2NaHCO3Na2CO3+CO2↑+H2O,则NaHCO3的质量分数是____________。
12.“套管实验”的实验装置如图所示,请分析实验原理,并回答下列问题:
(1)整个实验过程中,能观察到烧杯A中的现象是_______;烧杯B中的现象是_______。
(2)写出实验过程中套管中发生反应的化学方程式:_______。
(3)该实验可证明NaHCO3的热稳定性_______(填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?_______(填“能”或“不能”)。
【参考答案】
一、选择题
1.B
解析:A.在该反应中,中的硫元素的化合价从+6价降低到Na2S中的-2价,是氧化剂,故A正确;
B.该反应中,C的化合价升高,做还原剂,S的化合价降低,Na2S是还原产物,根据还原剂的还原性强于还原产物的还原性,还原性:C>Na2S,故B错误;
C.钠的焰色是黄色,钾的焰色是紫色(需透过蓝色钴玻璃),故可用焰色试验鉴别芒硝和硫酸钾,故C正确;
D.该反应中,每生成10mol水,有4molC参加反应,C的化合价从0价升高到+2价,则转移8mol电子,所以每生成1mol水,转移的电子数为0.8NA,故D正确;
故选B。
2.B
解析:A.钠元素在自然界中都以化合物的形式存在,是因为金属钠具有很强的还原性,A错误;
B.过氧化钠能与空气中的水蒸气和CO2反应而变质,因此过氧化钠要密封保存,B正确;
C.金属钠保存在煤油中,是因为钠的密度比煤油的密度大,C错误;
D.钠可与硫酸铜溶液反应的方程式为2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑,由此可知反应后得不到铜,D错误;
故答案为:B。
3.D
解析:A.胶体有丁达尔效应,溶液没有丁达尔效应,则图A可以区分胶体和溶液,能达到相应目的,故A不符合;
B.通过蒸馏的方法可以制蒸馏水,能达到相应目的,故B不符合;
C.用坩埚灼烧干海带,能达到相应目的,故C不符合;
D.因钾盐中混有钠盐,检验钾元素需要透过蓝色钴玻璃观察以滤去黄光,不能达到相应目的,故D符合;
故选D。
4.B
【分析】①根据Na的性质很活泼,在自然界中只能以化合态形式存在;
②根据金属Na着火后生成了过氧化钠,过氧化钠可以与二氧化碳反应生成碳酸钠和氧气,燃烧更剧烈;
③根据Na的性质;
④根据Na的物理性质;
⑤根据钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应;
⑥Na在空气中燃烧生成Na2O2;
解析:①因Na的性质很活泼,在自然界中只能以化合态形式存在,故①错误;
②因金属Na着火后生成了过氧化钠,过氧化钠可以与二氧化碳反应生成碳酸钠和氧气,燃烧更剧烈,所以不能用泡沫灭火器救火,故②错误;
③因Na性质活泼,易于氧气反应,所以在空气中易被氧化成Na2O,故③正确;
④Na是金属,所以易导电,故④正确;
⑤因钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应,所以Na不能从CuCl2溶液中置换出Cu,故⑤错误;
⑥Na在空气中燃烧生成Na2O2,故⑥正确;
故答案为:B。
5.A
解析:A.碳酸氢钠溶解后可使溶液温度下降,A正确;
B.NaOH溶于水放热,B错误;
C.溶于水放热,C错误;
D.CaO溶于水放热,D错误;
故选A。
6.A
解析:A.H2O与Na2O2、Na2O均能反应,但与Na2O2反应时能产生气体,A项正确;
B.CO2与Na2O2、Na2O均能反应,但与Na2O2反应时生成的O2是无色无味的气体,无法进行鉴别,B项错误;
C.在空气中加热Na2O和Na2O2的混合物,Na2O会转化为Na2O2,不能除去Na2O2,C项错误;
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,均先与溶液中的水反应生成碱而使溶液变为红色,但Na2O2具有漂白性能将红色溶液漂白,D项错误;
故答案选A。
7.B
解析:钾的焰色试验为紫色(透过蓝色钴玻璃),因此灼烧粉末,透过蓝色钴玻璃观察其火焰颜色为紫色,故答案选B。
8.A
解析:某物质焰色反应呈紫色(透过蓝色钴玻璃)则说明该物质中含有钾元素,可能是含钾的化合物,也可能是钾的单质,也有可能是钾离子,故选A。
二、非选择题
9. CO2 H2O Na2CO3 CO2+H2O+Na2CO3=2NaHCO3 CO+2H+=H2O+CO2↑
解析:(1)①中CO2是酸性氧化物,其余是碱性氧化物,②中H2O是氧化物,其余是酸,③中Na2CO3是盐,其余是碱,故答案为:CO2;H2O;Na2CO3;
(2) CO2;H2O;Na2CO3三种物质发生反应生成碳酸氢钠,化学方程式为:CO2+H2O+Na2CO3=2NaHCO3,故答案为:CO2+H2O+Na2CO3=2NaHCO3;
(3)Na2CO3与H2SO4的反应是复分解反应生成Na2SO4、CO2和H2O,故化学方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,离子反应方程式为:CO+2H+=H2O+CO2↑
故答案为:CO+2H+=H2O+CO2↑;
10. 吸附 CaO+H2O=Ca(OH)2 缺铁性贫血病 过滤 NaHCO3+HCl=NaCl+H2O+CO2↑
解析:(1)活性炭具有吸附作用,可除去冰箱中的异味;
(2)氧化钙能与水反应生成氢氧化钙:CaO+H2O=Ca(OH)2,故可作干燥剂;
(3)人体缺铁时,容易患缺铁性贫血病,向人体中补充铁时,可以有效防止此类疾病的发生;
(4)茶杯内的纱网能滤去茶叶,和过滤器除去水中泥沙原理是一样的,则将茶叶与茶水分离原理为过滤;
(5)小苏打是碳酸氢钠的俗称,和胃酸中的盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。
11.
解析:碳酸钠受热不分解,性质稳定;碳酸氢钠性质不稳定,受热易发生分解,利用差量法进行如下计算:
由题意得,解得:x=,
故,故答案为:。
12.(1) 有气泡冒出 有气泡产生,澄清石灰水变浑浊
(2)
(3)弱于 不能
解析:实验开始时,大试管中的气体受热膨胀,烧杯A的导气管中会有气泡冒出。碳酸氢钠受热分解生成二氧化碳气体,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,从而验证了稳定性碳酸钠大于碳酸氢钠,由此分析。
(1)根据分析可知,烧杯A中的现象是有气泡产生,烧杯B的导气管中有气泡产生,澄清石灰水变浑浊;
(2)套管中装的是碳酸氢钠,热稳定性较差,加热发生分解反应:。
(3)碳酸氢钠在小试管中,碳酸钠在大试管中,给大试管直接加热,温度较高。依据温度较高的管中的物质不分解,而温度较低的管中的物质分解,可判断热稳定性:Na2CO3>NaHCO3,故Na2CO3与NaHCO3的位置不能互换
一、选择题
1.工业上常用芒硝和煤粉在高温下生成硫化钠,其化学方程式为,下列说法错误的是
A.该反应中,是氧化剂
B.由该反应可知还原性:
C.鉴别芒硝和硫酸钾可用焰色试验法
D.该反应每有生成转移电子数为(为阿伏加德罗常数的值)
2.下列关于钠及其化合物的叙述中,正确的是
A.钠元素在自然界中都以化合物的形式存在,是因为金属钠具有很强的氧化性
B.过氧化钠要密封保存,是因为过氧化钠露置于空气中会发生反应变质
C.金属钠保存在煤油中,是因为钠的密度比煤油的密度小
D.钠可与硫酸铜溶液反应得到铜,是因为钠的性质比铜活泼
3.下图所示的实验操作中,不能达到相应目的的是
A.图A是区分胶体和溶液 B.图B是制蒸馏水
C.图C是灼烧干海带 D.图D是检验草木灰中含
4.关于Na的描述正确的是
①Na在自然界中既以游离态又以化合态形式存在;
②金属Na着火可以用泡沫灭火器救火;
③Na在空气中易被氧化成;
④Na可以导电;
⑤Na比Cu活泼,因而Na可以从溶液中置换出Cu;
⑥Na在空气中燃烧,产物是。
A.①③④⑤⑥ B.③④⑥ C.③④ D.全部
5.往盛水的烧杯中(如图所示)加入下列某固体物质,充分溶解后可使溶液的温度降低的是
A. B.NaOH C. D.CaO
6.下列判断正确的是
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.可利用在空气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
7.灼烧粉末,透过蓝色钴玻璃观察其火焰颜色为
A.绿色 B.紫色 C.黄色 D.砖红色
8.某物质焰色反应呈紫色(透过蓝色钴玻璃)则说明该物质中
A.含有钾元素 B.钾的化合物 C.钾的单质 D.含有钾离子
二、非选择题
9.下列三组物质中,均有一种物质的类别与其它三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)这三种物质依次是(填化学式)
①___;②___;③___。
(2)这三种物质相互作用可生成一种新的物质NaHCO3,该反应的化学方程式是___。
(3)写出物质③与足量稀硫酸反应的离子方程式___。
10.利用化学的知识,可解释生活中的现象
(1)用活性炭可以除去冰箱中的异味,因为活性炭具有_______性;
(2)氧化钙可作干燥剂,因为____________________(用化学方程式回答);
(3)使用铁锅炒菜时,适当添加一些醋,有利于生成人体易吸收的亚铁离子,可有效防治的疾病是________;
(4)茶杯中的纱网可将茶水和茶叶分离而便于饮用,该设计应用的化学原理是________;
(5)用小苏打治疗胃酸过多,其反应化学方程式是____________________
11.为了求某NaHCO3、Na2CO3混合物中NaHCO3的质量分数,现将m1g样品加热,至质量恒定时停止加热,此时质量为m2g。已知加热时发生的反应为2NaHCO3Na2CO3+CO2↑+H2O,则NaHCO3的质量分数是____________。
12.“套管实验”的实验装置如图所示,请分析实验原理,并回答下列问题:
(1)整个实验过程中,能观察到烧杯A中的现象是_______;烧杯B中的现象是_______。
(2)写出实验过程中套管中发生反应的化学方程式:_______。
(3)该实验可证明NaHCO3的热稳定性_______(填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?_______(填“能”或“不能”)。
【参考答案】
一、选择题
1.B
解析:A.在该反应中,中的硫元素的化合价从+6价降低到Na2S中的-2价,是氧化剂,故A正确;
B.该反应中,C的化合价升高,做还原剂,S的化合价降低,Na2S是还原产物,根据还原剂的还原性强于还原产物的还原性,还原性:C>Na2S,故B错误;
C.钠的焰色是黄色,钾的焰色是紫色(需透过蓝色钴玻璃),故可用焰色试验鉴别芒硝和硫酸钾,故C正确;
D.该反应中,每生成10mol水,有4molC参加反应,C的化合价从0价升高到+2价,则转移8mol电子,所以每生成1mol水,转移的电子数为0.8NA,故D正确;
故选B。
2.B
解析:A.钠元素在自然界中都以化合物的形式存在,是因为金属钠具有很强的还原性,A错误;
B.过氧化钠能与空气中的水蒸气和CO2反应而变质,因此过氧化钠要密封保存,B正确;
C.金属钠保存在煤油中,是因为钠的密度比煤油的密度大,C错误;
D.钠可与硫酸铜溶液反应的方程式为2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑,由此可知反应后得不到铜,D错误;
故答案为:B。
3.D
解析:A.胶体有丁达尔效应,溶液没有丁达尔效应,则图A可以区分胶体和溶液,能达到相应目的,故A不符合;
B.通过蒸馏的方法可以制蒸馏水,能达到相应目的,故B不符合;
C.用坩埚灼烧干海带,能达到相应目的,故C不符合;
D.因钾盐中混有钠盐,检验钾元素需要透过蓝色钴玻璃观察以滤去黄光,不能达到相应目的,故D符合;
故选D。
4.B
【分析】①根据Na的性质很活泼,在自然界中只能以化合态形式存在;
②根据金属Na着火后生成了过氧化钠,过氧化钠可以与二氧化碳反应生成碳酸钠和氧气,燃烧更剧烈;
③根据Na的性质;
④根据Na的物理性质;
⑤根据钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应;
⑥Na在空气中燃烧生成Na2O2;
解析:①因Na的性质很活泼,在自然界中只能以化合态形式存在,故①错误;
②因金属Na着火后生成了过氧化钠,过氧化钠可以与二氧化碳反应生成碳酸钠和氧气,燃烧更剧烈,所以不能用泡沫灭火器救火,故②错误;
③因Na性质活泼,易于氧气反应,所以在空气中易被氧化成Na2O,故③正确;
④Na是金属,所以易导电,故④正确;
⑤因钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应,所以Na不能从CuCl2溶液中置换出Cu,故⑤错误;
⑥Na在空气中燃烧生成Na2O2,故⑥正确;
故答案为:B。
5.A
解析:A.碳酸氢钠溶解后可使溶液温度下降,A正确;
B.NaOH溶于水放热,B错误;
C.溶于水放热,C错误;
D.CaO溶于水放热,D错误;
故选A。
6.A
解析:A.H2O与Na2O2、Na2O均能反应,但与Na2O2反应时能产生气体,A项正确;
B.CO2与Na2O2、Na2O均能反应,但与Na2O2反应时生成的O2是无色无味的气体,无法进行鉴别,B项错误;
C.在空气中加热Na2O和Na2O2的混合物,Na2O会转化为Na2O2,不能除去Na2O2,C项错误;
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,均先与溶液中的水反应生成碱而使溶液变为红色,但Na2O2具有漂白性能将红色溶液漂白,D项错误;
故答案选A。
7.B
解析:钾的焰色试验为紫色(透过蓝色钴玻璃),因此灼烧粉末,透过蓝色钴玻璃观察其火焰颜色为紫色,故答案选B。
8.A
解析:某物质焰色反应呈紫色(透过蓝色钴玻璃)则说明该物质中含有钾元素,可能是含钾的化合物,也可能是钾的单质,也有可能是钾离子,故选A。
二、非选择题
9. CO2 H2O Na2CO3 CO2+H2O+Na2CO3=2NaHCO3 CO+2H+=H2O+CO2↑
解析:(1)①中CO2是酸性氧化物,其余是碱性氧化物,②中H2O是氧化物,其余是酸,③中Na2CO3是盐,其余是碱,故答案为:CO2;H2O;Na2CO3;
(2) CO2;H2O;Na2CO3三种物质发生反应生成碳酸氢钠,化学方程式为:CO2+H2O+Na2CO3=2NaHCO3,故答案为:CO2+H2O+Na2CO3=2NaHCO3;
(3)Na2CO3与H2SO4的反应是复分解反应生成Na2SO4、CO2和H2O,故化学方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,离子反应方程式为:CO+2H+=H2O+CO2↑
故答案为:CO+2H+=H2O+CO2↑;
10. 吸附 CaO+H2O=Ca(OH)2 缺铁性贫血病 过滤 NaHCO3+HCl=NaCl+H2O+CO2↑
解析:(1)活性炭具有吸附作用,可除去冰箱中的异味;
(2)氧化钙能与水反应生成氢氧化钙:CaO+H2O=Ca(OH)2,故可作干燥剂;
(3)人体缺铁时,容易患缺铁性贫血病,向人体中补充铁时,可以有效防止此类疾病的发生;
(4)茶杯内的纱网能滤去茶叶,和过滤器除去水中泥沙原理是一样的,则将茶叶与茶水分离原理为过滤;
(5)小苏打是碳酸氢钠的俗称,和胃酸中的盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。
11.
解析:碳酸钠受热不分解,性质稳定;碳酸氢钠性质不稳定,受热易发生分解,利用差量法进行如下计算:
由题意得,解得:x=,
故,故答案为:。
12.(1) 有气泡冒出 有气泡产生,澄清石灰水变浑浊
(2)
(3)弱于 不能
解析:实验开始时,大试管中的气体受热膨胀,烧杯A的导气管中会有气泡冒出。碳酸氢钠受热分解生成二氧化碳气体,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,从而验证了稳定性碳酸钠大于碳酸氢钠,由此分析。
(1)根据分析可知,烧杯A中的现象是有气泡产生,烧杯B的导气管中有气泡产生,澄清石灰水变浑浊;
(2)套管中装的是碳酸氢钠,热稳定性较差,加热发生分解反应:。
(3)碳酸氢钠在小试管中,碳酸钠在大试管中,给大试管直接加热,温度较高。依据温度较高的管中的物质不分解,而温度较低的管中的物质分解,可判断热稳定性:Na2CO3>NaHCO3,故Na2CO3与NaHCO3的位置不能互换
