2.2化学平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2化学平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 22:15:30 | ||
图片预览




文档简介
2.2化学平衡同步练习题
一、选择题
1.溶液中某光学活性卤化物的消旋反应为:。某温度下X和Y的浓度随时间的变化曲线如图所示。
下列说法错误的是
A.
B.L点处X的转化率为20%
C.时,
D.Y溶液含有少量X,经足够长时间后
2.为考查和共存对制氢的影响,在0.1MPa下,的混合气体反应达到平衡时,反应物的转化率、产物的物质的量分数随温度的变化分别如图-1、图-2所示,体系中的反应主要有:
Ⅰ、
Ⅱ、
Ⅲ、
下列说法不正确的是
A.反应
B.图-1中曲线①表示转化率随温度的变化
C.温度700℃时,反应Ⅰ是体系中的主要反应
D.反应Ⅲ的平衡常数:K(400℃)>K(700℃)
3.下列实验操作、现象及相应的结论均正确的是
选项 实验操作 现象 结论
A 将NO2球分别浸泡在冰水和热水中 冰水中NO2球颜色变浅 正反应吸热
B 向某无色溶液中滴加稀硫酸 产生有刺激性气味的气体和淡黄色沉淀 该无色溶液中一定含有Na2S2O3
C 取两支试管M和N,各加入2 mL0.01 mol/L酸性KMnO4溶液,向M试管中滴加2 mL 0.01 mol/L H2C2O4溶液,向N试管中滴加2 mL 0.02 mol/L H2C2O4溶液 M、N试管均褪色,且褪色时间:M>N 其他条件相同时,增大反应物浓度,反应速率增大
D 向两支均盛有2 mL 5% H2O2溶液的试管中分别滴入0.1mol/L的FeCl3和CuCl2溶液各1mL 前者产生气泡较快 不同的催化剂对同一反应的催化效果不同
A.A B.B C.C D.D
4.时,含等浓度的与的混合溶液中发生反应 ,时刻,改变某一外界条件继续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是
已知:时,该反应的化学平衡常数。
A.若时刻未改变外界条件,则此时该反应:
B.若时刻反应达到平衡,则时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率:(表示内的平均反应速率,表示内的平均反应速率)
D.内的平均反应速率为
5.在盛有载氧体的恒容密闭容器中充入空气[氧气的体积分数为21%],发生反应: 。平衡时随反应温度T变化的曲线如图所示。下列说法错误的是
A.升高温度,平衡向逆反应方向移动导致增大
B.必须控制才能保持载氧体活性
C.在1030℃时加入催化剂,
D.985℃时的平衡转化率约为58%
6.下列有关反应 的平衡移动的判断正确的是
选项 条件 平衡移动判断
A , 升高温度,平衡向左移动
B , 降低温度,平衡向右移动
C , 压缩体积,平衡向左移动
, 加入催化剂,平衡向右移动
A.A B.B C.C D.D
7.在一定条件下,恒容密闭容器中反应2A(g)2B(g)+C(g) ΔH>0,达到平衡后,能使B的浓度增大的措施是
A.升温 B.充入惰性气体 C.加压 D.减少A的浓度
8.室温下,某溶液初始时仅溶有M,同时发生以下两个反应:①;②。反应①的速率可表示为,反应②的速率可表示为(、为速率常数)。体系中生成物浓度(c)随时间(t)变化的曲线如图所示。下列说法错误的是
A.0~10s内,M的平均反应速率
B.温度不变,反应过程中的值不变
C.反应①的活化能比反应②的活化能大
D.温度升高,体系中的值减小
9.在一定条件下恒容密闭容器中反应达到平衡后,能使Z的浓度增大的措施是
A.降温 B.使用催化剂 C.升温 D.减少X的浓度
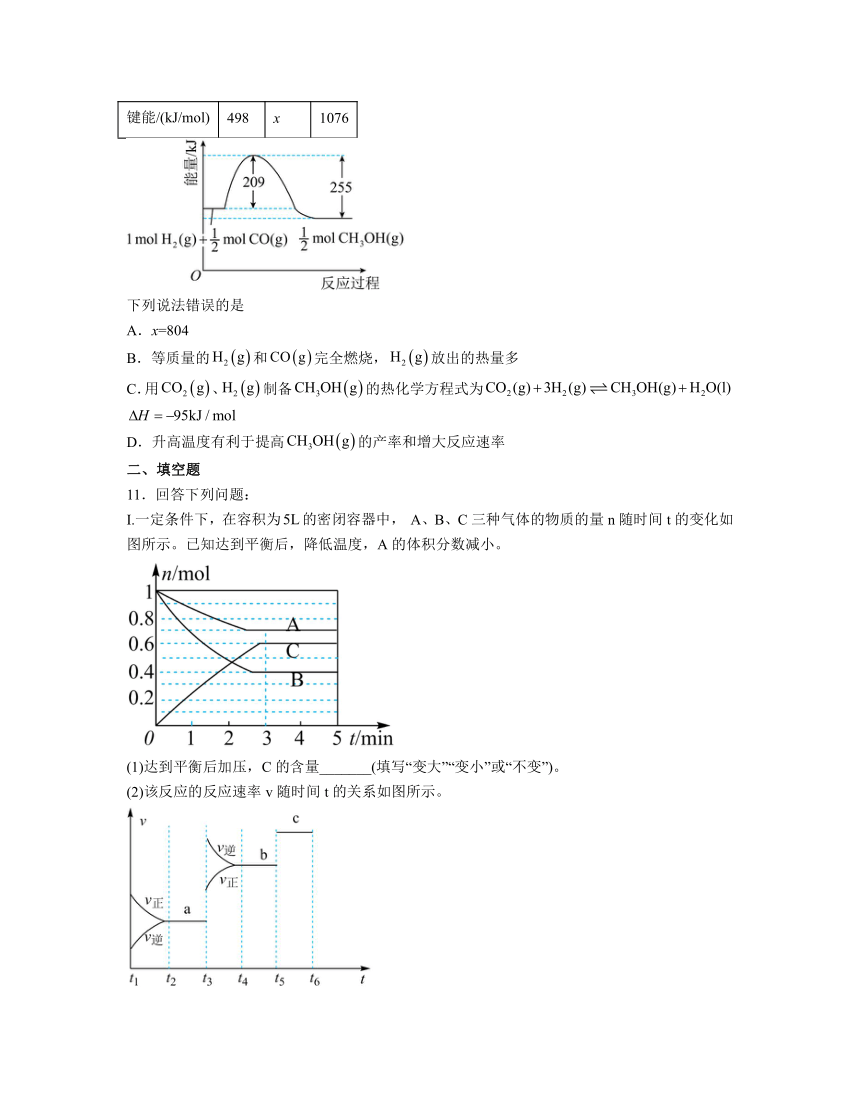
10.工业上可用、或、CO反应制备清洁能源,已知和的燃烧热分别为286kJ/mol、283kJ/ mol,和反应制备的能量变化如图所示,部分化学键的键能如表所示:
化学键 O=O C=O C≡O
键能/(kJ/mol) 498 x 1076
下列说法错误的是
A.x=804
B.等质量的和完全燃烧,放出的热量多
C.用、制备的热化学方程式为
D.升高温度有利于提高的产率和增大反应速率
二、填空题
11.回答下列问题:
Ⅰ.一定条件下,在容积为的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)达到平衡后加压,C的含量_______(填写“变大”“变小”或“不变”)。
(2)该反应的反应速率v随时间t的关系如图所示。
①根据图判断,在时刻改变的外界条件是_______。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______。
Ⅱ.在密闭容器中充入一定量的,发生反应 。如图所示为气体分解生成和的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是_______(填“吸热反应”或“放热反应”)。
(4)N点的体积分数是_______。
(5)M点对应的平衡常数_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
12.一种新型催化剂用于NO和CO的反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 t(℃) NO初始浓度(mol/L) CO初始浓度(mol/L) 催化剂的比表面积(m2/g)
Ⅰ 280 1.2×10-3 5.80×10-3 82
Ⅱ 280 1.2×10-3 b 124
Ⅲ 350 a 5.80×10-3 82
(1)请将表中数据补充完整:a___,b___。
(2)能验证温度对化学反应速率规律的是实验___(填实验序号)。
(3)实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线___(填“甲”或“乙”)。
(4)在容积固定的容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是___(不定项选择);
A.容器内CO浓度不变
B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2)
D.容器内混合气体密度保持不变
13.氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
途径一,用水和天然气作原料一步反应制得。
途径二,用煤和水作原料经多步反应制得。
请回答下列问题:
(1)途径一反应的还原产物是____。
(2)途径二中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0
①上述反应达到平衡后,为提高CO的转化率,下列措施中正确的是____(填写序号)。
A.增大压强 B.降低温度 C.增大H2O(g)的浓度 D.使用催化剂
②已知1000K时,上述反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始时c(H2O):c(CO)不低于____。
(3)目前常用氨气处理硝酸生产的工业尾气,在400℃左右且有催化剂存在的情况下,氨气能把NO(g)还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为286kJ mol-1
N2(g)+3H2(g)2NH3(g) △H=-92.4kJ mol-1
N2(g)+O2(g)2NO(g) △H=+180kJ mol-1
试写出氨气与NO(g)反应生成无毒气体和液态水的热化学方程式____。
14.在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,A2、B2和C的浓度分别为0.5 mol/L、0.1mol/L、1.6 mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
(1)a、b应满足的关系是___________。
(2)a的取值范围是___________。
15.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)此反应的化学平衡常数为:______________________。
(2)如果缩小容器容积(温度不变),则平衡________(填“右移”、“左移”或“不移动”),平衡体系中混合气体的密度________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各mol,其他条件均不变,要使平衡时各物质的质量分数与原平衡相等,则还应加入________mol B。
(4)若向原平衡体系再投入A,B,C,D各1 mol,平衡________(填“右移”、“左移”或“不移动”)。
16.亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理:,实验装置如图所示。
回答下列问题:
(1)仪器a的名称为____________,写出装置A中发生反应的离子方程式____________
(2)请从化学平衡的角度解释饱和NaCl溶液的作用___________________
(3)装置C中装入的化学试剂为______________
(4)装药品之后,关闭________(填“”,“”,“”,下同),打开__________,引发A中反应,通入一段时间气体,其目的是排除_____________ 对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应。
(5)装置E的作用为___________________
17.硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:
①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s 0 10 20 30 40 50 60 70 100
c ( SO2 ) / ( mol L -1) 10 7 5 3.5 2 1 1 1 1
c ( O2 ) / ( mol L -1) 5 3.5 a 1.75 1 0.5 b 0.5 0.5
c ( SO3 ) / ( mol L -1) 0 3 5 6.5 8 9 9 9 9
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题
①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。
【参考答案】
一、选择题
1.C
解析:A.由图可知,两个点都不是平衡点,则,A正确;
B.由图可知,X的起始浓度为0.1mol/L ,L点时X的浓度为0.08mol/L,则转化的X的浓度为0.02mol/L,X的转化率为20%,B正确;
C.化学反应速率为平均速率,根据方程式可知,X和Y的计量系数相同,故某个时间段的,但某个时刻无法根据平均速率公式求解,C错误;
D.由图可知,经足够长时间后,反应达到平衡,两者的浓度相等,则两者的物质的量相等,D正确;
故选C。
2.D
解析:A.根据盖斯定律可知反应CH4(g)+H2O(g)=3H2(g)+CO(g)可由反应I-反应Ⅱ得到,则 ΔH=+260.4kJ mol 1-(+34.0kJ mol 1)= +226.4kJ mol 1,A正确;
B.反应I、Ⅱ、Ⅲ三个反应都由CO2参加反应,所以在几种反应物中转化率最高,三个反应都是吸热反应,升高温度CO2转化率提高,故图-1中曲线①表示CO2转化率随温度的变化,B正确;
C.反应I、Ⅱ、Ⅲ三个反应都是吸热反应,升高温度平衡正反应方向移动,根据图-2可知,升高温度COS、H2O的物质的量分数没有增加,CO、H2的物质的量分数不断增加,说明提高温度后对反应Ⅱ、Ⅲ影响较小,而对反应I影响较大,故温度700℃时,反应Ⅰ是体系中的主要反应,C正确;
D.反应Ⅲ为吸热反应,温度升高平衡正向移动,平衡常数变大,故反应进行平衡常数:K(400℃)<K(700℃),D错误;
故答案为:D。
3.D
解析:A.将NO2球分别浸泡在冰水和热水中,冰水中NO2球颜色变浅,说明温度降低平衡右移,所以正反应是放热反应,A错误;
B.向某无色溶液中滴加稀硫酸,产生有刺激性气味的气体和淡黄色沉淀,所以该无色溶液中一定含有,B错误;
C.取两支试管M和N,各加入2 mL0.01 mol/L酸性KMnO4溶液,向M试管中滴加2 mL 0.01 mol/L H2C2O4溶液,向N试管中滴加2 mL 0.02 mol/L H2C2O4溶液,两试管中高锰酸钾均过量,颜色变化不易观察,C错误;
D.向两支均盛有2 mL 5% H2O2溶液的试管中分别滴入0.1mol/L的FeCl3和CuCl2溶液各1mL,前者产生气泡较快,说明不同的催化剂对同一反应的催化效果不同,D正确;
故选D。
4.C
解析:A.因为混合溶液中与等浓度,因此Ag+与Fe2+浓度相等,根据反应式可知,Ag+、Fe2+、Fe3+三者系数比为1:1:1,即三者变化量相等。若时刻未改变外界条件,则浓度商,因此此时该反应处于平衡状态, ,A错误;
B.该反应为放热反应,升温会导致平衡逆向移动,根据图像可知,时刻改变条件后,平衡正向移动,因此时刻改变的条件不是升温,B错误;
C.因为Ag+、Fe2+系数比为1:1,因此v(Fe2+)=v(Ag+),且,根据图像,=,=,因此,C正确;
D.根据图像,内的平均反应速率为,D错误。
故选C。
5.C
解析:A.题述反应是放热反应,升高温度,平衡向左移动,体积分数增大,故A正确;
B.当温度等于1030℃时,的体积分数与空气中的相等,如果继续升温,体积分数大于21%,载氧体变为脱氧体,失去反应活性,故B正确;
C.平衡时,加入催化剂,不会使平衡移动,体积分数不变,故C错误;
D.取100 mol空气,占21 mol,设985℃下平衡时消耗的物质的量为,则,解得:,平衡转化率为,故D正确;
选C。
6.A
解析:A.即放热反应,升高温度平衡向左移动,A正确;
B.即吸热反应,降低温度平衡向左移动,B错误;
C.即等体积反应,压缩体积速度加快,平衡不移动,C错误;
D.催化剂不影响平衡移动,D错误;
故选A。
7.A
解析:A.该反应正反应是吸热反应,升高温度,平衡正向移动,B的浓度增大,选项A正确;
B.反应在恒容密闭容器中进行,充入惰性气体,气体的总压增大,但参与反应的气体浓度增不变,平衡不移动,B的浓度不变,选项B错误;
C.增大压强,平衡向气体体积缩小的逆反应方向移动,B的浓度减小,选项C错误;
D.减少A的浓度,平衡逆向移动,B的浓度减小,选项D错误;
答案选A。
8.D
解析:A.由反应可知M的浓度变化量等于Y和Z的浓度变化量之和,0~10s内,M的平均反应速率,故A正确;
B. ,温度不变时,比值不变,则恒定不变,v1与成正比,v2与成正比,则的值不变,故B正确;
C.由图可知相同条件下,Z的速率大于Y,可知反应②的速率大于反应①,根据反应活化能越大反应速率越小,可知反应①的活化能比反应②的活化能大,故C正确;
D.反应的吸放热情况不确定,稳定升高平衡的移动方向不确定,因此体系中的值无法确定,故D错误;
故选:D。
9.C
解析:A.该反应是吸热反应,降低温度向放热反应的方向进行,平衡逆向移动,A项错误;
B.使用催化剂,反应速率增大,平衡不移动,B项错误;
C.升高温度向吸热反应方向进行,平衡正向移动,C项错误;
D.减少X是浓度,平衡逆向移动,D项错误;
答案选C。
10.D
解析:A.根据的燃烧热写出① ,反应物键能总和-生成物键能总和,解得,A项正确;
B.和的燃烧热分别为286kJ/mol、283kJ/ mol,所以等质量的和完全燃烧,放出的热量多,B项正确;
C.根据的燃烧热写出② ,根据题图写出③,,由③+②-①可得 ,C项正确;
D.制备的反应为放热反应,升高温度平衡逆向移动,的产率降低,D项错误;
故选D。
二、填空题
11.(1)变大
(2) 升高温度 a
(3)放热反应
(4)40%
(5)1
解析:(1)根据图示可知:随着反应的进行,A、B物质的量减少,C物质的量增加,说明A、B是反应物,C是生成物,3 mol后三种物质的物质的量都不再发生变化,说明该反应为可逆反应。在3 min内A、B、C改变的物质的量分别是0.3 mol、0.6 mol、0.6 mol,改变的物质的量的比为1:2:2,故该反应方程式为:A(g)+2B(g)2C(g)。该反应的正反应是气体体积减小的反应,在其他条件不变时,增大压强,化学平衡向气体体积减小的正反应方向移动,故达到平衡后C的含量变大;
(2)①已知达到平衡后,降低温度,A的体积分数减小。,说明降低温度化学平衡正向移动,该反应的正反应为放热反应。在t3时刻改变条件时正、逆反应速率都增大且逆反应速率大于正反应速率,化学平衡逆向移动,故改变的条件是升高温度;
②t3时刻改变条件后化学平衡逆向移动,导致A的转化率降低;t5时刻正、逆反应速率都增大但仍然相等,化学平衡不移动,平衡正向移动A的转化率增大,所以A转化率最大时生成物C体积分数最大的是a点;
(3)根据图像可知:在压强不变时,升高温度H2S的平衡转化率增大,说明升高温度,化学平衡正向移动,则该反应的正反应为吸热反应,则逆反应为放热反应;
(4)根据图示可知:在N点时H2S的平衡转化率为50%,假设反应开始时n(H2S)=1 mol,则平衡时n(H2S)=0.5 mol,n(H2)=0.5 mol,n(S2)=0.25 mol,在相同外界条件下气体的体积比等于气体的物质的量的比,则H2的体积分数为;
(5)假设反应开始时加入1 mol H2S,M点时H2S的平衡转化率为50%,则根据物质反应转化关系可知平衡时n(H2S)=0.5 mol,n(H2)=0.5 mol,n(S2)=0.25 mol,n(总)=0.5 mol+0.5 mol+0.25 mol=1.25 mol,则p(H2S)=p(H2)=,p(S2)= ,所以该反应的化学平衡常数Kp=。
12.2×10-3 5.80×10-3 Ⅰ和Ⅲ 乙 BD
解析:(1)根据表格中的已知数据可知,Ⅰ和Ⅲ对比是要验证温度对化学反应速率的影响,则温度要不同,其他条件相同,所以a=1.2×10-3;Ⅰ和Ⅱ对比是要验证催化剂的比表面积对化学反应速率的影响,要催化剂的比表面积不同,其他条件相同,b=5.80×10-3;
(2)实验Ⅰ和Ⅲ只有温度不同,其他条件相同,可以验证温度对化学反应速率的影响;
(3)实验Ⅱ所用催化剂的表面积更大,与反应物的接触面积也就越大,反应速率更快,所用曲线乙表示实验Ⅱ;
(4)A.可逆反应达到平衡时正逆反应速率相等,各物质的浓度不再改变,所以CO的浓度不变可以说明反应达到平衡,故A不符合题意;
B.NO的浓度和CO2的浓度大小关系与初始投料和转化率有关,平衡时不一定相等,故B符合题意;
C.当v逆(NO)=2v正(N2)时,根据方程式可知2v正(N2)= v正(NO),所以此时v逆(NO)= v正(NO),说明反应达到平衡,故C不符合题意;
D.该反应中反应物和生成物均为气体,所以气体的总质量不变,容器恒容,所以气体的密度一直不变,所以密度不变不能说明反应平衡,故D符合题意;
综上所述答案为BD。
13.(1)氢气
(2) BC 13.8
(3)4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH=-2071.2kJ mol-1
解析:(1)途径一是用水和甲烷作原料一步反应制得氢气,氢元素的化合价降低,所以氢气是还原产物;
(2)①A.增大压强,平衡不会发生移动,CO转化率不变,故不选A;
B.降低温度,平衡正向进行,CO转化率增大,故选B;
C.增大水蒸气的浓度,平衡向着正方向进行,CO转化率增大,故选C;
D.催化剂不会引起化学平衡的移动,CO转化率不变,故不选D;
故选BC;
②设CO的起始浓度为xmol,的起始浓度为ymol,则转化的CO的最小值为,
根据平衡常数列式:,解得,故此只要此值大于,转化率就会超过;
(3)氢气的燃烧热为,则氢气的燃烧的热化学方程式为:
①
②
③
根据盖斯定律①×6-②×2-③×3得。
14. a-b=0.4 0.4≤a≤1.3
解析:(1)A2(g)+B2(g) 2C(g),参加反应的A2和B2的浓度相同,故二者平衡浓度之差应等于起始浓度之差,即a-b=0.5-0.1=0.4;
(2)若平衡从正向建立,C的起始浓度为0时,a取最大值,则
(a-0.5)×2=1.6,解得a=1.3
若平衡从逆向建立,B的起始浓度为0时,a取最小值,则
a+0.1=0.5,解得a=0.4
故a的取值范围为:0.4≤a≤1.3。
15.5 不移动 增大 左移
解析:(1)根据方程式3A(g)+B(g)2C(g)+2D(g)中物质转化关系可知:若反应达到平衡时产生0.8 mol D,必然同时产生0.8 mol C,反应消耗1.2 mol A和0.4 mol B,平衡时各种气体的物质的量分别是n(A)=2 mol-1.2 mol=0.8 mol,n(B)=2 mol-0.4 mol=1.6 mol,n(C)= n(D)=0.8 mol,由于容器的容积是2 L,则各种气体的平衡浓度分别是c(A)=0.4 mol/L,c(B)=0.8 mol/L,c(C)=c(D)=0.4 mol/L,带入平衡常数表达式可得K==0.5;
(2)如果缩小容器容积(温度不变),容器内气体压强增大。由于该反应是反应前后气体物质的量不变的反应,增大压强,化学平衡不移动;
由于反应混合物都是气体,反应前后气体的总质量不变,气体体积减小,则混合气体的密度会增大;
(3)由于平衡时各物质的质量分数与原平衡相等,则平衡为等效平衡。反应前后气体体积不变,根据化学计量数一边倒转化到方程式的左边,满足n(A):n(B)=1:1即可。认为C和D各mol是由A、B反应产生的,则相当于开始时加入A:=2 mol,加入B: mol,假设还应该加入B的物质的量为x,则2 mol:(x+) mol=2 mol:2 mol,解得x=mol;
(4)若向原平衡体系再投入A,B,C,D各1 mol,则此时各种气体的浓度c(A)=(0.4+0.5)mol/L=0.9 mol/L,c(B)=(0.8+0.5)mol=1.3 mol/L,c(C)=c(D)= (0.4+0.5)mol/L=0.9 mol/L,Qc=>0.5,则化学平衡向左移动。
16. 圆底烧瓶 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动 P2O5或硅胶 和 排除装置中的空气 吸收多余的Cl2,进行尾气处理
【分析】本题以实验室制备氯气并模拟NO和Cl2反应来制备NOCl,装置A为氯气的发生装置,发生的反应为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B为除去Cl2中的HCl,装置C为干燥氯气,装置D为制备NOCl的发生装置,发生的反应为,装置E为尾气吸收装置,据此分析解题。
解析:(1)由实验装置图可知,仪器a的名称为圆底烧瓶,装置A为实验室制备氯气的发生装置,故发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,故答案为:圆底烧瓶;MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
(2)由于Cl2溶于水后发生离子反应为:Cl2+H2OH++Cl-+HClO,故使用饱和NaCl溶液增大了氯离子浓度,使化学平衡逆向移动,故可以使用饱和食盐水来除去Cl2中的HCl,故答案为:Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动;
(3)由分析可知,装置C为干燥Cl2装置,故装置C中装入的化学试剂为P2O5或硅胶,故答案为:P2O5或硅胶;
(4)由题干信息可知,亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,同时装置内的氧气会和一氧化氮反应,故实验过程中,发生之前需将装置中的空气排空,故装药品之后,关闭,打开和,引发A中反应,通入一段时间气体,其目的是排除装置中的空气对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应,故答案为:;和;排除装置中的空气;
(5)由分析可知,装置E的作用为吸收多余的Cl2,进行尾气处理,故答案未:吸收多余的Cl2,进行尾气处理。
17. CaSO4 2H2O和Na2SO4 10H2O CuFeS2 III 4 11O2 2 8 2.5 0.5 自50s开始SO2、SO3的浓度保持不变 固体由白色变为蓝色 H2O 除去CO2中的SO2,并检验是否除尽 酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽。
解析:(1)从图2可知X、Y分别代表+6价的盐和-2价的盐,图1中只有CuFeS2和CaSO4 2H2O、Na2SO4 10H2O,故答案为:CaSO4 2H2O和Na2SO4 10H2O;CuFeS2;
(2)①氧化还原反应的特征是元素的化合价发生变化,过程I 由FeS2中- 1价的S转化为SO2中+4价的S,故是氧化还原反应,过程II是由SO2中+4价的S转化为SO3中+6价的S,故是氧化还原反应,过程III由SO3转化为H2SO4没有化合价的改变,故不是氧化还原反应,答案为:III;
②根据反应前后元素种类不变发现,反应物在缺少O元素,故反应物中由O2,再黄铁矿( FeS2 ) 中S为- 1价转化为SO2中+4价,Fe为+2价转化为Fe2O3中+3价,故可1molFeS2在反应中共失去11mole-,而1molO2由0价转化为-2价,得到4mole-,根据得失电子守恒,最小公倍数为44,故FeS2前面的系数为4,氧气的系数为11,再根据硫原子守恒可知SO2的系数为8,根据铁原子守恒可知Fe2O3的系数为2,故答案为:4 ;11O2 ;2;8;
③根据过程II 中发生的反应进行计算: ,可知a=5-2.5=2.5,从表中可知,自50s以后SO2、SO3的浓度均不再改变,说明从50s开始反应达到化学平衡,故b=0.5,化学平衡的重要标志是正逆反应速率相等,体系各组分的浓度保持不变,故答案为:2.5; 0.5 ;自50s开始SO2、SO3的浓度保持不变;
(3) ①浓硫酸与木炭在加热条件下生成SO2、CO2和H2O,故浓硫酸与木炭反应的化学方程式是 ,故答案为:;
②装置 A 中装有白色的无水硫酸铜遇水会变为蓝色的硫酸铜晶体(CuSO4 5H2O),故装置 A 中的实验现象是固体由白色变为蓝色,证明的产物是H2O;故答案为:固体由白色变为蓝色;H2O;
③装置B是检验SO2的,现象为品红溶液红色褪去,由于CO2、SO2均能使澄清石灰水变浑浊,故需先出去SO2再检验CO2,故装置 C 的作用是除去CO2中的SO2,并根据褪色情况检验SO2是否除尽,故答案为:除去CO2中的SO2,并检验是否除尽;
④CO2不能使酸性高锰酸钾溶液褪色,而SO2可以,SO2使酸性高锰酸钾溶液褪色的过程也使吸收SO2的过程,故酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,故答案为:酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽
一、选择题
1.溶液中某光学活性卤化物的消旋反应为:。某温度下X和Y的浓度随时间的变化曲线如图所示。
下列说法错误的是
A.
B.L点处X的转化率为20%
C.时,
D.Y溶液含有少量X,经足够长时间后
2.为考查和共存对制氢的影响,在0.1MPa下,的混合气体反应达到平衡时,反应物的转化率、产物的物质的量分数随温度的变化分别如图-1、图-2所示,体系中的反应主要有:
Ⅰ、
Ⅱ、
Ⅲ、
下列说法不正确的是
A.反应
B.图-1中曲线①表示转化率随温度的变化
C.温度700℃时,反应Ⅰ是体系中的主要反应
D.反应Ⅲ的平衡常数:K(400℃)>K(700℃)
3.下列实验操作、现象及相应的结论均正确的是
选项 实验操作 现象 结论
A 将NO2球分别浸泡在冰水和热水中 冰水中NO2球颜色变浅 正反应吸热
B 向某无色溶液中滴加稀硫酸 产生有刺激性气味的气体和淡黄色沉淀 该无色溶液中一定含有Na2S2O3
C 取两支试管M和N,各加入2 mL0.01 mol/L酸性KMnO4溶液,向M试管中滴加2 mL 0.01 mol/L H2C2O4溶液,向N试管中滴加2 mL 0.02 mol/L H2C2O4溶液 M、N试管均褪色,且褪色时间:M>N 其他条件相同时,增大反应物浓度,反应速率增大
D 向两支均盛有2 mL 5% H2O2溶液的试管中分别滴入0.1mol/L的FeCl3和CuCl2溶液各1mL 前者产生气泡较快 不同的催化剂对同一反应的催化效果不同
A.A B.B C.C D.D
4.时,含等浓度的与的混合溶液中发生反应 ,时刻,改变某一外界条件继续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是
已知:时,该反应的化学平衡常数。
A.若时刻未改变外界条件,则此时该反应:
B.若时刻反应达到平衡,则时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率:(表示内的平均反应速率,表示内的平均反应速率)
D.内的平均反应速率为
5.在盛有载氧体的恒容密闭容器中充入空气[氧气的体积分数为21%],发生反应: 。平衡时随反应温度T变化的曲线如图所示。下列说法错误的是
A.升高温度,平衡向逆反应方向移动导致增大
B.必须控制才能保持载氧体活性
C.在1030℃时加入催化剂,
D.985℃时的平衡转化率约为58%
6.下列有关反应 的平衡移动的判断正确的是
选项 条件 平衡移动判断
A , 升高温度,平衡向左移动
B , 降低温度,平衡向右移动
C , 压缩体积,平衡向左移动
, 加入催化剂,平衡向右移动
A.A B.B C.C D.D
7.在一定条件下,恒容密闭容器中反应2A(g)2B(g)+C(g) ΔH>0,达到平衡后,能使B的浓度增大的措施是
A.升温 B.充入惰性气体 C.加压 D.减少A的浓度
8.室温下,某溶液初始时仅溶有M,同时发生以下两个反应:①;②。反应①的速率可表示为,反应②的速率可表示为(、为速率常数)。体系中生成物浓度(c)随时间(t)变化的曲线如图所示。下列说法错误的是
A.0~10s内,M的平均反应速率
B.温度不变,反应过程中的值不变
C.反应①的活化能比反应②的活化能大
D.温度升高,体系中的值减小
9.在一定条件下恒容密闭容器中反应达到平衡后,能使Z的浓度增大的措施是
A.降温 B.使用催化剂 C.升温 D.减少X的浓度
10.工业上可用、或、CO反应制备清洁能源,已知和的燃烧热分别为286kJ/mol、283kJ/ mol,和反应制备的能量变化如图所示,部分化学键的键能如表所示:
化学键 O=O C=O C≡O
键能/(kJ/mol) 498 x 1076
下列说法错误的是
A.x=804
B.等质量的和完全燃烧,放出的热量多
C.用、制备的热化学方程式为
D.升高温度有利于提高的产率和增大反应速率
二、填空题
11.回答下列问题:
Ⅰ.一定条件下,在容积为的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)达到平衡后加压,C的含量_______(填写“变大”“变小”或“不变”)。
(2)该反应的反应速率v随时间t的关系如图所示。
①根据图判断,在时刻改变的外界条件是_______。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______。
Ⅱ.在密闭容器中充入一定量的,发生反应 。如图所示为气体分解生成和的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是_______(填“吸热反应”或“放热反应”)。
(4)N点的体积分数是_______。
(5)M点对应的平衡常数_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
12.一种新型催化剂用于NO和CO的反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 t(℃) NO初始浓度(mol/L) CO初始浓度(mol/L) 催化剂的比表面积(m2/g)
Ⅰ 280 1.2×10-3 5.80×10-3 82
Ⅱ 280 1.2×10-3 b 124
Ⅲ 350 a 5.80×10-3 82
(1)请将表中数据补充完整:a___,b___。
(2)能验证温度对化学反应速率规律的是实验___(填实验序号)。
(3)实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线___(填“甲”或“乙”)。
(4)在容积固定的容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是___(不定项选择);
A.容器内CO浓度不变
B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2)
D.容器内混合气体密度保持不变
13.氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
途径一,用水和天然气作原料一步反应制得。
途径二,用煤和水作原料经多步反应制得。
请回答下列问题:
(1)途径一反应的还原产物是____。
(2)途径二中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0
①上述反应达到平衡后,为提高CO的转化率,下列措施中正确的是____(填写序号)。
A.增大压强 B.降低温度 C.增大H2O(g)的浓度 D.使用催化剂
②已知1000K时,上述反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始时c(H2O):c(CO)不低于____。
(3)目前常用氨气处理硝酸生产的工业尾气,在400℃左右且有催化剂存在的情况下,氨气能把NO(g)还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为286kJ mol-1
N2(g)+3H2(g)2NH3(g) △H=-92.4kJ mol-1
N2(g)+O2(g)2NO(g) △H=+180kJ mol-1
试写出氨气与NO(g)反应生成无毒气体和液态水的热化学方程式____。
14.在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,A2、B2和C的浓度分别为0.5 mol/L、0.1mol/L、1.6 mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
(1)a、b应满足的关系是___________。
(2)a的取值范围是___________。
15.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)此反应的化学平衡常数为:______________________。
(2)如果缩小容器容积(温度不变),则平衡________(填“右移”、“左移”或“不移动”),平衡体系中混合气体的密度________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各mol,其他条件均不变,要使平衡时各物质的质量分数与原平衡相等,则还应加入________mol B。
(4)若向原平衡体系再投入A,B,C,D各1 mol,平衡________(填“右移”、“左移”或“不移动”)。
16.亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理:,实验装置如图所示。
回答下列问题:
(1)仪器a的名称为____________,写出装置A中发生反应的离子方程式____________
(2)请从化学平衡的角度解释饱和NaCl溶液的作用___________________
(3)装置C中装入的化学试剂为______________
(4)装药品之后,关闭________(填“”,“”,“”,下同),打开__________,引发A中反应,通入一段时间气体,其目的是排除_____________ 对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应。
(5)装置E的作用为___________________
17.硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:
①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s 0 10 20 30 40 50 60 70 100
c ( SO2 ) / ( mol L -1) 10 7 5 3.5 2 1 1 1 1
c ( O2 ) / ( mol L -1) 5 3.5 a 1.75 1 0.5 b 0.5 0.5
c ( SO3 ) / ( mol L -1) 0 3 5 6.5 8 9 9 9 9
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题
①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。
【参考答案】
一、选择题
1.C
解析:A.由图可知,两个点都不是平衡点,则,A正确;
B.由图可知,X的起始浓度为0.1mol/L ,L点时X的浓度为0.08mol/L,则转化的X的浓度为0.02mol/L,X的转化率为20%,B正确;
C.化学反应速率为平均速率,根据方程式可知,X和Y的计量系数相同,故某个时间段的,但某个时刻无法根据平均速率公式求解,C错误;
D.由图可知,经足够长时间后,反应达到平衡,两者的浓度相等,则两者的物质的量相等,D正确;
故选C。
2.D
解析:A.根据盖斯定律可知反应CH4(g)+H2O(g)=3H2(g)+CO(g)可由反应I-反应Ⅱ得到,则 ΔH=+260.4kJ mol 1-(+34.0kJ mol 1)= +226.4kJ mol 1,A正确;
B.反应I、Ⅱ、Ⅲ三个反应都由CO2参加反应,所以在几种反应物中转化率最高,三个反应都是吸热反应,升高温度CO2转化率提高,故图-1中曲线①表示CO2转化率随温度的变化,B正确;
C.反应I、Ⅱ、Ⅲ三个反应都是吸热反应,升高温度平衡正反应方向移动,根据图-2可知,升高温度COS、H2O的物质的量分数没有增加,CO、H2的物质的量分数不断增加,说明提高温度后对反应Ⅱ、Ⅲ影响较小,而对反应I影响较大,故温度700℃时,反应Ⅰ是体系中的主要反应,C正确;
D.反应Ⅲ为吸热反应,温度升高平衡正向移动,平衡常数变大,故反应进行平衡常数:K(400℃)<K(700℃),D错误;
故答案为:D。
3.D
解析:A.将NO2球分别浸泡在冰水和热水中,冰水中NO2球颜色变浅,说明温度降低平衡右移,所以正反应是放热反应,A错误;
B.向某无色溶液中滴加稀硫酸,产生有刺激性气味的气体和淡黄色沉淀,所以该无色溶液中一定含有,B错误;
C.取两支试管M和N,各加入2 mL0.01 mol/L酸性KMnO4溶液,向M试管中滴加2 mL 0.01 mol/L H2C2O4溶液,向N试管中滴加2 mL 0.02 mol/L H2C2O4溶液,两试管中高锰酸钾均过量,颜色变化不易观察,C错误;
D.向两支均盛有2 mL 5% H2O2溶液的试管中分别滴入0.1mol/L的FeCl3和CuCl2溶液各1mL,前者产生气泡较快,说明不同的催化剂对同一反应的催化效果不同,D正确;
故选D。
4.C
解析:A.因为混合溶液中与等浓度,因此Ag+与Fe2+浓度相等,根据反应式可知,Ag+、Fe2+、Fe3+三者系数比为1:1:1,即三者变化量相等。若时刻未改变外界条件,则浓度商,因此此时该反应处于平衡状态, ,A错误;
B.该反应为放热反应,升温会导致平衡逆向移动,根据图像可知,时刻改变条件后,平衡正向移动,因此时刻改变的条件不是升温,B错误;
C.因为Ag+、Fe2+系数比为1:1,因此v(Fe2+)=v(Ag+),且,根据图像,=,=,因此,C正确;
D.根据图像,内的平均反应速率为,D错误。
故选C。
5.C
解析:A.题述反应是放热反应,升高温度,平衡向左移动,体积分数增大,故A正确;
B.当温度等于1030℃时,的体积分数与空气中的相等,如果继续升温,体积分数大于21%,载氧体变为脱氧体,失去反应活性,故B正确;
C.平衡时,加入催化剂,不会使平衡移动,体积分数不变,故C错误;
D.取100 mol空气,占21 mol,设985℃下平衡时消耗的物质的量为,则,解得:,平衡转化率为,故D正确;
选C。
6.A
解析:A.即放热反应,升高温度平衡向左移动,A正确;
B.即吸热反应,降低温度平衡向左移动,B错误;
C.即等体积反应,压缩体积速度加快,平衡不移动,C错误;
D.催化剂不影响平衡移动,D错误;
故选A。
7.A
解析:A.该反应正反应是吸热反应,升高温度,平衡正向移动,B的浓度增大,选项A正确;
B.反应在恒容密闭容器中进行,充入惰性气体,气体的总压增大,但参与反应的气体浓度增不变,平衡不移动,B的浓度不变,选项B错误;
C.增大压强,平衡向气体体积缩小的逆反应方向移动,B的浓度减小,选项C错误;
D.减少A的浓度,平衡逆向移动,B的浓度减小,选项D错误;
答案选A。
8.D
解析:A.由反应可知M的浓度变化量等于Y和Z的浓度变化量之和,0~10s内,M的平均反应速率,故A正确;
B. ,温度不变时,比值不变,则恒定不变,v1与成正比,v2与成正比,则的值不变,故B正确;
C.由图可知相同条件下,Z的速率大于Y,可知反应②的速率大于反应①,根据反应活化能越大反应速率越小,可知反应①的活化能比反应②的活化能大,故C正确;
D.反应的吸放热情况不确定,稳定升高平衡的移动方向不确定,因此体系中的值无法确定,故D错误;
故选:D。
9.C
解析:A.该反应是吸热反应,降低温度向放热反应的方向进行,平衡逆向移动,A项错误;
B.使用催化剂,反应速率增大,平衡不移动,B项错误;
C.升高温度向吸热反应方向进行,平衡正向移动,C项错误;
D.减少X是浓度,平衡逆向移动,D项错误;
答案选C。
10.D
解析:A.根据的燃烧热写出① ,反应物键能总和-生成物键能总和,解得,A项正确;
B.和的燃烧热分别为286kJ/mol、283kJ/ mol,所以等质量的和完全燃烧,放出的热量多,B项正确;
C.根据的燃烧热写出② ,根据题图写出③,,由③+②-①可得 ,C项正确;
D.制备的反应为放热反应,升高温度平衡逆向移动,的产率降低,D项错误;
故选D。
二、填空题
11.(1)变大
(2) 升高温度 a
(3)放热反应
(4)40%
(5)1
解析:(1)根据图示可知:随着反应的进行,A、B物质的量减少,C物质的量增加,说明A、B是反应物,C是生成物,3 mol后三种物质的物质的量都不再发生变化,说明该反应为可逆反应。在3 min内A、B、C改变的物质的量分别是0.3 mol、0.6 mol、0.6 mol,改变的物质的量的比为1:2:2,故该反应方程式为:A(g)+2B(g)2C(g)。该反应的正反应是气体体积减小的反应,在其他条件不变时,增大压强,化学平衡向气体体积减小的正反应方向移动,故达到平衡后C的含量变大;
(2)①已知达到平衡后,降低温度,A的体积分数减小。,说明降低温度化学平衡正向移动,该反应的正反应为放热反应。在t3时刻改变条件时正、逆反应速率都增大且逆反应速率大于正反应速率,化学平衡逆向移动,故改变的条件是升高温度;
②t3时刻改变条件后化学平衡逆向移动,导致A的转化率降低;t5时刻正、逆反应速率都增大但仍然相等,化学平衡不移动,平衡正向移动A的转化率增大,所以A转化率最大时生成物C体积分数最大的是a点;
(3)根据图像可知:在压强不变时,升高温度H2S的平衡转化率增大,说明升高温度,化学平衡正向移动,则该反应的正反应为吸热反应,则逆反应为放热反应;
(4)根据图示可知:在N点时H2S的平衡转化率为50%,假设反应开始时n(H2S)=1 mol,则平衡时n(H2S)=0.5 mol,n(H2)=0.5 mol,n(S2)=0.25 mol,在相同外界条件下气体的体积比等于气体的物质的量的比,则H2的体积分数为;
(5)假设反应开始时加入1 mol H2S,M点时H2S的平衡转化率为50%,则根据物质反应转化关系可知平衡时n(H2S)=0.5 mol,n(H2)=0.5 mol,n(S2)=0.25 mol,n(总)=0.5 mol+0.5 mol+0.25 mol=1.25 mol,则p(H2S)=p(H2)=,p(S2)= ,所以该反应的化学平衡常数Kp=。
12.2×10-3 5.80×10-3 Ⅰ和Ⅲ 乙 BD
解析:(1)根据表格中的已知数据可知,Ⅰ和Ⅲ对比是要验证温度对化学反应速率的影响,则温度要不同,其他条件相同,所以a=1.2×10-3;Ⅰ和Ⅱ对比是要验证催化剂的比表面积对化学反应速率的影响,要催化剂的比表面积不同,其他条件相同,b=5.80×10-3;
(2)实验Ⅰ和Ⅲ只有温度不同,其他条件相同,可以验证温度对化学反应速率的影响;
(3)实验Ⅱ所用催化剂的表面积更大,与反应物的接触面积也就越大,反应速率更快,所用曲线乙表示实验Ⅱ;
(4)A.可逆反应达到平衡时正逆反应速率相等,各物质的浓度不再改变,所以CO的浓度不变可以说明反应达到平衡,故A不符合题意;
B.NO的浓度和CO2的浓度大小关系与初始投料和转化率有关,平衡时不一定相等,故B符合题意;
C.当v逆(NO)=2v正(N2)时,根据方程式可知2v正(N2)= v正(NO),所以此时v逆(NO)= v正(NO),说明反应达到平衡,故C不符合题意;
D.该反应中反应物和生成物均为气体,所以气体的总质量不变,容器恒容,所以气体的密度一直不变,所以密度不变不能说明反应平衡,故D符合题意;
综上所述答案为BD。
13.(1)氢气
(2) BC 13.8
(3)4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH=-2071.2kJ mol-1
解析:(1)途径一是用水和甲烷作原料一步反应制得氢气,氢元素的化合价降低,所以氢气是还原产物;
(2)①A.增大压强,平衡不会发生移动,CO转化率不变,故不选A;
B.降低温度,平衡正向进行,CO转化率增大,故选B;
C.增大水蒸气的浓度,平衡向着正方向进行,CO转化率增大,故选C;
D.催化剂不会引起化学平衡的移动,CO转化率不变,故不选D;
故选BC;
②设CO的起始浓度为xmol,的起始浓度为ymol,则转化的CO的最小值为,
根据平衡常数列式:,解得,故此只要此值大于,转化率就会超过;
(3)氢气的燃烧热为,则氢气的燃烧的热化学方程式为:
①
②
③
根据盖斯定律①×6-②×2-③×3得。
14. a-b=0.4 0.4≤a≤1.3
解析:(1)A2(g)+B2(g) 2C(g),参加反应的A2和B2的浓度相同,故二者平衡浓度之差应等于起始浓度之差,即a-b=0.5-0.1=0.4;
(2)若平衡从正向建立,C的起始浓度为0时,a取最大值,则
(a-0.5)×2=1.6,解得a=1.3
若平衡从逆向建立,B的起始浓度为0时,a取最小值,则
a+0.1=0.5,解得a=0.4
故a的取值范围为:0.4≤a≤1.3。
15.5 不移动 增大 左移
解析:(1)根据方程式3A(g)+B(g)2C(g)+2D(g)中物质转化关系可知:若反应达到平衡时产生0.8 mol D,必然同时产生0.8 mol C,反应消耗1.2 mol A和0.4 mol B,平衡时各种气体的物质的量分别是n(A)=2 mol-1.2 mol=0.8 mol,n(B)=2 mol-0.4 mol=1.6 mol,n(C)= n(D)=0.8 mol,由于容器的容积是2 L,则各种气体的平衡浓度分别是c(A)=0.4 mol/L,c(B)=0.8 mol/L,c(C)=c(D)=0.4 mol/L,带入平衡常数表达式可得K==0.5;
(2)如果缩小容器容积(温度不变),容器内气体压强增大。由于该反应是反应前后气体物质的量不变的反应,增大压强,化学平衡不移动;
由于反应混合物都是气体,反应前后气体的总质量不变,气体体积减小,则混合气体的密度会增大;
(3)由于平衡时各物质的质量分数与原平衡相等,则平衡为等效平衡。反应前后气体体积不变,根据化学计量数一边倒转化到方程式的左边,满足n(A):n(B)=1:1即可。认为C和D各mol是由A、B反应产生的,则相当于开始时加入A:=2 mol,加入B: mol,假设还应该加入B的物质的量为x,则2 mol:(x+) mol=2 mol:2 mol,解得x=mol;
(4)若向原平衡体系再投入A,B,C,D各1 mol,则此时各种气体的浓度c(A)=(0.4+0.5)mol/L=0.9 mol/L,c(B)=(0.8+0.5)mol=1.3 mol/L,c(C)=c(D)= (0.4+0.5)mol/L=0.9 mol/L,Qc=>0.5,则化学平衡向左移动。
16. 圆底烧瓶 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动 P2O5或硅胶 和 排除装置中的空气 吸收多余的Cl2,进行尾气处理
【分析】本题以实验室制备氯气并模拟NO和Cl2反应来制备NOCl,装置A为氯气的发生装置,发生的反应为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B为除去Cl2中的HCl,装置C为干燥氯气,装置D为制备NOCl的发生装置,发生的反应为,装置E为尾气吸收装置,据此分析解题。
解析:(1)由实验装置图可知,仪器a的名称为圆底烧瓶,装置A为实验室制备氯气的发生装置,故发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,故答案为:圆底烧瓶;MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
(2)由于Cl2溶于水后发生离子反应为:Cl2+H2OH++Cl-+HClO,故使用饱和NaCl溶液增大了氯离子浓度,使化学平衡逆向移动,故可以使用饱和食盐水来除去Cl2中的HCl,故答案为:Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动;
(3)由分析可知,装置C为干燥Cl2装置,故装置C中装入的化学试剂为P2O5或硅胶,故答案为:P2O5或硅胶;
(4)由题干信息可知,亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,同时装置内的氧气会和一氧化氮反应,故实验过程中,发生之前需将装置中的空气排空,故装药品之后,关闭,打开和,引发A中反应,通入一段时间气体,其目的是排除装置中的空气对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应,故答案为:;和;排除装置中的空气;
(5)由分析可知,装置E的作用为吸收多余的Cl2,进行尾气处理,故答案未:吸收多余的Cl2,进行尾气处理。
17. CaSO4 2H2O和Na2SO4 10H2O CuFeS2 III 4 11O2 2 8 2.5 0.5 自50s开始SO2、SO3的浓度保持不变 固体由白色变为蓝色 H2O 除去CO2中的SO2,并检验是否除尽 酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽。
解析:(1)从图2可知X、Y分别代表+6价的盐和-2价的盐,图1中只有CuFeS2和CaSO4 2H2O、Na2SO4 10H2O,故答案为:CaSO4 2H2O和Na2SO4 10H2O;CuFeS2;
(2)①氧化还原反应的特征是元素的化合价发生变化,过程I 由FeS2中- 1价的S转化为SO2中+4价的S,故是氧化还原反应,过程II是由SO2中+4价的S转化为SO3中+6价的S,故是氧化还原反应,过程III由SO3转化为H2SO4没有化合价的改变,故不是氧化还原反应,答案为:III;
②根据反应前后元素种类不变发现,反应物在缺少O元素,故反应物中由O2,再黄铁矿( FeS2 ) 中S为- 1价转化为SO2中+4价,Fe为+2价转化为Fe2O3中+3价,故可1molFeS2在反应中共失去11mole-,而1molO2由0价转化为-2价,得到4mole-,根据得失电子守恒,最小公倍数为44,故FeS2前面的系数为4,氧气的系数为11,再根据硫原子守恒可知SO2的系数为8,根据铁原子守恒可知Fe2O3的系数为2,故答案为:4 ;11O2 ;2;8;
③根据过程II 中发生的反应进行计算: ,可知a=5-2.5=2.5,从表中可知,自50s以后SO2、SO3的浓度均不再改变,说明从50s开始反应达到化学平衡,故b=0.5,化学平衡的重要标志是正逆反应速率相等,体系各组分的浓度保持不变,故答案为:2.5; 0.5 ;自50s开始SO2、SO3的浓度保持不变;
(3) ①浓硫酸与木炭在加热条件下生成SO2、CO2和H2O,故浓硫酸与木炭反应的化学方程式是 ,故答案为:;
②装置 A 中装有白色的无水硫酸铜遇水会变为蓝色的硫酸铜晶体(CuSO4 5H2O),故装置 A 中的实验现象是固体由白色变为蓝色,证明的产物是H2O;故答案为:固体由白色变为蓝色;H2O;
③装置B是检验SO2的,现象为品红溶液红色褪去,由于CO2、SO2均能使澄清石灰水变浑浊,故需先出去SO2再检验CO2,故装置 C 的作用是除去CO2中的SO2,并根据褪色情况检验SO2是否除尽,故答案为:除去CO2中的SO2,并检验是否除尽;
④CO2不能使酸性高锰酸钾溶液褪色,而SO2可以,SO2使酸性高锰酸钾溶液褪色的过程也使吸收SO2的过程,故酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,故答案为:酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽
