2.4化学反应的调控 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 448.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 22:35:53 | ||
图片预览



文档简介
2.4化学反应的调控同步练习题
一、选择题
1.下列哪种因素改变,会导致一个可逆反应的平衡常数会改变
A.压强 B.温度 C.催化剂 D.反应物浓度
2.T℃时,在某恒压密闭容器中充入2molSO2(g)、1molO2(g),发生反应,达到平衡时,O2(g)的物质的量分数为,下列说法可以说明该反应达到平衡的是
A.容器内的压强不再发生变化时
B.容器内气体的密度不变时
C.SO3(g)的体积分数为40%时
D.SO2(g)的转化率为50%时
3.在温度,体积一定的密闭容器中发生下列反应: 。下列叙述正确的是
A.增大容器体积,减小压强,不变
B.升高温度,K减小
C.加入催化剂,可增大CO平衡时的转化率
D.向其中加入一定量的氮气,平衡正向移动
4.下列叙述正确的是
A.反应NH3(g)+ HCl(g)=NH4Cl(s)在室温下能自发进行,该反应的 H >0
B.已知C(石墨,s)=C(金刚石,s) H >0, 则石墨比金刚石稳定
C.C(s)+H2O(g) CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
D.密闭容器中存在: N2O4(g)=2NO2(g),当=1:2时,该反应到达限度
5.利用和在催化剂的作用下合成甲醇,发生的反应为。下列说法正确的是
A.达到平衡后,增加的浓度,减小
B.工业上可采用升高温度来提高的转化率
C.催化剂能加快反应速率,使平衡向正反应方向移动
D.增大压强提高了甲醇的产率,但对化学平衡常数无影响
6.的KI溶液与的溶液发生反应:,达到平衡。下列说法中正确的是
A.该反应的平衡常数
B.加入少量KC1固体,平衡正向移动,溶液颜色变深
C.加入萃取后,上层溶液呈紫红色,下层溶液呈浅绿色
D.经萃取后,向水层溶液中滴入KSCN溶液,呈血红色
7.在一定温度下,容积固定为2L的密闭容器中充入和,发生反应:,4min末反应达到平衡,测得为0.1mol,下列说法正确的是
A.该体系密度不发生变化,可说明该反应达到平衡状态
B.从开始到平衡时的平均反应速率
C.平衡后的转化率为40%
D.平衡后再通入,能提高的转化率
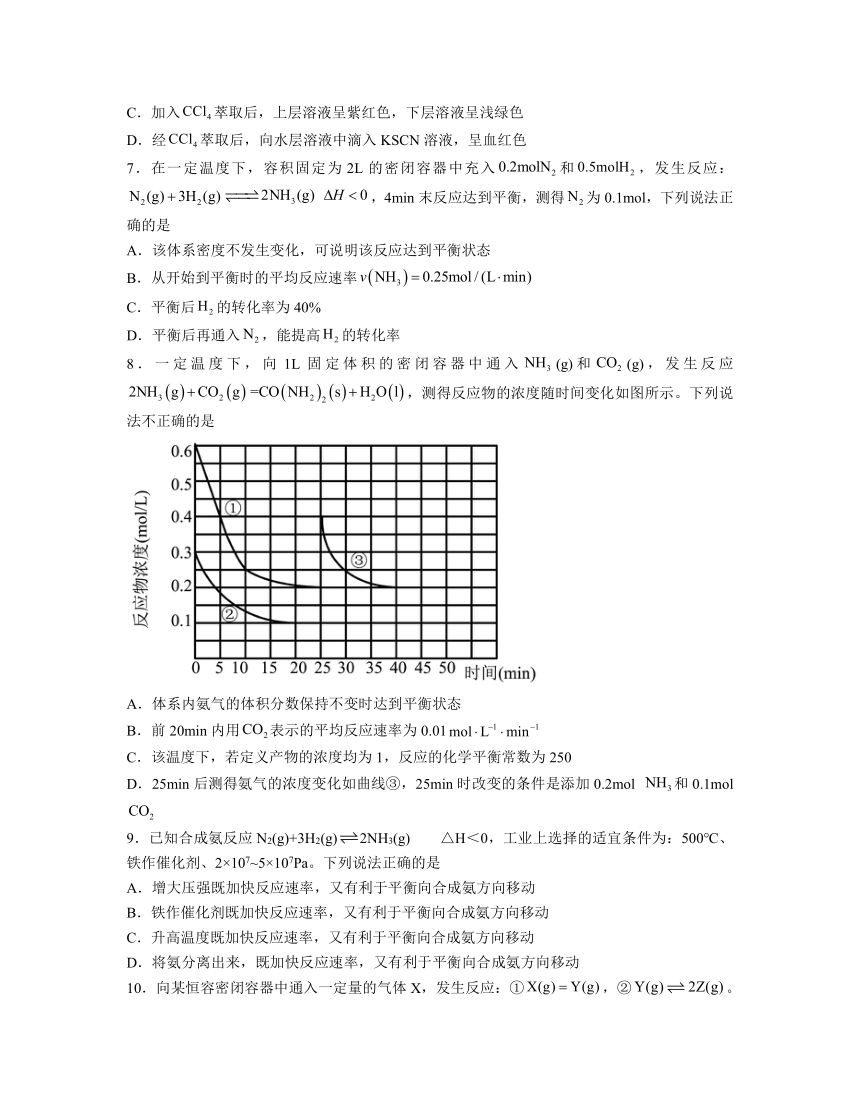
8.一定温度下,向1L固定体积的密闭容器中通入(g)和(g),发生反应,测得反应物的浓度随时间变化如图所示。下列说法不正确的是
A.体系内氨气的体积分数保持不变时达到平衡状态
B.前20min内用表示的平均反应速率为0.01
C.该温度下,若定义产物的浓度均为1,反应的化学平衡常数为250
D.25min后测得氨气的浓度变化如曲线③,25min时改变的条件是添加0.2mol 和0.1mol
9.已知合成氨反应N2(g)+3H2(g)2NH3(g) △H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa。下列说法正确的是
A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动
B.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动
C.升高温度既加快反应速率,又有利于平衡向合成氨方向移动
D.将氨分离出来,既加快反应速率,又有利于平衡向合成氨方向移动
10.向某恒容密闭容器中通入一定量的气体X,发生反应:①,②。下列说法错误的是
A.曲线a为Z的浓度变化曲线
B.反应进行2min时,
C.反应进行10min后,体系达到平衡状态
D.反应②的平衡常数K=16.2
11.加热N2O5,依次发生的反应为:①N2O5(g)N2O3(g)+O2(g),②N2O3(g)N2O(g)+O2(g)。在容积为2L的密闭容器中充入5molN2O5,加热到t℃,达到平衡状态后O2为4mol,N2O3为2mol,则t℃时反应①的平衡常数为
A.1 B.2 C.4 D.5
12.在某一密闭容器中,若反应达到平衡后,保持温度不变,将该密闭容器的体积增加一倍,再次达到新的平衡时,下列说法正确的是
A.容器内混合气体的密度减小 B.平衡向正反应方向移动
C.氢气的浓度增大 D.氨气的体积分数增大
13.在密闭容器中发生如下反应:xA(g) +yB(g) xC(g),达到平衡后测得A的浓度为0.20 mol·L-1。恒温增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.45 mol·L-1。下列说法正确的是
A.x+y>z B.平衡正向移动
C.B的转化率提高 D.C的体积分数降低
14.在2 L的恒容密闭容器中充入1mol X(g)和2 mol Y(g),发生反应:,测得在不同温度下、相同时间内X(g)与Z(g)的百分含量如图所示。下列说法错误的是
A.从反应开始到各点时的平均化学反应速率:
B.a点时,Y(g)的转化率为50%
C.T3℃下,平衡常数K=4
D.降低温度,有利于提高Z(g)的平衡产率
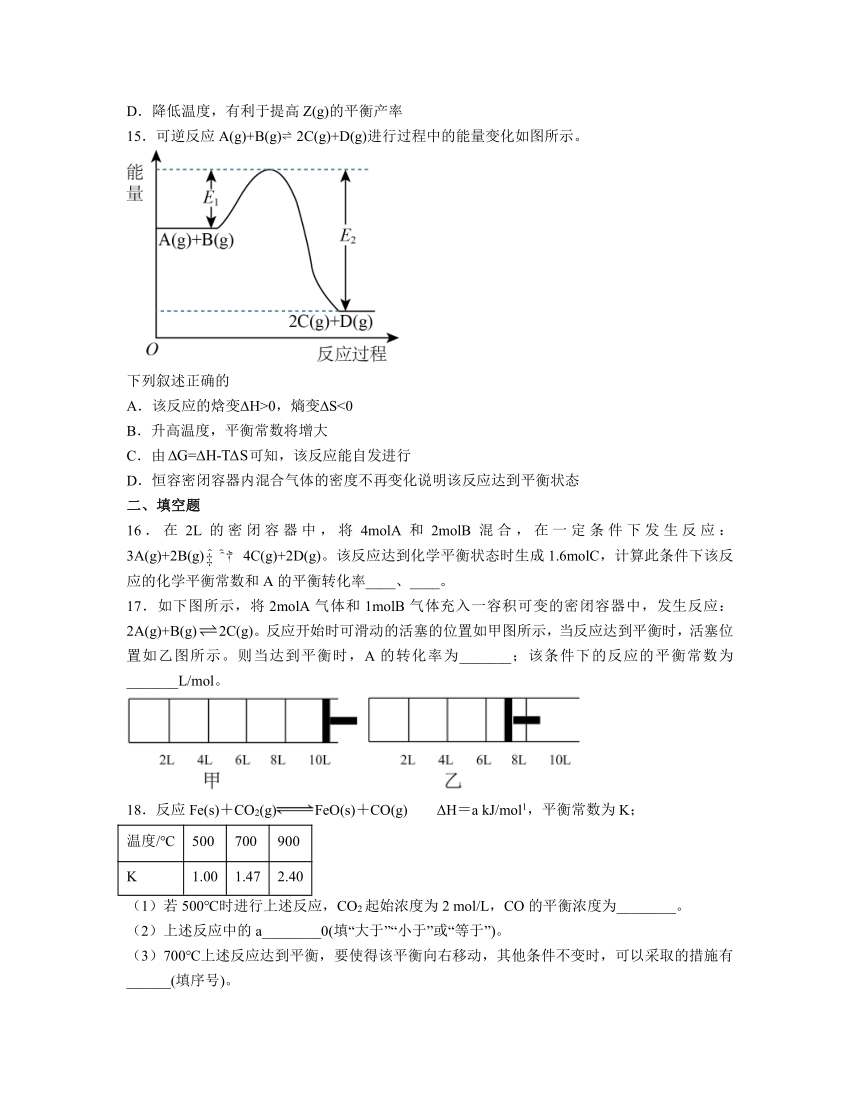
15.可逆反应A(g)+B(g) 2C(g)+D(g)进行过程中的能量变化如图所示。
下列叙述正确的
A.该反应的焓变 H>0,熵变 S<0
B.升高温度,平衡常数将增大
C.由可知,该反应能自发进行
D.恒容密闭容器内混合气体的密度不再变化说明该反应达到平衡状态
二、填空题
16.在2L的密闭容器中,将4molA和2molB混合,在一定条件下发生反应:3A(g)+2B(g)4C(g)+2D(g)。该反应达到化学平衡状态时生成1.6molC,计算此条件下该反应的化学平衡常数和A的平衡转化率____、____。
17.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中,发生反应:2A(g)+B(g)2C(g)。反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为_______;该条件下的反应的平衡常数为_______L/mol。
18.反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ/mol1,平衡常数为K;
温度/℃ 500 700 900
K 1.00 1.47 2.40
(1)若500℃时进行上述反应,CO2起始浓度为2 mol/L,CO的平衡浓度为________。
(2)上述反应中的a________0(填“大于”“小于”或“等于”)。
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有______(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
19.已知反应2NO(g)+2CO(g)N2(g)+CO2(g) △H=-746.8kJ mol-1。测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。若向1L密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为,则=_______(保留3位有效数字)。
20.已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+ B(g) C(g) H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”);
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______;
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)若使温度、压强都保持和题干中的一样不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时:A的转化率为_______(精确到0.01%),容器的容积为_______L。
21.如图I,在恒压密闭容器M中加入2molA和2molB,起始时容器体积为VL,发生如下反应并达到化学平衡状态:2A(?)+B(?) cC(g);△H<0,平衡时A、B、C的物质的量之比为1:3:4,C的物质的量为ymol。
(1)根据题中数据计算,x=_______、Y=_______;
(2)如图II,在体积为VL的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图III(t0时达平衡),平衡时容器中C的物质的量为zmol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
可能的情形 A、B是否为气态 z与y的大小关系 M(B)与M(C)的大小关系(M表示摩尔质量)
A B
① 是 不是 z=y 无法确定
② ___ __ ___ ___
③ __ __ ___ ___
【参考答案】
一、选择题
1.B
解析:化学平衡常数只与温度有关,与压强、催化剂、反应物浓度等其他因素均无关,故选B。
2.B
【分析】T℃时,在某恒压密闭容器中充入2molSO2(g)、1molO2(g),发生反应,达到平衡时,O2(g)的物质的量分数为,设参加反应O2的物质的量为x,则可建立如下三段式:
依题意可得:,则x=0.6mol。
解析:A. 因为容器为恒压容器,压强始终不变,所以当容器内的压强不再发生变化时,反应不一定达平衡状态,A不符合题意;
B.因为反应前后气体的分子数不等,容器内压强恒定,则达平衡时,混合气的体积减小,而混合气的质量不变,则混合气的密度改变,当容器内气体的密度不变时,反应达平衡状态,B符合题意;
C.平衡时,SO3(g)的体积分数为=50%,则SO3(g)的体积分数为40%时,反应未达平衡,C不符合题意;
D.平衡时,SO2(g)的转化率为=60%,则当SO2(g)的转化率为50%时,反应未达平衡,D不符合题意;
故选B。
3.B
解析:A.增大容器体积,体系内所有物质浓度均减小,减小,故A不选;
B.此反应的正反应是放热反应,升高温度平衡向逆反应方向进行,即升高温度,K减小,故B选;
C.加入催化剂,可加快CO单位时间内的反应速率,但不破坏平衡状态,平衡时转化率不变,故C不选;
D.加入氮气,并没有改变反应体系的浓度,平衡不被破坏,平衡不移动,故D不选;
故选B。
4.B
解析:A.该反应为气体减小的反应, S<0,若要存在某温度使得 H-T S<0成立,则 H必须小于0,A错误;
B.该反应焓变大于0,为吸热反应,说明石墨的能量较低,所以石墨更稳定,B正确;
C.该反应为气体系数之和增大的反应,缩小容器体积增大压强,平衡逆向移动,水蒸气的平衡转化率减小,C错误;
D.平衡时二者的浓度不再改变,但当=1:2时并不能说明浓度不再改变,故不能说明反应达到限度,D错误;
综上所述答案为B。
5.D
解析:A.的大小只与温度、压强有关,与浓度无关,不随浓度的变化而改变,A项错误;
B.此反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,H2的转化率减小,B项错误;
C.加入催化剂能加快反应速率,但平衡不移动,C项错误;
D.对于该反应增大压强,平衡向正向移动,甲醇产率增加,化学平衡常数只与温度有关,增大压强对化学平衡常数无影响,D项正确;
答案选D。
6.D
解析:A.根据离子方程式得到该反应的平衡常数,故A错误;
B.加入少量KC1固体,对离子方程式中的离子浓度改变,因此平衡不移动,溶液颜色不变,故B错误;
C.加入萃取后,由于四氯化碳密度比水大,因此下层溶液呈紫红色,上层溶液呈浅绿色,故C错误;
D.经萃取后,由于反应是可逆反应,因此溶液中依然还有铁离子,向水层溶液中滴入KSCN溶液,呈血红色,故D正确。
综上所述,答案为D。
7.D
解析:A.该反应过程中气体体积和质量都不变,体系密度不变,当该体系密度不发生变化,不能说明该反应达到平衡状态,故A错误;
B.4min末反应达到平衡,测得为0.1mol,从开始到平衡时的平均反应速率,故B错误;
C.平衡后的转化率为=60%,故C错误;
D.平衡后再通入,平衡正向移动,的转化率增大,故D正确;
故选D。
8.A
【分析】由方程式可知,NH3的转化量是CO2的3倍,则曲线①代表NH3,曲线②代表CO2,以此解答。
解析:A.根据图示,添加的(g)和(g)物质的量比为2:1,无论反应是否进行,氨气的体积分数永远是三分之二,A错误;
B.20min达到平衡时,二氧化碳浓度减少了0.2,故反应速率为0.01,B正确;
C.平衡常数,C正确;
D.25min时,氨气浓度变为0.4,可知增大了0.2,重新达到平衡时,氨气浓度不变。则二氧化碳的浓度也不变,根据反应方程式可推出25min时,二氧化碳的浓度为,即增加了0.1,D正确;
故选A。
9.A
解析:A.该反应正反应是气体体积减小的反应,增大压强反应速率加快,平衡向正反应方向移动,有利用氨气的合成,故A正确;
B.催化剂加快反应速率,但不能影响平衡移动,故B错误;
C.升高温度加快反应速率,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,不利于氨气的合成,故C错误;
D.将氨分离出,有利于平衡向合成氨方向移动,但反应速率降低,故D错误;
故答案为:A。
10.B
解析:A.由题意可知,反应①不可逆,反应②为可逆反应,曲线a起点为0,且随着反应的进行一直增大,故曲线a为Z的浓度变化曲线,A项正确;
B.设反应进行到2min时,反应了xmol/L的X,生成2ymol/L的Z: ,
由图可知,反应进行2min时,,则0.5-x=x-y=2y,解得x=0.3,y=0.1,即=0.2mol/L,B项错误;
C.反应进行10min时,Y、Z的浓度保持不变,达到平衡状态,C项正确;
D.反应进行10min时,达到平衡,X全部反应生成Y为0.5mol/L,Y再转化为Z,Y剩下0.05mol/L,则有:
反应②的平衡常数K==16.2,D项正确;
故选B。
11.B
解析:加热N2O5,依次发生的反应为:①N2O5(g)N2O3(g)+O2(g),②N2O3(g)N2O(g)+O2(g)。在容积为2L的密闭容器中充入5mol N2O5,加热到t℃,达到平衡状态后O2为4mol,N2O3为2mol,建立三段式,,x+y=4,x-y=2,x=3mol,y=1mol,则t℃时反应①的平衡常数,故答案为B。
综上所述,答案为B。
12.A
解析:A.组分都是气体,气体总质量保持不变,扩大容器的体积,气体体积增大,根据密度的定义,容器内混合气体的密度减小,故A说法正确;
B.温度不变,容器的体积增加一倍,各组分的浓度同等倍数减小,根据勒夏特列原理,平衡向逆反应方向移动,故B说法错误;
C.氢气的物质的量会增加,同时体积也增大,根据勒夏特列原理,氢气的浓度较小,故C说法错误;
D.平衡逆向移动,消耗氨气,氨气的体积分数减小,故D说法错误;
答案为A。
13.D
解析:A.在恒温下增大压强使容器容积缩小为原来的一半的瞬间,A的浓度是0.40mol/L。但再次达到平衡时,测得A的浓度为0.45mol/L,这说明增大压强,平衡向左移动,即正反应是体积增大的,即x+yB.平衡逆向移动,B错误;
C.平衡逆向移动,B的转化率降低,C错误;
D.平衡逆向移动,C的体积分数降低。D正确;
答案选D。
14.A
【分析】在2 L的恒容密闭容器中充入1mol X(g)和2 mol Y(g),发生反应:,设a点时,参加反应X的物质的量为nmol,则可建立如下三段式:
则1-n=n,n=0.5mol。
解析:A.对于可逆反应,温度越高,反应速率越快,T1<T2<T3,则从反应开始到各点时的平均化学反应速率:,A错误;
B.a点时,Y(g)的转化率为=50%,B正确;
C.T3 ℃下,平衡常数K==4,C正确;
D.从图中可以看出,当反应进行到b点时,反应达平衡状态,升高温度,X的百分含量增大,平衡逆向移动,则正反应为放热反应,所以降低温度,有利于提高Z(g)的平衡产率,D正确;
故选A。
15.C
【分析】根据图象可知,可逆反应A(g)+B(g) 2C(g)+D(g)中反应物的总能量大于生成物的总能量,该反应属于放热反应。
解析:A.根据上述分析可知,该反应的焓变 H<0,可逆反应A(g)+B(g) 2C(g)+D(g)是气体分子数增大的反应,所以熵变 S>0,A错误;
B.因为该反应反应物的总能量大于生成物的总能量,反应属于放热反应,所以升高温度,平衡常数减小,B错误;
C.反应放热, H<0,反应是气体分子数增大的反应,所以 S>0,由可知, G<0,该反应能自发进行,C正确;
D.恒容密闭容器内混合气体的密度等于气体的总质量与容器体积的比,属于恒量,所以密度始终保持不变,气体的密度不变不能说明反应达到平衡状态,D错误;
故选C。
二、填空题
16.38 30%
解析:容器体积为2L,则初始投料为2mol/LA和1mol/LB,平衡生成的C的浓度为0.8mol/L,根据题意列三行式有
所以该反应的平衡常数K=≈0.38,A的平衡转化率为×100%=30%。
17. 90% 5670L/mol
解析:假设反应过程中消耗A的物质的量为x,列式计算:
依据图1和图2反应开始和平衡后气体体积之比在相同条件下等于物质的量之比,则:(2-x+1-0.5x+x)∶(2+1)=7∶10,解得:x=1.8mol,A的转化率=×100%=90%;
A、B、C的平衡浓度分别为c(A)==mol/L、c(B)==mol/L、c(C)==mol/L,故平衡常数K===5670L/mol。
18.mol·L-1或1 mol/L 大于 BC
解析:(1)设CO的平衡浓度为xmol/L,则CO2的平衡浓度为2mol/L-xmol/L,因此根据平衡常数表达式可知,解得x=1,所以CO的平衡浓度为1mol/L;
(2)升高温度平衡常数增大,这说明升高温度平衡向正反应方向进行,即上述反应中的a大于0。
(3)A.反应前后体积不变,缩小反应器体积平衡不移动,A错误;B.通入CO2,增大反应物浓度,平衡向正反应方向进行,B正确;C.正反应是吸热反应,温度升高到900℃,平衡向正反应方向进行,C正确;D.使用合适的催化剂平衡不移动,D错误;答案选BC。
19.247
解析:若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则
,平衡时v正=v逆,则k正 c2(NO) c2(CO)=k逆 c(N2) c2(CO2),则= =0.247,故答案为:0.247。
20. 加快 D 57.14%
解析:(1)升高温度,活化分子百分数增大,反应速率加快,故答案为:加快;
(2)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,若只增大A或B的浓度,平衡向正反应移动,若只增大C的浓度,平衡向逆反应移动,若同等程度增大A、B、C的浓度,平衡向正反应移动;如果是加入其它不反应的气体引起压强的增大,反应混合物的浓度不发生变化,平衡不移动,故平衡平衡可能移动,可能不移动,故选D;
(3) 恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同,故在密闭容器中充入2mol A和2molB,反应达到平衡时C的体积分数为40%;令物质的量为a,则:故 =40%,解得a=,故A的平衡转化率为:;故平衡后反应混合物的总的物质的量为,同温同压下体积之比等于物质的量之比,所以容器的体积为=;故答案为:57.14%;。
【点睛】本题考查影响反应速率的因素、化学平衡的有关计算、等效平衡等,注意对等效平衡的理解,掌握等效平衡规律。
21.(1) x=2 y=1.6
(2) 是 是 z解析:略
一、选择题
1.下列哪种因素改变,会导致一个可逆反应的平衡常数会改变
A.压强 B.温度 C.催化剂 D.反应物浓度
2.T℃时,在某恒压密闭容器中充入2molSO2(g)、1molO2(g),发生反应,达到平衡时,O2(g)的物质的量分数为,下列说法可以说明该反应达到平衡的是
A.容器内的压强不再发生变化时
B.容器内气体的密度不变时
C.SO3(g)的体积分数为40%时
D.SO2(g)的转化率为50%时
3.在温度,体积一定的密闭容器中发生下列反应: 。下列叙述正确的是
A.增大容器体积,减小压强,不变
B.升高温度,K减小
C.加入催化剂,可增大CO平衡时的转化率
D.向其中加入一定量的氮气,平衡正向移动
4.下列叙述正确的是
A.反应NH3(g)+ HCl(g)=NH4Cl(s)在室温下能自发进行,该反应的 H >0
B.已知C(石墨,s)=C(金刚石,s) H >0, 则石墨比金刚石稳定
C.C(s)+H2O(g) CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
D.密闭容器中存在: N2O4(g)=2NO2(g),当=1:2时,该反应到达限度
5.利用和在催化剂的作用下合成甲醇,发生的反应为。下列说法正确的是
A.达到平衡后,增加的浓度,减小
B.工业上可采用升高温度来提高的转化率
C.催化剂能加快反应速率,使平衡向正反应方向移动
D.增大压强提高了甲醇的产率,但对化学平衡常数无影响
6.的KI溶液与的溶液发生反应:,达到平衡。下列说法中正确的是
A.该反应的平衡常数
B.加入少量KC1固体,平衡正向移动,溶液颜色变深
C.加入萃取后,上层溶液呈紫红色,下层溶液呈浅绿色
D.经萃取后,向水层溶液中滴入KSCN溶液,呈血红色
7.在一定温度下,容积固定为2L的密闭容器中充入和,发生反应:,4min末反应达到平衡,测得为0.1mol,下列说法正确的是
A.该体系密度不发生变化,可说明该反应达到平衡状态
B.从开始到平衡时的平均反应速率
C.平衡后的转化率为40%
D.平衡后再通入,能提高的转化率
8.一定温度下,向1L固定体积的密闭容器中通入(g)和(g),发生反应,测得反应物的浓度随时间变化如图所示。下列说法不正确的是
A.体系内氨气的体积分数保持不变时达到平衡状态
B.前20min内用表示的平均反应速率为0.01
C.该温度下,若定义产物的浓度均为1,反应的化学平衡常数为250
D.25min后测得氨气的浓度变化如曲线③,25min时改变的条件是添加0.2mol 和0.1mol
9.已知合成氨反应N2(g)+3H2(g)2NH3(g) △H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa。下列说法正确的是
A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动
B.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动
C.升高温度既加快反应速率,又有利于平衡向合成氨方向移动
D.将氨分离出来,既加快反应速率,又有利于平衡向合成氨方向移动
10.向某恒容密闭容器中通入一定量的气体X,发生反应:①,②。下列说法错误的是
A.曲线a为Z的浓度变化曲线
B.反应进行2min时,
C.反应进行10min后,体系达到平衡状态
D.反应②的平衡常数K=16.2
11.加热N2O5,依次发生的反应为:①N2O5(g)N2O3(g)+O2(g),②N2O3(g)N2O(g)+O2(g)。在容积为2L的密闭容器中充入5molN2O5,加热到t℃,达到平衡状态后O2为4mol,N2O3为2mol,则t℃时反应①的平衡常数为
A.1 B.2 C.4 D.5
12.在某一密闭容器中,若反应达到平衡后,保持温度不变,将该密闭容器的体积增加一倍,再次达到新的平衡时,下列说法正确的是
A.容器内混合气体的密度减小 B.平衡向正反应方向移动
C.氢气的浓度增大 D.氨气的体积分数增大
13.在密闭容器中发生如下反应:xA(g) +yB(g) xC(g),达到平衡后测得A的浓度为0.20 mol·L-1。恒温增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.45 mol·L-1。下列说法正确的是
A.x+y>z B.平衡正向移动
C.B的转化率提高 D.C的体积分数降低
14.在2 L的恒容密闭容器中充入1mol X(g)和2 mol Y(g),发生反应:,测得在不同温度下、相同时间内X(g)与Z(g)的百分含量如图所示。下列说法错误的是
A.从反应开始到各点时的平均化学反应速率:
B.a点时,Y(g)的转化率为50%
C.T3℃下,平衡常数K=4
D.降低温度,有利于提高Z(g)的平衡产率
15.可逆反应A(g)+B(g) 2C(g)+D(g)进行过程中的能量变化如图所示。
下列叙述正确的
A.该反应的焓变 H>0,熵变 S<0
B.升高温度,平衡常数将增大
C.由可知,该反应能自发进行
D.恒容密闭容器内混合气体的密度不再变化说明该反应达到平衡状态
二、填空题
16.在2L的密闭容器中,将4molA和2molB混合,在一定条件下发生反应:3A(g)+2B(g)4C(g)+2D(g)。该反应达到化学平衡状态时生成1.6molC,计算此条件下该反应的化学平衡常数和A的平衡转化率____、____。
17.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中,发生反应:2A(g)+B(g)2C(g)。反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为_______;该条件下的反应的平衡常数为_______L/mol。
18.反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ/mol1,平衡常数为K;
温度/℃ 500 700 900
K 1.00 1.47 2.40
(1)若500℃时进行上述反应,CO2起始浓度为2 mol/L,CO的平衡浓度为________。
(2)上述反应中的a________0(填“大于”“小于”或“等于”)。
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有______(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
19.已知反应2NO(g)+2CO(g)N2(g)+CO2(g) △H=-746.8kJ mol-1。测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。若向1L密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为,则=_______(保留3位有效数字)。
20.已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+ B(g) C(g) H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”);
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______;
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)若使温度、压强都保持和题干中的一样不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时:A的转化率为_______(精确到0.01%),容器的容积为_______L。
21.如图I,在恒压密闭容器M中加入2molA和2molB,起始时容器体积为VL,发生如下反应并达到化学平衡状态:2A(?)+B(?) cC(g);△H<0,平衡时A、B、C的物质的量之比为1:3:4,C的物质的量为ymol。
(1)根据题中数据计算,x=_______、Y=_______;
(2)如图II,在体积为VL的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图III(t0时达平衡),平衡时容器中C的物质的量为zmol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
可能的情形 A、B是否为气态 z与y的大小关系 M(B)与M(C)的大小关系(M表示摩尔质量)
A B
① 是 不是 z=y 无法确定
② ___ __ ___ ___
③ __ __ ___ ___
【参考答案】
一、选择题
1.B
解析:化学平衡常数只与温度有关,与压强、催化剂、反应物浓度等其他因素均无关,故选B。
2.B
【分析】T℃时,在某恒压密闭容器中充入2molSO2(g)、1molO2(g),发生反应,达到平衡时,O2(g)的物质的量分数为,设参加反应O2的物质的量为x,则可建立如下三段式:
依题意可得:,则x=0.6mol。
解析:A. 因为容器为恒压容器,压强始终不变,所以当容器内的压强不再发生变化时,反应不一定达平衡状态,A不符合题意;
B.因为反应前后气体的分子数不等,容器内压强恒定,则达平衡时,混合气的体积减小,而混合气的质量不变,则混合气的密度改变,当容器内气体的密度不变时,反应达平衡状态,B符合题意;
C.平衡时,SO3(g)的体积分数为=50%,则SO3(g)的体积分数为40%时,反应未达平衡,C不符合题意;
D.平衡时,SO2(g)的转化率为=60%,则当SO2(g)的转化率为50%时,反应未达平衡,D不符合题意;
故选B。
3.B
解析:A.增大容器体积,体系内所有物质浓度均减小,减小,故A不选;
B.此反应的正反应是放热反应,升高温度平衡向逆反应方向进行,即升高温度,K减小,故B选;
C.加入催化剂,可加快CO单位时间内的反应速率,但不破坏平衡状态,平衡时转化率不变,故C不选;
D.加入氮气,并没有改变反应体系的浓度,平衡不被破坏,平衡不移动,故D不选;
故选B。
4.B
解析:A.该反应为气体减小的反应, S<0,若要存在某温度使得 H-T S<0成立,则 H必须小于0,A错误;
B.该反应焓变大于0,为吸热反应,说明石墨的能量较低,所以石墨更稳定,B正确;
C.该反应为气体系数之和增大的反应,缩小容器体积增大压强,平衡逆向移动,水蒸气的平衡转化率减小,C错误;
D.平衡时二者的浓度不再改变,但当=1:2时并不能说明浓度不再改变,故不能说明反应达到限度,D错误;
综上所述答案为B。
5.D
解析:A.的大小只与温度、压强有关,与浓度无关,不随浓度的变化而改变,A项错误;
B.此反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,H2的转化率减小,B项错误;
C.加入催化剂能加快反应速率,但平衡不移动,C项错误;
D.对于该反应增大压强,平衡向正向移动,甲醇产率增加,化学平衡常数只与温度有关,增大压强对化学平衡常数无影响,D项正确;
答案选D。
6.D
解析:A.根据离子方程式得到该反应的平衡常数,故A错误;
B.加入少量KC1固体,对离子方程式中的离子浓度改变,因此平衡不移动,溶液颜色不变,故B错误;
C.加入萃取后,由于四氯化碳密度比水大,因此下层溶液呈紫红色,上层溶液呈浅绿色,故C错误;
D.经萃取后,由于反应是可逆反应,因此溶液中依然还有铁离子,向水层溶液中滴入KSCN溶液,呈血红色,故D正确。
综上所述,答案为D。
7.D
解析:A.该反应过程中气体体积和质量都不变,体系密度不变,当该体系密度不发生变化,不能说明该反应达到平衡状态,故A错误;
B.4min末反应达到平衡,测得为0.1mol,从开始到平衡时的平均反应速率,故B错误;
C.平衡后的转化率为=60%,故C错误;
D.平衡后再通入,平衡正向移动,的转化率增大,故D正确;
故选D。
8.A
【分析】由方程式可知,NH3的转化量是CO2的3倍,则曲线①代表NH3,曲线②代表CO2,以此解答。
解析:A.根据图示,添加的(g)和(g)物质的量比为2:1,无论反应是否进行,氨气的体积分数永远是三分之二,A错误;
B.20min达到平衡时,二氧化碳浓度减少了0.2,故反应速率为0.01,B正确;
C.平衡常数,C正确;
D.25min时,氨气浓度变为0.4,可知增大了0.2,重新达到平衡时,氨气浓度不变。则二氧化碳的浓度也不变,根据反应方程式可推出25min时,二氧化碳的浓度为,即增加了0.1,D正确;
故选A。
9.A
解析:A.该反应正反应是气体体积减小的反应,增大压强反应速率加快,平衡向正反应方向移动,有利用氨气的合成,故A正确;
B.催化剂加快反应速率,但不能影响平衡移动,故B错误;
C.升高温度加快反应速率,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,不利于氨气的合成,故C错误;
D.将氨分离出,有利于平衡向合成氨方向移动,但反应速率降低,故D错误;
故答案为:A。
10.B
解析:A.由题意可知,反应①不可逆,反应②为可逆反应,曲线a起点为0,且随着反应的进行一直增大,故曲线a为Z的浓度变化曲线,A项正确;
B.设反应进行到2min时,反应了xmol/L的X,生成2ymol/L的Z: ,
由图可知,反应进行2min时,,则0.5-x=x-y=2y,解得x=0.3,y=0.1,即=0.2mol/L,B项错误;
C.反应进行10min时,Y、Z的浓度保持不变,达到平衡状态,C项正确;
D.反应进行10min时,达到平衡,X全部反应生成Y为0.5mol/L,Y再转化为Z,Y剩下0.05mol/L,则有:
反应②的平衡常数K==16.2,D项正确;
故选B。
11.B
解析:加热N2O5,依次发生的反应为:①N2O5(g)N2O3(g)+O2(g),②N2O3(g)N2O(g)+O2(g)。在容积为2L的密闭容器中充入5mol N2O5,加热到t℃,达到平衡状态后O2为4mol,N2O3为2mol,建立三段式,,x+y=4,x-y=2,x=3mol,y=1mol,则t℃时反应①的平衡常数,故答案为B。
综上所述,答案为B。
12.A
解析:A.组分都是气体,气体总质量保持不变,扩大容器的体积,气体体积增大,根据密度的定义,容器内混合气体的密度减小,故A说法正确;
B.温度不变,容器的体积增加一倍,各组分的浓度同等倍数减小,根据勒夏特列原理,平衡向逆反应方向移动,故B说法错误;
C.氢气的物质的量会增加,同时体积也增大,根据勒夏特列原理,氢气的浓度较小,故C说法错误;
D.平衡逆向移动,消耗氨气,氨气的体积分数减小,故D说法错误;
答案为A。
13.D
解析:A.在恒温下增大压强使容器容积缩小为原来的一半的瞬间,A的浓度是0.40mol/L。但再次达到平衡时,测得A的浓度为0.45mol/L,这说明增大压强,平衡向左移动,即正反应是体积增大的,即x+y
C.平衡逆向移动,B的转化率降低,C错误;
D.平衡逆向移动,C的体积分数降低。D正确;
答案选D。
14.A
【分析】在2 L的恒容密闭容器中充入1mol X(g)和2 mol Y(g),发生反应:,设a点时,参加反应X的物质的量为nmol,则可建立如下三段式:
则1-n=n,n=0.5mol。
解析:A.对于可逆反应,温度越高,反应速率越快,T1<T2<T3,则从反应开始到各点时的平均化学反应速率:,A错误;
B.a点时,Y(g)的转化率为=50%,B正确;
C.T3 ℃下,平衡常数K==4,C正确;
D.从图中可以看出,当反应进行到b点时,反应达平衡状态,升高温度,X的百分含量增大,平衡逆向移动,则正反应为放热反应,所以降低温度,有利于提高Z(g)的平衡产率,D正确;
故选A。
15.C
【分析】根据图象可知,可逆反应A(g)+B(g) 2C(g)+D(g)中反应物的总能量大于生成物的总能量,该反应属于放热反应。
解析:A.根据上述分析可知,该反应的焓变 H<0,可逆反应A(g)+B(g) 2C(g)+D(g)是气体分子数增大的反应,所以熵变 S>0,A错误;
B.因为该反应反应物的总能量大于生成物的总能量,反应属于放热反应,所以升高温度,平衡常数减小,B错误;
C.反应放热, H<0,反应是气体分子数增大的反应,所以 S>0,由可知, G<0,该反应能自发进行,C正确;
D.恒容密闭容器内混合气体的密度等于气体的总质量与容器体积的比,属于恒量,所以密度始终保持不变,气体的密度不变不能说明反应达到平衡状态,D错误;
故选C。
二、填空题
16.38 30%
解析:容器体积为2L,则初始投料为2mol/LA和1mol/LB,平衡生成的C的浓度为0.8mol/L,根据题意列三行式有
所以该反应的平衡常数K=≈0.38,A的平衡转化率为×100%=30%。
17. 90% 5670L/mol
解析:假设反应过程中消耗A的物质的量为x,列式计算:
依据图1和图2反应开始和平衡后气体体积之比在相同条件下等于物质的量之比,则:(2-x+1-0.5x+x)∶(2+1)=7∶10,解得:x=1.8mol,A的转化率=×100%=90%;
A、B、C的平衡浓度分别为c(A)==mol/L、c(B)==mol/L、c(C)==mol/L,故平衡常数K===5670L/mol。
18.mol·L-1或1 mol/L 大于 BC
解析:(1)设CO的平衡浓度为xmol/L,则CO2的平衡浓度为2mol/L-xmol/L,因此根据平衡常数表达式可知,解得x=1,所以CO的平衡浓度为1mol/L;
(2)升高温度平衡常数增大,这说明升高温度平衡向正反应方向进行,即上述反应中的a大于0。
(3)A.反应前后体积不变,缩小反应器体积平衡不移动,A错误;B.通入CO2,增大反应物浓度,平衡向正反应方向进行,B正确;C.正反应是吸热反应,温度升高到900℃,平衡向正反应方向进行,C正确;D.使用合适的催化剂平衡不移动,D错误;答案选BC。
19.247
解析:若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则
,平衡时v正=v逆,则k正 c2(NO) c2(CO)=k逆 c(N2) c2(CO2),则= =0.247,故答案为:0.247。
20. 加快 D 57.14%
解析:(1)升高温度,活化分子百分数增大,反应速率加快,故答案为:加快;
(2)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,若只增大A或B的浓度,平衡向正反应移动,若只增大C的浓度,平衡向逆反应移动,若同等程度增大A、B、C的浓度,平衡向正反应移动;如果是加入其它不反应的气体引起压强的增大,反应混合物的浓度不发生变化,平衡不移动,故平衡平衡可能移动,可能不移动,故选D;
(3) 恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同,故在密闭容器中充入2mol A和2molB,反应达到平衡时C的体积分数为40%;令物质的量为a,则:故 =40%,解得a=,故A的平衡转化率为:;故平衡后反应混合物的总的物质的量为,同温同压下体积之比等于物质的量之比,所以容器的体积为=;故答案为:57.14%;。
【点睛】本题考查影响反应速率的因素、化学平衡的有关计算、等效平衡等,注意对等效平衡的理解,掌握等效平衡规律。
21.(1) x=2 y=1.6
(2) 是 是 z
