高中化学人教版(2019)必修第二册7.3.1乙醇(共19张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册7.3.1乙醇(共19张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 22:40:10 | ||
图片预览




文档简介
(共19张PPT)
第七章 有机化合物
第三节 乙醇与乙酸
第1课时 乙醇
含酒精:25% - 68%
1、酒香不怕巷子深
2、高烧病人擦酒精降温
3、洗头时,在水中加适量的啤酒洗起来清新爽头,油污洗即净。
4、各种酒类的酒精度从3%~68%不等
无色、易挥发,有特殊香味的液体
易挥发
能溶解多种有机物和无机物,是常用的有机溶剂
与水以任意比例互溶
体积分数
含酒精:3% - 5%
含酒精:8% - 15%
任务一、通过生活中接触到的乙醇总结物理性质
有特殊香味
颜色:
气味:
密度:
溶解性:
挥发性:
熔沸点:
无色
比水小,密度为0.789g/cm3
较低(沸点:78.5℃,熔点: 117.3℃)
能与水以任意比互溶,能溶解多种有机物和无机物
易挥发
(需密封保存!)
1、乙醇的物理性质
任务一、通过生活中接触到的乙醇总结物理性质
状态:
液体
已知乙醇分子式为C2H6O,你能拼出几种模型?
任务二、根据C、H、O成键规律,拼插球棍模型
H—C —C—O—H
H H
H H
H—C —O—C—H
H H
H H
A B
信息提示:
乙醇含有氢氧键,水也含有氢氧键。
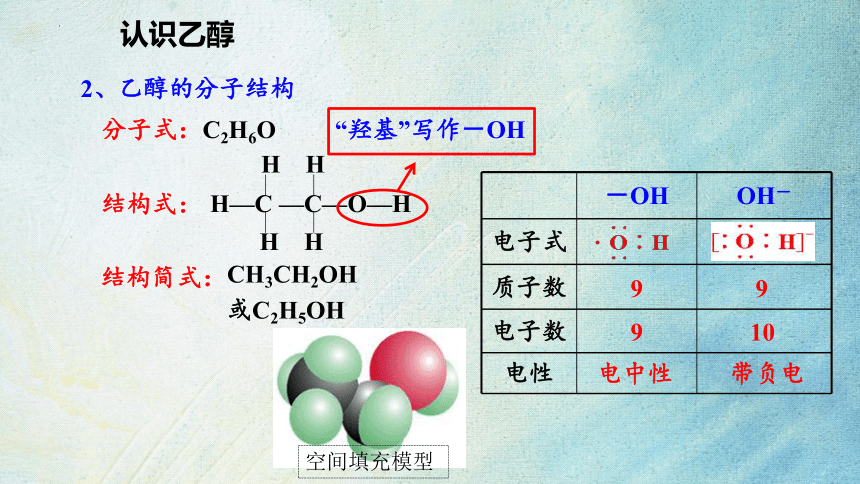
认识乙醇
2、乙醇的分子结构
分子式:C2H6O
结构式:
结构简式:
H—C —C—O—H
H H
H H
“羟基”写作-OH
CH3CH2OH
或C2H5OH
-OH OH-
电子式
质子数
电子数
电性
9 9
9 10
电中性 带负电
空间填充模型
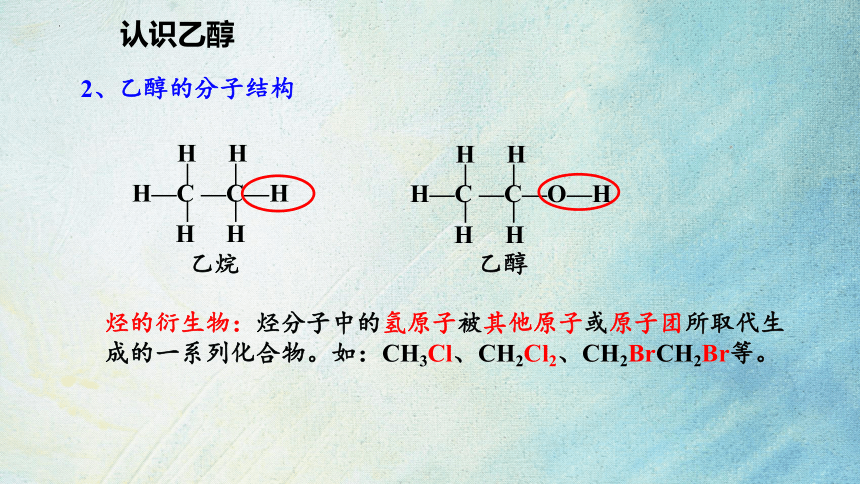
认识乙醇
2、乙醇的分子结构
乙烷 乙醇
H—C —C—H
H H
H H
H—C —C—O—H
H H
H H
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代生成的一系列化合物。如:CH3Cl、CH2Cl2、CH2BrCH2Br等。
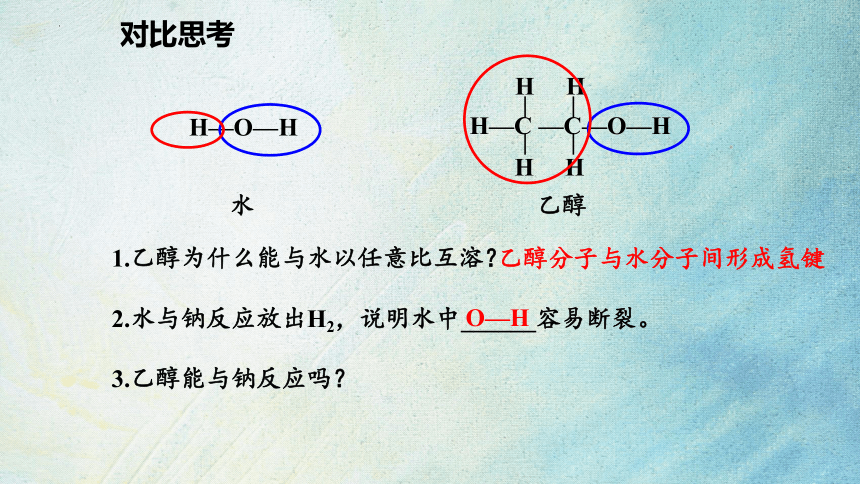
1.乙醇为什么能与水以任意比互溶?
2.水与钠反应放出H2,说明水中______容易断裂。
3.乙醇能与钠反应吗?
对比思考
H—O—H
H—C —C—O—H
H H
H H
水 乙醇
O—H
乙醇分子与水分子间形成氢键
任务三、乙醇与钠的探究实验
实验操作:在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃。再将干燥的小烧杯罩在火焰上,待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入澄清石灰水,观察现象。
实验现象:
a.钠开始沉于试管底部,有无色无味气体产生,一段时间后钠块上浮,逐渐变小至消失;
b.点燃,火焰呈淡蓝色;
c.用干燥的小烧杯罩在火焰上,烧杯内壁有液滴产生;
d.向烧杯中加入澄清石灰水,澄清石灰水不变浑浊。
CH3CH2OH + Na → CH3CH2ONa + H2↑
H—C —C—O—H
H H
H H
①该反应属于 反应。
②反应速率比水慢,说明羟基中的H原子的活泼性:乙醇 水。
注意:
①处O—H键断开
①
认识乙醇
3、乙醇的化学性质
(1)乙醇与钠反应
置换
<
2 2 2
官能团:决定有机化合物特性的原子或原子团。
-OH就是乙醇的官能团。
点燃
CH3CH2OH + 3O2 2CO2+ 3H2O
①燃烧(彻底氧化)
现象:
认识乙醇
3、乙醇的化学性质
(2)氧化反应
淡蓝色火焰,放出大量的热。
固体酒精
认识乙醇
家中不易大量囤积酒精
1
安全使用酒精
2
注意室内通风
3
乙醇使用注意事项
避光存放,防止倾倒破损
4
存放时避免儿童拿到
5
铜匠用酒精清洗生锈的铜丝
真?假?
车内喷洒酒精消毒,小汽车被烧
员工用酒精在办公室内进行喷洒消毒,引发火灾。
实验操作:向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。
任务四、乙醇的催化氧化探究实验
实验现象:
铜丝加热变黑,插入乙醇中又变为红色。闻到刺激性气味。
铜丝变黑:
又变为红色:
反应原理:
2Cu +O2 2CuO
H O
│
H- C-C-H
│
H
H O-H
│ │
H-C- C-H
│ │
H H
+ CuO
+ Cu
△
乙醛
醛基,-CHO
乙醇分子脱去羟基H和羟基碳上的H,并形成一个碳氧双键。
+ H2O
②乙醇的催化氧化
3、乙醇的化学性质
(2)氧化反应
认识乙醇
铜丝变黑:
又变为红色:
2Cu +O2 2CuO (1)
H O
│
H- C-C-H
│
H
H O-H
│ │
H-C- C-H
│ │
H H
+ CuO
+H2O+Cu(2)
△
乙醛
(1) + (2) ×2 并整理:
2CH3CH2OH + O2
2CH3CHO + 2H2O
催化剂
△
乙醛
Cu或Ag
③与强氧化剂反应
3、乙醇的化学性质
(2)氧化反应
认识乙醇
交警检查司机是否酒驾的装置中,含有橙色的酸性重铬酸钾(K2Cr2O7),当其遇到乙醇时,橙色变绿色,由此可判断司机酒后驾车。
CH3CH2OH CH3COOH
K2Cr2O7,H+
或KMnO4,H+
长期过量饮酒,会使人发胖,还会损伤肝脏;血液中高浓度的乙醛(一级致癌物)还能致癌,并容易导致心血管病急性发作。因此,青少年不应饮酒,机动车驾驶员严禁酒后驾车。劝君少饮一杯酒!
过量饮酒的危害
4、乙醇的常见用途:
认识乙醇
酒
燃料
化工原料和溶剂
消毒剂
2 2 2
课堂小结
组成 结构 性质 转化 应用
乙醇
与Na反应:
彻底燃烧:
催化氧化:
CH3CH2OH + Na → CH3CH2ONa + H2↑
点燃
CH3CH2OH + 3O2 2CO2+ 3H2O
2CH3CH2OH + O2
2CH3CHO + 2H2O
催化剂
△
化学反应
与钠反应
催化氧化
键的断裂
断①键
断①③或①⑥键
H
O
C
H
C
①
②
③
④
⑤
H
H
H
H
燃烧
断①②③④⑤⑥键
⑥
练习
谢谢观看
第七章 有机化合物
第三节 乙醇与乙酸
第1课时 乙醇
含酒精:25% - 68%
1、酒香不怕巷子深
2、高烧病人擦酒精降温
3、洗头时,在水中加适量的啤酒洗起来清新爽头,油污洗即净。
4、各种酒类的酒精度从3%~68%不等
无色、易挥发,有特殊香味的液体
易挥发
能溶解多种有机物和无机物,是常用的有机溶剂
与水以任意比例互溶
体积分数
含酒精:3% - 5%
含酒精:8% - 15%
任务一、通过生活中接触到的乙醇总结物理性质
有特殊香味
颜色:
气味:
密度:
溶解性:
挥发性:
熔沸点:
无色
比水小,密度为0.789g/cm3
较低(沸点:78.5℃,熔点: 117.3℃)
能与水以任意比互溶,能溶解多种有机物和无机物
易挥发
(需密封保存!)
1、乙醇的物理性质
任务一、通过生活中接触到的乙醇总结物理性质
状态:
液体
已知乙醇分子式为C2H6O,你能拼出几种模型?
任务二、根据C、H、O成键规律,拼插球棍模型
H—C —C—O—H
H H
H H
H—C —O—C—H
H H
H H
A B
信息提示:
乙醇含有氢氧键,水也含有氢氧键。
认识乙醇
2、乙醇的分子结构
分子式:C2H6O
结构式:
结构简式:
H—C —C—O—H
H H
H H
“羟基”写作-OH
CH3CH2OH
或C2H5OH
-OH OH-
电子式
质子数
电子数
电性
9 9
9 10
电中性 带负电
空间填充模型
认识乙醇
2、乙醇的分子结构
乙烷 乙醇
H—C —C—H
H H
H H
H—C —C—O—H
H H
H H
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代生成的一系列化合物。如:CH3Cl、CH2Cl2、CH2BrCH2Br等。
1.乙醇为什么能与水以任意比互溶?
2.水与钠反应放出H2,说明水中______容易断裂。
3.乙醇能与钠反应吗?
对比思考
H—O—H
H—C —C—O—H
H H
H H
水 乙醇
O—H
乙醇分子与水分子间形成氢键
任务三、乙醇与钠的探究实验
实验操作:在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃。再将干燥的小烧杯罩在火焰上,待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入澄清石灰水,观察现象。
实验现象:
a.钠开始沉于试管底部,有无色无味气体产生,一段时间后钠块上浮,逐渐变小至消失;
b.点燃,火焰呈淡蓝色;
c.用干燥的小烧杯罩在火焰上,烧杯内壁有液滴产生;
d.向烧杯中加入澄清石灰水,澄清石灰水不变浑浊。
CH3CH2OH + Na → CH3CH2ONa + H2↑
H—C —C—O—H
H H
H H
①该反应属于 反应。
②反应速率比水慢,说明羟基中的H原子的活泼性:乙醇 水。
注意:
①处O—H键断开
①
认识乙醇
3、乙醇的化学性质
(1)乙醇与钠反应
置换
<
2 2 2
官能团:决定有机化合物特性的原子或原子团。
-OH就是乙醇的官能团。
点燃
CH3CH2OH + 3O2 2CO2+ 3H2O
①燃烧(彻底氧化)
现象:
认识乙醇
3、乙醇的化学性质
(2)氧化反应
淡蓝色火焰,放出大量的热。
固体酒精
认识乙醇
家中不易大量囤积酒精
1
安全使用酒精
2
注意室内通风
3
乙醇使用注意事项
避光存放,防止倾倒破损
4
存放时避免儿童拿到
5
铜匠用酒精清洗生锈的铜丝
真?假?
车内喷洒酒精消毒,小汽车被烧
员工用酒精在办公室内进行喷洒消毒,引发火灾。
实验操作:向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。
任务四、乙醇的催化氧化探究实验
实验现象:
铜丝加热变黑,插入乙醇中又变为红色。闻到刺激性气味。
铜丝变黑:
又变为红色:
反应原理:
2Cu +O2 2CuO
H O
│
H- C-C-H
│
H
H O-H
│ │
H-C- C-H
│ │
H H
+ CuO
+ Cu
△
乙醛
醛基,-CHO
乙醇分子脱去羟基H和羟基碳上的H,并形成一个碳氧双键。
+ H2O
②乙醇的催化氧化
3、乙醇的化学性质
(2)氧化反应
认识乙醇
铜丝变黑:
又变为红色:
2Cu +O2 2CuO (1)
H O
│
H- C-C-H
│
H
H O-H
│ │
H-C- C-H
│ │
H H
+ CuO
+H2O+Cu(2)
△
乙醛
(1) + (2) ×2 并整理:
2CH3CH2OH + O2
2CH3CHO + 2H2O
催化剂
△
乙醛
Cu或Ag
③与强氧化剂反应
3、乙醇的化学性质
(2)氧化反应
认识乙醇
交警检查司机是否酒驾的装置中,含有橙色的酸性重铬酸钾(K2Cr2O7),当其遇到乙醇时,橙色变绿色,由此可判断司机酒后驾车。
CH3CH2OH CH3COOH
K2Cr2O7,H+
或KMnO4,H+
长期过量饮酒,会使人发胖,还会损伤肝脏;血液中高浓度的乙醛(一级致癌物)还能致癌,并容易导致心血管病急性发作。因此,青少年不应饮酒,机动车驾驶员严禁酒后驾车。劝君少饮一杯酒!
过量饮酒的危害
4、乙醇的常见用途:
认识乙醇
酒
燃料
化工原料和溶剂
消毒剂
2 2 2
课堂小结
组成 结构 性质 转化 应用
乙醇
与Na反应:
彻底燃烧:
催化氧化:
CH3CH2OH + Na → CH3CH2ONa + H2↑
点燃
CH3CH2OH + 3O2 2CO2+ 3H2O
2CH3CH2OH + O2
2CH3CHO + 2H2O
催化剂
△
化学反应
与钠反应
催化氧化
键的断裂
断①键
断①③或①⑥键
H
O
C
H
C
①
②
③
④
⑤
H
H
H
H
燃烧
断①②③④⑤⑥键
⑥
练习
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
