第2章 化学反应的方向、限度与速率(含解析) 测试题 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率(含解析) 测试题 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 600.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-30 23:53:11 | ||
图片预览




文档简介
第2章 化学反应的方向、限度与速率 测试题
一、选择题
1.10mL 浓度为 的硫酸与过量的锌粉反应,采取下列措施,能减慢反应 速率但又不影响氢气生成量的是
A.加压 B.加入少量 固体
C.升高温度 D.加入少量 固体
2.一定温度下,在恒容密闭容器中加入足量铁粉并充入一定量的气体,发生反应。下列说法不正确的是
A.时,的平均反应速率为
B.充入,容器内压强增大,则化学反应速率增大
C.时,,反应未达到平衡状态
D.后,混合气体的平均分子量为35.1
3.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下图是哈伯法的流程图。图中沿X路线到压缩机的物质是
A.N2和H2 B.催化剂 C.N2 D.H2
4.把0.6mol X气体和0.4mol Y气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2mol W,若测得以Z浓度变化来表示的化学反应速率为0.01mol/(L·min),则上述反应中Z气体的化学计量数n的值是
A.1 B.2 C.3 D.4
5.一定温度下,在溶液中发生反应:。已知某时刻的浓度为,后变为。下列叙述不正确的是
A.内 B.
C.内增加了 D.内浓度增加
6.下列做法或措施与反应速率无关的是
A.船体上镶嵌锌块,避免船体遭受腐蚀
B.肉制品制作过程中添加适量的防腐剂
C.实验室利用氯酸钾和二氧化锰的混合物加热制取氧气
D.侯氏制碱法:向饱和食盐水中先通氨气,再通二氧化碳
7.2021年10月6日诺贝尔化学奖揭晓,科学家David MacMillan和Benjamin List因在“不对称有机催化”研究方面的进展被授予该奖项。催化剂可改变化学反应的历程(如图所示),下列说法正确的是
A.相比曲线a,曲线b是使用了催化剂的反应历程
B.升高温度,催化剂的活性一定增强
C.加入合适的催化剂能够提高生成物的产率
D.图中
8.将一定量硫化氢气体加入密闭容器中,发生反应:2H2S(g)S2(g)+2H2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化曲线如图所示,下列说法错误的是
A.C点对应状态的平衡常数K=10-3.6380
B.该反应的△H>0
C.反应速率:vA>vC
D.30℃时,B点对应状态的v正>v逆
9.下列为可逆反应: A(g)+ 3B(g) 2C(g)+2D(g)在不同条件下的化学反应速率,其中表示的化学反应速率最快的是
A.v(A)= 0.50 mol·L-1·min-1 B.v(B)=0.2 mol·L-1·s-1
C.v(C)= 0.4 0 mol·L-1·min-1 D.v(D)=0.15 mol·L-1·s-1
10.下列叙述及解释正确的是
A. ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.,在达到平衡后,加少量固体,因为平衡向逆反应方向移动,故体系颜色变浅
D.,在达到平衡后,保持压强不变,充入,平衡向左移动
11.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol 1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=—122.5 kJ·mol 1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=×100%)
下列说法不正确的是
A.CO的选择性随温度的升高逐渐增大
B.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=—204.9 kJ·mol 1
C.在240~320℃范围内,温度升高,平衡时CH3OCH3的物质的量先增大后减小
D.反应一段时间后,测得CH3OCH3的选择性为48%(图中A点),增大压强可能将CH3OCH3的选择性提升到B点
12.一定温度下,在1 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.t1时,Z和X的浓度相等,达到了化学平衡状态
C.反应开始到10 s时,Y的正逆反应速率都相等
D.反应的化学方程式为:X(g)+Y(g)Z(g)
二、填空题
13.乙醇是酒精饮料的主要成分,由葡萄糖发酵生成。反应的化学方程式为:。若某次发酵过程中的反应速率是,则用表示的该反应的化学反应速率是多少 ?
14.如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2 N2O4 △H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:
(1)C中的气体颜色 ; (填“变浅” 或“变深”).
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.0125mol/L,c(N2O4)=0.0321mol/L,则NO2的起始浓度为 ,NO2的转化率为 .
15.减排和转化利用以及化学电池的发展都是目前研究的重要方向。
(1)CO在炼铁高炉中与存在以下反应:
I.
II.
III.
①
②1500℃时,反应III的平衡常数。该温度下,在某体积可变的密闭容器中,按物质的量之比3:4加入和发生反应III,平衡时的转化率为 (保留三位有效数字)。
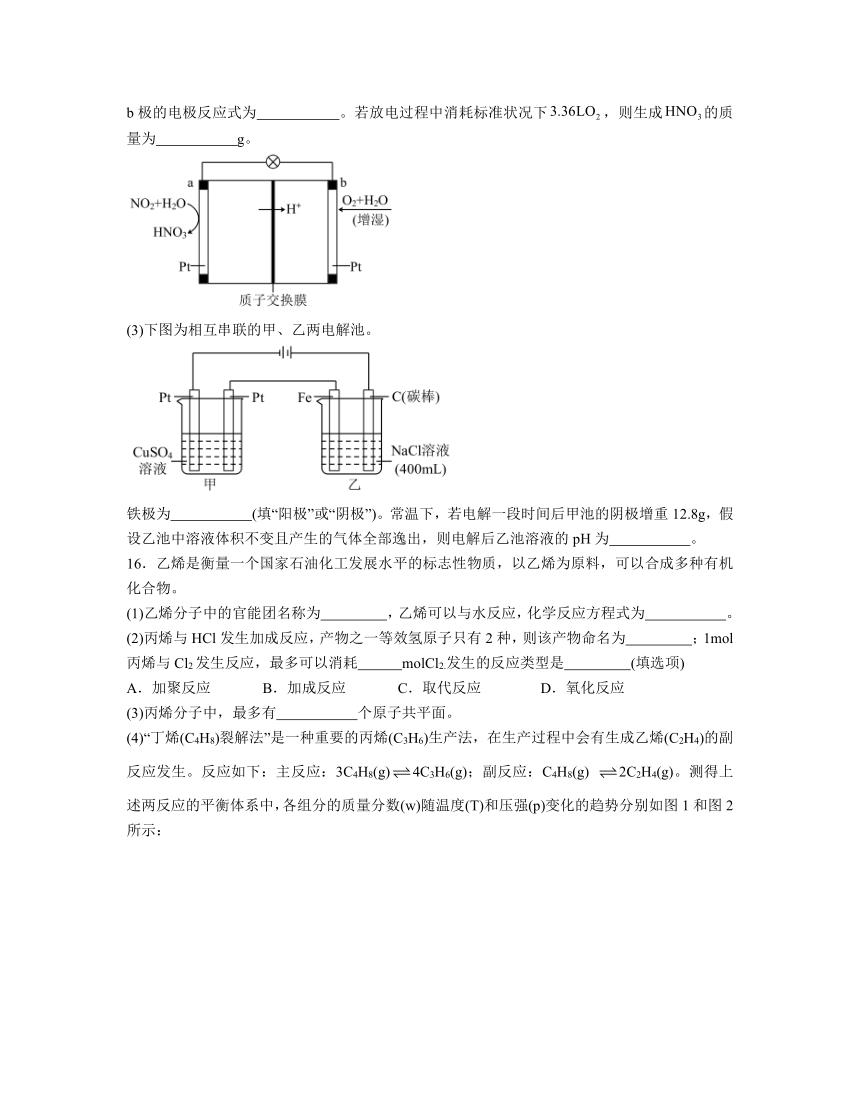
(2)二氧化氮-空气燃料电池的工作原理示意图如图所示,a极为 (填“正极”或“负极”),b极的电极反应式为 。若放电过程中消耗标准状况下,则生成的质量为 g。
(3)下图为相互串联的甲、乙两电解池。
铁极为 (填“阳极”或“阴极”)。常温下,若电解一段时间后甲池的阴极增重12.8g,假设乙池中溶液体积不变且产生的气体全部逸出,则电解后乙池溶液的pH为 。
16.乙烯是衡量一个国家石油化工发展水平的标志性物质,以乙烯为原料,可以合成多种有机化合物。
(1)乙烯分子中的官能团名称为 ,乙烯可以与水反应,化学反应方程式为 。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物命名为 ;1mol丙烯与Cl2发生反应,最多可以消耗 molCl2.发生的反应类型是 (填选项)
A.加聚反应 B.加成反应 C.取代反应 D.氧化反应
(3)丙烯分子中,最多有 个原子共平面。
(4)“丁烯(C4H8)裂解法”是一种重要的丙烯(C3H6)生产法,在生产过程中会有生成乙烯(C2H4)的副反应发生。反应如下:主反应:3C4H8(g)4C3H6(g);副反应:C4H8(g) 2C2H4(g)。测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:
平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图1和图2判断,反应条件应选择下列中的___________(填序号)。
A.300℃、0.1MPa B.700°C、0.1MPa
C.300℃、0.5MPa D.700℃、0.5MPa
17.把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:2X(g)+Y(g)= nZ(g)+2W(g)。2 min末生成0.2 mol W,若测知以Z的浓度变化表示的反应速率为0.1 mol·L-1·min-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 。
(2)2 min末时Y的浓度为 。
(3)化学反应方程式中n的值是 。
18.250℃和100kPa下密闭容器中发生反应:PCl5(g)PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
(1)PCl5的分压是 kPa。(保留三位有效数字)
(2)250℃时用分压表达的平衡常数Kp= kPa。(保留三位有效数字)
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是 ,理由是 。
19.氢燃料电池有良好的应用前景。工业上常用下列方法制取氢气。
Ⅰ.甲烷与水蒸气催化重整制取氢气,主要反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。
(1)上述反应体系中属于非极性分子的化合物是 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH4和1molH2O(g)发生上述反应,10min时反应达到平衡状态,此时CH4的浓度为0.4 mol L 1,则0~10min内H2的平均反应速率为 mol L 1 min 1。
Ⅱ.甲烷与硫化氢催化重整制取氢气,主要反应为:CH4(g)+2H2S(g)CS2(g)+4H2(g)。
(3)恒温恒容时,该反应一定处于平衡状态的标志是 。
a.υ正(H2S)=2υ逆(H2) b.CH4的体积分数不再变化
c.不再变化 d.混合气体的密度不再改变
(4)该反应平衡常数表达式K= ,若改变某一条件使平衡向正反应方向移动,则K值 。
a.一定改变 b.可能增大 c.可能减小 d.可能不变
III.将原料气按n(CH4):n(H2S)=1:2充入反应容器中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。平衡体系中各组分的物质的量分数x随温度T的变化如图所示:
(5)图中表示H2物质的量分数变化的曲线是 (选填字母),该反应的正反应为 反应(选填“放热”或“吸热”)。保持其他条件不变,升高温度测得CH4的平衡转化率先增大后下降,其原因可能是 。
20.课外实验小组以KI参与的某些反应来对反应过程和化学反应原理进行探究。
(1)KI中的促进分解的反应机理如下
① (慢)
② (快)
则此过程的决速步骤为 (填序号),在此过程中的作用是 。
(2)KI中的在经酸化的溶液中易被空气氧化:
实验小组探究外界条件对反应速率的影响,部分实验数据如下表。
编号 温度/℃ 硫酸体积/mL KI溶液体积/mL 体积/mL 淀粉溶液体积/mL 出现蓝色的时间/s
A 39 10.0 5.0 5.0 1.0 5
B 5 10.0 5.0 V 1.0 39
C 39 15.0 5.0 0.0 1.0 t
①为确保A组实验在39℃下进行,应采用的控温方法为 。
②B组实验中V= ,C组是探究 对反应速率的影响,t的取值范围为 。
(3)若将C组实验反应后溶液充分放置一段时间,检验其吸收的体积,可用标准溶液滴定吸收液(),实验时应将标准溶液放在 滴定管中,滴定终点时实验现象为 ,若消耗0.2mol/L标准溶液为15.00mL,则吸收氧气在标准状况下的体积为 。
【参考答案】
一、选择题
1.B
【分析】Zn与稀盐酸发生反应:Zn+2HCl=ZnCl2+H2↑,若加入物质使反应速率降低,则c(H+)减小。但是不影响产生氢气的物质的量,说明最终电离产生的n(H+)不变。
解析:A.硫酸与过量的锌粉反应为固液反应,几乎不受压强影响,A错误;
B.CH3COONa与HCl发生反应:CH3COONa + HCl = CH3COOH + NaCl,CH3COOH属于弱酸,使溶液中c(H+)减小,反应速率降低,随着H+的消耗会促进CH3COOH电离出H+继续反应,因此最终不会影响产生氢气的物质的量,B正确;
C.升高温度,速率加快,C错误;
D.若加入Na2CO3溶液,会与盐酸发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,使溶液中溶液中的c(H+)减小,但由于逸出了CO2气体,因此使n(H+)也减小,产生氢气的物质的量减小,D错误;
故选B。
2.B
解析:A.时,的平均反应速率为,A正确;
B.充入,容器内压强增大,反应体系的分压不变,化学反应速率不变,B错误;
C.时,,反应未达到平衡状态,从图像可知反应在时未达到平衡状态,C正确;
D.后,混合气体的平均摩尔质量,因此混合气体的平均分子量为35.1,D正确;
故选B。
3.A
解析:N2和H2通过压缩机、热交换器在催化剂作用下在合成塔中发生可逆反应生成氨气,将反应后气体经过冷凝器即得到液氨将其分离出去,在冷凝器中还有大量未反应的N2和H2,将其回流到压缩机中,通过氮气和氢气的循环使用,可以提高原料的利用率,故选A。
4.A
解析:5min末已生成0.2molW,则v (w)== =0.02mol·(L·min)-1,根据速率之比等于化学计量数之比,v (Z):v (W) =n:2=0.01mol·(L·min)-1:0.02mol·(L·min)-1,解得n=1;
答案选A。
5.C
【分析】已知某时刻的浓度为,后变为,则内;
解析:A.由分析可知,内,故A正确;
B.反应速率比等于系数比,,故B正确;
C.内过氧化氢浓度变化为0.3mol/L,反应的过氧化氢为0.3mol/L×0.1L=0.03mol,根据化学方程式可知,内增加了,故C错误;
D.内过氧化氢浓度变化为0.3mol/L,则内浓度增加,故D正确;
故选C。
6.D
解析:A.牺牲船体上镶嵌的锌块,是利用锌的活泼性强于铁,铁作正极,被保护,减慢了船体的腐蚀速率,A项不符合题意;
B.肉制品制作过程中添加适量的防腐剂,能延长肉制品保质期,与速率有关,B项不符合题意;
C.二氧化锰可作为氯酸钾分解制取氧气的催化剂,加快了反应速率,C项不符合题意;
D.侯氏制碱法中,向饱和食盐水中先通氨气,再通二氧化碳,是为了提高碳酸氢钠的浓度,与速率无关,D项符合题意。
答案选D。
7.A
解析:A.催化剂能降低反应的活化能,由图可知曲线b的活化能比a低,因此曲线b是使用了催化剂的反应历程,A正确;
B.催化剂的催化活性受温度影响,一定温度范围内其催化活性随温度升高而升高,超过一定范围,其催化活性可能随温度升高而降低,B错误;
C.催化剂只能改变化学反应速率,不能提高生成物的产率,C错误;
D.反应焓变为产物总能量减反应物总能量,,D错误;
答案选A。
8.D
【分析】由图象可知:升高温度,平衡常数的负对数减小,说明升高温度K增大,平衡正向移动,则正反应为吸热反应,根据温度越高反应速率越大,结合浓度商与平衡常数的关系判断反应的方向,据此分析解答。
解析:A.C点-lgK=3.6380,则平衡常数K=10-3.6380,A正确;
B.-lgK越大,则平衡常数K越小,由图可知:随温度升高,平衡常数增大,则升高温度化学平衡正向移动,正反应为吸热反应,故该反应的△H>0,B正确;
C.因为A点温度比C点高,所以A、C点反应速率:vA>vC,C正确;
D.B点浓度商大于化学平衡常数,所以化学反应向逆反应进行,则B点对应状态的v正<v逆,D错误;
故合理选项是D。
9.D
【分析】同一化学反应中,同一段时间内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率再进行比较,从而确定选项。
解析:A.v(A)=0.50 mol·L-1·min-1;
B.v(B)=0.2 mol·L-1·s-1,v(A)= v(B)= ×0.2 mol·L-1·s-1×60s min-1=4 mol·L-1·min-1;
C.v(C)=0.40 mol·L-1·min-1,所以v(A)==0.40 mol·L-1·min-1=0.20 mol·L-1·min-1;
D.v(D)=0.15 mol·L-1·s-1,所以v(A)==0.15 mol·L-1·s-1×60s·min-1=4.5 mol·L-1·min-1;
综上分析,所以反应最快的是D;
故选D。
10.D
解析:A.缩小容积、增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,但二氧化氮的浓度仍然增大,所以体系颜色加深,故A错误;
B.增大容积、减小压强,平衡不发生移动,但气体体积增大,各气体浓度均减小,混合气体颜色变浅,故B错误;
C.氯离子和钾离子不参与反应,平衡不移动,故C错误;
D.合成氨时保持压强不变,充入,则容器容积增大,相当于反应体系的压强减小,平衡向气体体积增大的方向移动,所以平衡向左移动,故D正确;
答案选D。
11.C
解析:A.由图可知,升高温度,二甲醚的选择性减小,由碳原子个数守恒可知,一氧化碳的选择性增大,故A正确;
B.由盖斯定律可知,反应II—2×反应I得到反应,则2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=(—122.5 kJ·mol 1)—2×(+41.2 kJ·mol 1)=—204.9 kJ·mol 1,故B正确;
C.反应II是放热反应,升高温度,平衡向逆反应方向移动,二甲醚的物质的量减小,故C错误;
D.反应II是气体体积减小的反应,在温度不变的条件下,增大压强,平衡向正反应方向移动,甲醚的物质的量增大,二甲醚的选择性增大,则增大压强可能将二甲醚的选择性由A点提升到B点,故D正确;
故选C。
12.A
解析:A.根据化学反应速率数学表达式,v(Z)=1.58/(1×10)mol/(L ·s)=0.158 mol/(L ·s),故正确;
B.达到化学平衡状态是各组分的浓度不再改变,而不是相等,故错误;
C.开始时到平衡v正>v逆,故错误;
D.根据化学反应速率之比=化学计量数之比,因为是体积相同、时间相同,则物质的量的变化值=化学计量数之比,即X:Y:Z=(1.2-0.41):(1-0.21):1.58=1:1:2,反应方程式为:X(g)+Y(g)2Z(g),故错误。
二、填空题
13.
解析:根据化学方程式可知,若某次发酵过程中的反应速率是,则用表示的该反应的化学反应速率是。
14.变浅 0.0767mol/L 83.7%
【分析】(1)硝酸铵的溶解过程是吸热过程,温度降低,C中平衡正向移动;氢氧化钠溶解是放热过程、与盐酸反应放出热量,D中平衡逆向移动;
(2)根据四氧化二氮的平衡浓度,计算二氧化氮浓度变化量,进而人家是二氧化氮起始浓度与转化率。
解析:(1)A中硝酸铵的溶解过程是吸热过程,溶解后C中温度降低,化学平衡2NO2 N2O4,△H=-57kJ/mol,平衡会向着正反应方向移动,二氧化氮浓度减小,所以颜色变浅;
因此,本题正确答案是:变浅;
(2)设二氧化氮的初始浓度为cmol/L,根据题意信息可以知道:
2NO2 N2O4
初始浓度(mol/L):c 0
变化浓度(mol/L):c-0.0125 0.0321
平衡浓度(mol/L):0.0125 0.0321
则c-0.0125=2×0.0321,计算得出c=0.0767mol/L,
NO2的转化率为:×100%≈83.7%.
因此,本题正确答案是:0.0767mol/L;83.7%。
15.(1) -25 22.2%
(2)负极 37.8
(3)阴极 14
解析:(1)①根据盖斯定律,由得反应III,则。
②1500℃时,反应III的平衡常数,根据反应可知,参与反应的CO和剩余的CO相等。设CO为4mol,则为3mol,反应消耗2molCO、,平衡时的转化率为。
(2)a极为负极,b极为正极,b极反应式为;消耗标准状况下时,生成硝酸的物质的量为0.6mol,质量为37.8g。
(3)甲池阴极析出的是铜,当阴极增重12.8g时,,转移电子0.4mol,乙池中阴极发生的电极反应为,当转移0.4mol电子时,溶液中生成的氢氧根离子的物质的量为0.4mol,氢氧根离子的物质的量浓度为,则,。
16.(1) 碳碳双键
(2)2 氯丙烷 7 BC
(3)7
(4)C
解析:(1)乙烯分子中的官能团名称为碳碳双键;乙烯可以与水在催化剂作用下反应生成乙醇,则化学反应方程式为;故答案为:碳碳双键;。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物为,则该产物命名为2 氯丙烷;1mol丙烯含有1mol碳碳双键,则1mol丙烯与Cl2发生加成反应,最多可以消耗1molCl2.,得到的产物有6个氢原子,因此1mol又与6mol氯气发生取代反应,因此共7mol氯气反应;故答案为:2 氯丙烷;7;BC。
(3)根据乙烯中6个原子共平面,甲烷中三个原子共平面,单键可以旋转,因此丙烯分子中,最多有7个原子共平面;故答案为:7。
(4)根据题中信息,从产物的纯度考虑,该数值越高越好,说明乙烯杂质尽量小,则根据图1得到温度在300℃时乙烯质量分数最小,图2压强在0.5MPa时乙烯的百分含量最小,则反应条件应选择300℃、0.5MPa;故答案为:C。
17.05 mol L-1 min-1 0.25mol/L 4
解析:(1)2X(g)+Y(g)=nZ(g)+2W(g)
2 2
0.2mol 0.2mol
v(X)=△c/△t=0.2mol/2L/2min=0.05 mol L-1 min-1,答案为:0.05mol L-1 min-1;
(2) X(g)+Y(g)= nZ(g)+2W(g)
开始时的物质的量(mol) 0.6 0.6 0 0
转化的物质的量(mol) 0.1 0.1 0.1×n 0.2
2min末的物质的量(mol) 0.5 0.5 0.1×n 0.2
Y的浓度为0.5mol/0.2L=0.25mol/L,答案为:0.25mol/L
(3)v(Z)=0.1×nmol/2L/2min=0.1mol·L-1 min-1,n=4,答案为:4.
18.1 1.78×102或178 向右进行(或向正方向进行) 经计算Q=1.25×102解析:(1)不妨设初始投料为10mol PCl5(g),分解率为80.0%,即Δn(PCl5)=8mol,结合方程式可知平衡时n(PCl5)=2mol、n(PCl3)=8mol、n(Cl2)=8mol,所以p(PCl5)== 11.1kPa;
(2)平衡时p(PCl5)== kPa,同理可得p(PCl3)=p(Cl2)=kPa,所以Kp==1.78×102或178 kPa;
(3)密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,则p(PCl5)== 12.5kPa,p(PCl3)=62.5kPa,p(Cl2)=25kPa,则此时Qp==125kPa< Kp,所以平衡向右进行。
19.(1)CH4
(2)0.03
(3)b
(4) bd
(5)a 吸热 随着温度升高,硫化氢会发生分解,导致硫化氢浓度减小,甲烷的平衡转化率下降
解析:(1)CH4是含共价键的非极性分子,H2O、CO是含共价键的极性分子,H2含共价键的非极性分子,氢气是单质,因此上述反应体系中属于非极性分子的化合物是CH4;故答案为:CH4。
(2)根据题意,10min时反应达到平衡状态,此时CH4的浓度为0.4 mol L 1,则甲烷浓度改变量为0.1 mol L 1,氢气浓度改变量为0.3 mol L 1,则0~10min内H2的平均反应速率为;故答案为:0.03。
(3)a.υ正(H2S)=2υ逆(H2),一个正反应速率,一个逆反应速率,两个不同方向,两者速率之比不等于计量系数之比,不能作为判断平衡标志,故a不符合题意;
b.CH4的体积分数不再变化,则能作为判断平衡标志,故b符合题意;
c.开始加入的甲烷和硫化氢按照计量之比加入,则始终不改变,当不再变化,不能作为判断平衡标志,故c不符合题意;
d.密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不再改变,当混合气体的密度不再改变,不能作为判断平衡标志,故d不符合题意;
综上所述,答案为:b。
(4)该反应平衡常数表达式,若改变某一条件使平衡向正反应方向移动,若是增大反应物浓度或减小压强,平衡常数不变,若是改变温度,平衡向正反应方向移动,则平衡常数变大,因此bd符合题意;综上所述,答案为:;bd。
(5)根据题意减少的为甲烷和硫化氢,增加的为CS2、H2,再根据计量系数得到氢气增加的幅度大,因此图中表示H2物质的量分数变化的曲线是a;根据图中信息,升高温度,甲烷、硫化氢的量减少,说明平衡正向移动,正反应为吸热反应。保持其他条件不变,由于温度升高,硫化氢会发生分解,导致硫化氢的浓度减小,因此甲烷的转化率降低;故答案为:a;吸热;随着温度升高,硫化氢会发生分解,导致硫化氢浓度减小,甲烷的平衡转化率下降。
20.(1) ① 作为中间产物
(2)水浴加热 5.0 硫酸浓度 t<5
(3)碱式 当最后半滴溶液滴进去时,溶液颜色由蓝色变无色,且半分钟不 0.0168L
解析:(1)反应历程中,决速步骤是反应较慢的反应,所以是反应①,在反应①中是生成物,反应②中是反应物,所以在此过程中的作用是作为中间产物;故答案是①;作为中间产物;
(2)①为确保A组实验在39℃下进行,应采用的控温方法为水浴加热;
②实验A、B、C采用控制变量法探究外界条件对反应速率的影响。实验中加水的体积是为了保证三个实验的总体积相同,所以B组实验中V=5.0;C组硫酸的体积与实验A不同,其他相同,故C组是探究硫酸的浓度对反应速率的影响;相比实验A,实验C的硫酸浓度较大,反应速率快,所以t的取值范围为t<5;
(3)溶液显碱性,滴定时放在碱式滴定管中;C组实验反应后溶液中存在I2,与淀粉形成蓝色溶液,滴定时I2与反应,故滴定终点时实验现象为当最后半滴溶液滴进去时,溶液颜色由蓝色变无色,且半分钟不变;根据、,可得到关系式:O2~2I2~4,若消耗0.2mol/L标准溶液为15.00mL,则吸收氧气在标况下的体积是×0.2mol/L×15.00×10-3L×22.4L/mol=0.0168L
一、选择题
1.10mL 浓度为 的硫酸与过量的锌粉反应,采取下列措施,能减慢反应 速率但又不影响氢气生成量的是
A.加压 B.加入少量 固体
C.升高温度 D.加入少量 固体
2.一定温度下,在恒容密闭容器中加入足量铁粉并充入一定量的气体,发生反应。下列说法不正确的是
A.时,的平均反应速率为
B.充入,容器内压强增大,则化学反应速率增大
C.时,,反应未达到平衡状态
D.后,混合气体的平均分子量为35.1
3.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下图是哈伯法的流程图。图中沿X路线到压缩机的物质是
A.N2和H2 B.催化剂 C.N2 D.H2
4.把0.6mol X气体和0.4mol Y气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2mol W,若测得以Z浓度变化来表示的化学反应速率为0.01mol/(L·min),则上述反应中Z气体的化学计量数n的值是
A.1 B.2 C.3 D.4
5.一定温度下,在溶液中发生反应:。已知某时刻的浓度为,后变为。下列叙述不正确的是
A.内 B.
C.内增加了 D.内浓度增加
6.下列做法或措施与反应速率无关的是
A.船体上镶嵌锌块,避免船体遭受腐蚀
B.肉制品制作过程中添加适量的防腐剂
C.实验室利用氯酸钾和二氧化锰的混合物加热制取氧气
D.侯氏制碱法:向饱和食盐水中先通氨气,再通二氧化碳
7.2021年10月6日诺贝尔化学奖揭晓,科学家David MacMillan和Benjamin List因在“不对称有机催化”研究方面的进展被授予该奖项。催化剂可改变化学反应的历程(如图所示),下列说法正确的是
A.相比曲线a,曲线b是使用了催化剂的反应历程
B.升高温度,催化剂的活性一定增强
C.加入合适的催化剂能够提高生成物的产率
D.图中
8.将一定量硫化氢气体加入密闭容器中,发生反应:2H2S(g)S2(g)+2H2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化曲线如图所示,下列说法错误的是
A.C点对应状态的平衡常数K=10-3.6380
B.该反应的△H>0
C.反应速率:vA>vC
D.30℃时,B点对应状态的v正>v逆
9.下列为可逆反应: A(g)+ 3B(g) 2C(g)+2D(g)在不同条件下的化学反应速率,其中表示的化学反应速率最快的是
A.v(A)= 0.50 mol·L-1·min-1 B.v(B)=0.2 mol·L-1·s-1
C.v(C)= 0.4 0 mol·L-1·min-1 D.v(D)=0.15 mol·L-1·s-1
10.下列叙述及解释正确的是
A. ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.,在达到平衡后,加少量固体,因为平衡向逆反应方向移动,故体系颜色变浅
D.,在达到平衡后,保持压强不变,充入,平衡向左移动
11.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol 1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=—122.5 kJ·mol 1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=×100%)
下列说法不正确的是
A.CO的选择性随温度的升高逐渐增大
B.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=—204.9 kJ·mol 1
C.在240~320℃范围内,温度升高,平衡时CH3OCH3的物质的量先增大后减小
D.反应一段时间后,测得CH3OCH3的选择性为48%(图中A点),增大压强可能将CH3OCH3的选择性提升到B点
12.一定温度下,在1 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.t1时,Z和X的浓度相等,达到了化学平衡状态
C.反应开始到10 s时,Y的正逆反应速率都相等
D.反应的化学方程式为:X(g)+Y(g)Z(g)
二、填空题
13.乙醇是酒精饮料的主要成分,由葡萄糖发酵生成。反应的化学方程式为:。若某次发酵过程中的反应速率是,则用表示的该反应的化学反应速率是多少 ?
14.如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2 N2O4 △H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:
(1)C中的气体颜色 ; (填“变浅” 或“变深”).
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.0125mol/L,c(N2O4)=0.0321mol/L,则NO2的起始浓度为 ,NO2的转化率为 .
15.减排和转化利用以及化学电池的发展都是目前研究的重要方向。
(1)CO在炼铁高炉中与存在以下反应:
I.
II.
III.
①
②1500℃时,反应III的平衡常数。该温度下,在某体积可变的密闭容器中,按物质的量之比3:4加入和发生反应III,平衡时的转化率为 (保留三位有效数字)。
(2)二氧化氮-空气燃料电池的工作原理示意图如图所示,a极为 (填“正极”或“负极”),b极的电极反应式为 。若放电过程中消耗标准状况下,则生成的质量为 g。
(3)下图为相互串联的甲、乙两电解池。
铁极为 (填“阳极”或“阴极”)。常温下,若电解一段时间后甲池的阴极增重12.8g,假设乙池中溶液体积不变且产生的气体全部逸出,则电解后乙池溶液的pH为 。
16.乙烯是衡量一个国家石油化工发展水平的标志性物质,以乙烯为原料,可以合成多种有机化合物。
(1)乙烯分子中的官能团名称为 ,乙烯可以与水反应,化学反应方程式为 。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物命名为 ;1mol丙烯与Cl2发生反应,最多可以消耗 molCl2.发生的反应类型是 (填选项)
A.加聚反应 B.加成反应 C.取代反应 D.氧化反应
(3)丙烯分子中,最多有 个原子共平面。
(4)“丁烯(C4H8)裂解法”是一种重要的丙烯(C3H6)生产法,在生产过程中会有生成乙烯(C2H4)的副反应发生。反应如下:主反应:3C4H8(g)4C3H6(g);副反应:C4H8(g) 2C2H4(g)。测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:
平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图1和图2判断,反应条件应选择下列中的___________(填序号)。
A.300℃、0.1MPa B.700°C、0.1MPa
C.300℃、0.5MPa D.700℃、0.5MPa
17.把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:2X(g)+Y(g)= nZ(g)+2W(g)。2 min末生成0.2 mol W,若测知以Z的浓度变化表示的反应速率为0.1 mol·L-1·min-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 。
(2)2 min末时Y的浓度为 。
(3)化学反应方程式中n的值是 。
18.250℃和100kPa下密闭容器中发生反应:PCl5(g)PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
(1)PCl5的分压是 kPa。(保留三位有效数字)
(2)250℃时用分压表达的平衡常数Kp= kPa。(保留三位有效数字)
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是 ,理由是 。
19.氢燃料电池有良好的应用前景。工业上常用下列方法制取氢气。
Ⅰ.甲烷与水蒸气催化重整制取氢气,主要反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。
(1)上述反应体系中属于非极性分子的化合物是 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH4和1molH2O(g)发生上述反应,10min时反应达到平衡状态,此时CH4的浓度为0.4 mol L 1,则0~10min内H2的平均反应速率为 mol L 1 min 1。
Ⅱ.甲烷与硫化氢催化重整制取氢气,主要反应为:CH4(g)+2H2S(g)CS2(g)+4H2(g)。
(3)恒温恒容时,该反应一定处于平衡状态的标志是 。
a.υ正(H2S)=2υ逆(H2) b.CH4的体积分数不再变化
c.不再变化 d.混合气体的密度不再改变
(4)该反应平衡常数表达式K= ,若改变某一条件使平衡向正反应方向移动,则K值 。
a.一定改变 b.可能增大 c.可能减小 d.可能不变
III.将原料气按n(CH4):n(H2S)=1:2充入反应容器中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。平衡体系中各组分的物质的量分数x随温度T的变化如图所示:
(5)图中表示H2物质的量分数变化的曲线是 (选填字母),该反应的正反应为 反应(选填“放热”或“吸热”)。保持其他条件不变,升高温度测得CH4的平衡转化率先增大后下降,其原因可能是 。
20.课外实验小组以KI参与的某些反应来对反应过程和化学反应原理进行探究。
(1)KI中的促进分解的反应机理如下
① (慢)
② (快)
则此过程的决速步骤为 (填序号),在此过程中的作用是 。
(2)KI中的在经酸化的溶液中易被空气氧化:
实验小组探究外界条件对反应速率的影响,部分实验数据如下表。
编号 温度/℃ 硫酸体积/mL KI溶液体积/mL 体积/mL 淀粉溶液体积/mL 出现蓝色的时间/s
A 39 10.0 5.0 5.0 1.0 5
B 5 10.0 5.0 V 1.0 39
C 39 15.0 5.0 0.0 1.0 t
①为确保A组实验在39℃下进行,应采用的控温方法为 。
②B组实验中V= ,C组是探究 对反应速率的影响,t的取值范围为 。
(3)若将C组实验反应后溶液充分放置一段时间,检验其吸收的体积,可用标准溶液滴定吸收液(),实验时应将标准溶液放在 滴定管中,滴定终点时实验现象为 ,若消耗0.2mol/L标准溶液为15.00mL,则吸收氧气在标准状况下的体积为 。
【参考答案】
一、选择题
1.B
【分析】Zn与稀盐酸发生反应:Zn+2HCl=ZnCl2+H2↑,若加入物质使反应速率降低,则c(H+)减小。但是不影响产生氢气的物质的量,说明最终电离产生的n(H+)不变。
解析:A.硫酸与过量的锌粉反应为固液反应,几乎不受压强影响,A错误;
B.CH3COONa与HCl发生反应:CH3COONa + HCl = CH3COOH + NaCl,CH3COOH属于弱酸,使溶液中c(H+)减小,反应速率降低,随着H+的消耗会促进CH3COOH电离出H+继续反应,因此最终不会影响产生氢气的物质的量,B正确;
C.升高温度,速率加快,C错误;
D.若加入Na2CO3溶液,会与盐酸发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,使溶液中溶液中的c(H+)减小,但由于逸出了CO2气体,因此使n(H+)也减小,产生氢气的物质的量减小,D错误;
故选B。
2.B
解析:A.时,的平均反应速率为,A正确;
B.充入,容器内压强增大,反应体系的分压不变,化学反应速率不变,B错误;
C.时,,反应未达到平衡状态,从图像可知反应在时未达到平衡状态,C正确;
D.后,混合气体的平均摩尔质量,因此混合气体的平均分子量为35.1,D正确;
故选B。
3.A
解析:N2和H2通过压缩机、热交换器在催化剂作用下在合成塔中发生可逆反应生成氨气,将反应后气体经过冷凝器即得到液氨将其分离出去,在冷凝器中还有大量未反应的N2和H2,将其回流到压缩机中,通过氮气和氢气的循环使用,可以提高原料的利用率,故选A。
4.A
解析:5min末已生成0.2molW,则v (w)== =0.02mol·(L·min)-1,根据速率之比等于化学计量数之比,v (Z):v (W) =n:2=0.01mol·(L·min)-1:0.02mol·(L·min)-1,解得n=1;
答案选A。
5.C
【分析】已知某时刻的浓度为,后变为,则内;
解析:A.由分析可知,内,故A正确;
B.反应速率比等于系数比,,故B正确;
C.内过氧化氢浓度变化为0.3mol/L,反应的过氧化氢为0.3mol/L×0.1L=0.03mol,根据化学方程式可知,内增加了,故C错误;
D.内过氧化氢浓度变化为0.3mol/L,则内浓度增加,故D正确;
故选C。
6.D
解析:A.牺牲船体上镶嵌的锌块,是利用锌的活泼性强于铁,铁作正极,被保护,减慢了船体的腐蚀速率,A项不符合题意;
B.肉制品制作过程中添加适量的防腐剂,能延长肉制品保质期,与速率有关,B项不符合题意;
C.二氧化锰可作为氯酸钾分解制取氧气的催化剂,加快了反应速率,C项不符合题意;
D.侯氏制碱法中,向饱和食盐水中先通氨气,再通二氧化碳,是为了提高碳酸氢钠的浓度,与速率无关,D项符合题意。
答案选D。
7.A
解析:A.催化剂能降低反应的活化能,由图可知曲线b的活化能比a低,因此曲线b是使用了催化剂的反应历程,A正确;
B.催化剂的催化活性受温度影响,一定温度范围内其催化活性随温度升高而升高,超过一定范围,其催化活性可能随温度升高而降低,B错误;
C.催化剂只能改变化学反应速率,不能提高生成物的产率,C错误;
D.反应焓变为产物总能量减反应物总能量,,D错误;
答案选A。
8.D
【分析】由图象可知:升高温度,平衡常数的负对数减小,说明升高温度K增大,平衡正向移动,则正反应为吸热反应,根据温度越高反应速率越大,结合浓度商与平衡常数的关系判断反应的方向,据此分析解答。
解析:A.C点-lgK=3.6380,则平衡常数K=10-3.6380,A正确;
B.-lgK越大,则平衡常数K越小,由图可知:随温度升高,平衡常数增大,则升高温度化学平衡正向移动,正反应为吸热反应,故该反应的△H>0,B正确;
C.因为A点温度比C点高,所以A、C点反应速率:vA>vC,C正确;
D.B点浓度商大于化学平衡常数,所以化学反应向逆反应进行,则B点对应状态的v正<v逆,D错误;
故合理选项是D。
9.D
【分析】同一化学反应中,同一段时间内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率再进行比较,从而确定选项。
解析:A.v(A)=0.50 mol·L-1·min-1;
B.v(B)=0.2 mol·L-1·s-1,v(A)= v(B)= ×0.2 mol·L-1·s-1×60s min-1=4 mol·L-1·min-1;
C.v(C)=0.40 mol·L-1·min-1,所以v(A)==0.40 mol·L-1·min-1=0.20 mol·L-1·min-1;
D.v(D)=0.15 mol·L-1·s-1,所以v(A)==0.15 mol·L-1·s-1×60s·min-1=4.5 mol·L-1·min-1;
综上分析,所以反应最快的是D;
故选D。
10.D
解析:A.缩小容积、增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,但二氧化氮的浓度仍然增大,所以体系颜色加深,故A错误;
B.增大容积、减小压强,平衡不发生移动,但气体体积增大,各气体浓度均减小,混合气体颜色变浅,故B错误;
C.氯离子和钾离子不参与反应,平衡不移动,故C错误;
D.合成氨时保持压强不变,充入,则容器容积增大,相当于反应体系的压强减小,平衡向气体体积增大的方向移动,所以平衡向左移动,故D正确;
答案选D。
11.C
解析:A.由图可知,升高温度,二甲醚的选择性减小,由碳原子个数守恒可知,一氧化碳的选择性增大,故A正确;
B.由盖斯定律可知,反应II—2×反应I得到反应,则2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=(—122.5 kJ·mol 1)—2×(+41.2 kJ·mol 1)=—204.9 kJ·mol 1,故B正确;
C.反应II是放热反应,升高温度,平衡向逆反应方向移动,二甲醚的物质的量减小,故C错误;
D.反应II是气体体积减小的反应,在温度不变的条件下,增大压强,平衡向正反应方向移动,甲醚的物质的量增大,二甲醚的选择性增大,则增大压强可能将二甲醚的选择性由A点提升到B点,故D正确;
故选C。
12.A
解析:A.根据化学反应速率数学表达式,v(Z)=1.58/(1×10)mol/(L ·s)=0.158 mol/(L ·s),故正确;
B.达到化学平衡状态是各组分的浓度不再改变,而不是相等,故错误;
C.开始时到平衡v正>v逆,故错误;
D.根据化学反应速率之比=化学计量数之比,因为是体积相同、时间相同,则物质的量的变化值=化学计量数之比,即X:Y:Z=(1.2-0.41):(1-0.21):1.58=1:1:2,反应方程式为:X(g)+Y(g)2Z(g),故错误。
二、填空题
13.
解析:根据化学方程式可知,若某次发酵过程中的反应速率是,则用表示的该反应的化学反应速率是。
14.变浅 0.0767mol/L 83.7%
【分析】(1)硝酸铵的溶解过程是吸热过程,温度降低,C中平衡正向移动;氢氧化钠溶解是放热过程、与盐酸反应放出热量,D中平衡逆向移动;
(2)根据四氧化二氮的平衡浓度,计算二氧化氮浓度变化量,进而人家是二氧化氮起始浓度与转化率。
解析:(1)A中硝酸铵的溶解过程是吸热过程,溶解后C中温度降低,化学平衡2NO2 N2O4,△H=-57kJ/mol,平衡会向着正反应方向移动,二氧化氮浓度减小,所以颜色变浅;
因此,本题正确答案是:变浅;
(2)设二氧化氮的初始浓度为cmol/L,根据题意信息可以知道:
2NO2 N2O4
初始浓度(mol/L):c 0
变化浓度(mol/L):c-0.0125 0.0321
平衡浓度(mol/L):0.0125 0.0321
则c-0.0125=2×0.0321,计算得出c=0.0767mol/L,
NO2的转化率为:×100%≈83.7%.
因此,本题正确答案是:0.0767mol/L;83.7%。
15.(1) -25 22.2%
(2)负极 37.8
(3)阴极 14
解析:(1)①根据盖斯定律,由得反应III,则。
②1500℃时,反应III的平衡常数,根据反应可知,参与反应的CO和剩余的CO相等。设CO为4mol,则为3mol,反应消耗2molCO、,平衡时的转化率为。
(2)a极为负极,b极为正极,b极反应式为;消耗标准状况下时,生成硝酸的物质的量为0.6mol,质量为37.8g。
(3)甲池阴极析出的是铜,当阴极增重12.8g时,,转移电子0.4mol,乙池中阴极发生的电极反应为,当转移0.4mol电子时,溶液中生成的氢氧根离子的物质的量为0.4mol,氢氧根离子的物质的量浓度为,则,。
16.(1) 碳碳双键
(2)2 氯丙烷 7 BC
(3)7
(4)C
解析:(1)乙烯分子中的官能团名称为碳碳双键;乙烯可以与水在催化剂作用下反应生成乙醇,则化学反应方程式为;故答案为:碳碳双键;。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物为,则该产物命名为2 氯丙烷;1mol丙烯含有1mol碳碳双键,则1mol丙烯与Cl2发生加成反应,最多可以消耗1molCl2.,得到的产物有6个氢原子,因此1mol又与6mol氯气发生取代反应,因此共7mol氯气反应;故答案为:2 氯丙烷;7;BC。
(3)根据乙烯中6个原子共平面,甲烷中三个原子共平面,单键可以旋转,因此丙烯分子中,最多有7个原子共平面;故答案为:7。
(4)根据题中信息,从产物的纯度考虑,该数值越高越好,说明乙烯杂质尽量小,则根据图1得到温度在300℃时乙烯质量分数最小,图2压强在0.5MPa时乙烯的百分含量最小,则反应条件应选择300℃、0.5MPa;故答案为:C。
17.05 mol L-1 min-1 0.25mol/L 4
解析:(1)2X(g)+Y(g)=nZ(g)+2W(g)
2 2
0.2mol 0.2mol
v(X)=△c/△t=0.2mol/2L/2min=0.05 mol L-1 min-1,答案为:0.05mol L-1 min-1;
(2) X(g)+Y(g)= nZ(g)+2W(g)
开始时的物质的量(mol) 0.6 0.6 0 0
转化的物质的量(mol) 0.1 0.1 0.1×n 0.2
2min末的物质的量(mol) 0.5 0.5 0.1×n 0.2
Y的浓度为0.5mol/0.2L=0.25mol/L,答案为:0.25mol/L
(3)v(Z)=0.1×nmol/2L/2min=0.1mol·L-1 min-1,n=4,答案为:4.
18.1 1.78×102或178 向右进行(或向正方向进行) 经计算Q=1.25×102
(2)平衡时p(PCl5)== kPa,同理可得p(PCl3)=p(Cl2)=kPa,所以Kp==1.78×102或178 kPa;
(3)密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,则p(PCl5)== 12.5kPa,p(PCl3)=62.5kPa,p(Cl2)=25kPa,则此时Qp==125kPa< Kp,所以平衡向右进行。
19.(1)CH4
(2)0.03
(3)b
(4) bd
(5)a 吸热 随着温度升高,硫化氢会发生分解,导致硫化氢浓度减小,甲烷的平衡转化率下降
解析:(1)CH4是含共价键的非极性分子,H2O、CO是含共价键的极性分子,H2含共价键的非极性分子,氢气是单质,因此上述反应体系中属于非极性分子的化合物是CH4;故答案为:CH4。
(2)根据题意,10min时反应达到平衡状态,此时CH4的浓度为0.4 mol L 1,则甲烷浓度改变量为0.1 mol L 1,氢气浓度改变量为0.3 mol L 1,则0~10min内H2的平均反应速率为;故答案为:0.03。
(3)a.υ正(H2S)=2υ逆(H2),一个正反应速率,一个逆反应速率,两个不同方向,两者速率之比不等于计量系数之比,不能作为判断平衡标志,故a不符合题意;
b.CH4的体积分数不再变化,则能作为判断平衡标志,故b符合题意;
c.开始加入的甲烷和硫化氢按照计量之比加入,则始终不改变,当不再变化,不能作为判断平衡标志,故c不符合题意;
d.密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不再改变,当混合气体的密度不再改变,不能作为判断平衡标志,故d不符合题意;
综上所述,答案为:b。
(4)该反应平衡常数表达式,若改变某一条件使平衡向正反应方向移动,若是增大反应物浓度或减小压强,平衡常数不变,若是改变温度,平衡向正反应方向移动,则平衡常数变大,因此bd符合题意;综上所述,答案为:;bd。
(5)根据题意减少的为甲烷和硫化氢,增加的为CS2、H2,再根据计量系数得到氢气增加的幅度大,因此图中表示H2物质的量分数变化的曲线是a;根据图中信息,升高温度,甲烷、硫化氢的量减少,说明平衡正向移动,正反应为吸热反应。保持其他条件不变,由于温度升高,硫化氢会发生分解,导致硫化氢的浓度减小,因此甲烷的转化率降低;故答案为:a;吸热;随着温度升高,硫化氢会发生分解,导致硫化氢浓度减小,甲烷的平衡转化率下降。
20.(1) ① 作为中间产物
(2)水浴加热 5.0 硫酸浓度 t<5
(3)碱式 当最后半滴溶液滴进去时,溶液颜色由蓝色变无色,且半分钟不 0.0168L
解析:(1)反应历程中,决速步骤是反应较慢的反应,所以是反应①,在反应①中是生成物,反应②中是反应物,所以在此过程中的作用是作为中间产物;故答案是①;作为中间产物;
(2)①为确保A组实验在39℃下进行,应采用的控温方法为水浴加热;
②实验A、B、C采用控制变量法探究外界条件对反应速率的影响。实验中加水的体积是为了保证三个实验的总体积相同,所以B组实验中V=5.0;C组硫酸的体积与实验A不同,其他相同,故C组是探究硫酸的浓度对反应速率的影响;相比实验A,实验C的硫酸浓度较大,反应速率快,所以t的取值范围为t<5;
(3)溶液显碱性,滴定时放在碱式滴定管中;C组实验反应后溶液中存在I2,与淀粉形成蓝色溶液,滴定时I2与反应,故滴定终点时实验现象为当最后半滴溶液滴进去时,溶液颜色由蓝色变无色,且半分钟不变;根据、,可得到关系式:O2~2I2~4,若消耗0.2mol/L标准溶液为15.00mL,则吸收氧气在标况下的体积是×0.2mol/L×15.00×10-3L×22.4L/mol=0.0168L
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
