2024北京课改化学九年级下学期课时练--第二节 溶液组成的定量表示
文档属性
| 名称 | 2024北京课改化学九年级下学期课时练--第二节 溶液组成的定量表示 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 14:00:15 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024北京课改化学九年级下学期
第9章 溶液
第二节 溶液组成的定量表示
基础过关全练
知识点1 溶液中溶质的质量分数
1.【新独家原创】5%的葡萄糖溶液可用于补充人体所需能量。其中“5%”不能表示 ( )
A.100 g溶液中含有5 g葡萄糖
B.100 g水中溶解了5 g葡萄糖
C.葡萄糖的质量分数
D.葡萄糖与水的质量比为5∶95
2.【教材变式·P18实验】配制50 g 如图1所示的溶液。
图1 图2
(1)称量NaCl固体(如图2)时,应在托盘天平的右盘上放 g砝码,并将游码拨至3 g 处。
(2)量取水时,应选用 (填“10 mL ”“50 mL ”或“100 mL ”)的量筒。
(3)需要用玻璃棒搅拌的实验步骤是 (填序号)。
A.称量 B.量取 C.溶解
知识点2 有关溶液中溶质的质量分数的计算
3.某学校实验室有一桶久置的过氧化氢溶液,测得其密度为1.069 g/mL,该温度下溶液的密度和溶质质量分数的对应关系如图所示。
桶上标签提供的信息:1.过氧化氢的质量分数为30%;2.内装溶液质量50 kg。
完成下列问题:
(1)若用此久置的过氧化氢溶液来配制溶质质量分数为3%的环境消毒液200 kg,需用这种过氧化氢溶液 kg。
(2)若将这桶过氧化氢溶液放置至H2O2完全分解,桶中剩下的液体质量是多少 (假设液体不挥发,通过计算回答,结果精确到0.1)
能力提升全练
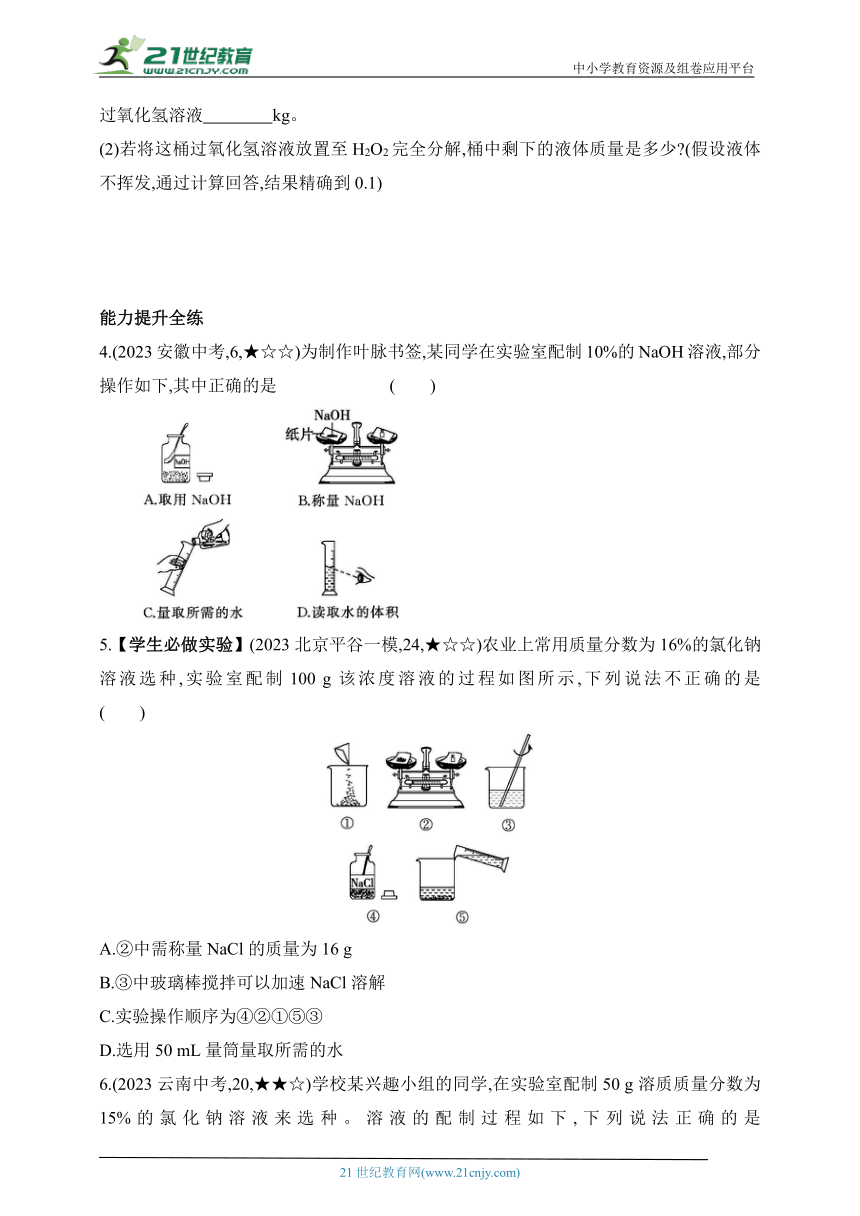
4.(2023安徽中考,6,★☆☆)为制作叶脉书签,某同学在实验室配制10%的NaOH溶液,部分操作如下,其中正确的是 ( )
5.【学生必做实验】(2023北京平谷一模,24,★☆☆)农业上常用质量分数为16%的氯化钠溶液选种,实验室配制100 g该浓度溶液的过程如图所示,下列说法不正确的是 ( )
A.②中需称量NaCl的质量为16 g
B.③中玻璃棒搅拌可以加速NaCl溶解
C.实验操作顺序为④②①⑤③
D.选用50 mL量筒量取所需的水
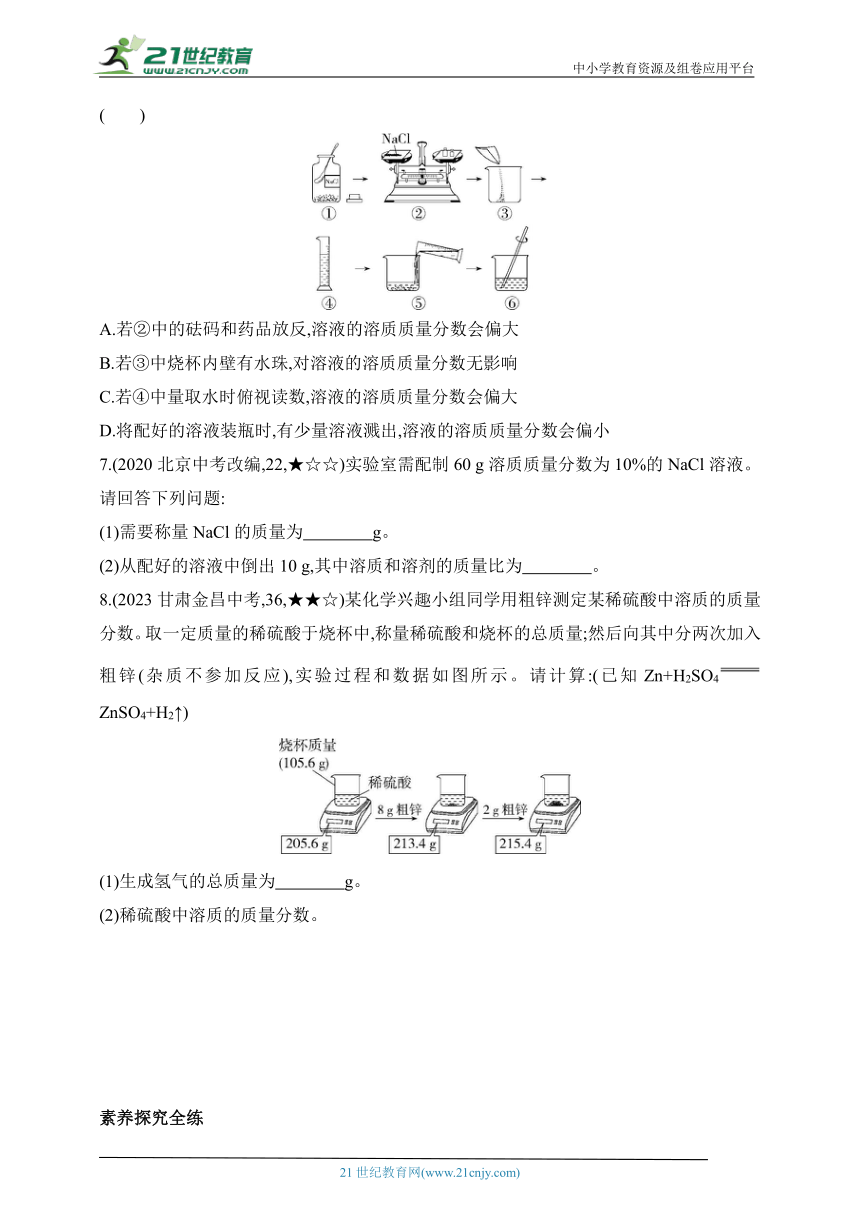
6.(2023云南中考,20,★★☆)学校某兴趣小组的同学,在实验室配制50 g溶质质量分数为15%的氯化钠溶液来选种。溶液的配制过程如下,下列说法正确的是 ( )
A.若②中的砝码和药品放反,溶液的溶质质量分数会偏大
B.若③中烧杯内壁有水珠,对溶液的溶质质量分数无影响
C.若④中量取水时俯视读数,溶液的溶质质量分数会偏大
D.将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数会偏小
7.(2020北京中考改编,22,★☆☆)实验室需配制60 g溶质质量分数为10%的NaCl溶液。请回答下列问题:
(1)需要称量NaCl的质量为 g。
(2)从配好的溶液中倒出10 g,其中溶质和溶剂的质量比为 。
8.(2023甘肃金昌中考,36,★★☆)某化学兴趣小组同学用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:(已知Zn+H2SO4 ZnSO4+H2↑)
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
素养探究全练
9.【学科素养·科学探究与实践】已知:①向水中加入固体氯化钠,溶液的密度增大;②向水中加入乙醇,溶液的密度减小;③向水中加入盐酸,溶液的密度增大。
如图所示,将三枚大小相同的生鸡蛋(鸡蛋壳的主要成分是碳酸钙)分别放在三种液体中进行实验(图示状态为生鸡蛋在水中的状态),最终鸡蛋下沉的是 (填序号)。
导致C中鸡蛋没入溶液的体积发生变化的原因是① ;② 。
推测:一艘满载货物的轮船由内陆河进入海洋时,没入水中的体积将 (填“增大”或“减小”)。
答案全解全析
基础过关全练
1.B 题中的“5%”表示每100 g葡萄糖溶液中含有5 g葡萄糖,表示葡萄糖的质量分数为5%,表示葡萄糖与水的质量比为5∶95。
2.(1)5 (2)50 mL (3)C
解析 (1)配制50 g 16%的NaCl溶液,需要NaCl的质量为50 g×16%=8 g,则应在托盘天平的右盘上放5 g砝码,并将游码拨至3 g处。(2)配制50 g 16%的NaCl溶液,需要水的质量为50 g-8 g=42 g,合42 mL,故选用50 mL的量筒。(3)溶解步骤要用玻璃棒搅拌,以加快NaCl的溶解速率。
3.(1)30
(2)解:设桶中的过氧化氢完全分解放出的O2的质量为x。
2H2O22H2O+O2↑
68 32
50 kg×30% x
=
x≈7.1 kg
桶中剩下的液体的质量为50 kg-7.1 kg=42.9 kg
答:桶中剩下的液体的质量为42.9 kg。
解析 (1)已知题中久置的过氧化氢溶液的密度为1.069 g/mL,结合题图可知,该溶液的溶质质量分数为20%。设需要的溶液质量为y,根据溶液稀释前后溶质质量不变,可得y×20%=200 kg×3%,解得y=30 kg。(2)原溶液中过氧化氢的质量为50 kg×30%=15 kg,根据化学方程式,由过氧化氢的质量求得氧气的质量,桶中原溶液的质量减去生成氧气的质量就是剩下的液体的质量。
能力提升全练
4.C 取用NaOH时,瓶塞应该倒放,A错误;氢氧化钠具有强腐蚀性,应放在小烧杯等玻璃器皿中称量,B错误;量取水时,试剂瓶的标签向着手心,量筒稍微倾斜,试剂瓶口紧挨着量筒口,C正确;量取液体读数时,量筒必须放平,视线与液体凹液面的最低处保持水平,D错误。
5.D ②中需称量NaCl的质量为16%×100 g=16 g,A正确;③中玻璃棒搅拌可以加速NaCl溶解,B正确;配制溶液的一般过程为计算、称量(量取)、溶解,则操作顺序为④②①⑤③,C正确;需要水的质量为100 g-16 g=84 g,即84 mL,故选择100 mL的量筒,D错误。
6.C 若②中的砝码和药品放反,称量过程中使用了游码,则药品质量=砝码质量-游码示数,药品质量偏小,溶液的溶质质量分数会偏小,A错误;若③中烧杯内壁有水珠,溶剂质量增大,溶液的溶质质量分数偏小,B错误;若④中量取水时俯视读数,实际量取水的体积偏小,溶液的溶质质量分数会偏大,C正确;溶液是均一、稳定的混合物,装瓶时有少量溶液溅出,溶液的溶质质量分数不变,D错误。
7.(1)6 (2)1∶9
解析 (1)溶质质量=溶液质量×溶质质量分数,则需氯化钠的质量为60 g×10%=6 g。(2)溶液具有均一性,从配好的溶液中倒出10 g,溶质质量分数仍为10%,其中溶质和溶剂的质量比为10%∶(1-10%)=1∶9。
8.(1)0.2
(2)解:设参加反应的稀硫酸中溶质的质量为x。
Zn+H2SO4 ZnSO4+H2↑
98 2
x 0.2 g
= x=9.8 g
稀硫酸中溶质的质量分数为×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%。
解析 (1)由题图中数据分析可知,第2次加入的粗锌没有参加反应,根据质量守恒定律知,生成氢气的质量为205.6 g+8 g-213.4 g=0.2 g。(2)根据化学方程式,利用生成的0.2 g氢气计算出稀硫酸中溶质的质量,进而计算出稀硫酸中溶质的质量分数。
素养探究全练
9.B 鸡蛋质量减小 溶液的密度增大 减小
解析 鸡蛋壳的主要成分是碳酸钙,碳酸钙能与盐酸反应放出CO2气体,所以向水中加入盐酸时,一方面溶液密度会增大,另一方面鸡蛋质量会因发生反应而减小,同时,生成的二氧化碳气体也会改变鸡蛋所受到的浮力,因此鸡蛋没入溶液的体积会发生改变。内陆河河水密度小于海水密度,而轮船在内陆河和海水中所受浮力相等,所以轮船由内陆河进入海洋时,没入水中的体积会减小。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024北京课改化学九年级下学期
第9章 溶液
第二节 溶液组成的定量表示
基础过关全练
知识点1 溶液中溶质的质量分数
1.【新独家原创】5%的葡萄糖溶液可用于补充人体所需能量。其中“5%”不能表示 ( )
A.100 g溶液中含有5 g葡萄糖
B.100 g水中溶解了5 g葡萄糖
C.葡萄糖的质量分数
D.葡萄糖与水的质量比为5∶95
2.【教材变式·P18实验】配制50 g 如图1所示的溶液。
图1 图2
(1)称量NaCl固体(如图2)时,应在托盘天平的右盘上放 g砝码,并将游码拨至3 g 处。
(2)量取水时,应选用 (填“10 mL ”“50 mL ”或“100 mL ”)的量筒。
(3)需要用玻璃棒搅拌的实验步骤是 (填序号)。
A.称量 B.量取 C.溶解
知识点2 有关溶液中溶质的质量分数的计算
3.某学校实验室有一桶久置的过氧化氢溶液,测得其密度为1.069 g/mL,该温度下溶液的密度和溶质质量分数的对应关系如图所示。
桶上标签提供的信息:1.过氧化氢的质量分数为30%;2.内装溶液质量50 kg。
完成下列问题:
(1)若用此久置的过氧化氢溶液来配制溶质质量分数为3%的环境消毒液200 kg,需用这种过氧化氢溶液 kg。
(2)若将这桶过氧化氢溶液放置至H2O2完全分解,桶中剩下的液体质量是多少 (假设液体不挥发,通过计算回答,结果精确到0.1)
能力提升全练
4.(2023安徽中考,6,★☆☆)为制作叶脉书签,某同学在实验室配制10%的NaOH溶液,部分操作如下,其中正确的是 ( )
5.【学生必做实验】(2023北京平谷一模,24,★☆☆)农业上常用质量分数为16%的氯化钠溶液选种,实验室配制100 g该浓度溶液的过程如图所示,下列说法不正确的是 ( )
A.②中需称量NaCl的质量为16 g
B.③中玻璃棒搅拌可以加速NaCl溶解
C.实验操作顺序为④②①⑤③
D.选用50 mL量筒量取所需的水
6.(2023云南中考,20,★★☆)学校某兴趣小组的同学,在实验室配制50 g溶质质量分数为15%的氯化钠溶液来选种。溶液的配制过程如下,下列说法正确的是 ( )
A.若②中的砝码和药品放反,溶液的溶质质量分数会偏大
B.若③中烧杯内壁有水珠,对溶液的溶质质量分数无影响
C.若④中量取水时俯视读数,溶液的溶质质量分数会偏大
D.将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数会偏小
7.(2020北京中考改编,22,★☆☆)实验室需配制60 g溶质质量分数为10%的NaCl溶液。请回答下列问题:
(1)需要称量NaCl的质量为 g。
(2)从配好的溶液中倒出10 g,其中溶质和溶剂的质量比为 。
8.(2023甘肃金昌中考,36,★★☆)某化学兴趣小组同学用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:(已知Zn+H2SO4 ZnSO4+H2↑)
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
素养探究全练
9.【学科素养·科学探究与实践】已知:①向水中加入固体氯化钠,溶液的密度增大;②向水中加入乙醇,溶液的密度减小;③向水中加入盐酸,溶液的密度增大。
如图所示,将三枚大小相同的生鸡蛋(鸡蛋壳的主要成分是碳酸钙)分别放在三种液体中进行实验(图示状态为生鸡蛋在水中的状态),最终鸡蛋下沉的是 (填序号)。
导致C中鸡蛋没入溶液的体积发生变化的原因是① ;② 。
推测:一艘满载货物的轮船由内陆河进入海洋时,没入水中的体积将 (填“增大”或“减小”)。
答案全解全析
基础过关全练
1.B 题中的“5%”表示每100 g葡萄糖溶液中含有5 g葡萄糖,表示葡萄糖的质量分数为5%,表示葡萄糖与水的质量比为5∶95。
2.(1)5 (2)50 mL (3)C
解析 (1)配制50 g 16%的NaCl溶液,需要NaCl的质量为50 g×16%=8 g,则应在托盘天平的右盘上放5 g砝码,并将游码拨至3 g处。(2)配制50 g 16%的NaCl溶液,需要水的质量为50 g-8 g=42 g,合42 mL,故选用50 mL的量筒。(3)溶解步骤要用玻璃棒搅拌,以加快NaCl的溶解速率。
3.(1)30
(2)解:设桶中的过氧化氢完全分解放出的O2的质量为x。
2H2O22H2O+O2↑
68 32
50 kg×30% x
=
x≈7.1 kg
桶中剩下的液体的质量为50 kg-7.1 kg=42.9 kg
答:桶中剩下的液体的质量为42.9 kg。
解析 (1)已知题中久置的过氧化氢溶液的密度为1.069 g/mL,结合题图可知,该溶液的溶质质量分数为20%。设需要的溶液质量为y,根据溶液稀释前后溶质质量不变,可得y×20%=200 kg×3%,解得y=30 kg。(2)原溶液中过氧化氢的质量为50 kg×30%=15 kg,根据化学方程式,由过氧化氢的质量求得氧气的质量,桶中原溶液的质量减去生成氧气的质量就是剩下的液体的质量。
能力提升全练
4.C 取用NaOH时,瓶塞应该倒放,A错误;氢氧化钠具有强腐蚀性,应放在小烧杯等玻璃器皿中称量,B错误;量取水时,试剂瓶的标签向着手心,量筒稍微倾斜,试剂瓶口紧挨着量筒口,C正确;量取液体读数时,量筒必须放平,视线与液体凹液面的最低处保持水平,D错误。
5.D ②中需称量NaCl的质量为16%×100 g=16 g,A正确;③中玻璃棒搅拌可以加速NaCl溶解,B正确;配制溶液的一般过程为计算、称量(量取)、溶解,则操作顺序为④②①⑤③,C正确;需要水的质量为100 g-16 g=84 g,即84 mL,故选择100 mL的量筒,D错误。
6.C 若②中的砝码和药品放反,称量过程中使用了游码,则药品质量=砝码质量-游码示数,药品质量偏小,溶液的溶质质量分数会偏小,A错误;若③中烧杯内壁有水珠,溶剂质量增大,溶液的溶质质量分数偏小,B错误;若④中量取水时俯视读数,实际量取水的体积偏小,溶液的溶质质量分数会偏大,C正确;溶液是均一、稳定的混合物,装瓶时有少量溶液溅出,溶液的溶质质量分数不变,D错误。
7.(1)6 (2)1∶9
解析 (1)溶质质量=溶液质量×溶质质量分数,则需氯化钠的质量为60 g×10%=6 g。(2)溶液具有均一性,从配好的溶液中倒出10 g,溶质质量分数仍为10%,其中溶质和溶剂的质量比为10%∶(1-10%)=1∶9。
8.(1)0.2
(2)解:设参加反应的稀硫酸中溶质的质量为x。
Zn+H2SO4 ZnSO4+H2↑
98 2
x 0.2 g
= x=9.8 g
稀硫酸中溶质的质量分数为×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%。
解析 (1)由题图中数据分析可知,第2次加入的粗锌没有参加反应,根据质量守恒定律知,生成氢气的质量为205.6 g+8 g-213.4 g=0.2 g。(2)根据化学方程式,利用生成的0.2 g氢气计算出稀硫酸中溶质的质量,进而计算出稀硫酸中溶质的质量分数。
素养探究全练
9.B 鸡蛋质量减小 溶液的密度增大 减小
解析 鸡蛋壳的主要成分是碳酸钙,碳酸钙能与盐酸反应放出CO2气体,所以向水中加入盐酸时,一方面溶液密度会增大,另一方面鸡蛋质量会因发生反应而减小,同时,生成的二氧化碳气体也会改变鸡蛋所受到的浮力,因此鸡蛋没入溶液的体积会发生改变。内陆河河水密度小于海水密度,而轮船在内陆河和海水中所受浮力相等,所以轮船由内陆河进入海洋时,没入水中的体积会减小。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
