2024北京课改化学九年级下学期课时练--第二节 盐的性质
文档属性
| 名称 | 2024北京课改化学九年级下学期课时练--第二节 盐的性质 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 14:00:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024北京课改化学九年级下学期
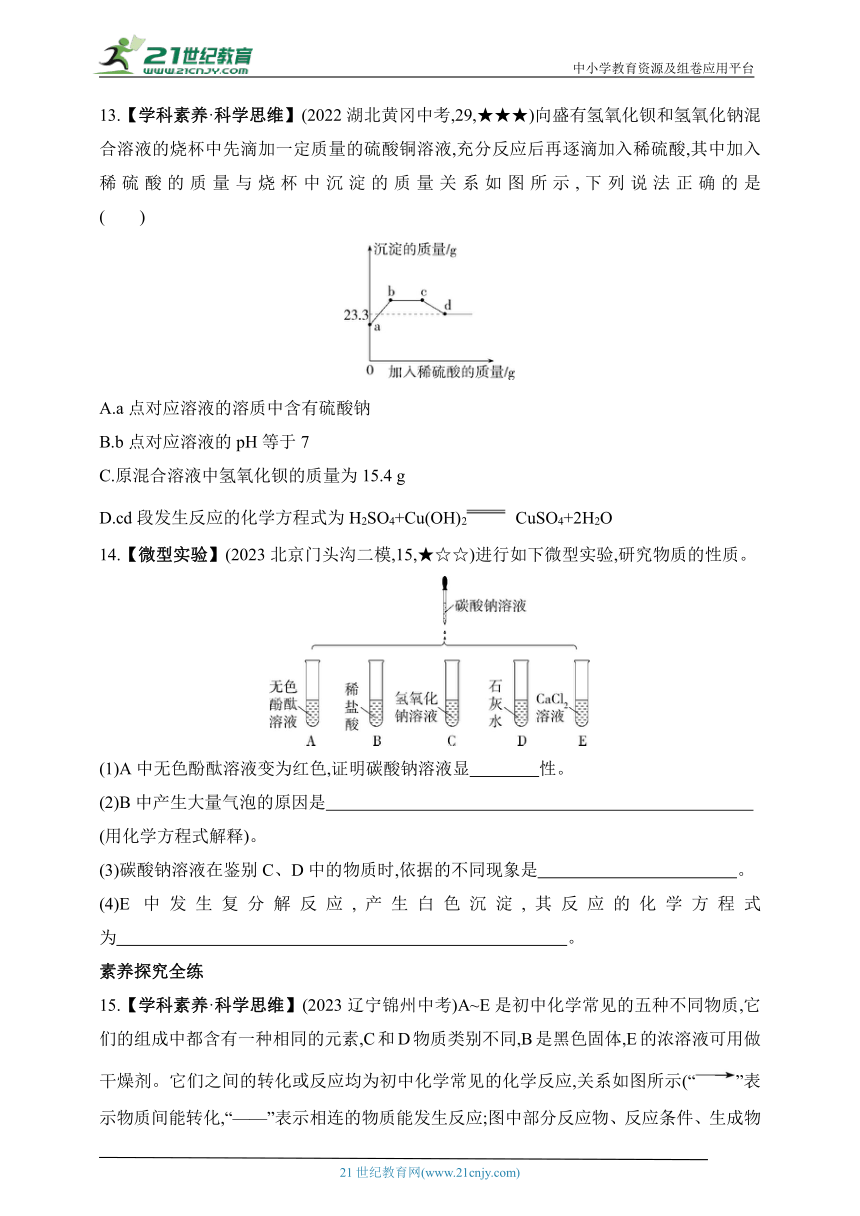
第12章 盐
第二节 盐的性质
基础过关全练
知识点1 盐的性质
1.(2022上海模拟)可以把氢氧化钠、氢氧化钙、盐酸三种溶液一次性鉴别出来的是 ( )
A.硝酸银溶液 B.氯化钡溶液
C.稀硫酸 D.碳酸钠溶液
2.【教材变式·P78实验】有一包白色粉末可能由碳酸钠、硫酸钠、氯化钠、氯化钡中的一种或几种组成。把少量该粉末放入足量水中,搅拌、静置、过滤,得到白色固体和滤液。向所得固体中加入稀硝酸充分反应,固体部分溶解,下列说法正确的是 ( )
A.一定有碳酸钠、硫酸钠、氯化钡,一定无氯化钠
B.一定有碳酸钠、氯化钡、氯化钠
C.一定有碳酸钠、硫酸钠、氯化钡,可能有氯化钠
D.一定有硫酸钠、氯化钡,一定无氯化钠
3.下列选项所示的物质间转化均能一步实现的是 ( )
A.CuCuSO4Cu(OH)2
B.SSO2H2SO4
C.FeFeCl3AgCl
D.CCO2CaCO3
知识点2 复分解反应及其发生的条件
4.【新独家原创】下列各组物质相互混合,有气体生成的复分解反应是( )
A.氯化钠溶液和硝酸银溶液
B.氯化钾溶液和氢氧化钠溶液
C.碳酸钙溶液和稀盐酸
D.锌粒和稀硫酸
5.下列化学反应属于下图所示关系图中阴影部分的是 ( )
A.CuO+CO Cu+CO2
B.2H2O 2H2↑+O2↑
C.CaO+H2O Ca(OH)2
D.2NaOH+H2SO4 Na2SO4+2H2O
6.(2023山东滨州中考)下列离子在溶液中可以大量共存的是 ( )
A.N、Na+、N、Cl-
B.K+、H+、C、S
C.Ca2+、K+、C、N
D.Fe3+、Na+、OH-、Cl-
7.酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20 ℃时的溶解性。请利用此表完成下列问题:
离子 OH- Cl- N S
H+ —— 溶、挥 溶 溶
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 溶 微
Ba2+ 溶 溶 溶 不
(1)判断氯化钠溶液与硝酸钙溶液能否发生反应并说明理由: 。
(2)写出一个生成不溶物且属于中和反应的化学方程式: 。
能力提升全练
(2023浙江杭州中考,16,★☆☆)有一瓶标签无法辨认的试剂,是碳酸钠溶液或硫酸钠溶液中的一种。仅用下列试剂无法进行鉴别的是
( )
A.pH试纸 B.酚酞试液
C.稀硫酸 D.硝酸钡溶液
9.(2023湖南怀化中考,17,★☆☆)下列各组物质在同一溶液中能大量共存,且溶液为无色的是(C9212002) ( )
A.NaCl、BaCl2、HCl
B.CuCl2、KCl、H2SO4
C.Ca(NO3)2、Na2CO3、KOH
D.HCl、NaOH、Na2SO4
10.(2023湖南株洲中考,18,★☆☆)下列化学方程式书写正确且属于复分解反应的是( )
A.铁与稀盐酸反应:2Fe+6HCl 2FeCl3+3H2↑
B.镁带在空气中燃烧:Mg+O2 MgO2
C.在高温下CaCO3分解:CaCO3 CaO+CO2↑
D.氢氧化铝治疗胃酸过多:Al(OH)3+3HCl AlCl3+3H2O
11.(2023甘肃金昌中考,23,★☆☆)实验室有一瓶无色透明的废液。经同学们测定,其pH=2,对其中可能存在的离子组合,推测合理的是 ( )
A.Fe3+、Na+、Cl-、N B.Na+、K+、Cl-、S
C.K+、Na+、Cl-、C D.Ba2+、Ca2+、S、C
12.(2023江苏丹阳二模,16,★★☆)取一支试管,按下列顺序加入试剂。
实验1:加入1 mL NaCl溶液,滴入酚酞试液,不变红。
实验2:滴入5滴Na2CO3溶液,溶液变红。
实验3:加入过量稀HNO3,冒气泡。
实验4:加入6滴AgNO3溶液,产生白色固体。
下列说法不正确的是 ( )
A.实验1可得出:中性溶液不能使酚酞试液变红
B.实验2可得出:Na2CO3溶液显碱性,且其碱性与C有关
C.实验3中还可观察到溶液变无色,所得溶液中含有2种溶质
D.实验4中发生反应:AgNO3+NaCl AgCl↓+NaNO3
13.【学科素养·科学思维】(2022湖北黄冈中考,29,★★★)向盛有氢氧化钡和氢氧化钠混合溶液的烧杯中先滴加一定质量的硫酸铜溶液,充分反应后再逐滴加入稀硫酸,其中加入稀硫酸的质量与烧杯中沉淀的质量关系如图所示,下列说法正确的是 ( )
A.a点对应溶液的溶质中含有硫酸钠
B.b点对应溶液的pH等于7
C.原混合溶液中氢氧化钡的质量为15.4 g
D.cd段发生反应的化学方程式为H2SO4+Cu(OH)2 CuSO4+2H2O
14.【微型实验】(2023北京门头沟二模,15,★☆☆)进行如下微型实验,研究物质的性质。
(1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显 性。
(2)B中产生大量气泡的原因是 (用化学方程式解释)。
(3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是 。
(4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为 。
素养探究全练
15.【学科素养·科学思维】(2023辽宁锦州中考)A~E是初中化学常见的五种不同物质,它们的组成中都含有一种相同的元素,C和D物质类别不同,B是黑色固体,E的浓溶液可用做干燥剂。它们之间的转化或反应均为初中化学常见的化学反应,关系如图所示(“”表示物质间能转化,“——”表示相连的物质能发生反应;图中部分反应物、反应条件、生成物已省略)。请回答下列问题:
(1)A的化学式为 。
(2)C的物质类别是 (填“单质”“氧化物”“酸”“碱”或“盐”)。
(3)B——E反应的现象是 。
(4)写出BD反应的化学方程式 ,该反应的基本反应类型是 。
16.【学科素养·科学探究与实践】(2023甘肃金昌中考)某校化学兴趣小组的同学利用稀盐酸、碳酸钠、Ba(OH)2溶液三种物质探究“复分解反应发生的条件”,做了以下实验。
(1)大家一致认为在试管①中还需要加入 溶液才能证明发生了复分解反应。
(2)试管②中观察到的现象是 ,试管③中反应的化学方程式为 。
(3)通过三组实验,同学们得出复分解反应发生的条件是 。
(4)兴趣小组的同学将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究。
【提出问题】滤液中溶质的成分是什么
【猜想假设】猜想一:NaOH;
猜想二:Ba(OH)2、NaOH;
猜想三: 。
【设计实验】验证你的猜想正确。
实验操作 现象 结论
步骤一:取试管③中滤液少量于试管中,加入足量CaCl2溶液 有 产生 猜想三 正确
步骤二:静置一段时间,向上层清液中滴加适量 溶液 有蓝色 沉淀产生
【反思拓展】通过探究实验,同学们发现Ba(OH)2和NaOH化学性质相似,你认为Ba(OH)2的保存方法是 。
答案全解全析
基础过关全练
1.D 硝酸银溶液无法鉴别氢氧化钙溶液和氢氧化钠溶液,A不符合题意;氯化钡溶液和稀硫酸与题干中三种溶液混合都没有明显现象,B、C不符合题意;加入碳酸钠溶液,有白色沉淀产生的是氢氧化钙溶液,有气泡产生的是盐酸,无现象的是氢氧化钠溶液,D符合题意。
2.C 碳酸钡不溶于水,溶于稀硝酸;硫酸钡不溶于水,也不溶于稀硝酸。向白色沉淀中加入稀硝酸充分反应,固体部分溶解,说明白色沉淀是碳酸钡和硫酸钡,可推断白色粉末中一定有碳酸钠、硫酸钠和氯化钡,但不确定是否有氯化钠。故选C。
3.D Cu和稀硫酸不反应,CuCuSO4不能一步实现,A错误。SO2和蒸馏水反应不能生成H2SO4,B错误。Fe和稀盐酸反应生成的是FeCl2,C错误。碳在氧气中完全燃烧能生成二氧化碳,二氧化碳与澄清石灰水反应能生成碳酸钙,D正确。
4.C 氯化钠溶液和硝酸银溶液反应生成氯化银白色沉淀,是复分解反应,但无气体生成;氯化钾溶液和氢氧化钠溶液不能发生反应;锌粒和稀硫酸反应生成硫酸锌和氢气,有气体生成,但不是复分解反应,故选C。
5.A 题图中阴影部分表示四种基本反应类型以外的反应。CuO+CO Cu+CO2不属于四种基本反应类型中的任何一种,A符合题意。
6.A H+、C能结合生成水和二氧化碳,不能大量共存,B错误;Ca2+、C能结合生成碳酸钙沉淀,不能大量共存,C错误;OH-、Fe3+能结合生成氢氧化铁沉淀,不能大量共存,D错误。
7.(1)不能,氯化钠与硝酸钙互相交换成分后没有沉淀或气体或水生成,因此不能发生化学反应 (2)H2SO4+Ba(OH)2 BaSO4↓+2H2O(合理即可)
解析 (2)中和反应是酸与碱作用生成盐和水的反应,所以符合要求的化学方程式可以是H2SO4+Ba(OH)2 BaSO4↓+2H2O。
能力提升全练
8.D 用pH试纸检测,pH大的是碳酸钠,pH小的是硫酸钠;滴入酚酞试液,使酚酞试液变红的是碳酸钠,不变色的是硫酸钠;滴加稀硫酸,有气泡产生的是碳酸钠,无气泡产生的是硫酸钠;滴加硝酸钡溶液都产生白色沉淀,无法鉴别。
9.A 铜离子在溶液中显蓝色,B错误;Ca(NO3)2、Na2CO3在溶液中能相互交换成分生成碳酸钙沉淀和硝酸钠,不能大量共存,C错误;HCl、NaOH在溶液中能相互交换成分生成氯化钠和水,不能大量共存,D错误,故选A。
10.D 铁和稀盐酸反应生成氯化亚铁(FeCl2)和氢气,A错误;氧化镁的化学式为MgO,B错误;C项中的反应符合“一变多”的特征,属于分解反应,C错误。
11.B pH=2的水溶液显酸性,水溶液中含有大量的H+,且溶液无色透明,不含有颜色的离子。含有Fe3+的溶液呈黄色,A错误;四种离子间不能结合成沉淀或气体或水,能在酸性溶液中大量共存,且不存在有色离子,B正确;C与H+在溶液中能结合生成水和二氧化碳,二者不能大量共存,C错误;C与H+在溶液中能结合生成水和二氧化碳,且选项中阳离子与阴离子两两结合均会生成沉淀,不能大量共存,D错误。
12.C 加入过量稀HNO3,硝酸和碳酸钠反应生成硝酸钠、水和二氧化碳,此时溶液显酸性,溶液变为无色,所得溶液中含有氯化钠、硝酸钠、硝酸3种溶质,C错误。
13.D 加入硫酸沉淀质量增大,说明加硫酸之前溶液中氢氧化钡有剩余,而氢氧化钡与硫酸钠不能共存,故a点对应溶液的溶质中不含硫酸钠,A错误;bc段沉淀质量不变,是硫酸与氢氧化钠反应,故b点溶液中有氢氧化钠,溶液呈碱性,pH大于7,B错误;cd段沉淀溶解,最终剩余的沉淀为硫酸钡,其质量为23.3 g,根据质量守恒定律,硫酸钡中钡元素质量与氢氧化钡中钡元素质量相等,故原混合溶液中氢氧化钡的质量为23.3 g×÷=17.1 g,C错误;cd段沉淀溶解,而硫酸钡不溶于硫酸,只能是氢氧化铜与硫酸反应,反应的化学方程式为H2SO4+Cu(OH)2CuSO4+2H2O,D正确。
14.(1)碱 (2)Na2CO3+2HCl 2NaCl+H2O+CO2↑ (3)C中无现象,D中出现白色沉淀
(4)Na2CO3+CaCl2 2NaCl+CaCO3↓
解析 (1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显碱性。(2)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳。(3)氢氧化钠与碳酸钠溶液不反应,碳酸钠溶液和氢氧化钙反应生成碳酸钙白色沉淀。(4)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠。
素养探究全练
15.(1)O2 (2)氧化物 (3)黑色固体逐渐减少,溶液由无色变为蓝色 (4)CuO+H2SO4 CuSO4+H2O 复分解反应
解析 氧化铜是常见黑色固体,B可以是氧化铜;浓硫酸具有吸水性,是常见的干燥剂,E是硫酸;氧化铜和硫酸中都含有氧元素,所以五种物质中含有的相同元素为氧元素,氧气与铜反应生成氧化铜,氧化铜与酸﹑氢气反应均有水生成,水和氧气可以相互转化,所以A可以是氧气,C可以是水;氧化铜与硫酸反应生成硫酸铜和水,C、D物质类别不同,所以D可以是硫酸铜,代入检验,推论正确。(4)B是氧化铜,D是硫酸铜,氧化铜与稀硫酸反应生成硫酸铜和水;该反应是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应。
16.(1)酚酞(或紫色石蕊) (2)固体溶解,有气泡产生 Ba(OH)2+Na2CO3 BaCO3↓+2NaOH (3)要有沉淀或气体或水生成 (4)【猜想假设】NaOH、Na2CO3 【设计实验】白色沉淀 CuSO4[或CuCl2、Cu(NO3)2等] 【反思拓展】密封干燥保存
解析 (1)氢氧化钡溶液中加入几滴酚酞溶液,溶液变红,加入稀盐酸,若红色溶液变成了无色,说明发生了复分解反应。(2)稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,会观察到固体溶解,有气泡产生;试管③中氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠。(3)试管①中有水生成,试管②中有气体生成,试管③中有沉淀生成,故通过三组实验,可得出复分解反应发生的条件是有水或气体或沉淀生成。(4)【猜想假设】氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,若恰好完全反应,滤液中溶质的成分是NaOH;若氢氧化钡过量,滤液中溶质的成分是Ba(OH)2、NaOH;若碳酸钠过量,滤液中溶质的成分是NaOH、Na2CO3。【设计实验】猜想三正确,说明滤液中溶质的成分是NaOH、Na2CO3,加入足量CaCl2溶液,碳酸钠与CaCl2反应生成白色沉淀碳酸钙和氯化钠;根据实验现象有蓝色沉淀产生可知,可向上层清液中滴加适量的硫酸铜溶液,氢氧化钠与硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠。【反思拓展】NaOH固体不仅能吸收空气中的水分而发生潮解,还能与空气中的二氧化碳反应而变质,Ba(OH)2和NaOH化学性质相似,则Ba(OH)2的保存方法是密封干燥保存。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024北京课改化学九年级下学期
第12章 盐
第二节 盐的性质
基础过关全练
知识点1 盐的性质
1.(2022上海模拟)可以把氢氧化钠、氢氧化钙、盐酸三种溶液一次性鉴别出来的是 ( )
A.硝酸银溶液 B.氯化钡溶液
C.稀硫酸 D.碳酸钠溶液
2.【教材变式·P78实验】有一包白色粉末可能由碳酸钠、硫酸钠、氯化钠、氯化钡中的一种或几种组成。把少量该粉末放入足量水中,搅拌、静置、过滤,得到白色固体和滤液。向所得固体中加入稀硝酸充分反应,固体部分溶解,下列说法正确的是 ( )
A.一定有碳酸钠、硫酸钠、氯化钡,一定无氯化钠
B.一定有碳酸钠、氯化钡、氯化钠
C.一定有碳酸钠、硫酸钠、氯化钡,可能有氯化钠
D.一定有硫酸钠、氯化钡,一定无氯化钠
3.下列选项所示的物质间转化均能一步实现的是 ( )
A.CuCuSO4Cu(OH)2
B.SSO2H2SO4
C.FeFeCl3AgCl
D.CCO2CaCO3
知识点2 复分解反应及其发生的条件
4.【新独家原创】下列各组物质相互混合,有气体生成的复分解反应是( )
A.氯化钠溶液和硝酸银溶液
B.氯化钾溶液和氢氧化钠溶液
C.碳酸钙溶液和稀盐酸
D.锌粒和稀硫酸
5.下列化学反应属于下图所示关系图中阴影部分的是 ( )
A.CuO+CO Cu+CO2
B.2H2O 2H2↑+O2↑
C.CaO+H2O Ca(OH)2
D.2NaOH+H2SO4 Na2SO4+2H2O
6.(2023山东滨州中考)下列离子在溶液中可以大量共存的是 ( )
A.N、Na+、N、Cl-
B.K+、H+、C、S
C.Ca2+、K+、C、N
D.Fe3+、Na+、OH-、Cl-
7.酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20 ℃时的溶解性。请利用此表完成下列问题:
离子 OH- Cl- N S
H+ —— 溶、挥 溶 溶
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 溶 微
Ba2+ 溶 溶 溶 不
(1)判断氯化钠溶液与硝酸钙溶液能否发生反应并说明理由: 。
(2)写出一个生成不溶物且属于中和反应的化学方程式: 。
能力提升全练
(2023浙江杭州中考,16,★☆☆)有一瓶标签无法辨认的试剂,是碳酸钠溶液或硫酸钠溶液中的一种。仅用下列试剂无法进行鉴别的是
( )
A.pH试纸 B.酚酞试液
C.稀硫酸 D.硝酸钡溶液
9.(2023湖南怀化中考,17,★☆☆)下列各组物质在同一溶液中能大量共存,且溶液为无色的是(C9212002) ( )
A.NaCl、BaCl2、HCl
B.CuCl2、KCl、H2SO4
C.Ca(NO3)2、Na2CO3、KOH
D.HCl、NaOH、Na2SO4
10.(2023湖南株洲中考,18,★☆☆)下列化学方程式书写正确且属于复分解反应的是( )
A.铁与稀盐酸反应:2Fe+6HCl 2FeCl3+3H2↑
B.镁带在空气中燃烧:Mg+O2 MgO2
C.在高温下CaCO3分解:CaCO3 CaO+CO2↑
D.氢氧化铝治疗胃酸过多:Al(OH)3+3HCl AlCl3+3H2O
11.(2023甘肃金昌中考,23,★☆☆)实验室有一瓶无色透明的废液。经同学们测定,其pH=2,对其中可能存在的离子组合,推测合理的是 ( )
A.Fe3+、Na+、Cl-、N B.Na+、K+、Cl-、S
C.K+、Na+、Cl-、C D.Ba2+、Ca2+、S、C
12.(2023江苏丹阳二模,16,★★☆)取一支试管,按下列顺序加入试剂。
实验1:加入1 mL NaCl溶液,滴入酚酞试液,不变红。
实验2:滴入5滴Na2CO3溶液,溶液变红。
实验3:加入过量稀HNO3,冒气泡。
实验4:加入6滴AgNO3溶液,产生白色固体。
下列说法不正确的是 ( )
A.实验1可得出:中性溶液不能使酚酞试液变红
B.实验2可得出:Na2CO3溶液显碱性,且其碱性与C有关
C.实验3中还可观察到溶液变无色,所得溶液中含有2种溶质
D.实验4中发生反应:AgNO3+NaCl AgCl↓+NaNO3
13.【学科素养·科学思维】(2022湖北黄冈中考,29,★★★)向盛有氢氧化钡和氢氧化钠混合溶液的烧杯中先滴加一定质量的硫酸铜溶液,充分反应后再逐滴加入稀硫酸,其中加入稀硫酸的质量与烧杯中沉淀的质量关系如图所示,下列说法正确的是 ( )
A.a点对应溶液的溶质中含有硫酸钠
B.b点对应溶液的pH等于7
C.原混合溶液中氢氧化钡的质量为15.4 g
D.cd段发生反应的化学方程式为H2SO4+Cu(OH)2 CuSO4+2H2O
14.【微型实验】(2023北京门头沟二模,15,★☆☆)进行如下微型实验,研究物质的性质。
(1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显 性。
(2)B中产生大量气泡的原因是 (用化学方程式解释)。
(3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是 。
(4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为 。
素养探究全练
15.【学科素养·科学思维】(2023辽宁锦州中考)A~E是初中化学常见的五种不同物质,它们的组成中都含有一种相同的元素,C和D物质类别不同,B是黑色固体,E的浓溶液可用做干燥剂。它们之间的转化或反应均为初中化学常见的化学反应,关系如图所示(“”表示物质间能转化,“——”表示相连的物质能发生反应;图中部分反应物、反应条件、生成物已省略)。请回答下列问题:
(1)A的化学式为 。
(2)C的物质类别是 (填“单质”“氧化物”“酸”“碱”或“盐”)。
(3)B——E反应的现象是 。
(4)写出BD反应的化学方程式 ,该反应的基本反应类型是 。
16.【学科素养·科学探究与实践】(2023甘肃金昌中考)某校化学兴趣小组的同学利用稀盐酸、碳酸钠、Ba(OH)2溶液三种物质探究“复分解反应发生的条件”,做了以下实验。
(1)大家一致认为在试管①中还需要加入 溶液才能证明发生了复分解反应。
(2)试管②中观察到的现象是 ,试管③中反应的化学方程式为 。
(3)通过三组实验,同学们得出复分解反应发生的条件是 。
(4)兴趣小组的同学将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究。
【提出问题】滤液中溶质的成分是什么
【猜想假设】猜想一:NaOH;
猜想二:Ba(OH)2、NaOH;
猜想三: 。
【设计实验】验证你的猜想正确。
实验操作 现象 结论
步骤一:取试管③中滤液少量于试管中,加入足量CaCl2溶液 有 产生 猜想三 正确
步骤二:静置一段时间,向上层清液中滴加适量 溶液 有蓝色 沉淀产生
【反思拓展】通过探究实验,同学们发现Ba(OH)2和NaOH化学性质相似,你认为Ba(OH)2的保存方法是 。
答案全解全析
基础过关全练
1.D 硝酸银溶液无法鉴别氢氧化钙溶液和氢氧化钠溶液,A不符合题意;氯化钡溶液和稀硫酸与题干中三种溶液混合都没有明显现象,B、C不符合题意;加入碳酸钠溶液,有白色沉淀产生的是氢氧化钙溶液,有气泡产生的是盐酸,无现象的是氢氧化钠溶液,D符合题意。
2.C 碳酸钡不溶于水,溶于稀硝酸;硫酸钡不溶于水,也不溶于稀硝酸。向白色沉淀中加入稀硝酸充分反应,固体部分溶解,说明白色沉淀是碳酸钡和硫酸钡,可推断白色粉末中一定有碳酸钠、硫酸钠和氯化钡,但不确定是否有氯化钠。故选C。
3.D Cu和稀硫酸不反应,CuCuSO4不能一步实现,A错误。SO2和蒸馏水反应不能生成H2SO4,B错误。Fe和稀盐酸反应生成的是FeCl2,C错误。碳在氧气中完全燃烧能生成二氧化碳,二氧化碳与澄清石灰水反应能生成碳酸钙,D正确。
4.C 氯化钠溶液和硝酸银溶液反应生成氯化银白色沉淀,是复分解反应,但无气体生成;氯化钾溶液和氢氧化钠溶液不能发生反应;锌粒和稀硫酸反应生成硫酸锌和氢气,有气体生成,但不是复分解反应,故选C。
5.A 题图中阴影部分表示四种基本反应类型以外的反应。CuO+CO Cu+CO2不属于四种基本反应类型中的任何一种,A符合题意。
6.A H+、C能结合生成水和二氧化碳,不能大量共存,B错误;Ca2+、C能结合生成碳酸钙沉淀,不能大量共存,C错误;OH-、Fe3+能结合生成氢氧化铁沉淀,不能大量共存,D错误。
7.(1)不能,氯化钠与硝酸钙互相交换成分后没有沉淀或气体或水生成,因此不能发生化学反应 (2)H2SO4+Ba(OH)2 BaSO4↓+2H2O(合理即可)
解析 (2)中和反应是酸与碱作用生成盐和水的反应,所以符合要求的化学方程式可以是H2SO4+Ba(OH)2 BaSO4↓+2H2O。
能力提升全练
8.D 用pH试纸检测,pH大的是碳酸钠,pH小的是硫酸钠;滴入酚酞试液,使酚酞试液变红的是碳酸钠,不变色的是硫酸钠;滴加稀硫酸,有气泡产生的是碳酸钠,无气泡产生的是硫酸钠;滴加硝酸钡溶液都产生白色沉淀,无法鉴别。
9.A 铜离子在溶液中显蓝色,B错误;Ca(NO3)2、Na2CO3在溶液中能相互交换成分生成碳酸钙沉淀和硝酸钠,不能大量共存,C错误;HCl、NaOH在溶液中能相互交换成分生成氯化钠和水,不能大量共存,D错误,故选A。
10.D 铁和稀盐酸反应生成氯化亚铁(FeCl2)和氢气,A错误;氧化镁的化学式为MgO,B错误;C项中的反应符合“一变多”的特征,属于分解反应,C错误。
11.B pH=2的水溶液显酸性,水溶液中含有大量的H+,且溶液无色透明,不含有颜色的离子。含有Fe3+的溶液呈黄色,A错误;四种离子间不能结合成沉淀或气体或水,能在酸性溶液中大量共存,且不存在有色离子,B正确;C与H+在溶液中能结合生成水和二氧化碳,二者不能大量共存,C错误;C与H+在溶液中能结合生成水和二氧化碳,且选项中阳离子与阴离子两两结合均会生成沉淀,不能大量共存,D错误。
12.C 加入过量稀HNO3,硝酸和碳酸钠反应生成硝酸钠、水和二氧化碳,此时溶液显酸性,溶液变为无色,所得溶液中含有氯化钠、硝酸钠、硝酸3种溶质,C错误。
13.D 加入硫酸沉淀质量增大,说明加硫酸之前溶液中氢氧化钡有剩余,而氢氧化钡与硫酸钠不能共存,故a点对应溶液的溶质中不含硫酸钠,A错误;bc段沉淀质量不变,是硫酸与氢氧化钠反应,故b点溶液中有氢氧化钠,溶液呈碱性,pH大于7,B错误;cd段沉淀溶解,最终剩余的沉淀为硫酸钡,其质量为23.3 g,根据质量守恒定律,硫酸钡中钡元素质量与氢氧化钡中钡元素质量相等,故原混合溶液中氢氧化钡的质量为23.3 g×÷=17.1 g,C错误;cd段沉淀溶解,而硫酸钡不溶于硫酸,只能是氢氧化铜与硫酸反应,反应的化学方程式为H2SO4+Cu(OH)2CuSO4+2H2O,D正确。
14.(1)碱 (2)Na2CO3+2HCl 2NaCl+H2O+CO2↑ (3)C中无现象,D中出现白色沉淀
(4)Na2CO3+CaCl2 2NaCl+CaCO3↓
解析 (1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显碱性。(2)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳。(3)氢氧化钠与碳酸钠溶液不反应,碳酸钠溶液和氢氧化钙反应生成碳酸钙白色沉淀。(4)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠。
素养探究全练
15.(1)O2 (2)氧化物 (3)黑色固体逐渐减少,溶液由无色变为蓝色 (4)CuO+H2SO4 CuSO4+H2O 复分解反应
解析 氧化铜是常见黑色固体,B可以是氧化铜;浓硫酸具有吸水性,是常见的干燥剂,E是硫酸;氧化铜和硫酸中都含有氧元素,所以五种物质中含有的相同元素为氧元素,氧气与铜反应生成氧化铜,氧化铜与酸﹑氢气反应均有水生成,水和氧气可以相互转化,所以A可以是氧气,C可以是水;氧化铜与硫酸反应生成硫酸铜和水,C、D物质类别不同,所以D可以是硫酸铜,代入检验,推论正确。(4)B是氧化铜,D是硫酸铜,氧化铜与稀硫酸反应生成硫酸铜和水;该反应是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应。
16.(1)酚酞(或紫色石蕊) (2)固体溶解,有气泡产生 Ba(OH)2+Na2CO3 BaCO3↓+2NaOH (3)要有沉淀或气体或水生成 (4)【猜想假设】NaOH、Na2CO3 【设计实验】白色沉淀 CuSO4[或CuCl2、Cu(NO3)2等] 【反思拓展】密封干燥保存
解析 (1)氢氧化钡溶液中加入几滴酚酞溶液,溶液变红,加入稀盐酸,若红色溶液变成了无色,说明发生了复分解反应。(2)稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,会观察到固体溶解,有气泡产生;试管③中氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠。(3)试管①中有水生成,试管②中有气体生成,试管③中有沉淀生成,故通过三组实验,可得出复分解反应发生的条件是有水或气体或沉淀生成。(4)【猜想假设】氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,若恰好完全反应,滤液中溶质的成分是NaOH;若氢氧化钡过量,滤液中溶质的成分是Ba(OH)2、NaOH;若碳酸钠过量,滤液中溶质的成分是NaOH、Na2CO3。【设计实验】猜想三正确,说明滤液中溶质的成分是NaOH、Na2CO3,加入足量CaCl2溶液,碳酸钠与CaCl2反应生成白色沉淀碳酸钙和氯化钠;根据实验现象有蓝色沉淀产生可知,可向上层清液中滴加适量的硫酸铜溶液,氢氧化钠与硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠。【反思拓展】NaOH固体不仅能吸收空气中的水分而发生潮解,还能与空气中的二氧化碳反应而变质,Ba(OH)2和NaOH化学性质相似,则Ba(OH)2的保存方法是密封干燥保存。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
