2024北京课改化学九年级下学期课时练--第一节 几种常见的盐
文档属性
| 名称 | 2024北京课改化学九年级下学期课时练--第一节 几种常见的盐 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 14:00:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024北京课改化学九年级下学期
第12章 盐
第一节 几种常见的盐
基础过关全练
知识点1 氯化钠
1.【新素材·传统工艺】(2022重庆重点学校模拟)古籍《天工开物》收录了井盐的生产过程。其中对“入于釜中煎炼,顷刻结盐,色成至白”的分析不合理的是 ( )
A.食盐是一种白色的固体
B.“结盐”时发生了化学变化
C.该过程能说明井盐的化学性质稳定
D.“入于釜中煎炼,顷刻结盐”类似于蒸发操作
2.(2021江苏扬州中考)氯化钠是一种常见的化学物质。下列说法不正确的是 ( )
A.氯化钠是常见的食品调味剂
B.氯化钠可用于生产氯气、烧碱
C.蒸发海水即可获得纯净的氯化钠固体
D.氯化钠可用于腌制食品
3.【学科素养·化学观念】下列关于氯化钠的认识,正确的是 ( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
4.(2023北京丰台一模)下列去除粗盐中难溶性杂质得到精盐的实验操作中,说法不正确的是 ( )
A.正确的操作顺序是①③②
B.操作①利用了氯化钠易溶于水的性质
C.①②③中玻璃棒的作用相同
D.操作②采用了蒸发溶剂的方法得到精盐
知识点2 碳酸钠、碳酸氢钠和碳酸钙
5.(2023湖南长沙二模)侯氏制碱法中的“碱”是指纯碱(碳酸钠),下列有关碳酸钠的说法,正确的是 ( )
A.俗称为纯碱、烧碱
B.化学式为NaCO3
C.工业上广泛用于玻璃、造纸、纺织、洗涤剂的生产
D.医疗上常用于配制生理盐水
6.(2019四川广安中考)向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:
①Na2CO3+HCl NaHCO3+NaCl
②NaHCO3+HCl NaCl+H2O+CO2↑
向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生二氧化碳的质量与所加盐酸的质量图像关系正确的是(C9212001) ( )
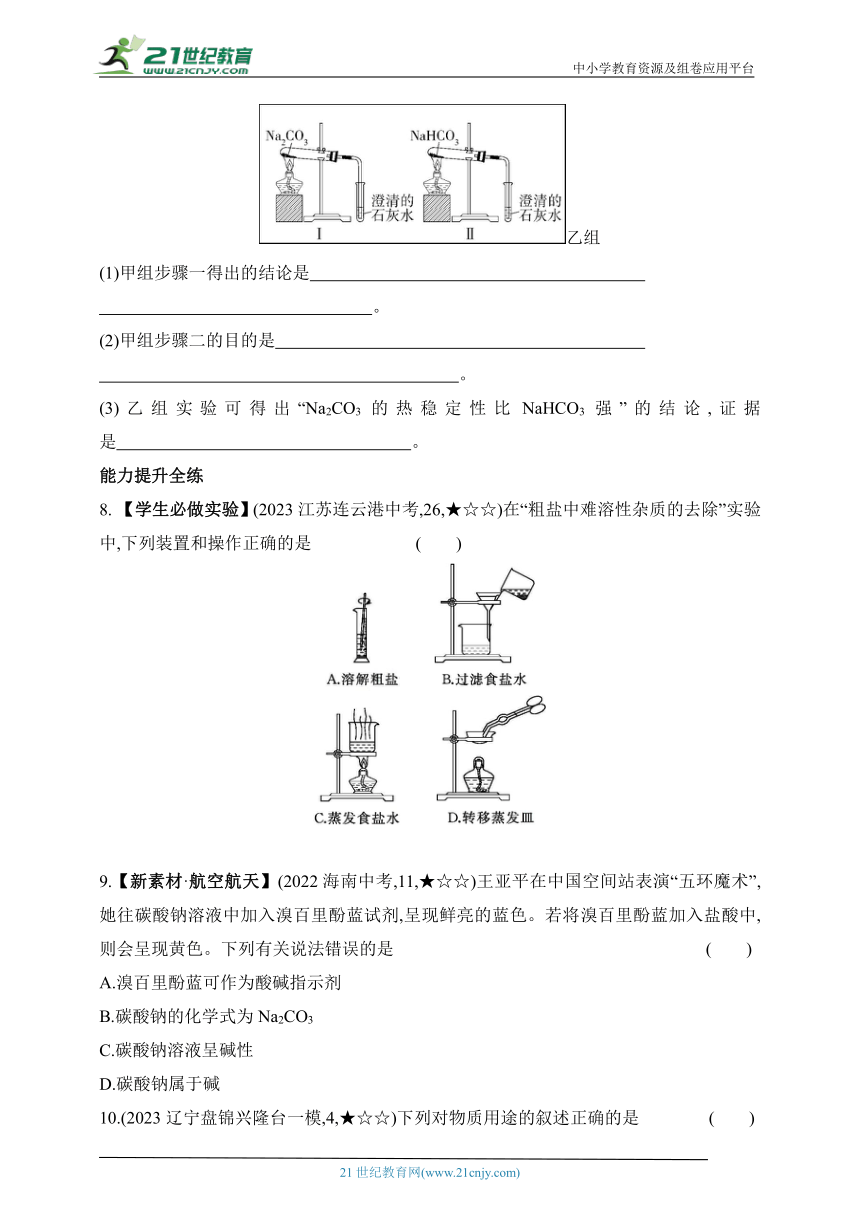
7.【教材变式·P75实验】(2022北京顺义一模)用下列两组实验研究Na2CO3和NaHCO3的性质。
甲组
乙组
(1)甲组步骤一得出的结论是 。
(2)甲组步骤二的目的是 。
(3)乙组实验可得出“Na2CO3的热稳定性比NaHCO3强”的结论,证据是 。
能力提升全练
8. 【学生必做实验】(2023江苏连云港中考,26,★☆☆)在“粗盐中难溶性杂质的去除”实验中,下列装置和操作正确的是 ( )
9.【新素材·航空航天】(2022海南中考,11,★☆☆)王亚平在中国空间站表演“五环魔术”,她往碳酸钠溶液中加入溴百里酚蓝试剂,呈现鲜亮的蓝色。若将溴百里酚蓝加入盐酸中,则会呈现黄色。下列有关说法错误的是 ( )
A.溴百里酚蓝可作为酸碱指示剂
B.碳酸钠的化学式为Na2CO3
C.碳酸钠溶液呈碱性
D.碳酸钠属于碱
10.(2023辽宁盘锦兴隆台一模,4,★☆☆)下列对物质用途的叙述正确的是 ( )
A.氯化钠是生活中的调味品,还可用于去除油脂
B.纯碱可在工业上用于制火碱,其热溶液可以除水垢
C.小苏打可用做发酵粉,常在做馒头、面包等发面食品中使用
D.硫酸钙可用做食品干燥剂
11.【创新装置】(2023四川绵阳期中,12,★★☆)某学习小组设计下图所示实验来比较碳酸钠和碳酸氢钠的热稳定性,装置中盛装药品错误的是 ( )
A.Na2CO3 B.NaHCO3
C.澄清石灰水 D.NaOH溶液
12.(2021贵州贵阳中考改编,6,★★☆)取等质量的Na2CO3和NaHCO3固体分别置于两个体积相同的密闭容器中,分别一次性加入等浓度、等体积的过量稀硫酸,用压强传感器测得两容器内压强随时间的变化关系如图所示。下列说法正确的是 ( )
A.曲线a表示Na2CO3与稀硫酸反应过程中压强随时间的变化关系
B.反应过程中两容器内溶液的pH均逐渐减小
C.反应结束后,两容器中H2SO4的质量相等,Na2SO4的质量也相等
D.反应结束后,两容器中硫元素的质量相等
13.(2022河南中考,19,★☆☆)如图是某胃药标签的部分文字说明。碳酸氢钠与胃酸(含盐酸)作用的化学方程式为 ;如果将该胃药中的碳酸氢钠用相同质量的碳酸镁代替,则每次用药量应 (填“增加”“减少”或“不变”)。
主要成分:碳酸氢钠、淀粉
每片含量:200 mg碳酸氢钠
适应症:用于缓解胃痛
注意事项:胃溃疡患者慎用
素养探究全练
14.【学科素养·科学探究与实践】(2023北京顺义二模)Na2CO3是一种重要的化工原料,工业制Na2CO3的主要流程如图所示。已知:CaS难溶于水。
(1)Na2CO3中碳元素的化合价为 。
(2)步骤①发生反应的基本反应类型为 。
(3)步骤③能用溶解、过滤的方法分离Na2CO3和CaS的原因是 。
答案全解全析
基础过关全练
1.B 食盐是一种白色的固体;“结盐”时,无新物质生成,属于物理变化;经过煎炼,井盐能够结晶析出,没有发生反应,说明井盐的化学性质稳定;“入于釜中煎炼,顷刻结盐”指蒸发水分,使井盐结晶析出,类似于蒸发操作。
2.C 氯化钠是食盐的主要成分,是常用的食品调味剂;氯化钠中有氯元素和钠元素,可用于生产氯气和烧碱;海水中除了有水和氯化钠以外,还含有氯化镁、氯化钾等,蒸发海水得到的是粗盐;氯化钠可用于腌制食品。
3.C 氯化钠中含有钠离子和氯离子,A错误;氯化钠中不含氢离子,不能与碳酸盐反应,B错误;氯化钠中含有钠元素,可用于生产金属钠,C正确;常用海水晒盐的方法获得氯化钠,D错误。
4.C 在溶解操作中,玻璃棒的作用是搅拌,加快粗盐的溶解速率;在过滤操作中,玻璃棒的作用是引流;在蒸发操作中,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅。故选C。
5.C 碳酸钠俗称纯碱、苏打,烧碱是氢氧化钠的俗称,A错误;碳酸钠中,钠元素显+1价,碳酸根显-2价,化学式为Na2CO3,B错误;氯化钠在医疗上常用于配制生理盐水,D错误。
6.C 向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,碳酸钠会先与盐酸反应生成碳酸氢钠和氯化钠,然后碳酸氢钠再与盐酸反应生成氯化钠、水和二氧化碳,则反应开始时不产生二氧化碳,当碳酸钠完全转化为碳酸氢钠后,再加入稀盐酸,产生二氧化碳气体,碳酸氢钠完全消耗后不再产生二氧化碳,故选C。
7.(1)室温下,Na2CO3在水中的溶解能力比NaHCO3强 (2)探究Na2CO3、NaHCO3溶液的酸碱性 (3)Ⅱ中澄清的石灰水变浑浊,Ⅰ中无明显变化
解析 (1)甲组步骤一中,碳酸钠完全溶解,碳酸氢钠部分溶解,说明在室温下Na2CO3在水中的溶解能力比NaHCO3强。(2)石蕊溶液是常用的酸碱指示剂,所以甲组步骤二的目的是探究Na2CO3、NaHCO3溶液的酸碱性。(3)乙组实验中,Ⅱ中澄清的石灰水变浑浊,说明碳酸氢钠受热分解生成了二氧化碳,Ⅰ中澄清的石灰水无明显变化,说明碳酸钠受热不易分解。
能力提升全练
8.D 溶解操作应在烧杯中进行,A错误;过滤时,要用玻璃棒引流,B错误;蒸发操作应在蒸发皿中进行,C错误。
9.D 碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,D错误。
10.C 氯化钠是食盐的主要成分,是生活中的调味品,但不能用于去除油脂,A错误;纯碱能与氢氧化钙反应生成氢氧化钠和碳酸钙,可在工业上用于制火碱,但其热溶液不能与水垢中的氢氧化镁和碳酸钙反应,不可以除水垢,B错误;小苏打受热或与面粉发酵产生的酸性物质反应产生二氧化碳,能使面制品疏松多孔,C正确;硫酸钙不具有吸水性,也不与水反应,不可用做食品干燥剂,D错误。
11.D Na2CO3比较稳定,受热不易分解,而NaHCO3不稳定,受热易分解,应该将稳定性强的Na2CO3放在外管进行加热,把稳定性比较弱的NaHCO3放在内管进行加热,A、B正确。NaHCO3不稳定,受热易分解产生Na2CO3、H2O、CO2,CO2能使澄清石灰水变浑浊,因此在C、D两个烧杯中应放入澄清石灰水,根据石灰水是否变浑浊,来确定碳酸钠和碳酸氢钠的热稳定性;CO2与NaOH溶液反应无明显现象,不能用NaOH溶液检验CO2气体的产生,C正确、D错误。
12.D 等质量的碳酸氢钠和碳酸钠与足量的稀硫酸反应,碳酸氢钠生成的二氧化碳多,容器内压强大,a是碳酸氢钠与稀硫酸反应的压强变化曲线,故A错误;反应过程中稀硫酸逐渐被消耗,两容器内溶液的pH均逐渐增大,故B错误;等质量的碳酸氢钠和碳酸钠与足量的稀硫酸反应,碳酸氢钠消耗稀硫酸的质量少,生成的硫酸钠少,故C错误;硫元素的来源是S,加入稀硫酸的质量相等,即硫酸根离子的质量相等,而硫酸根离子又不参与反应,所以硫元素的质量相等,故D正确。
13.NaHCO3+HClNaCl+H2O+CO2↑ 减少
解析 由反应的化学方程式NaHCO3+HClNaCl+H2O+CO2↑和MgCO3+2HClMgCl2+H2O+CO2↑可知,相同质量的碳酸氢钠和碳酸镁与盐酸反应,碳酸镁消耗的盐酸多,所以若将该胃药中的碳酸氢钠用相同质量的碳酸镁代替,则每次用药量应减少。
素养探究全练
14.(1)+4 (2)复分解反应 (3)碳酸钠易溶于水,CaS难溶于水
解析 (1)在碳酸钠中钠元素显+1价,氧元素显-2价,设碳元素的化合价是x,根据化合物中各元素正负化合价代数和为零,可得(+1)×2+x+(-2)×3=0,则x=+4。(2)步骤①是氯化钠和硫酸在加热的条件下反应生成硫酸钠和氯化氢气体,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024北京课改化学九年级下学期
第12章 盐
第一节 几种常见的盐
基础过关全练
知识点1 氯化钠
1.【新素材·传统工艺】(2022重庆重点学校模拟)古籍《天工开物》收录了井盐的生产过程。其中对“入于釜中煎炼,顷刻结盐,色成至白”的分析不合理的是 ( )
A.食盐是一种白色的固体
B.“结盐”时发生了化学变化
C.该过程能说明井盐的化学性质稳定
D.“入于釜中煎炼,顷刻结盐”类似于蒸发操作
2.(2021江苏扬州中考)氯化钠是一种常见的化学物质。下列说法不正确的是 ( )
A.氯化钠是常见的食品调味剂
B.氯化钠可用于生产氯气、烧碱
C.蒸发海水即可获得纯净的氯化钠固体
D.氯化钠可用于腌制食品
3.【学科素养·化学观念】下列关于氯化钠的认识,正确的是 ( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
4.(2023北京丰台一模)下列去除粗盐中难溶性杂质得到精盐的实验操作中,说法不正确的是 ( )
A.正确的操作顺序是①③②
B.操作①利用了氯化钠易溶于水的性质
C.①②③中玻璃棒的作用相同
D.操作②采用了蒸发溶剂的方法得到精盐
知识点2 碳酸钠、碳酸氢钠和碳酸钙
5.(2023湖南长沙二模)侯氏制碱法中的“碱”是指纯碱(碳酸钠),下列有关碳酸钠的说法,正确的是 ( )
A.俗称为纯碱、烧碱
B.化学式为NaCO3
C.工业上广泛用于玻璃、造纸、纺织、洗涤剂的生产
D.医疗上常用于配制生理盐水
6.(2019四川广安中考)向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:
①Na2CO3+HCl NaHCO3+NaCl
②NaHCO3+HCl NaCl+H2O+CO2↑
向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生二氧化碳的质量与所加盐酸的质量图像关系正确的是(C9212001) ( )
7.【教材变式·P75实验】(2022北京顺义一模)用下列两组实验研究Na2CO3和NaHCO3的性质。
甲组
乙组
(1)甲组步骤一得出的结论是 。
(2)甲组步骤二的目的是 。
(3)乙组实验可得出“Na2CO3的热稳定性比NaHCO3强”的结论,证据是 。
能力提升全练
8. 【学生必做实验】(2023江苏连云港中考,26,★☆☆)在“粗盐中难溶性杂质的去除”实验中,下列装置和操作正确的是 ( )
9.【新素材·航空航天】(2022海南中考,11,★☆☆)王亚平在中国空间站表演“五环魔术”,她往碳酸钠溶液中加入溴百里酚蓝试剂,呈现鲜亮的蓝色。若将溴百里酚蓝加入盐酸中,则会呈现黄色。下列有关说法错误的是 ( )
A.溴百里酚蓝可作为酸碱指示剂
B.碳酸钠的化学式为Na2CO3
C.碳酸钠溶液呈碱性
D.碳酸钠属于碱
10.(2023辽宁盘锦兴隆台一模,4,★☆☆)下列对物质用途的叙述正确的是 ( )
A.氯化钠是生活中的调味品,还可用于去除油脂
B.纯碱可在工业上用于制火碱,其热溶液可以除水垢
C.小苏打可用做发酵粉,常在做馒头、面包等发面食品中使用
D.硫酸钙可用做食品干燥剂
11.【创新装置】(2023四川绵阳期中,12,★★☆)某学习小组设计下图所示实验来比较碳酸钠和碳酸氢钠的热稳定性,装置中盛装药品错误的是 ( )
A.Na2CO3 B.NaHCO3
C.澄清石灰水 D.NaOH溶液
12.(2021贵州贵阳中考改编,6,★★☆)取等质量的Na2CO3和NaHCO3固体分别置于两个体积相同的密闭容器中,分别一次性加入等浓度、等体积的过量稀硫酸,用压强传感器测得两容器内压强随时间的变化关系如图所示。下列说法正确的是 ( )
A.曲线a表示Na2CO3与稀硫酸反应过程中压强随时间的变化关系
B.反应过程中两容器内溶液的pH均逐渐减小
C.反应结束后,两容器中H2SO4的质量相等,Na2SO4的质量也相等
D.反应结束后,两容器中硫元素的质量相等
13.(2022河南中考,19,★☆☆)如图是某胃药标签的部分文字说明。碳酸氢钠与胃酸(含盐酸)作用的化学方程式为 ;如果将该胃药中的碳酸氢钠用相同质量的碳酸镁代替,则每次用药量应 (填“增加”“减少”或“不变”)。
主要成分:碳酸氢钠、淀粉
每片含量:200 mg碳酸氢钠
适应症:用于缓解胃痛
注意事项:胃溃疡患者慎用
素养探究全练
14.【学科素养·科学探究与实践】(2023北京顺义二模)Na2CO3是一种重要的化工原料,工业制Na2CO3的主要流程如图所示。已知:CaS难溶于水。
(1)Na2CO3中碳元素的化合价为 。
(2)步骤①发生反应的基本反应类型为 。
(3)步骤③能用溶解、过滤的方法分离Na2CO3和CaS的原因是 。
答案全解全析
基础过关全练
1.B 食盐是一种白色的固体;“结盐”时,无新物质生成,属于物理变化;经过煎炼,井盐能够结晶析出,没有发生反应,说明井盐的化学性质稳定;“入于釜中煎炼,顷刻结盐”指蒸发水分,使井盐结晶析出,类似于蒸发操作。
2.C 氯化钠是食盐的主要成分,是常用的食品调味剂;氯化钠中有氯元素和钠元素,可用于生产氯气和烧碱;海水中除了有水和氯化钠以外,还含有氯化镁、氯化钾等,蒸发海水得到的是粗盐;氯化钠可用于腌制食品。
3.C 氯化钠中含有钠离子和氯离子,A错误;氯化钠中不含氢离子,不能与碳酸盐反应,B错误;氯化钠中含有钠元素,可用于生产金属钠,C正确;常用海水晒盐的方法获得氯化钠,D错误。
4.C 在溶解操作中,玻璃棒的作用是搅拌,加快粗盐的溶解速率;在过滤操作中,玻璃棒的作用是引流;在蒸发操作中,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅。故选C。
5.C 碳酸钠俗称纯碱、苏打,烧碱是氢氧化钠的俗称,A错误;碳酸钠中,钠元素显+1价,碳酸根显-2价,化学式为Na2CO3,B错误;氯化钠在医疗上常用于配制生理盐水,D错误。
6.C 向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,碳酸钠会先与盐酸反应生成碳酸氢钠和氯化钠,然后碳酸氢钠再与盐酸反应生成氯化钠、水和二氧化碳,则反应开始时不产生二氧化碳,当碳酸钠完全转化为碳酸氢钠后,再加入稀盐酸,产生二氧化碳气体,碳酸氢钠完全消耗后不再产生二氧化碳,故选C。
7.(1)室温下,Na2CO3在水中的溶解能力比NaHCO3强 (2)探究Na2CO3、NaHCO3溶液的酸碱性 (3)Ⅱ中澄清的石灰水变浑浊,Ⅰ中无明显变化
解析 (1)甲组步骤一中,碳酸钠完全溶解,碳酸氢钠部分溶解,说明在室温下Na2CO3在水中的溶解能力比NaHCO3强。(2)石蕊溶液是常用的酸碱指示剂,所以甲组步骤二的目的是探究Na2CO3、NaHCO3溶液的酸碱性。(3)乙组实验中,Ⅱ中澄清的石灰水变浑浊,说明碳酸氢钠受热分解生成了二氧化碳,Ⅰ中澄清的石灰水无明显变化,说明碳酸钠受热不易分解。
能力提升全练
8.D 溶解操作应在烧杯中进行,A错误;过滤时,要用玻璃棒引流,B错误;蒸发操作应在蒸发皿中进行,C错误。
9.D 碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,D错误。
10.C 氯化钠是食盐的主要成分,是生活中的调味品,但不能用于去除油脂,A错误;纯碱能与氢氧化钙反应生成氢氧化钠和碳酸钙,可在工业上用于制火碱,但其热溶液不能与水垢中的氢氧化镁和碳酸钙反应,不可以除水垢,B错误;小苏打受热或与面粉发酵产生的酸性物质反应产生二氧化碳,能使面制品疏松多孔,C正确;硫酸钙不具有吸水性,也不与水反应,不可用做食品干燥剂,D错误。
11.D Na2CO3比较稳定,受热不易分解,而NaHCO3不稳定,受热易分解,应该将稳定性强的Na2CO3放在外管进行加热,把稳定性比较弱的NaHCO3放在内管进行加热,A、B正确。NaHCO3不稳定,受热易分解产生Na2CO3、H2O、CO2,CO2能使澄清石灰水变浑浊,因此在C、D两个烧杯中应放入澄清石灰水,根据石灰水是否变浑浊,来确定碳酸钠和碳酸氢钠的热稳定性;CO2与NaOH溶液反应无明显现象,不能用NaOH溶液检验CO2气体的产生,C正确、D错误。
12.D 等质量的碳酸氢钠和碳酸钠与足量的稀硫酸反应,碳酸氢钠生成的二氧化碳多,容器内压强大,a是碳酸氢钠与稀硫酸反应的压强变化曲线,故A错误;反应过程中稀硫酸逐渐被消耗,两容器内溶液的pH均逐渐增大,故B错误;等质量的碳酸氢钠和碳酸钠与足量的稀硫酸反应,碳酸氢钠消耗稀硫酸的质量少,生成的硫酸钠少,故C错误;硫元素的来源是S,加入稀硫酸的质量相等,即硫酸根离子的质量相等,而硫酸根离子又不参与反应,所以硫元素的质量相等,故D正确。
13.NaHCO3+HClNaCl+H2O+CO2↑ 减少
解析 由反应的化学方程式NaHCO3+HClNaCl+H2O+CO2↑和MgCO3+2HClMgCl2+H2O+CO2↑可知,相同质量的碳酸氢钠和碳酸镁与盐酸反应,碳酸镁消耗的盐酸多,所以若将该胃药中的碳酸氢钠用相同质量的碳酸镁代替,则每次用药量应减少。
素养探究全练
14.(1)+4 (2)复分解反应 (3)碳酸钠易溶于水,CaS难溶于水
解析 (1)在碳酸钠中钠元素显+1价,氧元素显-2价,设碳元素的化合价是x,根据化合物中各元素正负化合价代数和为零,可得(+1)×2+x+(-2)×3=0,则x=+4。(2)步骤①是氯化钠和硫酸在加热的条件下反应生成硫酸钠和氯化氢气体,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
