2024北京课改化学九年级下学期课时练--专项素养综合全练(六) 科学探究
文档属性
| 名称 | 2024北京课改化学九年级下学期课时练--专项素养综合全练(六) 科学探究 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 14:00:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024北京课改化学九年级下学期
专项素养综合全练(六)
科学探究
1.(2023湖北鄂州中考)某化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘了盖上瓶盖。对于该瓶溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质。
为了验证假设,同学们共同设计了实验方案并进行实验,请你帮他们完善该探究过程。
查阅资料发现,Ba(NO3)2溶液呈中性。
实验过程 实验现象 实验结论
步骤一:取少量该瓶溶液于试管中,滴加过量的Ba(NO3)2溶液,振荡 原溶液中一定含有碳酸钠
步骤二:取步骤一试管中的少量上层清液于另一支试管中,滴加酚酞溶液 溶液变红色 原溶液中一定含有
结论:假设二成立。
反思一:氢氧化钠溶液露置于空气中易变质,写出反应的化学方程式: 。
反思二:步骤一中,滴加Ba(NO3)2溶液过量的目的是 。
2.(2023四川自贡中考)1921年,正在美国留学的侯德榜先生为了发展我国的民族工业毅然回国,其“侯氏制碱法”为我国纯碱和氮肥工业技术的发展作出了杰出贡献。工业纯碱中可能混有少量NaCl,某化学兴趣小组对工业纯碱样品展开探究。
【探究一】确定纯碱样品中是否含有NaCl
(1)取样品加水溶解,加入过量稀硝酸,观察到实验现象:有 产生。
(2)取上述溶液,继续滴加适量AgNO3溶液,观察到实验现象:有 产生。
【结论】样品中含有NaCl。
(3)甲、乙、丙三个同学分别用以下药品代替稀硝酸进行(1)步实验,也能确定样品中是否含有NaCl的是 (填“甲”“乙”或“丙”)。
甲.CaCl2溶液 乙.稀盐酸 丙.Ba(NO3)2溶液
【探究二】测定纯碱样品中Na2CO3的质量分数
(4)兴趣小组设计了以下两个测定方案:
方案一:将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。
方案二:如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据球形干燥管的增重计算Na2CO3的质量分数。
【讨论】①上述两个方案中,你认为方案 更优。
②方案二锥形瓶内发生反应的化学方程式为 。
【探究三】确定Na2CO3溶液的酸碱性
(5)向Na2CO3溶液中滴加酚酞,溶液变成红色,所以Na2CO3溶液呈 性。
【知识拓展】
(6)纯碱属于 (填“酸”“碱”或“盐”)。
3.【学科素养·科学探究与实践】(2023河北中考)登山运动员登山时常用氢化钙作为供氢剂,用来提供能源。某兴趣小组同学对放置了一段时间的氢化钙取样进行探究。
【查阅资料】氢化钙(CaH2)是一种固态储氢物质,它遇水剧烈反应释放出氢气,反应的化学方程式为CaH2+2H2O Ca(OH)2+2H2↑。
【提出问题】该氢化钙样品与水反应是否还能生成氢气
【实验1】小组同学用适量氢化钙样品和水进行实验。
(1)图1所示是小组同学设计的两个实验装置,为便于控制反应速率,最好选用装置 (填“A”或“B”)。
图1
(2)连接好装置后,加入药品前,应进行的操作是 。
(3)向装置中加入药品并开始实验。锥形瓶中快速产生气泡;将导管插入肥皂水中,吹出肥皂泡,用燃着的木条靠近上升到空中的肥皂泡,肥皂泡被点燃。“肥皂泡被点燃”是因为氢气具有 性。
【得出结论】该氢化钙样品与水反应还能生成氢气。
【提出新问题】实验1中不再产生气泡后,锥形瓶中有较多白色浑浊物。白色浑浊物是什么
【分析讨论】氢化钙与水反应生成了氢氧化钙,氢氧化钙微溶于水,白色浑浊物中一定含有氢氧化钙;氢化钙在保存过程中可能变质生成碳酸钙,故白色浑浊物中还可能含有碳酸钙。
【实验2】按图2所示,将白色浑浊物装入锥形瓶中,用注射器注入适量稀盐酸,并利用二氧化碳传感器测得锥形瓶中二氧化碳的体积分数随时间的变化如图3所示。
图2 图3
(4)实验2中锥形瓶内发生反应的化学方程式为 (写一个即可)。
(5)图3中说明有二氧化碳生成的依据是 。
【得出结论】白色浑浊物中含有氢氧化钙和碳酸钙,同时说明氢化钙样品有少量变质。
【反思拓展】
(6)保存氢化钙的一条建议是 。
(7)氢能有很多优点,如 (写一条即可)。我们共同努力,助力我国早日进入“氢能经济”时代。
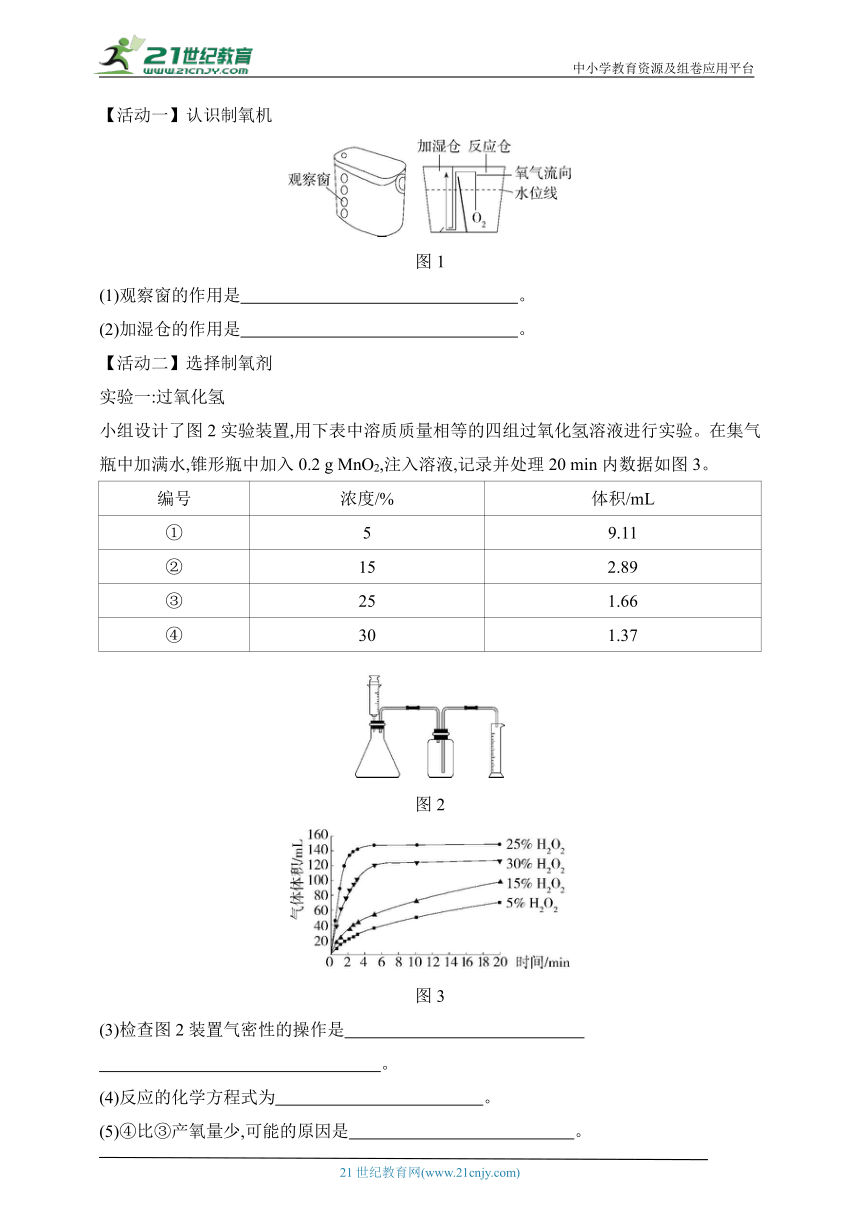
4.【跨学科实践活动】(2023四川成都中考)学习小组开展了“设计和制作简易供氧器”的实践活动。
某品牌制氧机的制氧剂为过碳酸钠(化学式2Na2CO3·3H2O2,相对分子质量为314,白色固体)和二氧化锰。制氧过程的反应为2(2Na2CO3·3H2O2) 4Na2CO3+6H2O+3O2↑,该反应为放热反应。
【活动一】认识制氧机
图1
(1)观察窗的作用是 。
(2)加湿仓的作用是 。
【活动二】选择制氧剂
实验一:过氧化氢
小组设计了图2实验装置,用下表中溶质质量相等的四组过氧化氢溶液进行实验。在集气瓶中加满水,锥形瓶中加入0.2 g MnO2,注入溶液,记录并处理20 min内数据如图3。
编号 浓度/% 体积/mL
① 5 9.11
② 15 2.89
③ 25 1.66
④ 30 1.37
图2
图3
(3)检查图2装置气密性的操作是 。
(4)反应的化学方程式为 。
(5)④比③产氧量少,可能的原因是 。
实验二:过碳酸钠
往锥形瓶中加入a g过碳酸钠、0.2 g MnO2和9.11 mL水,待反应完全后收集到约159.1 mL水(产生氧气的量与表中药品得到氧气的最大量相等)。
其他药品质量不变,再分别用不同体积的水进行实验。记录并处理20 min内数据如图4。
图4
(6)a= (氧气密度为1.43 g/L,忽略其他因素的影响)。
(7)由图4可得出的结论是 。
【活动三】制作供氧器
(8)综合分析,选用过碳酸钠做制氧剂的理由是 。
(9)学习小组利用身边物品自制了如图5的简易供氧器。与真实产品对比中,形成的观点不正确的是 (填字母)。
图5
A.产氧和洗气装置组合不用一体化
B.内部气体流向采用高进低出方式
C.特定需求是选择制氧方法的重要依据
D.制氧机要符合美学、工程、安全等标准
答案全解全析
1.步骤一:产生白色沉淀 步骤二:氢氧化钠 反思一:CO2+2NaOH Na2CO3+H2O
反思二:除尽溶液中的碳酸钠
解析 步骤一:由实验结论可知,原溶液中一定含有碳酸钠,因此取少量该瓶溶液于试管中,滴加过量的Ba(NO3)2溶液,碳酸钠与Ba(NO3)2反应生成硝酸钠和白色沉淀碳酸钡,可观察到有白色沉淀产生。步骤二:由于酚酞溶液变红,证明溶液呈碱性,因此原溶液中一定含有氢氧化钠。反思一:氢氧化钠溶液易与空气中的二氧化碳反应生成碳酸钠和水。反思二:由于碳酸钠溶液显碱性,也能使酚酞溶液变红,因此要用无色酚酞溶液检验溶液中是否含有氢氧化钠时,先要除去溶液中的碳酸钠。
2.(1)气泡 (2)白色沉淀 (3)丙 (4)①一
②Na2CO3+2HCl 2NaCl+H2O+CO2↑ (5)碱 (6)盐
解析 (1)取样品加水溶解,加入过量稀硝酸,碳酸钠和硝酸反应生成硝酸钠、水和二氧化碳,观察到的实验现象为有气泡产生。(2)取(1)得到的溶液,继续滴加适量AgNO3溶液,结论是样品中含有NaCl,而氯化钠能和硝酸银反应生成氯化银沉淀和硝酸钠,则观察到的实验现象为有白色沉淀产生。(3)CaCl2溶液和稀盐酸中均含有氯离子,会对后续实验造成干扰,不能确定样品中是否含有NaCl;Ba(NO3)2和碳酸钠反应生成碳酸钡沉淀和硝酸钠,没有引入氯离子,不会对后续实验造成干扰。(4)①方案一中过量CaCl2溶液能将碳酸钠完全反应,由沉淀的质量即可求出碳酸钠的质量,进而得到Na2CO3的质量分数;方案二中,生成的二氧化碳气体会带出氯化氢气体和水蒸气,这些气体能全部被氢氧化钠吸收,由此得出的碳酸钠的质量会偏大,导致结果不准确。②方案二锥形瓶内发生的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。(5)无色酚酞溶液遇碱性溶液变红,向Na2CO3溶液中滴加酚酞,溶液变成红色,所以Na2CO3溶液呈碱性。(6)纯碱由钠离子和碳酸根离子构成,属于盐。
3.(1)A (2)检查装置的气密性 (3)可燃 (4)Ca(OH)2+2HCl CaCl2+2H2O(或CaCO3+2HCl CaCl2+H2O+CO2↑) (5)二氧化碳的体积分数增大 (6)密封保存(合理即可) (7)无污染(合理即可)
解析 (1)题图1 A、B两个实验装置中,装置A可通过调节分液漏斗滴加液体的速率来控制反应速率,而装置B无法控制反应速率。(4)锥形瓶内白色浑浊物一定含有氢氧化钙,结合题图3分析,加入稀盐酸后有气体产生,因此白色混合物中一定含有碳酸钙,向锥形瓶内滴加稀盐酸时,Ca(OH)2与稀盐酸反应生成CaCl2和H2O,CaCO3与稀盐酸反应生成CaCl2、H2O和CO2。(5)分析题图3中的曲线可知,刚开始反应一段时间内二氧化碳的体积分数接近于0,一段时间后二氧化碳的体积分数迅速增大直至不再变化,说明装置内有二氧化碳生成。(6)由于氢化钙极易吸水而变质,因此氢化钙应密封保存。(7)氢能有很多优点,如制备来源广泛,可再生,燃烧热值高,燃烧产物是水,对环境无污染等。
4.(1)观察是否有气泡产生和产生气体的快慢 (2)洗气,使氧气具有一定的湿度 (3)堵住末端导管口,将注射器活塞拉动到一定位置,松开手后,活塞回到原位置 (4)2H2O2 2H2O+O2↑ (5)反应放出大量热,使反应物减少 (6)1.4 (7)在实验条件下,过碳酸钠的产氧速率随加水量的增加而增大 (8)便于携带,能持续平稳地提供氧气 (9)A
解析 (1)在使用制氧机的过程中,通过观察窗可观察制氧机内是否有气泡产生和产生气体的速率快慢,从而判断制氧机是否正常工作。(2)反应仓内产生的氧气,在通过加湿仓时,可使部分水蒸气进入氧气,使氧气具有一定的湿度,同时还可除去氧气中的杂质气体。(4)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,据此写出反应的化学方程式。(5)由于反应放出大量热,导致过氧化氢蒸发而脱离反应体系,反应物减少,生成氧气的量也随之减少,因此④比③产氧量少。(6)当量筒内收集到159.1 mL水时,说明集气瓶内收集到的氧气体积为159.1 mL-9.11 mL=149.99 mL,则收集到氧气的质量为149.99×10-3 L×1.43 g/L≈0.214 g。
2(2Na2CO3·3H2O2) 4Na2CO3+6H2O+3O2↑
628 96
a g 0.214 g
= a≈1.4。
(8)由题图4与题图3曲线对比可知,过碳酸钠较过氧化氢溶液分解速率稳定,能持续平稳地提供氧气,而且固体较液体更易携带。(9)由题图5可知,产氧和洗气装置不一体时,无法完成气体的制备与洗气、加湿一体化,A不正确;为使产生的氧气加湿并洗气,产气装置产生的气体要采用高进低出的方式进入加湿、洗气装置,即内部气体流向应采用高进低出的方式,B正确;实验室可采用加热高锰酸钾的方法制取氧气,而制氧机要选择过碳酸钠在二氧化锰的催化作用下分解产生氧气,因此特定的需求是选择制氧方法的重要依据,C正确;制氧机要符合美学、工程、安全等标准,才能具有实用且美观等特点,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024北京课改化学九年级下学期
专项素养综合全练(六)
科学探究
1.(2023湖北鄂州中考)某化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘了盖上瓶盖。对于该瓶溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质。
为了验证假设,同学们共同设计了实验方案并进行实验,请你帮他们完善该探究过程。
查阅资料发现,Ba(NO3)2溶液呈中性。
实验过程 实验现象 实验结论
步骤一:取少量该瓶溶液于试管中,滴加过量的Ba(NO3)2溶液,振荡 原溶液中一定含有碳酸钠
步骤二:取步骤一试管中的少量上层清液于另一支试管中,滴加酚酞溶液 溶液变红色 原溶液中一定含有
结论:假设二成立。
反思一:氢氧化钠溶液露置于空气中易变质,写出反应的化学方程式: 。
反思二:步骤一中,滴加Ba(NO3)2溶液过量的目的是 。
2.(2023四川自贡中考)1921年,正在美国留学的侯德榜先生为了发展我国的民族工业毅然回国,其“侯氏制碱法”为我国纯碱和氮肥工业技术的发展作出了杰出贡献。工业纯碱中可能混有少量NaCl,某化学兴趣小组对工业纯碱样品展开探究。
【探究一】确定纯碱样品中是否含有NaCl
(1)取样品加水溶解,加入过量稀硝酸,观察到实验现象:有 产生。
(2)取上述溶液,继续滴加适量AgNO3溶液,观察到实验现象:有 产生。
【结论】样品中含有NaCl。
(3)甲、乙、丙三个同学分别用以下药品代替稀硝酸进行(1)步实验,也能确定样品中是否含有NaCl的是 (填“甲”“乙”或“丙”)。
甲.CaCl2溶液 乙.稀盐酸 丙.Ba(NO3)2溶液
【探究二】测定纯碱样品中Na2CO3的质量分数
(4)兴趣小组设计了以下两个测定方案:
方案一:将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。
方案二:如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据球形干燥管的增重计算Na2CO3的质量分数。
【讨论】①上述两个方案中,你认为方案 更优。
②方案二锥形瓶内发生反应的化学方程式为 。
【探究三】确定Na2CO3溶液的酸碱性
(5)向Na2CO3溶液中滴加酚酞,溶液变成红色,所以Na2CO3溶液呈 性。
【知识拓展】
(6)纯碱属于 (填“酸”“碱”或“盐”)。
3.【学科素养·科学探究与实践】(2023河北中考)登山运动员登山时常用氢化钙作为供氢剂,用来提供能源。某兴趣小组同学对放置了一段时间的氢化钙取样进行探究。
【查阅资料】氢化钙(CaH2)是一种固态储氢物质,它遇水剧烈反应释放出氢气,反应的化学方程式为CaH2+2H2O Ca(OH)2+2H2↑。
【提出问题】该氢化钙样品与水反应是否还能生成氢气
【实验1】小组同学用适量氢化钙样品和水进行实验。
(1)图1所示是小组同学设计的两个实验装置,为便于控制反应速率,最好选用装置 (填“A”或“B”)。
图1
(2)连接好装置后,加入药品前,应进行的操作是 。
(3)向装置中加入药品并开始实验。锥形瓶中快速产生气泡;将导管插入肥皂水中,吹出肥皂泡,用燃着的木条靠近上升到空中的肥皂泡,肥皂泡被点燃。“肥皂泡被点燃”是因为氢气具有 性。
【得出结论】该氢化钙样品与水反应还能生成氢气。
【提出新问题】实验1中不再产生气泡后,锥形瓶中有较多白色浑浊物。白色浑浊物是什么
【分析讨论】氢化钙与水反应生成了氢氧化钙,氢氧化钙微溶于水,白色浑浊物中一定含有氢氧化钙;氢化钙在保存过程中可能变质生成碳酸钙,故白色浑浊物中还可能含有碳酸钙。
【实验2】按图2所示,将白色浑浊物装入锥形瓶中,用注射器注入适量稀盐酸,并利用二氧化碳传感器测得锥形瓶中二氧化碳的体积分数随时间的变化如图3所示。
图2 图3
(4)实验2中锥形瓶内发生反应的化学方程式为 (写一个即可)。
(5)图3中说明有二氧化碳生成的依据是 。
【得出结论】白色浑浊物中含有氢氧化钙和碳酸钙,同时说明氢化钙样品有少量变质。
【反思拓展】
(6)保存氢化钙的一条建议是 。
(7)氢能有很多优点,如 (写一条即可)。我们共同努力,助力我国早日进入“氢能经济”时代。
4.【跨学科实践活动】(2023四川成都中考)学习小组开展了“设计和制作简易供氧器”的实践活动。
某品牌制氧机的制氧剂为过碳酸钠(化学式2Na2CO3·3H2O2,相对分子质量为314,白色固体)和二氧化锰。制氧过程的反应为2(2Na2CO3·3H2O2) 4Na2CO3+6H2O+3O2↑,该反应为放热反应。
【活动一】认识制氧机
图1
(1)观察窗的作用是 。
(2)加湿仓的作用是 。
【活动二】选择制氧剂
实验一:过氧化氢
小组设计了图2实验装置,用下表中溶质质量相等的四组过氧化氢溶液进行实验。在集气瓶中加满水,锥形瓶中加入0.2 g MnO2,注入溶液,记录并处理20 min内数据如图3。
编号 浓度/% 体积/mL
① 5 9.11
② 15 2.89
③ 25 1.66
④ 30 1.37
图2
图3
(3)检查图2装置气密性的操作是 。
(4)反应的化学方程式为 。
(5)④比③产氧量少,可能的原因是 。
实验二:过碳酸钠
往锥形瓶中加入a g过碳酸钠、0.2 g MnO2和9.11 mL水,待反应完全后收集到约159.1 mL水(产生氧气的量与表中药品得到氧气的最大量相等)。
其他药品质量不变,再分别用不同体积的水进行实验。记录并处理20 min内数据如图4。
图4
(6)a= (氧气密度为1.43 g/L,忽略其他因素的影响)。
(7)由图4可得出的结论是 。
【活动三】制作供氧器
(8)综合分析,选用过碳酸钠做制氧剂的理由是 。
(9)学习小组利用身边物品自制了如图5的简易供氧器。与真实产品对比中,形成的观点不正确的是 (填字母)。
图5
A.产氧和洗气装置组合不用一体化
B.内部气体流向采用高进低出方式
C.特定需求是选择制氧方法的重要依据
D.制氧机要符合美学、工程、安全等标准
答案全解全析
1.步骤一:产生白色沉淀 步骤二:氢氧化钠 反思一:CO2+2NaOH Na2CO3+H2O
反思二:除尽溶液中的碳酸钠
解析 步骤一:由实验结论可知,原溶液中一定含有碳酸钠,因此取少量该瓶溶液于试管中,滴加过量的Ba(NO3)2溶液,碳酸钠与Ba(NO3)2反应生成硝酸钠和白色沉淀碳酸钡,可观察到有白色沉淀产生。步骤二:由于酚酞溶液变红,证明溶液呈碱性,因此原溶液中一定含有氢氧化钠。反思一:氢氧化钠溶液易与空气中的二氧化碳反应生成碳酸钠和水。反思二:由于碳酸钠溶液显碱性,也能使酚酞溶液变红,因此要用无色酚酞溶液检验溶液中是否含有氢氧化钠时,先要除去溶液中的碳酸钠。
2.(1)气泡 (2)白色沉淀 (3)丙 (4)①一
②Na2CO3+2HCl 2NaCl+H2O+CO2↑ (5)碱 (6)盐
解析 (1)取样品加水溶解,加入过量稀硝酸,碳酸钠和硝酸反应生成硝酸钠、水和二氧化碳,观察到的实验现象为有气泡产生。(2)取(1)得到的溶液,继续滴加适量AgNO3溶液,结论是样品中含有NaCl,而氯化钠能和硝酸银反应生成氯化银沉淀和硝酸钠,则观察到的实验现象为有白色沉淀产生。(3)CaCl2溶液和稀盐酸中均含有氯离子,会对后续实验造成干扰,不能确定样品中是否含有NaCl;Ba(NO3)2和碳酸钠反应生成碳酸钡沉淀和硝酸钠,没有引入氯离子,不会对后续实验造成干扰。(4)①方案一中过量CaCl2溶液能将碳酸钠完全反应,由沉淀的质量即可求出碳酸钠的质量,进而得到Na2CO3的质量分数;方案二中,生成的二氧化碳气体会带出氯化氢气体和水蒸气,这些气体能全部被氢氧化钠吸收,由此得出的碳酸钠的质量会偏大,导致结果不准确。②方案二锥形瓶内发生的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。(5)无色酚酞溶液遇碱性溶液变红,向Na2CO3溶液中滴加酚酞,溶液变成红色,所以Na2CO3溶液呈碱性。(6)纯碱由钠离子和碳酸根离子构成,属于盐。
3.(1)A (2)检查装置的气密性 (3)可燃 (4)Ca(OH)2+2HCl CaCl2+2H2O(或CaCO3+2HCl CaCl2+H2O+CO2↑) (5)二氧化碳的体积分数增大 (6)密封保存(合理即可) (7)无污染(合理即可)
解析 (1)题图1 A、B两个实验装置中,装置A可通过调节分液漏斗滴加液体的速率来控制反应速率,而装置B无法控制反应速率。(4)锥形瓶内白色浑浊物一定含有氢氧化钙,结合题图3分析,加入稀盐酸后有气体产生,因此白色混合物中一定含有碳酸钙,向锥形瓶内滴加稀盐酸时,Ca(OH)2与稀盐酸反应生成CaCl2和H2O,CaCO3与稀盐酸反应生成CaCl2、H2O和CO2。(5)分析题图3中的曲线可知,刚开始反应一段时间内二氧化碳的体积分数接近于0,一段时间后二氧化碳的体积分数迅速增大直至不再变化,说明装置内有二氧化碳生成。(6)由于氢化钙极易吸水而变质,因此氢化钙应密封保存。(7)氢能有很多优点,如制备来源广泛,可再生,燃烧热值高,燃烧产物是水,对环境无污染等。
4.(1)观察是否有气泡产生和产生气体的快慢 (2)洗气,使氧气具有一定的湿度 (3)堵住末端导管口,将注射器活塞拉动到一定位置,松开手后,活塞回到原位置 (4)2H2O2 2H2O+O2↑ (5)反应放出大量热,使反应物减少 (6)1.4 (7)在实验条件下,过碳酸钠的产氧速率随加水量的增加而增大 (8)便于携带,能持续平稳地提供氧气 (9)A
解析 (1)在使用制氧机的过程中,通过观察窗可观察制氧机内是否有气泡产生和产生气体的速率快慢,从而判断制氧机是否正常工作。(2)反应仓内产生的氧气,在通过加湿仓时,可使部分水蒸气进入氧气,使氧气具有一定的湿度,同时还可除去氧气中的杂质气体。(4)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,据此写出反应的化学方程式。(5)由于反应放出大量热,导致过氧化氢蒸发而脱离反应体系,反应物减少,生成氧气的量也随之减少,因此④比③产氧量少。(6)当量筒内收集到159.1 mL水时,说明集气瓶内收集到的氧气体积为159.1 mL-9.11 mL=149.99 mL,则收集到氧气的质量为149.99×10-3 L×1.43 g/L≈0.214 g。
2(2Na2CO3·3H2O2) 4Na2CO3+6H2O+3O2↑
628 96
a g 0.214 g
= a≈1.4。
(8)由题图4与题图3曲线对比可知,过碳酸钠较过氧化氢溶液分解速率稳定,能持续平稳地提供氧气,而且固体较液体更易携带。(9)由题图5可知,产氧和洗气装置不一体时,无法完成气体的制备与洗气、加湿一体化,A不正确;为使产生的氧气加湿并洗气,产气装置产生的气体要采用高进低出的方式进入加湿、洗气装置,即内部气体流向应采用高进低出的方式,B正确;实验室可采用加热高锰酸钾的方法制取氧气,而制氧机要选择过碳酸钠在二氧化锰的催化作用下分解产生氧气,因此特定的需求是选择制氧方法的重要依据,C正确;制氧机要符合美学、工程、安全等标准,才能具有实用且美观等特点,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
