2.3.2气体摩尔体积 课件(共27张PPT)2023-2024学年高一化学(人教版2019必修第一册)
文档属性
| 名称 | 2.3.2气体摩尔体积 课件(共27张PPT)2023-2024学年高一化学(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-31 12:08:19 | ||
图片预览






文档简介
(共27张PPT)
第二章 海水中的重要元素—钠和氯
第三节 物质的量
第2课时 气体摩尔体积
PART
01
PART
02
了解气体摩尔体积及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
能基于物质的量认识物质组成及其化学变化,运用物质的量、气体摩尔体积之间的相互关系进行简单计算。
课程标准要求
PART
01
PART
02
能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
能基于物质的量认识物质的组成及变化,建立n、m、Vm之间的计算模型,熟悉阿伏加德罗定律的应用。
核心素养发展目标
情景引入
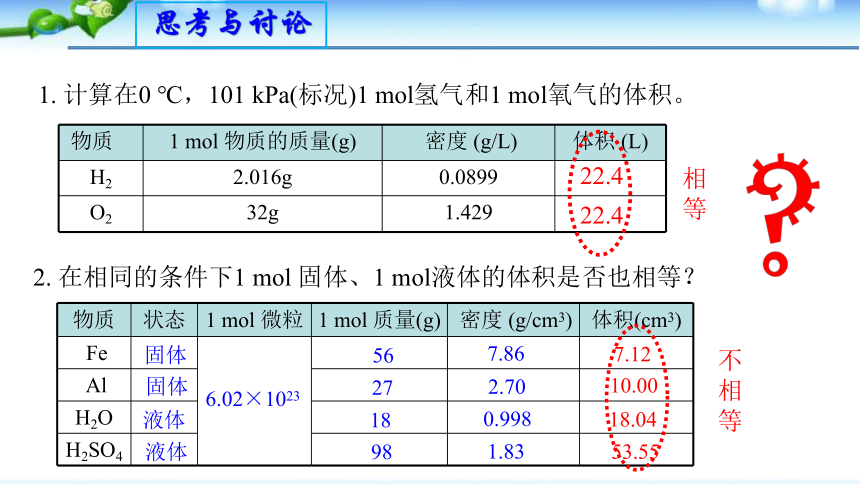
实验室中有一瓶氢气,我们应如何得到该气体的物质的量呢?
2. 在相同的条件下1 mol 固体、1 mol液体的体积是否也相等?
1. 计算在0 ℃,101 kPa(标况)1 mol氢气和1 mol氧气的体积。
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.4
物质 状态 1 mol 微粒 1 mol 质量(g) 密度 (g/cm3) 体积(cm3)
Fe
Al
H2O
H2SO4
固体
固体
液体
液体
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
6.02×1023
0.998
不相等
相等
思考与讨论
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?气体体积与什么有关?
思考与讨论
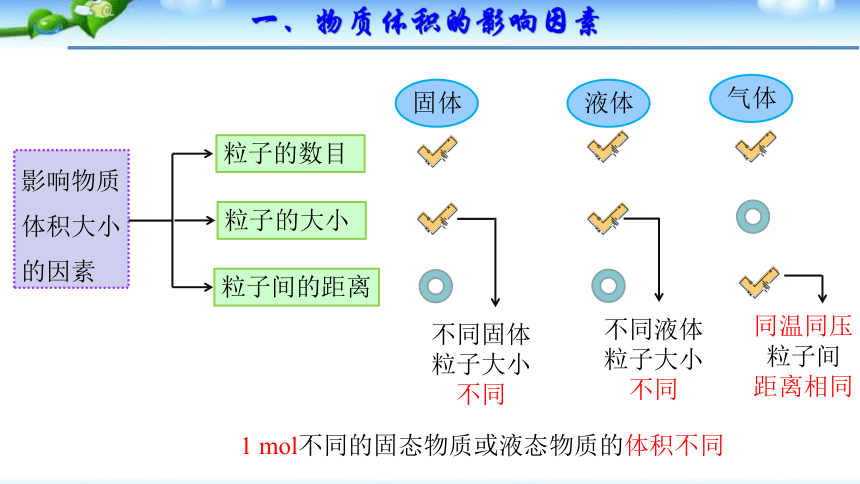
影响物质体积大小的因素
粒子的数目
粒子的大小
粒子间的距离
液体
固体
气体
不同固体
粒子大小
不同
不同液体
粒子大小
不同
同温同压
粒子间
距离相同
1 mol不同的固态物质或液态物质的体积不同
一、物质体积的影响因素
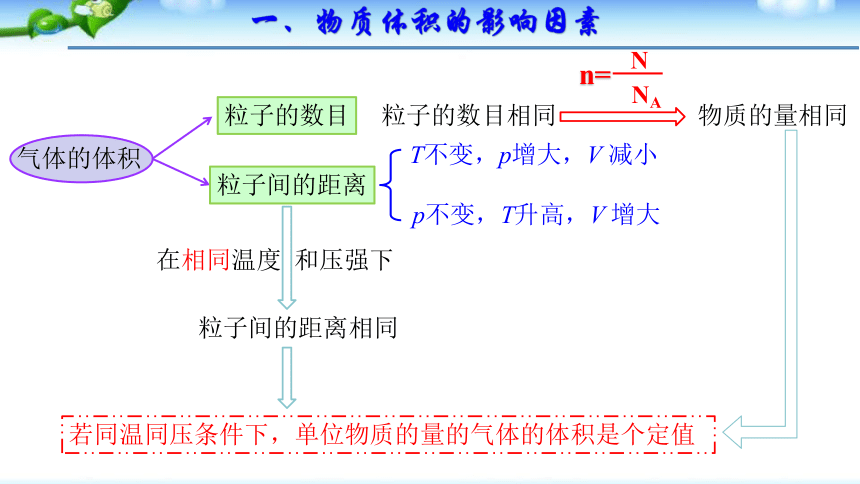
气体的体积
粒子的数目
粒子间的距离
p不变,T升高,V 增大
T不变,p增大,V 减小
在相同温度 和压强下
粒子间的距离相同
若同温同压条件下,单位物质的量的气体的体积是个定值
粒子的数目相同
n=
NA
N
物质的量相同
一、物质体积的影响因素
判断正误:
(1) 一定温度、压强下,气体体积由其分子的大小和数目决定( )
(2) 固态物质和液态物质的体积决定于粒子大小和粒子数目( )
(3) 同温同压下,若两种气体所占体积不同,其主要原因是气体分子间距离不同( )
(4) 1 mol一氧化碳和1 mol氧气所含的分子数相同,体积也相同( )
(5) 同温同压下,同体积的物质所含的分子数一定相等( )
对点训练
×
√
×
×
×
1.定义
单位物质的量的气体所占的体积叫做气体摩尔体积
2.符号
Vm
3.单位
L/mol或L mol-1
(升 每摩尔)
4.公式
Vm=
V
n
5.影响因素
温度越高,Vm越大
压强越高,Vm越小
Vm
V
n
=
二、气体摩尔体积
6.特例
只适用于气态物质,可以是单一气体也可以是混合气体
标况下,HF 、 H2O、NO2 、 SO3 、 CCl4 、溴、酒精、苯等不属于气态
Vm≈ 22.4 L/mol 的状态不一定是标准状况
二、气体摩尔体积
标准状况 (0℃,101KPa) Vm≈ 22.4 L/mol
判断正误:
(1) 1 mol任何气体的体积都为22.4 L( )
(2) 1 mol任何物质在标准状况下所占的体积都为22.4 L( )
(3) 标准状况下,1 mol水所占的体积是22.4 L( )
(4) 在常温常压下,11.2 L Cl2含有的分子数为0.5NA( )
(5) 标况下的Vm=22.4 L·mol-1,那么Vm=22.4 L·mol-1时也一定是标 准状况( )
对点训练
×
×
×
×
×
对点训练
2. 下列说法正确的是( )
A.在常温常压下,1 mol氦气含有的原子数为2NA
B.在标准状况下,H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol C所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的氮原子的物质的量约为2 mol
D
=n
NA
N
n =
Vm
V
=
NA
N
Vm
V
=
Vm
V
×NA
N
同温、同压Vm相同
若同温、同压、同体积,则气体所含粒子数相同
二、气体摩尔体积
同温
同压
同物质的量
任何气体
气体体积相同
同温同压下,相同体积的任何气体,含有相同数目的分子
n =
NA
N
物质的量相同
三、阿伏伽德罗定律
可简单总结为“四同”:同温、同压、同体积、同分子数。
“三同定一同”
适用于任何气体,包括混合气体
P V = n R T
气体的状态方程:
压强
体积
物质的量
常数
温度
只是用于气体
“三同定一同”
“两同定比例”
四、阿伏伽德罗定律的推论
同温同压
P V = n R T
体积比等于物质的量之比,等于粒子数之比
四、阿伏伽德罗定律的推论
类比气球:相同条件下,向两只气球中分别充入1 mol O2、 2 mol
H2的体积比是 。
1:2
同温同容
压强比等于物质的量之比,等于粒子数之比
P V = n R T
四、阿伏伽德罗定律的推论
类比篮球:相同条件下,向两只篮球中分别充入1 mol 空气、 2 mol
空气的压强比是 。
1:2
同温同物质的量
P V = n R T
压强比等于体积的反比
同温同压
=
ρ
m
=
M
m
密度比等于摩尔质量之比
P M = ρ R T
四、阿伏伽德罗定律的推论
对点训练
判断正误:
(1) 同温同压下,相同体积的任何气体都含有相同数目的原子( )
(2) 同温同压下,相同体积的氧气和氨气,前者质量小于后者( )
(3) 同温同压下,1 mol氢气与1 mol氧气,它们的分子数相同,质量不同( )
(4) 同温同压下,CO与CO2的密度之比为7∶11( )
×
×
× M
n
N
V
m
× Vm
× NA
P V = n R T
P M = ρ R T
课堂小结
下列有关气体体积叙述正确的是 ( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
B
2.下列说法中正确的是 ( )
A.标准状况下,22.4 L·mol-1就是气体摩尔体积
B.1 mol H2的质量只有在标准状况下才约为2 g
C.标准状况下,18 g水的体积为22.4 L
D.H2和O2的混合气体1 mol在标准状况下的体积约为22.4 L
D
3. NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,0.1NA个水分子所占的体积约为2.24 L
B.11.2 L CO2的物质的量为0.5 mol
C.NH3的摩尔质量等于NA个氨分子的质量之和
D.101 kPa、4 ℃时,18 mL水和202 kPa、27 ℃时32 g O2所含分子数均为NA
D
4.同温同压下等质量的SO2气体和CO2气体,下列有关比较的叙述正确的是( )
①密度比为16∶11 ②密度比为11∶16
③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
B
5.在标准状况下有:①6.72 L CH4,②3.01×1023个HCl分子,③13.6 g H2S,④0.2 mol NH3。下列对这四种气体的描述正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.cbd D.abcd
D
第2课时 气体摩尔体积
Thanks
谢谢观看
第二章 海水中的重要元素—钠和氯
第三节 物质的量
第2课时 气体摩尔体积
PART
01
PART
02
了解气体摩尔体积及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
能基于物质的量认识物质组成及其化学变化,运用物质的量、气体摩尔体积之间的相互关系进行简单计算。
课程标准要求
PART
01
PART
02
能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
能基于物质的量认识物质的组成及变化,建立n、m、Vm之间的计算模型,熟悉阿伏加德罗定律的应用。
核心素养发展目标
情景引入
实验室中有一瓶氢气,我们应如何得到该气体的物质的量呢?
2. 在相同的条件下1 mol 固体、1 mol液体的体积是否也相等?
1. 计算在0 ℃,101 kPa(标况)1 mol氢气和1 mol氧气的体积。
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.4
物质 状态 1 mol 微粒 1 mol 质量(g) 密度 (g/cm3) 体积(cm3)
Fe
Al
H2O
H2SO4
固体
固体
液体
液体
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
6.02×1023
0.998
不相等
相等
思考与讨论
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?气体体积与什么有关?
思考与讨论
影响物质体积大小的因素
粒子的数目
粒子的大小
粒子间的距离
液体
固体
气体
不同固体
粒子大小
不同
不同液体
粒子大小
不同
同温同压
粒子间
距离相同
1 mol不同的固态物质或液态物质的体积不同
一、物质体积的影响因素
气体的体积
粒子的数目
粒子间的距离
p不变,T升高,V 增大
T不变,p增大,V 减小
在相同温度 和压强下
粒子间的距离相同
若同温同压条件下,单位物质的量的气体的体积是个定值
粒子的数目相同
n=
NA
N
物质的量相同
一、物质体积的影响因素
判断正误:
(1) 一定温度、压强下,气体体积由其分子的大小和数目决定( )
(2) 固态物质和液态物质的体积决定于粒子大小和粒子数目( )
(3) 同温同压下,若两种气体所占体积不同,其主要原因是气体分子间距离不同( )
(4) 1 mol一氧化碳和1 mol氧气所含的分子数相同,体积也相同( )
(5) 同温同压下,同体积的物质所含的分子数一定相等( )
对点训练
×
√
×
×
×
1.定义
单位物质的量的气体所占的体积叫做气体摩尔体积
2.符号
Vm
3.单位
L/mol或L mol-1
(升 每摩尔)
4.公式
Vm=
V
n
5.影响因素
温度越高,Vm越大
压强越高,Vm越小
Vm
V
n
=
二、气体摩尔体积
6.特例
只适用于气态物质,可以是单一气体也可以是混合气体
标况下,HF 、 H2O、NO2 、 SO3 、 CCl4 、溴、酒精、苯等不属于气态
Vm≈ 22.4 L/mol 的状态不一定是标准状况
二、气体摩尔体积
标准状况 (0℃,101KPa) Vm≈ 22.4 L/mol
判断正误:
(1) 1 mol任何气体的体积都为22.4 L( )
(2) 1 mol任何物质在标准状况下所占的体积都为22.4 L( )
(3) 标准状况下,1 mol水所占的体积是22.4 L( )
(4) 在常温常压下,11.2 L Cl2含有的分子数为0.5NA( )
(5) 标况下的Vm=22.4 L·mol-1,那么Vm=22.4 L·mol-1时也一定是标 准状况( )
对点训练
×
×
×
×
×
对点训练
2. 下列说法正确的是( )
A.在常温常压下,1 mol氦气含有的原子数为2NA
B.在标准状况下,H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol C所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的氮原子的物质的量约为2 mol
D
=n
NA
N
n =
Vm
V
=
NA
N
Vm
V
=
Vm
V
×NA
N
同温、同压Vm相同
若同温、同压、同体积,则气体所含粒子数相同
二、气体摩尔体积
同温
同压
同物质的量
任何气体
气体体积相同
同温同压下,相同体积的任何气体,含有相同数目的分子
n =
NA
N
物质的量相同
三、阿伏伽德罗定律
可简单总结为“四同”:同温、同压、同体积、同分子数。
“三同定一同”
适用于任何气体,包括混合气体
P V = n R T
气体的状态方程:
压强
体积
物质的量
常数
温度
只是用于气体
“三同定一同”
“两同定比例”
四、阿伏伽德罗定律的推论
同温同压
P V = n R T
体积比等于物质的量之比,等于粒子数之比
四、阿伏伽德罗定律的推论
类比气球:相同条件下,向两只气球中分别充入1 mol O2、 2 mol
H2的体积比是 。
1:2
同温同容
压强比等于物质的量之比,等于粒子数之比
P V = n R T
四、阿伏伽德罗定律的推论
类比篮球:相同条件下,向两只篮球中分别充入1 mol 空气、 2 mol
空气的压强比是 。
1:2
同温同物质的量
P V = n R T
压强比等于体积的反比
同温同压
=
ρ
m
=
M
m
密度比等于摩尔质量之比
P M = ρ R T
四、阿伏伽德罗定律的推论
对点训练
判断正误:
(1) 同温同压下,相同体积的任何气体都含有相同数目的原子( )
(2) 同温同压下,相同体积的氧气和氨气,前者质量小于后者( )
(3) 同温同压下,1 mol氢气与1 mol氧气,它们的分子数相同,质量不同( )
(4) 同温同压下,CO与CO2的密度之比为7∶11( )
×
×
× M
n
N
V
m
× Vm
× NA
P V = n R T
P M = ρ R T
课堂小结
下列有关气体体积叙述正确的是 ( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
B
2.下列说法中正确的是 ( )
A.标准状况下,22.4 L·mol-1就是气体摩尔体积
B.1 mol H2的质量只有在标准状况下才约为2 g
C.标准状况下,18 g水的体积为22.4 L
D.H2和O2的混合气体1 mol在标准状况下的体积约为22.4 L
D
3. NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,0.1NA个水分子所占的体积约为2.24 L
B.11.2 L CO2的物质的量为0.5 mol
C.NH3的摩尔质量等于NA个氨分子的质量之和
D.101 kPa、4 ℃时,18 mL水和202 kPa、27 ℃时32 g O2所含分子数均为NA
D
4.同温同压下等质量的SO2气体和CO2气体,下列有关比较的叙述正确的是( )
①密度比为16∶11 ②密度比为11∶16
③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
B
5.在标准状况下有:①6.72 L CH4,②3.01×1023个HCl分子,③13.6 g H2S,④0.2 mol NH3。下列对这四种气体的描述正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.cbd D.abcd
D
第2课时 气体摩尔体积
Thanks
谢谢观看
