第6部分 第10章 第58讲 微点突破18 有机物制备中的分离提纯(共17张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第6部分 第10章 第58讲 微点突破18 有机物制备中的分离提纯(共17张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-31 20:03:39 | ||
图片预览





文档简介
(共17张PPT)
微点突破18 有机物制备中的分离提纯
第六部分 化学实验基础
第十章 化学实验基础
微点精讲
01
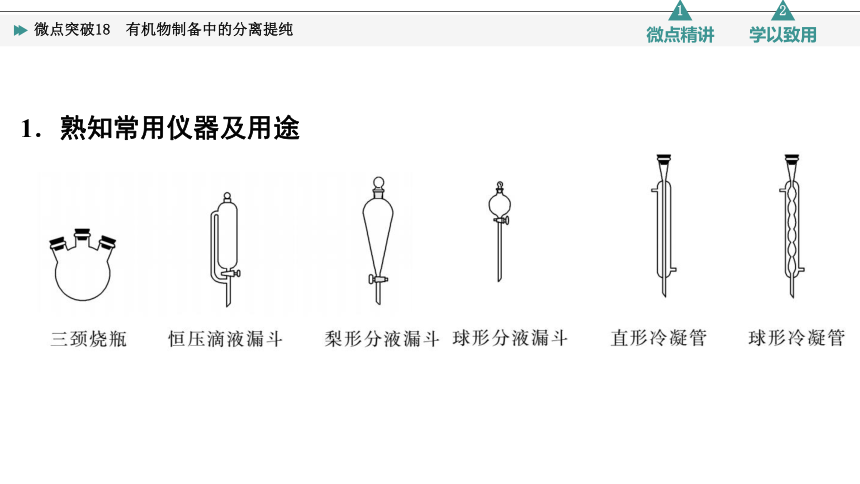
1.熟知常用仪器及用途
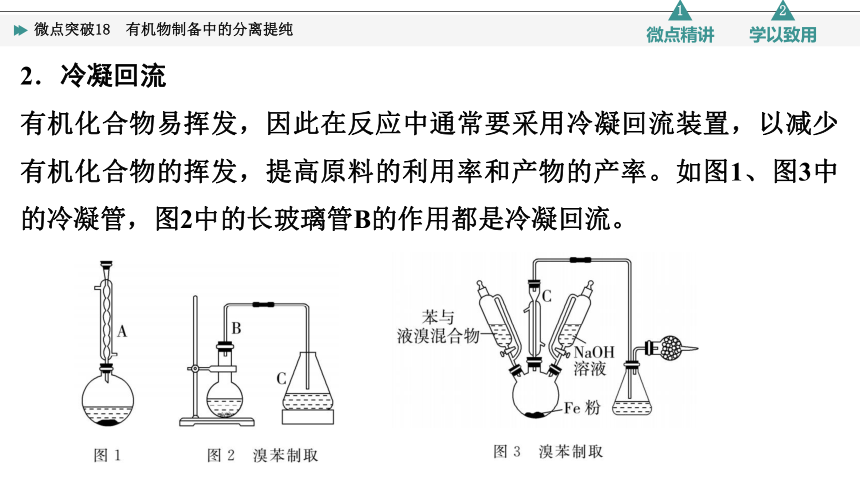
2.冷凝回流
有机化合物易挥发,因此在反应中通常要采用冷凝回流装置,以减少有机化合物的挥发,提高原料的利用率和产物的产率。如图1、图3中的冷凝管,图2中的长玻璃管B的作用都是冷凝回流。
3.常见有机化合物分离提纯的方法
(1)分液:用于分离两种互不相溶(密度也不同)的液体。
(2)蒸馏:用于分离沸点不同的液体。分馏的原理与此相同。
(3)萃取分液:有机物易溶于有机溶剂如CCl4,乙醇,丙酮等,分离有机物时常采用萃取分液。
(4)重结晶:制备的有机物常温下为固体物质且溶解度随温度升高而降低,如苯甲酸。
(2021·湖南选择性考试,T13)1 丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1 溴丁烷粗产品,装置如图所示:
已知:CH3(CH2)3OH+NaBr+H2SO4 CH3(CH2)3Br+NaHSO4+H2O。
下列说法正确的是( )
A.装置Ⅰ中回流的目的是减少物质的挥发,提高产率
B.装置Ⅱ中a为进水口,b为出水口
C.用装置Ⅲ萃取分液时,将分层的液体依次从下口放出
D.经装置Ⅲ得到的粗产品干燥后,使用装置Ⅱ再次蒸馏,可得到更纯的产品
AD [根据题意1 丁醇、溴化钠和70%的硫酸在装置Ⅰ中共热发生反应CH3(CH2)3OH+NaBr+H2SO4 CH3(CH2)3Br+NaHSO4+H2O,得到含CH3(CH2)3OH、CH3(CH2)3Br、NaHSO4、NaBr、H2SO4的混合物,混合物在装置Ⅱ中蒸馏得到CH3(CH2)3OH和CH3(CH2)3Br的混合物,在装置Ⅲ中用合适的萃取剂萃取分液得CH3(CH2)3Br粗产品。浓硫酸和NaBr反应会产生HBr,1 丁醇以及浓硫酸和NaBr产生的HBr均易挥发,用装置Ⅰ回流可减少反应物的挥发,提高产率,A正确;冷凝水应下进上出,装置Ⅱ中b为进水口,a为出水口,B错误;用装置Ⅲ萃取分液时,将下层液体从下口放出,上层液体从上口倒出,C错误;由题意可知经装置Ⅲ得到粗产品,由于粗产品中各物质沸点不同,再次进行蒸馏可得到更纯的产品,D正确。]
学以致用
02
1.(2022·济南模拟)溴乙烷是无色油状液体,是制造巴比妥的原料,工业上可用海水制备溴乙烷,部分工艺流程如图:
下列说法错误的是( )
A.粗盐提纯时,加入沉淀剂的顺序可以是BaCl2、NaOH和Na2CO3
B.向“母液”中通入热空气,利用溴的易挥发性,将溴吹出
C.“制备”时氧化剂和还原剂的物质的量之比为3∶1
D.“精制”时所用的玻璃仪器有分液漏斗、烧杯
D [溴乙烷易溶于乙醇,应用蒸馏法“精制”溴乙烷,所用的玻璃仪器有蒸馏烧瓶、冷凝管、锥形瓶、牛角管、温度计、酒精灯,D错误。]
主要实验装置示意图、制备原理和部分物质的性质如下:
物质 熔点/℃ 沸点/℃ 密度/(g·cm-3) 溶解性
环己醇 25.93 160.8 0.968 微溶于水
己二酸 152 330.5 1.36 微溶于水,溶解度随温度变化较大,当溶液温度由28 ℃升至78 ℃时,其溶解度可增大20倍
回答下列问题:
(1)仪器a的名称是________,冷却水的入口是________(填“m”或“n”)。
(2)三颈烧瓶中KMnO4被还原为MnO2,则该反应的化学方程式是____
__________________________________________________________。
(3)制备过程中,出现________现象时可停止加热。
(4)反应完成后在反应体系中加入NaHSO3的目的是_________________
__________________________________________________________。
(5)采用右图装置进行加热过滤,加热过滤的优点是________________
________________________________________________________,
该过滤的目的是______________________________________________
___________________________________________________________。
(3)环己醇微溶于水,而加热条件下,己二酸溶解于水,故反应完成时,反应液中没有油珠。(4)反应中加入了过量的KMnO4,NaHSO3具有还原性,能除去反应液中过量的KMnO4。(5)由题给信息可知,己二酸在升温时,溶解度增大,故加热过滤可以减少因己二酸析出到滤渣中而造成的损失。该制备反应中生成MnO2,则该过滤是为了除去MnO2。
谢谢观看 THANK YOU!
微点突破18 有机物制备中的分离提纯
第六部分 化学实验基础
第十章 化学实验基础
微点精讲
01
1.熟知常用仪器及用途
2.冷凝回流
有机化合物易挥发,因此在反应中通常要采用冷凝回流装置,以减少有机化合物的挥发,提高原料的利用率和产物的产率。如图1、图3中的冷凝管,图2中的长玻璃管B的作用都是冷凝回流。
3.常见有机化合物分离提纯的方法
(1)分液:用于分离两种互不相溶(密度也不同)的液体。
(2)蒸馏:用于分离沸点不同的液体。分馏的原理与此相同。
(3)萃取分液:有机物易溶于有机溶剂如CCl4,乙醇,丙酮等,分离有机物时常采用萃取分液。
(4)重结晶:制备的有机物常温下为固体物质且溶解度随温度升高而降低,如苯甲酸。
(2021·湖南选择性考试,T13)1 丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1 溴丁烷粗产品,装置如图所示:
已知:CH3(CH2)3OH+NaBr+H2SO4 CH3(CH2)3Br+NaHSO4+H2O。
下列说法正确的是( )
A.装置Ⅰ中回流的目的是减少物质的挥发,提高产率
B.装置Ⅱ中a为进水口,b为出水口
C.用装置Ⅲ萃取分液时,将分层的液体依次从下口放出
D.经装置Ⅲ得到的粗产品干燥后,使用装置Ⅱ再次蒸馏,可得到更纯的产品
AD [根据题意1 丁醇、溴化钠和70%的硫酸在装置Ⅰ中共热发生反应CH3(CH2)3OH+NaBr+H2SO4 CH3(CH2)3Br+NaHSO4+H2O,得到含CH3(CH2)3OH、CH3(CH2)3Br、NaHSO4、NaBr、H2SO4的混合物,混合物在装置Ⅱ中蒸馏得到CH3(CH2)3OH和CH3(CH2)3Br的混合物,在装置Ⅲ中用合适的萃取剂萃取分液得CH3(CH2)3Br粗产品。浓硫酸和NaBr反应会产生HBr,1 丁醇以及浓硫酸和NaBr产生的HBr均易挥发,用装置Ⅰ回流可减少反应物的挥发,提高产率,A正确;冷凝水应下进上出,装置Ⅱ中b为进水口,a为出水口,B错误;用装置Ⅲ萃取分液时,将下层液体从下口放出,上层液体从上口倒出,C错误;由题意可知经装置Ⅲ得到粗产品,由于粗产品中各物质沸点不同,再次进行蒸馏可得到更纯的产品,D正确。]
学以致用
02
1.(2022·济南模拟)溴乙烷是无色油状液体,是制造巴比妥的原料,工业上可用海水制备溴乙烷,部分工艺流程如图:
下列说法错误的是( )
A.粗盐提纯时,加入沉淀剂的顺序可以是BaCl2、NaOH和Na2CO3
B.向“母液”中通入热空气,利用溴的易挥发性,将溴吹出
C.“制备”时氧化剂和还原剂的物质的量之比为3∶1
D.“精制”时所用的玻璃仪器有分液漏斗、烧杯
D [溴乙烷易溶于乙醇,应用蒸馏法“精制”溴乙烷,所用的玻璃仪器有蒸馏烧瓶、冷凝管、锥形瓶、牛角管、温度计、酒精灯,D错误。]
主要实验装置示意图、制备原理和部分物质的性质如下:
物质 熔点/℃ 沸点/℃ 密度/(g·cm-3) 溶解性
环己醇 25.93 160.8 0.968 微溶于水
己二酸 152 330.5 1.36 微溶于水,溶解度随温度变化较大,当溶液温度由28 ℃升至78 ℃时,其溶解度可增大20倍
回答下列问题:
(1)仪器a的名称是________,冷却水的入口是________(填“m”或“n”)。
(2)三颈烧瓶中KMnO4被还原为MnO2,则该反应的化学方程式是____
__________________________________________________________。
(3)制备过程中,出现________现象时可停止加热。
(4)反应完成后在反应体系中加入NaHSO3的目的是_________________
__________________________________________________________。
(5)采用右图装置进行加热过滤,加热过滤的优点是________________
________________________________________________________,
该过滤的目的是______________________________________________
___________________________________________________________。
(3)环己醇微溶于水,而加热条件下,己二酸溶解于水,故反应完成时,反应液中没有油珠。(4)反应中加入了过量的KMnO4,NaHSO3具有还原性,能除去反应液中过量的KMnO4。(5)由题给信息可知,己二酸在升温时,溶解度增大,故加热过滤可以减少因己二酸析出到滤渣中而造成的损失。该制备反应中生成MnO2,则该过滤是为了除去MnO2。
谢谢观看 THANK YOU!
同课章节目录
