第6部分 第10章 第58讲 物质的分离与提纯(基础课)(共53张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第6部分 第10章 第58讲 物质的分离与提纯(基础课)(共53张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-31 20:10:25 | ||
图片预览








文档简介
(共53张PPT)
第58讲 物质的分离与提纯(基础课)
第六部分 化学实验基础
第十章 化学实验基础
1.了解过滤、蒸发、萃取、蒸馏等物质分离、提纯的常用方法,能对常见物质进行分离与提纯。 2.利用典型代表物的性质和反应特点,设计常见物质分离、提纯等简单问题的方案。 3.掌握有机物制备中涉及的分离与提纯。
知识点一 物质分离、提纯常用的物理方法
必备知识梳理
关键能力训练
01
1.固体与液体的分离提纯
(1)图1分离提纯方法称为______,涉及的玻璃仪器有
______、________、______。
适用范围:把不溶性______与______进行分离。
注意事项:①一贴:______紧贴漏斗内壁。二低:滤纸上缘低于__________,液面低于滤纸边缘。三靠:烧杯紧靠________,玻璃棒轻靠__________处,漏斗下端尖口处紧靠__________。
②若滤液浑浊,需________。浑浊的原因可能是__________、液面超过滤纸边缘。
过滤
烧杯
玻璃棒
漏斗
固体
液体
滤纸
漏斗边缘
玻璃棒
三层滤纸
烧杯内壁
再过滤
滤纸破损
(2)图2分离提纯方法称为______,涉及的仪器有铁架台(含铁圈)、________、________、________。
注意事项:加热时不要将溶液蒸干,当蒸发皿中出现较多晶体时,即停止加热,利用余热将液体蒸干。
(3)结晶的两种方式
①蒸发结晶——适用于溶解度随温度升高变化不大或减小且稳定的固体物质,如NaCl、Ca(OH)2等。
②冷却结晶——适用于溶解度随温度升高而增大或不稳定的结晶水合物或铵盐,如KNO3、CuSO4·5H2O、NH4Cl等。
蒸发
蒸发皿
玻璃棒
酒精灯
2.液体与液体的分离提纯
(1)图3的分离提纯方法称为萃取分液,
涉及的玻璃仪器主要是__________和烧杯。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的________不同,用一种溶剂(萃取剂)把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体__________且易分层的分离方法。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中的____;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④分液时,分液漏斗中的下层液体从____口放出,上层液体从____口倒出。
分液漏斗
溶解度
互不相溶
大
下
上
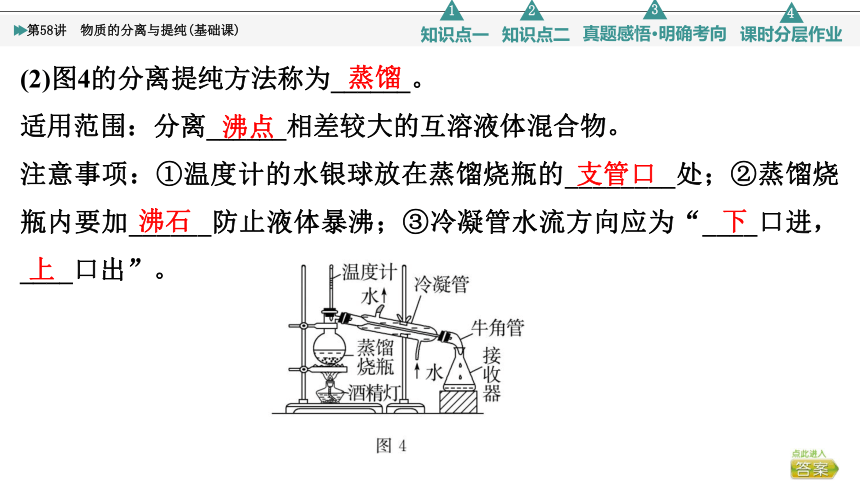
(2)图4的分离提纯方法称为______。
适用范围:分离______相差较大的互溶液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的________处;②蒸馏烧瓶内要加______防止液体暴沸;③冷凝管水流方向应为“____口进,____口出”。
蒸馏
沸点
支管口
沸石
下
上
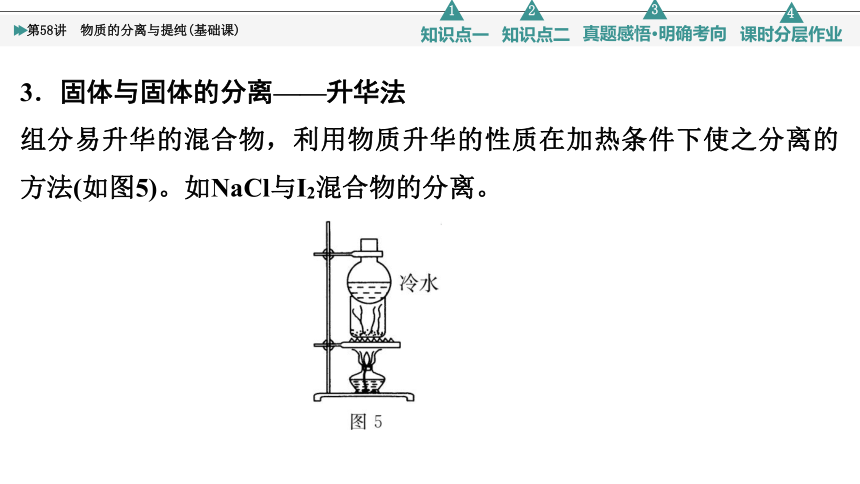
3.固体与固体的分离——升华法
组分易升华的混合物,利用物质升华的性质在加热条件下使之分离的方法(如图5)。如NaCl与I2混合物的分离。
4.气体与气体的分离提纯
(1)固体吸收法——干燥管或U形管。如用________干燥NH3。
(2)溶液吸收法——洗气瓶。如用________干燥HCl、SO2等。
(3)固体加热吸收法——硬质玻璃管。如用铜丝加热除去N2中的O2。
碱石灰
浓硫酸
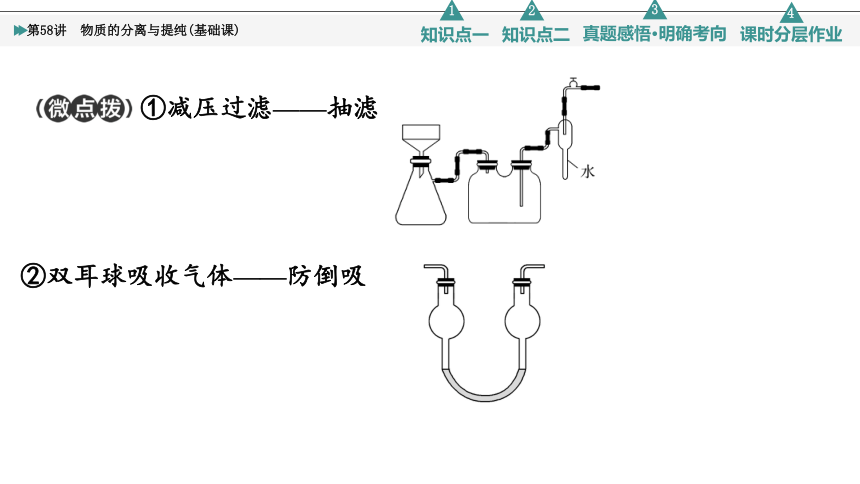
①减压过滤——抽滤
②双耳球吸收气体——防倒吸
1.判断正误(正确的打“√”,错误的打“×”)
(1)过滤时,为加快过滤速度,应用玻璃棒不断搅拌漏斗中的液体。( )
(2)从溶液中获取NaCl晶体,用蒸发结晶的方法,应使混合物中的水分完全蒸干后,再停止加热。( )
(3)根据食用油和汽油的密度不同,可选用分液的方法分离。( )
(4)用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇。( )
(5)利用加热的方法分离NH4Cl和I2的固体混合物。 ( )
[答案] (1)× (2)× (3)× (4)× (5)×
2.请选用适当的分离方法,按要求分离下列混合物。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
从海 水中 获得 粗食 盐 从溴 水中 提取 溴 除去氯 化钠溶 液中的 泥沙 分离固 体氯化 钠和单 质碘 用自来 水制取 蒸馏水 油脂发 生皂化 反应后 产物的 分离 四氯化 碳和水 的分离 除去硝
酸钾中
混有的
氯化钠
A.过滤 B.蒸发 C.萃取 D.蒸馏 E.升华
F.分液 G.重结晶 H.盐析
[答案] ①B ②C ③A ④E ⑤D ⑥H ⑦F ⑧G
1.下列实验操作或装置正确的是( )
C [A项,除去苯甲酸中的乙醇可以用蒸馏法,不能用蒸发法,错误;B项,苯酚微溶于水,不能用过滤法,错误;D项,CH3COOH易溶于水,无法用分液法,错误。]
2.某化学兴趣小组从含有KI、KNO3等成分的工业废水中回收I2和KNO3,其流程如下:
下列说法不正确的是( )
A.步骤1中无机相应从分液漏斗下端放出,有机相从上口倒出
B.步骤2为蒸馏
C.步骤3可在如图所示装置中完成
D.步骤4中,将溶液蒸发至只剩少量水时,用余热将晶体蒸干
D [步骤1为萃取分液操作,苯的密度比水小,故无机相应从分液漏斗下端放出,有机相从分液漏斗上口倒出,A正确;步骤2为蒸馏,B正确;步骤3为升华,用图中装置能较好地控制温度,C正确;由于KNO3的溶解度随温度变化比较大,步骤4应采用蒸发浓缩、冷却结晶的方法,因此加热至有少量晶体出现就可停止加热,D错误。]
3.根据下列各组溶解度曲线图,判断分离提纯方法。
(1)根据图①中Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g H2O),由Na2SO4溶液得到Na2SO4固体的操作为将溶液升温结晶、________、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是_________________
__________________________________________________________。
(2)根据图②所示相关物质的溶解度曲线。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为将过硫酸钾粗产品溶于适量水中,________________________________________________________________________________________________________________________________________________,干燥。
(3)根据图①中红矾钠(Na2Cr2O7·2H2O)和Na2SO4 的溶解度曲线。 从Na2Cr2O7和Na2SO4的混合溶液中提取红矾钠的操作为先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是_______________________
___________________________________________________________;
然后将滤液________,从而析出红矾钠。
[答案] (1)趁热过滤 防止形成Na2SO4·10H2O (2)在不超过80 ℃的条件下加热浓缩,冷却结晶,过滤,用冷水洗涤 (3)有利于Na2SO4结晶析出,又能防止Na2Cr2O7·2H2O结晶析出 冷却结晶
过滤操作中常考的热点问题
(1)如果蒸发结晶得到晶体,应趁热过滤,防止冷却时其他晶体析出。
(2)沉淀洗涤操作:向漏斗中注蒸馏水至水没过沉淀,待洗涤液滤出,重复2~3次。
(3)沉淀洗净检验操作:取少许最后一次洗涤液于试管中,然后加入检验试剂,根据现象确定是否洗净。
知识点二 物质分离、提纯常用的化学方法
02
必备知识梳理
关键能力训练
1.化学分离、提纯法
方法 原理 典例
加热法 混合物中混有__________差的物质时,可直接加热,使__________差的物质分解而除去 食盐中混有氯化铵、纯碱中混有小苏打
热稳定性
热稳定性
方法 原理 典例
沉淀法 在混合物中加入某试剂,使其中的一种或多种以______形式分离出去的方法,若使用多种试剂将溶液中不同物质逐一______,这时应注意后加试剂能将先加试剂的过量部分除去,最后加的试剂不引入新的杂质
沉淀
沉淀
方法 原理 典例
转化法 不能通过一次反应达到分离目的,而要转化为其他物质才能分离,然后再将转化物质恢复为原物质 苯酚中混有硝基苯时,先加入氢氧化钠溶液后分液,再向苯酚钠溶液中通入CO2重新生成苯酚
酸碱法 被提纯物不与酸反应,而杂质可与酸反应,用酸作除杂试剂;被提纯物不与碱反应,而杂质可与碱反应,用碱作除杂试剂 用盐酸除去二氧化硅中的碳酸钙,用氢氧化钠溶液除去铁粉中的铝粉
方法 原理 典例
氧化还原法 混合物中含有还原性杂质,加入适当氧化剂使其氧化为被提纯物质;混合物中含有氧化性杂质,加入适当还原剂使其还原为被提纯物质 氯化铁中含有氯化亚铁杂质可通入氯气,将氯化亚铁转化为氯化铁;氯化亚铁中含有氯化铁杂质可加入铁粉,振荡过滤,即可除去氯化铁
调节pH法 利用某些物质沉淀的pH范围不同,采取一定措施调节溶液pH,使某些物质沉淀进行分离 CuCl2溶液中含有Fe3+杂质可以加入CuO调节pH约为3时使Fe3+沉淀完全
电解法 利用电解原理除去杂质 粗铜作阳极、纯铜作阴极,硫酸铜作电解质溶液
2.化学分离和提纯物质的原则
不增 提纯过程中不增加新的杂质
不减 不减少被提纯的物质
易分离 被提纯物质与杂质容易分离
易复原 被提纯物质要易复原
三必须 一、除杂试剂必须过量;二、过量试剂必须除尽(因为过量试剂带入新的杂质);三、必须选最佳除杂途径
除去下列常见物质中的杂质,完成表格:
序号 原物质 所含杂质 除杂质试剂 主要操作方法
① N2 O2 ________ 固体吸收气体
② CO CO2 ________或_____ ________或固体吸收气体
③ CO2 CO ________ 用固体转化气体
序号 原物质 所含杂质 除杂质试剂 主要操作方法
④ CO2 HCl ________ ________
⑤ Cl2 HCl ________ ________
⑥ 碳粉 CuO ________ ________
⑦ Fe2O3 Al2O3 ________ ________
⑧ NaHCO3溶液 Na2CO3 ________ 加酸转化
序号 原物质 所含杂质 除杂质试剂 主要操作方法
⑨ FeCl3溶液 FeCl2 ________ 加氧化剂转化
⑩ FeCl2溶液 FeCl3 ________ 加还原剂转化
MgCl2溶液 FeCl3 ________ ________
NaCl晶体 NH4Cl ________
乙酸乙酯 乙酸 ________ ________
[答案] ①灼热的铜网 ②NaOH溶液 碱石灰 洗气 ③灼热的CuO ④饱和NaHCO3溶液 洗气 ⑤饱和食盐水 洗气 ⑥稀酸(如稀盐酸) 过滤 ⑦过量NaOH溶液 过滤 ⑧CO2 ⑨Cl2 ⑩Fe MgO 过滤 加热分解 饱和Na2CO3溶液 分液
1.下列实验操作能达到相应实验目的的是( )
选项 实验操作 实验目的
A 向FeCl3、CuCl2的混合溶液中加入足量铁粉,然后过滤 提纯FeCl3
B 向含有Br2的苯中加入适量的NaOH溶液,然后充分振荡、静置、分液 除去杂质Br2
C 将含有少量NaCl杂质的KNO3固体溶于水,然后蒸发结晶 提纯KNO3
D 向MgCl2、AlCl3混合溶液中加入过量的NaOH溶液,过滤后将沉淀溶于适量的盐酸;向滤液中加入适量盐酸 分离MgCl2、AlCl3
B [A项,向FeCl3、CuCl2的混合溶液中加入足量铁粉,FeCl3会和Fe反应生成FeCl2,错误;B项,Br2和NaOH溶液反应生成易溶于水的NaBr和NaBrO,充分振荡、静置、分液可以除去杂质Br2,正确;C项,KNO3的溶解度随温度升高变化较大,而NaCl的溶解度受温度影响不大,要提纯KNO3,将含有少量NaCl杂质的KNO3固体溶于水,蒸发浓缩、冷却结晶,然后过滤即可得较纯净的KNO3,错误;D项,滤液中含有NaCl,得不到纯净的AlCl3溶液,错误。]
2.(2022·济宁模拟)下列有关实验的说法错误的是( )
A.取5 mL 0.1 mol·L-1 KI溶液,加入1 mL 0.1 mol·L-1 FeCl3溶液,萃取分离出碘单质后,向溶液中滴加5~6滴15% KSCN溶液变红,说明Fe3+并未完全转化为Fe2+
B.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低
C.氯气和甲烷体积比为1∶1的混合气体,光照一段时间后瓶壁上有油状液滴附着
D.在苯与液溴制备溴苯的实验中,溴苯提纯步骤:水洗、用10%的氢氧化钠溶液洗涤、水洗、分液、用干燥剂干燥、蒸馏
B [蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,收集到的馏分沸点偏高,B错误。]
3.国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)发电玻璃被誉为“挂在墙上的油田”。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH。
Fe3+ Fe2+ Cu2+
开始沉淀 2.7 6.3 3.8
完全沉淀 3.2 8.3 5.0
下列说法错误的是( )
A.调节pH=5目的是除去Fe和Cu等杂质元素
B.“滤渣2”主要成分为MnO2
C.“置换”后滤液溶质主要成分是ZnSO4
D.“熔炼”过程可利用Cd与Na2ZnO2的密度差异将二者分离
AB [根据流程图,镉废渣加入硫酸溶解生成多种硫酸盐,加入石灰乳调节pH=5,滤渣1为Cu(OH)2和CaSO4;在滤液中加入KMnO4,把Fe2+氧化为Fe(OH)3沉淀、把Mn2+氧化为MnO2,滤渣2为Fe(OH)3和MnO2;滤液中加入锌置换出Cd,得到海绵镉,其中混有过量的锌,在“熔炼”中用氢氧化钠溶解过量的锌,得到Cd和Na2ZnO2,利用二者的密度差异可将其分离。调节pH=5,主要目的为除去杂质元素Cu,A错误;滤渣2主要成分为MnO2、Fe(OH)3,B错误;滤液中加入锌置换出Cd,滤液溶质主要成分是ZnSO4,C正确;根据分析可知,D正确。]
4.现需要纯净的氯化钠溶液,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体。某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案:
(1)操作①中发生反应的化学方程式是___________________________
_____________________________________________________________________________________________________________________。
(2)操作②中BaCl2溶液能否改用硝酸钡溶液________(填“能”或“不能”)。如果能,下一空不需要回答;如果不能,请说明理由:______
_____________________________________________________________
__________________________________________________________。
(3)操作③的目的是____________________________________________
__________________________________________________________。
(4)操作④的目的是_____________________________________________
___________________________________________________________。
[答案] (1)NH4HCO3 NH3↑+CO2↑+H2O (2)不能 选用Ba(NO3)2溶液会引入新的杂质离子 (3)除去过量的Ba2+ (4)除去溶解在溶液中的CO2和HCl
真题感悟·明确考向
03
1.(2022·山东等级考)已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是( )
A.苯胺既可与盐酸也可与NaOH溶液反应
B.由①、③分别获取相应粗品时可采用相同的操作方法
C.苯胺、甲苯、苯甲酸粗品依次由①、②、③获得
D.①、②、③均为两相混合体系
1
3
2
C [由题给流程可知,向甲苯、苯胺、苯甲酸的混合溶液中加入盐酸,盐酸将微溶于水的苯胺转化为易溶于水的苯胺盐酸盐,分液得到水相Ⅰ和有机相Ⅰ;向水相中加入氢氧化钠溶液将苯胺盐酸盐转化为苯胺,分液得到苯胺粗品①;向有机相中加入水洗涤除去混有的盐酸,分液得到废液和有机相Ⅱ,向有机相Ⅱ中加入碳酸钠溶液将微溶于水的苯甲酸转化为易溶于水的苯甲酸钠,分液得到甲苯粗品②和水相Ⅱ;向水相Ⅱ中加入盐酸,将苯甲酸钠转化为苯甲酸,经结晶或重结晶、过滤、洗涤得到苯甲酸粗品③。苯胺分子中含有的氨基能与盐酸反应,但不能与氢氧化钠溶液反应,故A错误;由分析可知,得到苯胺粗品①的分离方法为分液,得到苯甲酸粗品③的分离方法为结晶或重结晶、过滤、洗涤,获取两者的操作方法不同,故B错误;苯胺粗品、甲苯粗品、苯甲酸粗品依次由①、②、③获得,故C正确;①、②为液相,③为固相,都不是两相混合体系,故D错误。]
1
3
2
2.(2022·湖南选择性考试,T7)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
1
3
2
1
3
2
C [陶瓷中的SiO2能与HF反应,A项正确;喷淋法能使溶液与烟气充分接触,提高吸收效率,B项正确;根据流程梳理知,C项错误;滤液中含有Na2CO3,可用作吸收塔中的吸收剂,D项正确。]
3.(2022·全国甲卷,节选改编)硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)溶解回流装置如图所示,回流前无需加入沸石,其原因是________________
____。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的 。若气雾上升过高,可采取的措施是___________________________________________________
_________________________________________________________________________________________。
1
3
2
(2)回流时间不宜过长,原因是____________________________。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为________(填标号)。
A.①②③ B.③①② C.②①③ D.①③②
1
3
2
(3)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是______________________________。热过滤除去的杂质为________。若滤纸上析出大量晶体,则可能的原因是_________________________
___________。
(4)滤液冷却、结晶、过滤,晶体用少量________洗涤,干燥,得到Na2S·xH2O。
1
3
2
[解析] (1)回流前无需加入沸石,说明有物质可以代替沸石,由题干信息可知,粗品中含有煤灰、重金属硫化物等固体,具有“沸石”的作用。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的 ,若气雾上升过高,需要将温度降下来,故可采取的措施是停止加热,加快冷凝管内冷凝水的流速。(2)回流时间不宜过长,原因是避免Na2S接触空气被氧化。回流结束后,应将反应液的温度降下来,故先停止加热,移去水浴,最后关闭冷凝水。(3)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是防止液体沿烧杯内壁流下过程中与空气接触使Na2S被氧化。煤灰、重金属硫化物难溶于热乙醇,可以通过热过滤除去。若滤纸上析出大量晶体,则可能的原因是热过滤时漏斗的温度过低。(4)滤液冷却、结晶、过滤,晶体用少量常温下的乙醇(Na2S的溶解少、损失少)洗涤,干燥后,得到Na2S·xH2O。
1
3
2
[答案] (1)粗品中含有难溶于乙醇的煤灰、重金属硫化物等固体,有“沸石”作用 停止加热,加快冷凝管内冷凝水的流速 (2)避免Na2S接触空气被氧化 D (3)防止液体沿烧杯内壁流下过程中与空气接触使Na2S被氧化 煤灰、重金属硫化物 热过滤时漏斗的温度过低 (4)常温下的乙醇
1
3
2
谢谢观看 THANK YOU!
第58讲 物质的分离与提纯(基础课)
第六部分 化学实验基础
第十章 化学实验基础
1.了解过滤、蒸发、萃取、蒸馏等物质分离、提纯的常用方法,能对常见物质进行分离与提纯。 2.利用典型代表物的性质和反应特点,设计常见物质分离、提纯等简单问题的方案。 3.掌握有机物制备中涉及的分离与提纯。
知识点一 物质分离、提纯常用的物理方法
必备知识梳理
关键能力训练
01
1.固体与液体的分离提纯
(1)图1分离提纯方法称为______,涉及的玻璃仪器有
______、________、______。
适用范围:把不溶性______与______进行分离。
注意事项:①一贴:______紧贴漏斗内壁。二低:滤纸上缘低于__________,液面低于滤纸边缘。三靠:烧杯紧靠________,玻璃棒轻靠__________处,漏斗下端尖口处紧靠__________。
②若滤液浑浊,需________。浑浊的原因可能是__________、液面超过滤纸边缘。
过滤
烧杯
玻璃棒
漏斗
固体
液体
滤纸
漏斗边缘
玻璃棒
三层滤纸
烧杯内壁
再过滤
滤纸破损
(2)图2分离提纯方法称为______,涉及的仪器有铁架台(含铁圈)、________、________、________。
注意事项:加热时不要将溶液蒸干,当蒸发皿中出现较多晶体时,即停止加热,利用余热将液体蒸干。
(3)结晶的两种方式
①蒸发结晶——适用于溶解度随温度升高变化不大或减小且稳定的固体物质,如NaCl、Ca(OH)2等。
②冷却结晶——适用于溶解度随温度升高而增大或不稳定的结晶水合物或铵盐,如KNO3、CuSO4·5H2O、NH4Cl等。
蒸发
蒸发皿
玻璃棒
酒精灯
2.液体与液体的分离提纯
(1)图3的分离提纯方法称为萃取分液,
涉及的玻璃仪器主要是__________和烧杯。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的________不同,用一种溶剂(萃取剂)把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体__________且易分层的分离方法。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中的____;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④分液时,分液漏斗中的下层液体从____口放出,上层液体从____口倒出。
分液漏斗
溶解度
互不相溶
大
下
上
(2)图4的分离提纯方法称为______。
适用范围:分离______相差较大的互溶液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的________处;②蒸馏烧瓶内要加______防止液体暴沸;③冷凝管水流方向应为“____口进,____口出”。
蒸馏
沸点
支管口
沸石
下
上
3.固体与固体的分离——升华法
组分易升华的混合物,利用物质升华的性质在加热条件下使之分离的方法(如图5)。如NaCl与I2混合物的分离。
4.气体与气体的分离提纯
(1)固体吸收法——干燥管或U形管。如用________干燥NH3。
(2)溶液吸收法——洗气瓶。如用________干燥HCl、SO2等。
(3)固体加热吸收法——硬质玻璃管。如用铜丝加热除去N2中的O2。
碱石灰
浓硫酸
①减压过滤——抽滤
②双耳球吸收气体——防倒吸
1.判断正误(正确的打“√”,错误的打“×”)
(1)过滤时,为加快过滤速度,应用玻璃棒不断搅拌漏斗中的液体。( )
(2)从溶液中获取NaCl晶体,用蒸发结晶的方法,应使混合物中的水分完全蒸干后,再停止加热。( )
(3)根据食用油和汽油的密度不同,可选用分液的方法分离。( )
(4)用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇。( )
(5)利用加热的方法分离NH4Cl和I2的固体混合物。 ( )
[答案] (1)× (2)× (3)× (4)× (5)×
2.请选用适当的分离方法,按要求分离下列混合物。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
从海 水中 获得 粗食 盐 从溴 水中 提取 溴 除去氯 化钠溶 液中的 泥沙 分离固 体氯化 钠和单 质碘 用自来 水制取 蒸馏水 油脂发 生皂化 反应后 产物的 分离 四氯化 碳和水 的分离 除去硝
酸钾中
混有的
氯化钠
A.过滤 B.蒸发 C.萃取 D.蒸馏 E.升华
F.分液 G.重结晶 H.盐析
[答案] ①B ②C ③A ④E ⑤D ⑥H ⑦F ⑧G
1.下列实验操作或装置正确的是( )
C [A项,除去苯甲酸中的乙醇可以用蒸馏法,不能用蒸发法,错误;B项,苯酚微溶于水,不能用过滤法,错误;D项,CH3COOH易溶于水,无法用分液法,错误。]
2.某化学兴趣小组从含有KI、KNO3等成分的工业废水中回收I2和KNO3,其流程如下:
下列说法不正确的是( )
A.步骤1中无机相应从分液漏斗下端放出,有机相从上口倒出
B.步骤2为蒸馏
C.步骤3可在如图所示装置中完成
D.步骤4中,将溶液蒸发至只剩少量水时,用余热将晶体蒸干
D [步骤1为萃取分液操作,苯的密度比水小,故无机相应从分液漏斗下端放出,有机相从分液漏斗上口倒出,A正确;步骤2为蒸馏,B正确;步骤3为升华,用图中装置能较好地控制温度,C正确;由于KNO3的溶解度随温度变化比较大,步骤4应采用蒸发浓缩、冷却结晶的方法,因此加热至有少量晶体出现就可停止加热,D错误。]
3.根据下列各组溶解度曲线图,判断分离提纯方法。
(1)根据图①中Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g H2O),由Na2SO4溶液得到Na2SO4固体的操作为将溶液升温结晶、________、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是_________________
__________________________________________________________。
(2)根据图②所示相关物质的溶解度曲线。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为将过硫酸钾粗产品溶于适量水中,________________________________________________________________________________________________________________________________________________,干燥。
(3)根据图①中红矾钠(Na2Cr2O7·2H2O)和Na2SO4 的溶解度曲线。 从Na2Cr2O7和Na2SO4的混合溶液中提取红矾钠的操作为先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是_______________________
___________________________________________________________;
然后将滤液________,从而析出红矾钠。
[答案] (1)趁热过滤 防止形成Na2SO4·10H2O (2)在不超过80 ℃的条件下加热浓缩,冷却结晶,过滤,用冷水洗涤 (3)有利于Na2SO4结晶析出,又能防止Na2Cr2O7·2H2O结晶析出 冷却结晶
过滤操作中常考的热点问题
(1)如果蒸发结晶得到晶体,应趁热过滤,防止冷却时其他晶体析出。
(2)沉淀洗涤操作:向漏斗中注蒸馏水至水没过沉淀,待洗涤液滤出,重复2~3次。
(3)沉淀洗净检验操作:取少许最后一次洗涤液于试管中,然后加入检验试剂,根据现象确定是否洗净。
知识点二 物质分离、提纯常用的化学方法
02
必备知识梳理
关键能力训练
1.化学分离、提纯法
方法 原理 典例
加热法 混合物中混有__________差的物质时,可直接加热,使__________差的物质分解而除去 食盐中混有氯化铵、纯碱中混有小苏打
热稳定性
热稳定性
方法 原理 典例
沉淀法 在混合物中加入某试剂,使其中的一种或多种以______形式分离出去的方法,若使用多种试剂将溶液中不同物质逐一______,这时应注意后加试剂能将先加试剂的过量部分除去,最后加的试剂不引入新的杂质
沉淀
沉淀
方法 原理 典例
转化法 不能通过一次反应达到分离目的,而要转化为其他物质才能分离,然后再将转化物质恢复为原物质 苯酚中混有硝基苯时,先加入氢氧化钠溶液后分液,再向苯酚钠溶液中通入CO2重新生成苯酚
酸碱法 被提纯物不与酸反应,而杂质可与酸反应,用酸作除杂试剂;被提纯物不与碱反应,而杂质可与碱反应,用碱作除杂试剂 用盐酸除去二氧化硅中的碳酸钙,用氢氧化钠溶液除去铁粉中的铝粉
方法 原理 典例
氧化还原法 混合物中含有还原性杂质,加入适当氧化剂使其氧化为被提纯物质;混合物中含有氧化性杂质,加入适当还原剂使其还原为被提纯物质 氯化铁中含有氯化亚铁杂质可通入氯气,将氯化亚铁转化为氯化铁;氯化亚铁中含有氯化铁杂质可加入铁粉,振荡过滤,即可除去氯化铁
调节pH法 利用某些物质沉淀的pH范围不同,采取一定措施调节溶液pH,使某些物质沉淀进行分离 CuCl2溶液中含有Fe3+杂质可以加入CuO调节pH约为3时使Fe3+沉淀完全
电解法 利用电解原理除去杂质 粗铜作阳极、纯铜作阴极,硫酸铜作电解质溶液
2.化学分离和提纯物质的原则
不增 提纯过程中不增加新的杂质
不减 不减少被提纯的物质
易分离 被提纯物质与杂质容易分离
易复原 被提纯物质要易复原
三必须 一、除杂试剂必须过量;二、过量试剂必须除尽(因为过量试剂带入新的杂质);三、必须选最佳除杂途径
除去下列常见物质中的杂质,完成表格:
序号 原物质 所含杂质 除杂质试剂 主要操作方法
① N2 O2 ________ 固体吸收气体
② CO CO2 ________或_____ ________或固体吸收气体
③ CO2 CO ________ 用固体转化气体
序号 原物质 所含杂质 除杂质试剂 主要操作方法
④ CO2 HCl ________ ________
⑤ Cl2 HCl ________ ________
⑥ 碳粉 CuO ________ ________
⑦ Fe2O3 Al2O3 ________ ________
⑧ NaHCO3溶液 Na2CO3 ________ 加酸转化
序号 原物质 所含杂质 除杂质试剂 主要操作方法
⑨ FeCl3溶液 FeCl2 ________ 加氧化剂转化
⑩ FeCl2溶液 FeCl3 ________ 加还原剂转化
MgCl2溶液 FeCl3 ________ ________
NaCl晶体 NH4Cl ________
乙酸乙酯 乙酸 ________ ________
[答案] ①灼热的铜网 ②NaOH溶液 碱石灰 洗气 ③灼热的CuO ④饱和NaHCO3溶液 洗气 ⑤饱和食盐水 洗气 ⑥稀酸(如稀盐酸) 过滤 ⑦过量NaOH溶液 过滤 ⑧CO2 ⑨Cl2 ⑩Fe MgO 过滤 加热分解 饱和Na2CO3溶液 分液
1.下列实验操作能达到相应实验目的的是( )
选项 实验操作 实验目的
A 向FeCl3、CuCl2的混合溶液中加入足量铁粉,然后过滤 提纯FeCl3
B 向含有Br2的苯中加入适量的NaOH溶液,然后充分振荡、静置、分液 除去杂质Br2
C 将含有少量NaCl杂质的KNO3固体溶于水,然后蒸发结晶 提纯KNO3
D 向MgCl2、AlCl3混合溶液中加入过量的NaOH溶液,过滤后将沉淀溶于适量的盐酸;向滤液中加入适量盐酸 分离MgCl2、AlCl3
B [A项,向FeCl3、CuCl2的混合溶液中加入足量铁粉,FeCl3会和Fe反应生成FeCl2,错误;B项,Br2和NaOH溶液反应生成易溶于水的NaBr和NaBrO,充分振荡、静置、分液可以除去杂质Br2,正确;C项,KNO3的溶解度随温度升高变化较大,而NaCl的溶解度受温度影响不大,要提纯KNO3,将含有少量NaCl杂质的KNO3固体溶于水,蒸发浓缩、冷却结晶,然后过滤即可得较纯净的KNO3,错误;D项,滤液中含有NaCl,得不到纯净的AlCl3溶液,错误。]
2.(2022·济宁模拟)下列有关实验的说法错误的是( )
A.取5 mL 0.1 mol·L-1 KI溶液,加入1 mL 0.1 mol·L-1 FeCl3溶液,萃取分离出碘单质后,向溶液中滴加5~6滴15% KSCN溶液变红,说明Fe3+并未完全转化为Fe2+
B.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低
C.氯气和甲烷体积比为1∶1的混合气体,光照一段时间后瓶壁上有油状液滴附着
D.在苯与液溴制备溴苯的实验中,溴苯提纯步骤:水洗、用10%的氢氧化钠溶液洗涤、水洗、分液、用干燥剂干燥、蒸馏
B [蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,收集到的馏分沸点偏高,B错误。]
3.国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)发电玻璃被誉为“挂在墙上的油田”。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH。
Fe3+ Fe2+ Cu2+
开始沉淀 2.7 6.3 3.8
完全沉淀 3.2 8.3 5.0
下列说法错误的是( )
A.调节pH=5目的是除去Fe和Cu等杂质元素
B.“滤渣2”主要成分为MnO2
C.“置换”后滤液溶质主要成分是ZnSO4
D.“熔炼”过程可利用Cd与Na2ZnO2的密度差异将二者分离
AB [根据流程图,镉废渣加入硫酸溶解生成多种硫酸盐,加入石灰乳调节pH=5,滤渣1为Cu(OH)2和CaSO4;在滤液中加入KMnO4,把Fe2+氧化为Fe(OH)3沉淀、把Mn2+氧化为MnO2,滤渣2为Fe(OH)3和MnO2;滤液中加入锌置换出Cd,得到海绵镉,其中混有过量的锌,在“熔炼”中用氢氧化钠溶解过量的锌,得到Cd和Na2ZnO2,利用二者的密度差异可将其分离。调节pH=5,主要目的为除去杂质元素Cu,A错误;滤渣2主要成分为MnO2、Fe(OH)3,B错误;滤液中加入锌置换出Cd,滤液溶质主要成分是ZnSO4,C正确;根据分析可知,D正确。]
4.现需要纯净的氯化钠溶液,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体。某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案:
(1)操作①中发生反应的化学方程式是___________________________
_____________________________________________________________________________________________________________________。
(2)操作②中BaCl2溶液能否改用硝酸钡溶液________(填“能”或“不能”)。如果能,下一空不需要回答;如果不能,请说明理由:______
_____________________________________________________________
__________________________________________________________。
(3)操作③的目的是____________________________________________
__________________________________________________________。
(4)操作④的目的是_____________________________________________
___________________________________________________________。
[答案] (1)NH4HCO3 NH3↑+CO2↑+H2O (2)不能 选用Ba(NO3)2溶液会引入新的杂质离子 (3)除去过量的Ba2+ (4)除去溶解在溶液中的CO2和HCl
真题感悟·明确考向
03
1.(2022·山东等级考)已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是( )
A.苯胺既可与盐酸也可与NaOH溶液反应
B.由①、③分别获取相应粗品时可采用相同的操作方法
C.苯胺、甲苯、苯甲酸粗品依次由①、②、③获得
D.①、②、③均为两相混合体系
1
3
2
C [由题给流程可知,向甲苯、苯胺、苯甲酸的混合溶液中加入盐酸,盐酸将微溶于水的苯胺转化为易溶于水的苯胺盐酸盐,分液得到水相Ⅰ和有机相Ⅰ;向水相中加入氢氧化钠溶液将苯胺盐酸盐转化为苯胺,分液得到苯胺粗品①;向有机相中加入水洗涤除去混有的盐酸,分液得到废液和有机相Ⅱ,向有机相Ⅱ中加入碳酸钠溶液将微溶于水的苯甲酸转化为易溶于水的苯甲酸钠,分液得到甲苯粗品②和水相Ⅱ;向水相Ⅱ中加入盐酸,将苯甲酸钠转化为苯甲酸,经结晶或重结晶、过滤、洗涤得到苯甲酸粗品③。苯胺分子中含有的氨基能与盐酸反应,但不能与氢氧化钠溶液反应,故A错误;由分析可知,得到苯胺粗品①的分离方法为分液,得到苯甲酸粗品③的分离方法为结晶或重结晶、过滤、洗涤,获取两者的操作方法不同,故B错误;苯胺粗品、甲苯粗品、苯甲酸粗品依次由①、②、③获得,故C正确;①、②为液相,③为固相,都不是两相混合体系,故D错误。]
1
3
2
2.(2022·湖南选择性考试,T7)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
1
3
2
1
3
2
C [陶瓷中的SiO2能与HF反应,A项正确;喷淋法能使溶液与烟气充分接触,提高吸收效率,B项正确;根据流程梳理知,C项错误;滤液中含有Na2CO3,可用作吸收塔中的吸收剂,D项正确。]
3.(2022·全国甲卷,节选改编)硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)溶解回流装置如图所示,回流前无需加入沸石,其原因是________________
____。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的 。若气雾上升过高,可采取的措施是___________________________________________________
_________________________________________________________________________________________。
1
3
2
(2)回流时间不宜过长,原因是____________________________。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为________(填标号)。
A.①②③ B.③①② C.②①③ D.①③②
1
3
2
(3)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是______________________________。热过滤除去的杂质为________。若滤纸上析出大量晶体,则可能的原因是_________________________
___________。
(4)滤液冷却、结晶、过滤,晶体用少量________洗涤,干燥,得到Na2S·xH2O。
1
3
2
[解析] (1)回流前无需加入沸石,说明有物质可以代替沸石,由题干信息可知,粗品中含有煤灰、重金属硫化物等固体,具有“沸石”的作用。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的 ,若气雾上升过高,需要将温度降下来,故可采取的措施是停止加热,加快冷凝管内冷凝水的流速。(2)回流时间不宜过长,原因是避免Na2S接触空气被氧化。回流结束后,应将反应液的温度降下来,故先停止加热,移去水浴,最后关闭冷凝水。(3)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是防止液体沿烧杯内壁流下过程中与空气接触使Na2S被氧化。煤灰、重金属硫化物难溶于热乙醇,可以通过热过滤除去。若滤纸上析出大量晶体,则可能的原因是热过滤时漏斗的温度过低。(4)滤液冷却、结晶、过滤,晶体用少量常温下的乙醇(Na2S的溶解少、损失少)洗涤,干燥后,得到Na2S·xH2O。
1
3
2
[答案] (1)粗品中含有难溶于乙醇的煤灰、重金属硫化物等固体,有“沸石”作用 停止加热,加快冷凝管内冷凝水的流速 (2)避免Na2S接触空气被氧化 D (3)防止液体沿烧杯内壁流下过程中与空气接触使Na2S被氧化 煤灰、重金属硫化物 热过滤时漏斗的温度过低 (4)常温下的乙醇
1
3
2
谢谢观看 THANK YOU!
同课章节目录
