化学人教版(2019)必修第一册4.1.3认识元素周期表(共56张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.3认识元素周期表(共56张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 142.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 15:18:22 | ||
图片预览






文档简介
(共56张PPT)
新
教
材
原子结构和元素周期律
第一节
第3课时 元 素 周 期 表
丰富多彩的物质世界是由100多种元素组成的,这些元素有着各自不同的性质,但研究发现,某些元素之间又存在必然的联系。
为了更好的认识这100多种元素,科学家编制了元素周期表。
二:元素周期表 P88-89
首先,明确一个概念——原子序数
原子序数:
为了研究元素之间的联系,我们把不同的元素按核电荷数由小到大的顺序对其进行编号,这种编号就叫原子序数
(实际是人为的一种编号,就如我们的学号)
举例:
H
核电荷数为1,最小
He
→ → 编为1号元素
核电荷数为2,次小
→ → 编为2号元素
Li
核电荷数为3,再次
→ → 编为3号元素
┄ ┄ ┄
规律:
原子序数=
核电荷数
=质子数=核外电子数
阅读教材p88-89 ,回答问题
门捷列夫周期表的编排依据?
现行元素周期表的编排依据?
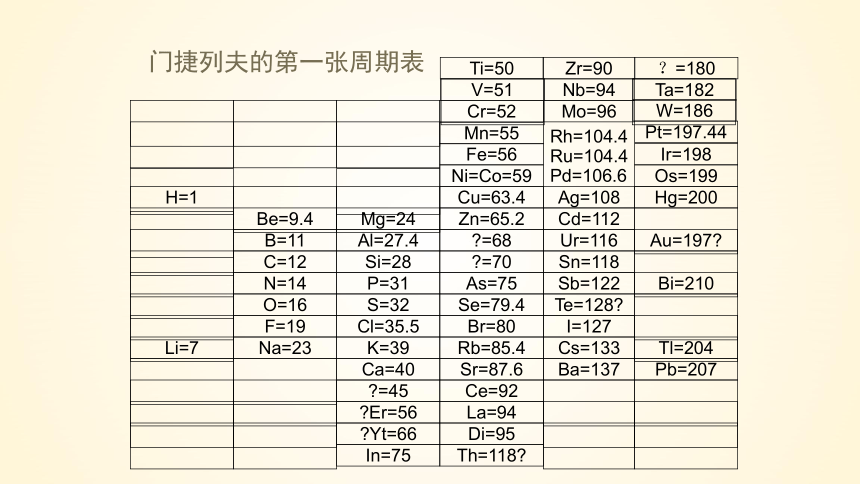
将元素按照相对原子质量由小到大依次排列
元素的原子序数由小到大依次排列
1869年 俄国化学家
Ti=50
Zr=90
?=180
V=51
Nb=94
Ta=182
Cr=52
Mo=96
W=186
Mn=55
Rh=104.4
Pt=197.44
Fe=56
Ru=104.4
Ir=198
Ni=Co=59
Pd=106.6
Os=199
H=1
Cu=63.4
Ag=108
Hg=200
Be=9.4
Mg=24
Zn=65.2
Cd=112
B=11
Al=27.4
=68
Ur=116
Au=197
C=12
Si=28
=70
Sn=118
N=14
P=31
As=75
Sb=122
Bi=210
O=16
S=32
Se=79.4
Te=128
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4
Cs=133
Tl=204
Ca=40
Sr=87.6
Ba=137
Pb=207
=45
Ce=92
Er=56
La=94
Yt=66
Di=95
In=75
Th=118
门捷列夫的第一张周期表
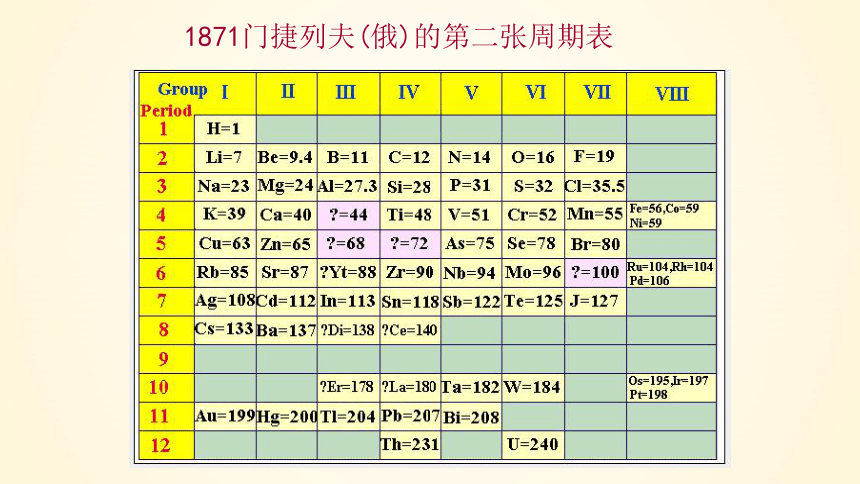
1871门捷列夫(俄)的第二张周期表
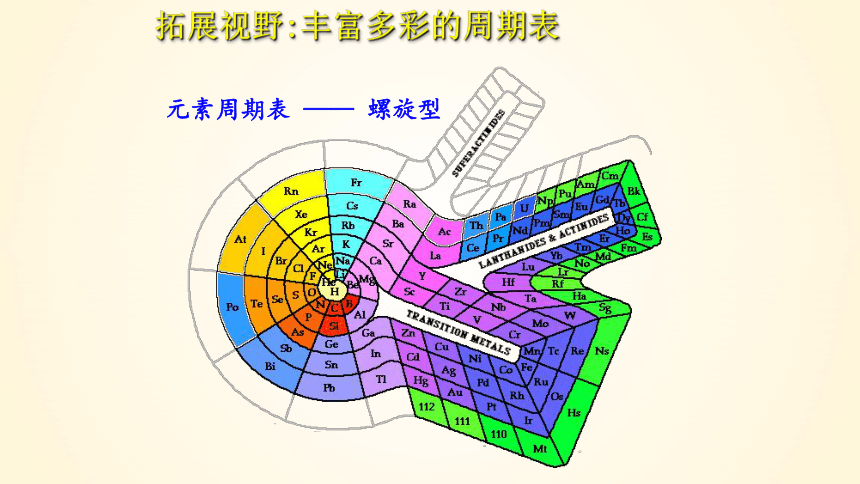
元素周期表 —— 螺旋型
拓展视野:丰富多彩的周期表
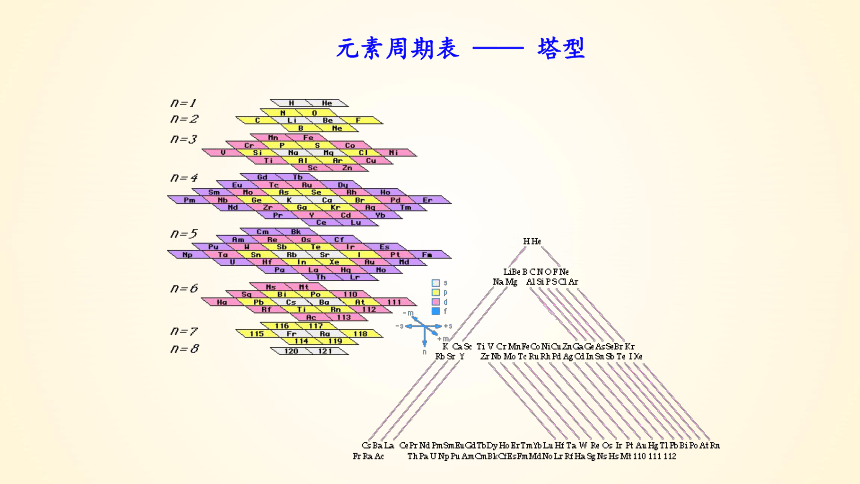
元素周期表 —— 塔型
元素周期表 —— 扇型
元素周期表 —— 性质版
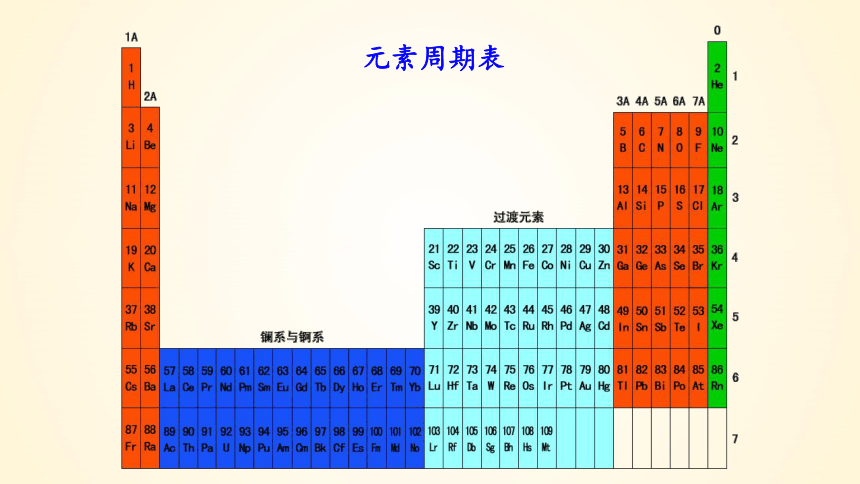
元素周期表
元素单质类元素周期表
(一) 元素周期表的编排依据
画出1~18号元素的原子结构示意图
横行:电子层相同
纵行:最外层电子相同
,得到什么结论?
把电子层数相同的元素按原子序数递增顺序从左到右排列。
把最外层电子数相同的元素按电子层数递增顺序从上而下排列。
1、横行:
2、纵行:
总共 个横行、 个纵行
7
18
元素周期表中,每一个横行称作一个“周期”,
每一个纵行或几个纵行称作“族”
(一) 元素周期表的编排依据
1
2
3
4
5
6
7
短周期
长周期
2
8
8
18
18
32
1、周期
周期表的结构
32
种类
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
第7周期:32种元素
(镧系元素:共15 种元素)
(锕系元素:共15 种元素)
(横行)
几 点 说 明:
3. 第六周期镧系元素和第七周期锕系元素各15种,它们原子电子层结构和性质相似,为了使元素周期表的结构紧凑,各放入同一个格子内,另外分列于周期表的下面
4. 锕系元素中92号U(铀)以后的元素,多为人工核反应制得,称为“超铀元素”,且均为放射性元素。
1.周期序数 = 原子核外电子层数
2. 短周期元素:即指1→18号元素
每个纵行的上面的罗马数字I、II…及A、B、0等字样分别表示什么意思?
0族元素都是什么种类的元素?
第VIII族有几个纵行?
从IIIB到IIB之间的元素名称,偏旁有什么特点?说明什么?
主族序数与最外层电子数的关系?
讨论
2、族
零族
副族
IA 主族
IIA
IIIA
IVA
VA
VIA
VIIA
7个
IB
IIB
IIIB
IVB
VB
VIB
VIIB
第VIII族
8个
用罗马数字表示族序数
2、族
(2)族的分类
由稀有气体元素构成
0族:
[由8、9、10三个纵行构成(属于副族,但不标注B)]
第Ⅷ族
由长周期元素构成
副族:
由短周期元素和长周期元素
共同构成(稀有气体元素除外)
主族:
族
(7个)
(8个)
(1个)
表示方法:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
表示方法:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
主族元素族序数 = 原子最外层电子数
过渡金属
18个纵行,16个族
符号:A
符号:B
一八又一零,二、三主副分
1
2
3
4
5
6
7
在下表中用实线补全元素周期表的边界
镧系
锕系
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
标出族序数及镧系、锕系的位置
ⅢB
ⅠA
ⅦA
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
一八又一零,二、三主副分
0
ⅣA
ⅤA
ⅥA
8 9 10
过渡金属
几 点 说 明:
1.主族序数 = 原子最外层电子数
2.八个副族 共60多种元素,统称为过渡元素且全部为金属,又称为过渡金属。
①最外层电子数:1~2个。
②在反应中,除最外层电子参加反应外,内层电子往往也会参加反应。
过渡金属
3. 含元素种数最多的族是 。
第IIIB族
(包括镧系、锕系元素和钪、钇共32种)
4.有些族还有特别的名称。
第ⅠA族:碱金属元素(H除外)
第ⅦA族:
卤族元素
副族元素的编排原则比较复杂,高二再学
族的分类
包含元素
表 示
个 数
ⅠA,ⅡA等 ⅠB, ⅡB… Ⅷ族等 0
周期
元素种数
分类 一 二 三 四 五 六 七
2
8
8
18
18
32
短周期
长周期
1.周期(三短、四长)
(32)
周期序数 = 电子层数
主族
副族
零族
长、短周期
长周期
稀有气体
7
8
1
2.族(七主、八副、一零)
主族序数 = 最外层电子数
非金属元素
金属元素
镧系和锕系元素
碱金属元素
卤族元素
稀有气体元素
过渡元素
超铀元素——92号元素以后的各种元素,多数是人工进行核反应制得的元素。
1. 甲、乙是周期表中同主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x + 2 B. x + 4 C. x + 8 D. x + 18
B
规律:
同主族两种元素原子序数相差可能为2、8、18、32或它们的和
9F
+ 8
CI
17
+ 18
Br
35
+ 18
I
53
+ 32
At
85
2. 某元素原子最外电子层上只有两个电子( )
A、一定是金属元素
B、一定是ⅡA族元素
C、一定是过渡元素
D、可能是金属也可能不是金属元素
D
解析:最外层只有2个电子的元素可能是ⅡA族元素或稀有气体元素氦,
也可能是过渡元素,如:Zn、Cd、Sc(ⅢB)、Ti(ⅣB)等。
2、请说出Na、C、Al、S在周期表中的位置。
Na
第三周期第IA族
C
+6
2 4
第二周期第ⅣA族
规律:原子结构与元素周期表中位置的关系
周期序数 = 原子电子层数
主族元素族序数 = 原子最外层电子数
例:氯元素位于_________________
(1)表达
第七主族
第VII主族
第VIIA族
第III周期
第三周期
第三周期 第ⅦA 族
2.根据稀有气体的原子序数
1. 根据原子核外电子排布
(2)推断
√
√
×
×
×
——“0族定位法”
例:35 号元素位于第 周期 族
52 号元素位于第 周期 族
四
ⅦA
五
ⅥA
He Ne Ar Kr Xe Rn Og
一 二 三 四 五 六 七
各周期稀有气体:
稀有气体的
原子序数:
2
10
18
36
54
86
118
2.“0族定位法”
1. 根据原子核外电子排布
+35
2 8 18 7
+52
2 8 18 18 6
记住稀有气体原子核外电子排布
+ 2
2
+10
2 8
+18
2 8 8
+36
2 8 18 8
+54
2 8 18 18 8
+86
2 8 18 32 18 8
+118
2 8 18 32 32 18 8
He
Ne
Ar
Kr
Xe
Rn
118号
第ⅠA、ⅡA族的元素:
在上一周期稀有气体原子核外电子排布外加一电子层,电子数1或2
第ⅢA→ⅦA族的元素:
与同周期稀有气体原子核外电子排布相似,最外层电子改为3→7.
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
确定34号、55号、96号的元素在元素周期表中的位置
2
10
18
36
54
86
118
Se
34
55
Cs
96
ⅠA
ⅣA
ⅤA
ⅥA
1.已知a为ⅡA族元素,b是ⅢA族元素,它们的原子序数分别为m和n,且a,b为同一周期元素,下列关系式必定错误的是( )
A、n=m+10 B、n=m+1
C、n=m+11 D、n=m+25
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
规律一: 同周期ⅡA与ⅢA元素原子序数可能相差 ?
2
10
18
36
54
86
118
Se
34
55
Cs
1、
96
ⅠA
ⅣA
ⅤA
ⅥA
11、
25
10个格子
第2、3周期是1
第6、7周期是10+1+14=25
第4、 5周期是10 +1=11
1.已知a为ⅡA族元素,b是ⅢA族元素,它们的原子序数分别为m和n,且a,b为同一周期元素,下列关系式必定错误的是( )
A、n=m+10 B、n=m+1
C、n=m+11 D、n=m+25
A
×
2. A、B是同主族的相邻元素,A所在周期共有m种元素,B所在周期共有n种元素,且m < n。若A的原子序数为x,
则B的原子序数可能为( )
A、x - (m-n) B、x - (m+n) C、x + n D、x + m
A
B
x
┄┄
┄┄
m种
n种
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
2
10
18
36
54
86
118
Se
34
55
Cs
96
ⅠA
ⅣA
ⅤA
ⅥA
规律二:同一主族相邻上下两种原子序数之差?
第ⅠA、ⅡA:
下层原子序数=上层原子序数+上层元素种数
第ⅢA-----0族:
下层原子序数=上层原子序数+下层元素种数
12Mg
20Ca
16S
2. A、B是同主族的相邻元素,A所在周期共有m种元素,B所在周期共有n种元素,且m < n。若A的原子序数为x,
则B的原子序数可能为( )
A、x - (m-n) B、x - (m+n) C、x + n D、x + m
A
B
x
┄┄
┄┄
m种
n种
C D
第ⅠA、ⅡA:
x + m
第ⅢA-----0族:
x + n
①同周期ⅡA和ⅢA原子序数差为:
②同主族相邻的两周期的元素原子序数的差可能为:
总结相关序差规律
1、11、25。
2、8、18、32.
同主族
若A、B为同主族元素,A所在周期有m种元素,B所在周期有n种元素,A在B的上一周期,设A的原子序数为a。
若A、B为ⅠA族或ⅡA族(位于过渡元素左边的元素),则B的原子序数为 。
若A、B为ⅢA~ⅦA族(位于过渡元素右边的元素),则B的原子序数为 。
(a+m)
(a+n)
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
2
10
18
36
54
86
118
Se
34
55
Cs
在下表中用虚线补全过渡金属元素的边界
96
ⅠA
ⅣA
ⅤA
ⅥA
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
2
10
18
36
54
86
118
Se
34
55
Cs
在周期表中画出金属与非金属的分界线。
B
Al
Si
Ge
As
Sb
Te
Po
At
金
96
ⅠA
ⅣA
ⅤA
ⅥA
117
1、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
递进练习
2、第三周期第IVA族的元素原子序数是: ;
Na元素的原子序数为11,相邻的同族元素的原子序数是: ;
短周期元素中,族序数=周期序数的元素有: ;
族序数等于周期序数2倍的元素有: ;
周期序数=族序数2倍的有: 。
14
3、19
H、Be、Al
C、S
Li、Ca
递进练习
3、某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期
C.ⅣA族 D.ⅥA族
A C
递进练习
4.除第一、二、三周期外,主族元素的次外层上( )
A.都是8个电子
B.都是18个电子
C.有的是8个电子,有的是18个电子
D.可以有8、18或32个电子
C
递进练习
A C
递进练习
6.X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示,试回答:
(1)X元素单质的化学式是________。
(2)Z元素的原子结构示意图为_______。
(3)Y在元素周期表中的位置是______________。
He
He
一
二
三
F
S
+16
2 8
6
第二周期,第ⅦA族
递进练习
7.短周期元素A、B、C的位置如右图所示。已知B、C两种元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别 。
O、P、Cl
递进练习
8、A、B、C为元素周期表中相邻三种元素,A与B 同周期,A与C同主族。已知这三种元素原子序数之和为41,最外层电子数之和为19。由此可推知这三种元素分别是____________。
S、Cl、O
解法:相邻三元素(A、B同周期,A、C同主族)在周期表中的位置关系可能为:
由于最外层电子数不超过8,三种元素相邻,并且最外层的电子数之和为19,19÷3=6……1,说明A、C必为ⅥA族,而B在ⅦA族。
√
√
再由原子序数之和为41加以验证,可得A为硫(S),B为氯(Cl),C为氧(O)。
9.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为z,则这五种元素的核电荷数之和为 ( )
A. 5z+10 B. 5z
C. 5z+14 D. 5z+16
A
8
8
18
二
三
四
z
Z+1
Z-1
Z-8
Z+18
递进练习
10.A、B、C、D、E五种主族元素在元素周期表中的位置如图所示,已知E的原子序数为X,则五种元素的原子序数之和不可能为:
A .5X B .5X+10 C . 5X+14 D. 5X+25
D
X
X+1
X—1
① 若为2、3、4周期元素
则A为X-18,C为X+18。
五种元素的原子序数之和为5X+14
五种元素的原子序数之和为5X
则A为X-8,C为X+18。
8
8
18
ⅢA →ⅦA
② 若为3、4、5周期元素
8
18
18
③若为4、5、6周期元素
18
18
32
五种元素的原子序数之和为5X+10
则A为X-18,C为X+32。
11. 假设原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层不超过15个,而各电子层电子的最大容量仍为2n2个,若按此规律排布周期表,那么该周期表第三、四、五周期含有的元素种类分别有( )
A. 5、10、15 B. 8、18、18 C. 8、10、15 D. 9、12、15
C
解析:
第二、三、四、五周期最后一个原子的结构分别为:
+7
2 5
+15
2 8 5
+25
2 8 10 5
+40
2 8 15 10 5
递进练习
【 基本规律】
1.原子序数=核电荷数=质子数=核外电子数
2. 周期序数=电子层数
3.主族序数=最外层电子数
4.各周期的元素种数:2,8,8,18,18,32,32
5.稀有气体的原子序数:2,10,18,36,54,86,118
新
教
材
原子结构和元素周期律
第一节
第3课时 元 素 周 期 表
丰富多彩的物质世界是由100多种元素组成的,这些元素有着各自不同的性质,但研究发现,某些元素之间又存在必然的联系。
为了更好的认识这100多种元素,科学家编制了元素周期表。
二:元素周期表 P88-89
首先,明确一个概念——原子序数
原子序数:
为了研究元素之间的联系,我们把不同的元素按核电荷数由小到大的顺序对其进行编号,这种编号就叫原子序数
(实际是人为的一种编号,就如我们的学号)
举例:
H
核电荷数为1,最小
He
→ → 编为1号元素
核电荷数为2,次小
→ → 编为2号元素
Li
核电荷数为3,再次
→ → 编为3号元素
┄ ┄ ┄
规律:
原子序数=
核电荷数
=质子数=核外电子数
阅读教材p88-89 ,回答问题
门捷列夫周期表的编排依据?
现行元素周期表的编排依据?
将元素按照相对原子质量由小到大依次排列
元素的原子序数由小到大依次排列
1869年 俄国化学家
Ti=50
Zr=90
?=180
V=51
Nb=94
Ta=182
Cr=52
Mo=96
W=186
Mn=55
Rh=104.4
Pt=197.44
Fe=56
Ru=104.4
Ir=198
Ni=Co=59
Pd=106.6
Os=199
H=1
Cu=63.4
Ag=108
Hg=200
Be=9.4
Mg=24
Zn=65.2
Cd=112
B=11
Al=27.4
=68
Ur=116
Au=197
C=12
Si=28
=70
Sn=118
N=14
P=31
As=75
Sb=122
Bi=210
O=16
S=32
Se=79.4
Te=128
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4
Cs=133
Tl=204
Ca=40
Sr=87.6
Ba=137
Pb=207
=45
Ce=92
Er=56
La=94
Yt=66
Di=95
In=75
Th=118
门捷列夫的第一张周期表
1871门捷列夫(俄)的第二张周期表
元素周期表 —— 螺旋型
拓展视野:丰富多彩的周期表
元素周期表 —— 塔型
元素周期表 —— 扇型
元素周期表 —— 性质版
元素周期表
元素单质类元素周期表
(一) 元素周期表的编排依据
画出1~18号元素的原子结构示意图
横行:电子层相同
纵行:最外层电子相同
,得到什么结论?
把电子层数相同的元素按原子序数递增顺序从左到右排列。
把最外层电子数相同的元素按电子层数递增顺序从上而下排列。
1、横行:
2、纵行:
总共 个横行、 个纵行
7
18
元素周期表中,每一个横行称作一个“周期”,
每一个纵行或几个纵行称作“族”
(一) 元素周期表的编排依据
1
2
3
4
5
6
7
短周期
长周期
2
8
8
18
18
32
1、周期
周期表的结构
32
种类
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
第7周期:32种元素
(镧系元素:共15 种元素)
(锕系元素:共15 种元素)
(横行)
几 点 说 明:
3. 第六周期镧系元素和第七周期锕系元素各15种,它们原子电子层结构和性质相似,为了使元素周期表的结构紧凑,各放入同一个格子内,另外分列于周期表的下面
4. 锕系元素中92号U(铀)以后的元素,多为人工核反应制得,称为“超铀元素”,且均为放射性元素。
1.周期序数 = 原子核外电子层数
2. 短周期元素:即指1→18号元素
每个纵行的上面的罗马数字I、II…及A、B、0等字样分别表示什么意思?
0族元素都是什么种类的元素?
第VIII族有几个纵行?
从IIIB到IIB之间的元素名称,偏旁有什么特点?说明什么?
主族序数与最外层电子数的关系?
讨论
2、族
零族
副族
IA 主族
IIA
IIIA
IVA
VA
VIA
VIIA
7个
IB
IIB
IIIB
IVB
VB
VIB
VIIB
第VIII族
8个
用罗马数字表示族序数
2、族
(2)族的分类
由稀有气体元素构成
0族:
[由8、9、10三个纵行构成(属于副族,但不标注B)]
第Ⅷ族
由长周期元素构成
副族:
由短周期元素和长周期元素
共同构成(稀有气体元素除外)
主族:
族
(7个)
(8个)
(1个)
表示方法:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
表示方法:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
主族元素族序数 = 原子最外层电子数
过渡金属
18个纵行,16个族
符号:A
符号:B
一八又一零,二、三主副分
1
2
3
4
5
6
7
在下表中用实线补全元素周期表的边界
镧系
锕系
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
标出族序数及镧系、锕系的位置
ⅢB
ⅠA
ⅦA
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
一八又一零,二、三主副分
0
ⅣA
ⅤA
ⅥA
8 9 10
过渡金属
几 点 说 明:
1.主族序数 = 原子最外层电子数
2.八个副族 共60多种元素,统称为过渡元素且全部为金属,又称为过渡金属。
①最外层电子数:1~2个。
②在反应中,除最外层电子参加反应外,内层电子往往也会参加反应。
过渡金属
3. 含元素种数最多的族是 。
第IIIB族
(包括镧系、锕系元素和钪、钇共32种)
4.有些族还有特别的名称。
第ⅠA族:碱金属元素(H除外)
第ⅦA族:
卤族元素
副族元素的编排原则比较复杂,高二再学
族的分类
包含元素
表 示
个 数
ⅠA,ⅡA等 ⅠB, ⅡB… Ⅷ族等 0
周期
元素种数
分类 一 二 三 四 五 六 七
2
8
8
18
18
32
短周期
长周期
1.周期(三短、四长)
(32)
周期序数 = 电子层数
主族
副族
零族
长、短周期
长周期
稀有气体
7
8
1
2.族(七主、八副、一零)
主族序数 = 最外层电子数
非金属元素
金属元素
镧系和锕系元素
碱金属元素
卤族元素
稀有气体元素
过渡元素
超铀元素——92号元素以后的各种元素,多数是人工进行核反应制得的元素。
1. 甲、乙是周期表中同主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x + 2 B. x + 4 C. x + 8 D. x + 18
B
规律:
同主族两种元素原子序数相差可能为2、8、18、32或它们的和
9F
+ 8
CI
17
+ 18
Br
35
+ 18
I
53
+ 32
At
85
2. 某元素原子最外电子层上只有两个电子( )
A、一定是金属元素
B、一定是ⅡA族元素
C、一定是过渡元素
D、可能是金属也可能不是金属元素
D
解析:最外层只有2个电子的元素可能是ⅡA族元素或稀有气体元素氦,
也可能是过渡元素,如:Zn、Cd、Sc(ⅢB)、Ti(ⅣB)等。
2、请说出Na、C、Al、S在周期表中的位置。
Na
第三周期第IA族
C
+6
2 4
第二周期第ⅣA族
规律:原子结构与元素周期表中位置的关系
周期序数 = 原子电子层数
主族元素族序数 = 原子最外层电子数
例:氯元素位于_________________
(1)表达
第七主族
第VII主族
第VIIA族
第III周期
第三周期
第三周期 第ⅦA 族
2.根据稀有气体的原子序数
1. 根据原子核外电子排布
(2)推断
√
√
×
×
×
——“0族定位法”
例:35 号元素位于第 周期 族
52 号元素位于第 周期 族
四
ⅦA
五
ⅥA
He Ne Ar Kr Xe Rn Og
一 二 三 四 五 六 七
各周期稀有气体:
稀有气体的
原子序数:
2
10
18
36
54
86
118
2.“0族定位法”
1. 根据原子核外电子排布
+35
2 8 18 7
+52
2 8 18 18 6
记住稀有气体原子核外电子排布
+ 2
2
+10
2 8
+18
2 8 8
+36
2 8 18 8
+54
2 8 18 18 8
+86
2 8 18 32 18 8
+118
2 8 18 32 32 18 8
He
Ne
Ar
Kr
Xe
Rn
118号
第ⅠA、ⅡA族的元素:
在上一周期稀有气体原子核外电子排布外加一电子层,电子数1或2
第ⅢA→ⅦA族的元素:
与同周期稀有气体原子核外电子排布相似,最外层电子改为3→7.
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
确定34号、55号、96号的元素在元素周期表中的位置
2
10
18
36
54
86
118
Se
34
55
Cs
96
ⅠA
ⅣA
ⅤA
ⅥA
1.已知a为ⅡA族元素,b是ⅢA族元素,它们的原子序数分别为m和n,且a,b为同一周期元素,下列关系式必定错误的是( )
A、n=m+10 B、n=m+1
C、n=m+11 D、n=m+25
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
规律一: 同周期ⅡA与ⅢA元素原子序数可能相差 ?
2
10
18
36
54
86
118
Se
34
55
Cs
1、
96
ⅠA
ⅣA
ⅤA
ⅥA
11、
25
10个格子
第2、3周期是1
第6、7周期是10+1+14=25
第4、 5周期是10 +1=11
1.已知a为ⅡA族元素,b是ⅢA族元素,它们的原子序数分别为m和n,且a,b为同一周期元素,下列关系式必定错误的是( )
A、n=m+10 B、n=m+1
C、n=m+11 D、n=m+25
A
×
2. A、B是同主族的相邻元素,A所在周期共有m种元素,B所在周期共有n种元素,且m < n。若A的原子序数为x,
则B的原子序数可能为( )
A、x - (m-n) B、x - (m+n) C、x + n D、x + m
A
B
x
┄┄
┄┄
m种
n种
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
2
10
18
36
54
86
118
Se
34
55
Cs
96
ⅠA
ⅣA
ⅤA
ⅥA
规律二:同一主族相邻上下两种原子序数之差?
第ⅠA、ⅡA:
下层原子序数=上层原子序数+上层元素种数
第ⅢA-----0族:
下层原子序数=上层原子序数+下层元素种数
12Mg
20Ca
16S
2. A、B是同主族的相邻元素,A所在周期共有m种元素,B所在周期共有n种元素,且m < n。若A的原子序数为x,
则B的原子序数可能为( )
A、x - (m-n) B、x - (m+n) C、x + n D、x + m
A
B
x
┄┄
┄┄
m种
n种
C D
第ⅠA、ⅡA:
x + m
第ⅢA-----0族:
x + n
①同周期ⅡA和ⅢA原子序数差为:
②同主族相邻的两周期的元素原子序数的差可能为:
总结相关序差规律
1、11、25。
2、8、18、32.
同主族
若A、B为同主族元素,A所在周期有m种元素,B所在周期有n种元素,A在B的上一周期,设A的原子序数为a。
若A、B为ⅠA族或ⅡA族(位于过渡元素左边的元素),则B的原子序数为 。
若A、B为ⅢA~ⅦA族(位于过渡元素右边的元素),则B的原子序数为 。
(a+m)
(a+n)
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
2
10
18
36
54
86
118
Se
34
55
Cs
在下表中用虚线补全过渡金属元素的边界
96
ⅠA
ⅣA
ⅤA
ⅥA
1
2
3
4
5
6
7
镧系
锕系
8
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
112
ⅢB
ⅦA
0
ⅦB
Ⅷ
ⅢA
ⅡA
ⅠB ⅡB
ⅣB
ⅤB
ⅥB
2
10
18
36
54
86
118
Se
34
55
Cs
在周期表中画出金属与非金属的分界线。
B
Al
Si
Ge
As
Sb
Te
Po
At
金
96
ⅠA
ⅣA
ⅤA
ⅥA
117
1、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
递进练习
2、第三周期第IVA族的元素原子序数是: ;
Na元素的原子序数为11,相邻的同族元素的原子序数是: ;
短周期元素中,族序数=周期序数的元素有: ;
族序数等于周期序数2倍的元素有: ;
周期序数=族序数2倍的有: 。
14
3、19
H、Be、Al
C、S
Li、Ca
递进练习
3、某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期
C.ⅣA族 D.ⅥA族
A C
递进练习
4.除第一、二、三周期外,主族元素的次外层上( )
A.都是8个电子
B.都是18个电子
C.有的是8个电子,有的是18个电子
D.可以有8、18或32个电子
C
递进练习
A C
递进练习
6.X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示,试回答:
(1)X元素单质的化学式是________。
(2)Z元素的原子结构示意图为_______。
(3)Y在元素周期表中的位置是______________。
He
He
一
二
三
F
S
+16
2 8
6
第二周期,第ⅦA族
递进练习
7.短周期元素A、B、C的位置如右图所示。已知B、C两种元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别 。
O、P、Cl
递进练习
8、A、B、C为元素周期表中相邻三种元素,A与B 同周期,A与C同主族。已知这三种元素原子序数之和为41,最外层电子数之和为19。由此可推知这三种元素分别是____________。
S、Cl、O
解法:相邻三元素(A、B同周期,A、C同主族)在周期表中的位置关系可能为:
由于最外层电子数不超过8,三种元素相邻,并且最外层的电子数之和为19,19÷3=6……1,说明A、C必为ⅥA族,而B在ⅦA族。
√
√
再由原子序数之和为41加以验证,可得A为硫(S),B为氯(Cl),C为氧(O)。
9.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为z,则这五种元素的核电荷数之和为 ( )
A. 5z+10 B. 5z
C. 5z+14 D. 5z+16
A
8
8
18
二
三
四
z
Z+1
Z-1
Z-8
Z+18
递进练习
10.A、B、C、D、E五种主族元素在元素周期表中的位置如图所示,已知E的原子序数为X,则五种元素的原子序数之和不可能为:
A .5X B .5X+10 C . 5X+14 D. 5X+25
D
X
X+1
X—1
① 若为2、3、4周期元素
则A为X-18,C为X+18。
五种元素的原子序数之和为5X+14
五种元素的原子序数之和为5X
则A为X-8,C为X+18。
8
8
18
ⅢA →ⅦA
② 若为3、4、5周期元素
8
18
18
③若为4、5、6周期元素
18
18
32
五种元素的原子序数之和为5X+10
则A为X-18,C为X+32。
11. 假设原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层不超过15个,而各电子层电子的最大容量仍为2n2个,若按此规律排布周期表,那么该周期表第三、四、五周期含有的元素种类分别有( )
A. 5、10、15 B. 8、18、18 C. 8、10、15 D. 9、12、15
C
解析:
第二、三、四、五周期最后一个原子的结构分别为:
+7
2 5
+15
2 8 5
+25
2 8 10 5
+40
2 8 15 10 5
递进练习
【 基本规律】
1.原子序数=核电荷数=质子数=核外电子数
2. 周期序数=电子层数
3.主族序数=最外层电子数
4.各周期的元素种数:2,8,8,18,18,32,32
5.稀有气体的原子序数:2,10,18,36,54,86,118
