3.2.4酸碱中和滴定课件(共30页)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.4酸碱中和滴定课件(共30页)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 11:02:11 | ||
图片预览








文档简介
(共30张PPT)
第三章 水溶液中的离子反应与平衡
第二节 电离平衡
第四课时 酸碱中和滴定
滴定:
一种定量分析的手段
通过两种溶液的定量反应来确定某种溶液的浓度
一、酸碱中和滴定
利用酸碱中和反应
用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
H+ + OH- = H2O
一、酸碱中和滴定
利用酸碱中和反应;用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
(一)中和反应的实质:H+ + OH- = H2O
n(H+)=n(OH-)
若是一元酸和一元碱反应: c酸·V酸 = c碱·V碱
酸式滴定管、碱式滴定管、滴定管夹、铁架台、烧杯、锥形瓶等
(二)滴定主要仪器
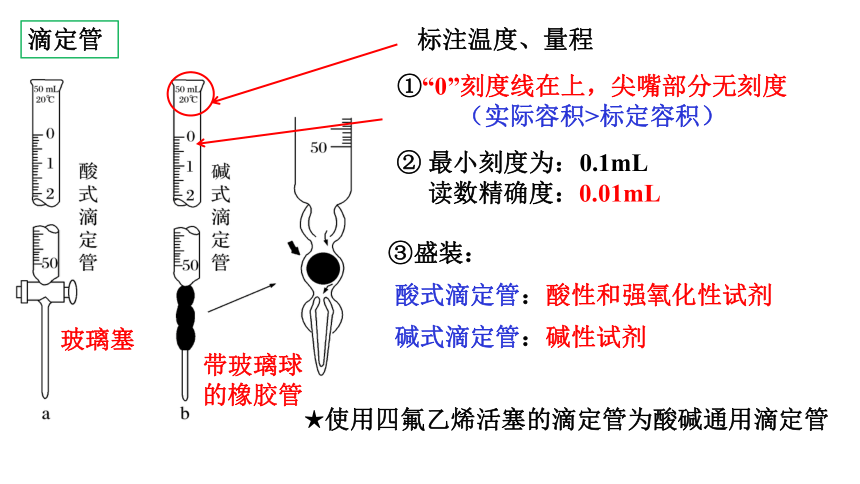
玻璃塞
带玻璃球的橡胶管
标注温度、量程
①“0”刻度线在上,尖嘴部分无刻度
(实际容积>标定容积)
③盛装:
酸式滴定管:酸性和强氧化性试剂
碱式滴定管:碱性试剂
② 最小刻度为:0.1mL
读数精确度:0.01mL
滴定管
★使用四氟乙烯活塞的滴定管为酸碱通用滴定管
【练习】1、50ml的滴定管盛有溶液,液面恰好在20.0处,若把滴定管中溶液全部排出,则体积( )
A、等于30 B、等于20 C、大于30 D、小于30
C
2、下列所述仪器“0”刻度位置正确的是( )
A.在量筒的上端 B.在滴定管上端
C.容量瓶上端 D.在托盘天平刻度尺的右边
B
3、量取25.00mL,KMnO4溶液可选用仪器( )
A.50mL量筒 B.100mL量筒
C.50mL酸式滴定管 D.50mL碱式滴定管
C
①查漏:使用前先检查滴定管活塞是否漏水。
②润洗:滴定管在加入反应液之前,先用蒸馏水洗涤干净,然后分别用所要盛装的溶液润洗2~3遍。(装待测液的锥形瓶不需润洗)
③装液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻
度线以上2~3mL处。
④调液面:调节活塞,赶出气泡,使液面处于“0”刻度或以下某刻度,读数并记录。
滴定前排出尖嘴处的气泡
酸式滴定管→快速放液;
碱式滴定管→橡皮管向上翘起
(三)滴定管的使用方法
(四)滴定的实验操作
(1)滴定前的准备
①滴定管:
查漏
②锥形瓶:水洗
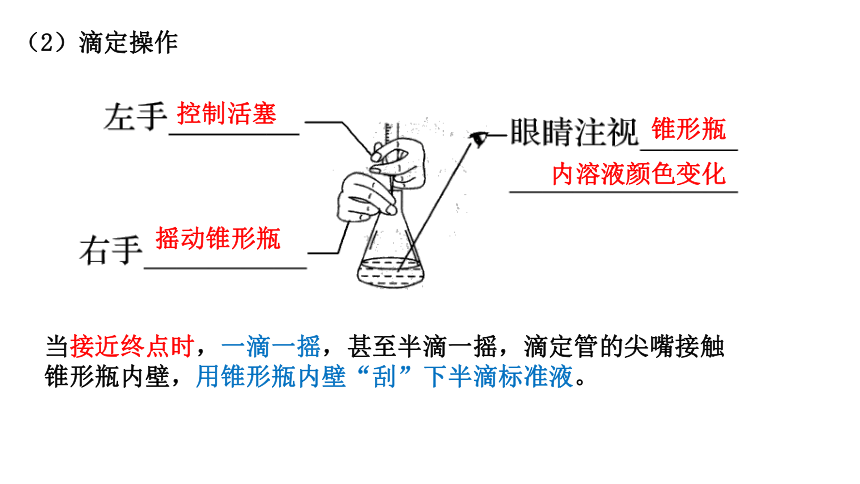
(2)滴定操作
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
当接近终点时,一滴一摇,甚至半滴一摇,滴定管的尖嘴接触锥形瓶内壁,用锥形瓶内壁“刮”下半滴标准液。
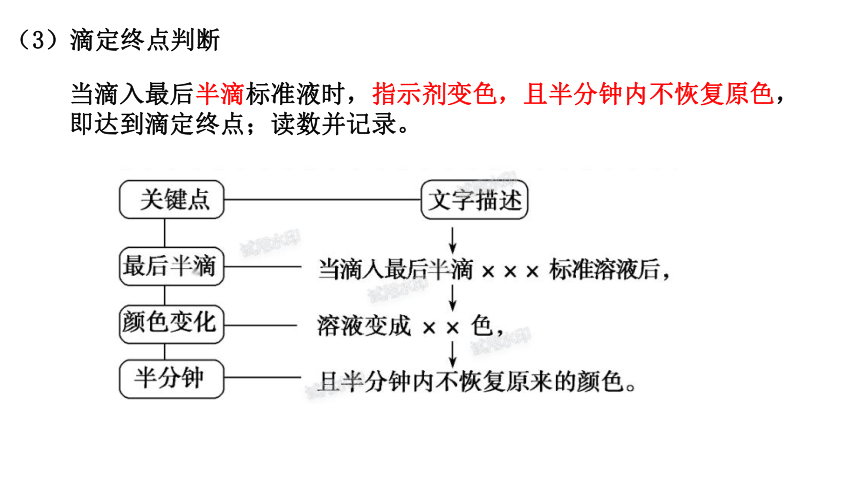
(3)滴定终点判断
当滴入最后半滴标准液时,指示剂变色,且半分钟内不恢复原色,即达到滴定终点;读数并记录。
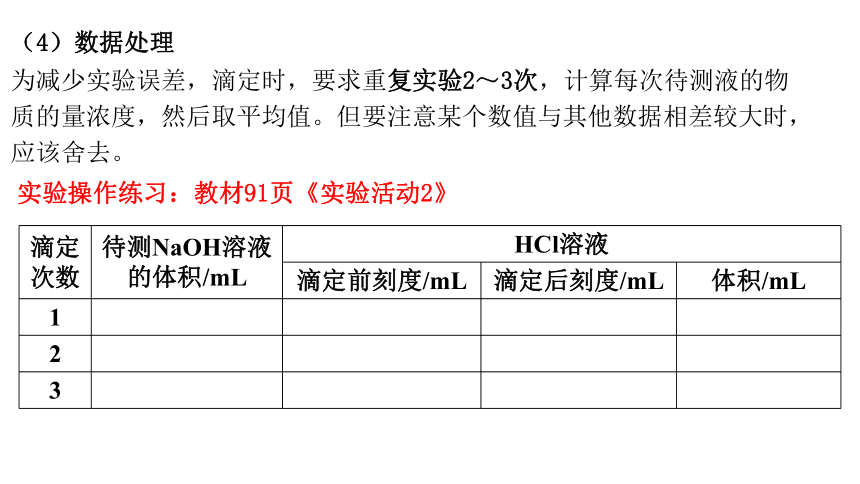
(4)数据处理
为减少实验误差,滴定时,要求重复实验2~3次,计算每次待测液的物
质的量浓度,然后取平均值。但要注意某个数值与其他数据相差较大时,
应该舍去。
实验操作练习:教材91页《实验活动2》
滴定次数 待测NaOH溶液的体积/mL HCl溶液
滴定前刻度/mL 滴定后刻度/mL 体积/mL
1
2
3
【自我诊断】 校本p78
(1)用酸式滴定管准确量取溶液( )
√
(2)将液面在“0”刻度处的的酸式滴定管中的液体全部放出,液体
的体积为 ( )
×
(3)锥形瓶在水洗后,要用待测液润洗次( )
×
(4)滴定实验中左手控制滴定管的活塞,右手摇动锥形瓶( )
√
(5)当观察到锥形瓶中溶液颜色发生变化时,立即停止滴定并记下滴定
管液面读数( )
×
学以致用 提升关键能力
1.在中和滴定实验中用到的下列仪器,只需用蒸馏水洗净,不能用待盛放
液体润洗的是( )
A.酸式滴定管 B.碱式滴定管 C.移液管 D.锥形瓶
√
校本p78
2.(2023·潍坊高二期末)用已知物质的量浓度的盐酸滴定未知浓度的氢氧化
钠溶液,选择甲基橙作为指示剂。下列操作正确的是( )
A.量取氢氧化钠溶液前,应按图示方式排气泡
B.酸式滴定管检漏、清洗后,直接注入已知物质的量浓度的盐酸
C.滴定前,盛放氢氧化钠溶液的锥形瓶用待装液润洗
D.滴定过程中眼睛注视滴定管中液面的变化
√
校本p79
3.下列有关酸碱中和滴定实验的操作顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否
漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
√
校本p82
3.(2023·咸阳高二检测)某学生欲用的盐酸来滴定未知物
质的量浓度的氢氧化钠溶液时,选择酚酞作为指示剂。
请回答下列问题:
(1)用标准盐酸滴定未知浓度的氢氧化钠溶液时,左手控制酸式滴定管的
活塞,右手摇动锥形瓶,眼睛注视________________________。直到因加入
半滴盐酸后,溶液由粉红色变为无色,并且____________________为止。
锥形瓶内溶液颜色的变化
半分钟内不恢复红色
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,
则起始读数为___ ,终点读数为______ 。
0
26.10
校本p79
(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 液/ 盐酸的体积/
滴定前 滴定后 溶液体积
第一次 25.00 0 26.11 26.11
第二次 25.00 1.56 30.30 28.74
第三次 25.00 0.22 26.31 26.09
该氢氧化钠溶液的物质的量浓度:<________________。
(一)以标准液体积为横坐标,以pH为纵坐标,作图(HCl 滴定NaOH)
二、酸碱中和滴定曲线
中和滴定终点是指示剂颜色发生突变的点,滴定终点只要在突变范围就行
(二)以标准液体积为横坐标,以pH为纵坐标,作图(NaOH滴定HCl)
3.如图所示是常温下盐酸与氢氧化钠溶液的滴定曲线a和b。
请回答下列问题:
(1)曲线a是用______________滴定______;
曲线b是用______滴定______________。
氢氧化钠溶液
盐酸
盐酸
氢氧化钠溶液
(2)P点的纵坐标为___。
7
(3)盐酸的物质的量浓度为___;氢氧化钠溶液的体积为 ____。
0.1
15.00
校本p81
学以致用 提升关键能力
1.如图所示是常温下向的盐酸中逐滴加入溶
液时,溶液的随溶液的体积变化的曲线,下列结论正确的是( )
A.盐酸的初始浓度为
B.
C.溶液时溶液
D.盐酸的初始浓度为
√
校本p80
石蕊:
甲基橙:
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
酚酞:
8.2
10
5
8
3.1
4.4
强碱滴定强酸
强酸滴定强碱
强酸滴定弱碱
强碱滴定弱酸
酚 酞
无→粉红
粉红→无
甲基橙
红→橙
黄→橙
石蕊因变色不明显,通常不用作指示剂
无→粉红
4.3 突跃范围 9.7
黄→橙
无→粉红
(三)指示剂的选择
【问题探究】
1.用溶液滴定未知浓度的盐酸,选用酚酞作为指示剂的终点现象是
什么?若选用甲基橙呢?
选用酚酞作为指示剂时,终点现象为滴入最后半滴溶液时,
溶液颜色由无色变为粉红色,且半分钟内不变色。
选用甲基橙作为指示剂,终点现象为滴入最后半滴溶液时,溶液颜
色由橙色变为黄色,且半分钟内不变色。
校本p80
三、酸碱中和滴定的误差分析
↓
计算
定值
↑
↓
预先量取(定值)
→滴定测得
分析V(标)的变化。
用的盐酸滴定某未知浓度的溶液20.00mL。
步骤 操作
洗涤 酸式滴定管未用标准溶液润洗 ______ ______
碱式滴定管未用标准溶液润洗 ______ ______
锥形瓶用待测溶液润洗 ______ ______
锥形瓶洗净后还留有蒸馏水 ______ ________
取液 放出碱液的滴定管开始有气泡,放出液 体后气泡消失 ______ ______
变大
偏高
变小
偏低
变大
偏高
不变
无影响
变小
偏低
2.常见的误差分析
(以用标准盐酸滴定待测氢氧化钠溶液为例)
c (NaOH)=
c (HCl ) · V[HCl(aq)]
V [NaOH(aq)]
步骤 操作
滴定 酸式滴定管滴定前有气泡,滴定终点时 气泡消失 ______ ______
振荡锥形瓶时部分液体溅出 ______ ______
部分酸液滴出锥形瓶外 ______ ______
溶液颜色较浅时滴入酸液过快,停止滴 定后再加一滴溶液无变化 ______ ______
变大
偏高
变小
偏低
变大
偏高
变大
偏高
c (NaOH)=
c (HCl ) · V[HCl(aq)]
V [NaOH(aq)]
步骤 操作
读数 滴定前读数正确,滴定后俯视读数(或 前仰后俯) ______ ______
滴定前读数正确,滴定后仰视读数(或 前俯后仰) ______ ______
变小
偏低
变大
偏高
c (NaOH)=
c (HCl ) · V[HCl(aq)]
V [NaOH(aq)]
1.量筒和滴定管所盛放液体的凹面都在刻度,若都采用仰视读数,
则前者比后者的读数( )
A.大 B.小 C.相等 D.不能比较
√
校本p82
2.(2023·上海西南位育中学高二期末)中和滴定时,下列操作不会引起误差
的是( )
A.锥形瓶用蒸馏水洗净后,未烘干就注入待测溶液
B.滴定管用蒸馏水洗净后,直接注入标准溶液进行滴定
C.锥形瓶用蒸馏水洗净后,用待测溶液润洗后再加入待测溶液
D.滴定开始时滴定管下端有气泡,滴定结束后气泡消失
√
校本p82
3.下列关于误差分析的判断正确的是( )
A.酸碱中和滴定中,滴定终点读数时滴定管内有气泡,会使测得的浓度偏大
B.用托盘天平称取药品时,药品和砝码位置颠倒,药品质量一定偏小
C.配制的溶液时,未恢复至室温就转移并定容,所得溶液
浓度偏大
D.用湿润的试纸测稀酸溶液的,测定值偏小
√
校本p82
第三章 水溶液中的离子反应与平衡
第二节 电离平衡
第四课时 酸碱中和滴定
滴定:
一种定量分析的手段
通过两种溶液的定量反应来确定某种溶液的浓度
一、酸碱中和滴定
利用酸碱中和反应
用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
H+ + OH- = H2O
一、酸碱中和滴定
利用酸碱中和反应;用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
(一)中和反应的实质:H+ + OH- = H2O
n(H+)=n(OH-)
若是一元酸和一元碱反应: c酸·V酸 = c碱·V碱
酸式滴定管、碱式滴定管、滴定管夹、铁架台、烧杯、锥形瓶等
(二)滴定主要仪器
玻璃塞
带玻璃球的橡胶管
标注温度、量程
①“0”刻度线在上,尖嘴部分无刻度
(实际容积>标定容积)
③盛装:
酸式滴定管:酸性和强氧化性试剂
碱式滴定管:碱性试剂
② 最小刻度为:0.1mL
读数精确度:0.01mL
滴定管
★使用四氟乙烯活塞的滴定管为酸碱通用滴定管
【练习】1、50ml的滴定管盛有溶液,液面恰好在20.0处,若把滴定管中溶液全部排出,则体积( )
A、等于30 B、等于20 C、大于30 D、小于30
C
2、下列所述仪器“0”刻度位置正确的是( )
A.在量筒的上端 B.在滴定管上端
C.容量瓶上端 D.在托盘天平刻度尺的右边
B
3、量取25.00mL,KMnO4溶液可选用仪器( )
A.50mL量筒 B.100mL量筒
C.50mL酸式滴定管 D.50mL碱式滴定管
C
①查漏:使用前先检查滴定管活塞是否漏水。
②润洗:滴定管在加入反应液之前,先用蒸馏水洗涤干净,然后分别用所要盛装的溶液润洗2~3遍。(装待测液的锥形瓶不需润洗)
③装液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻
度线以上2~3mL处。
④调液面:调节活塞,赶出气泡,使液面处于“0”刻度或以下某刻度,读数并记录。
滴定前排出尖嘴处的气泡
酸式滴定管→快速放液;
碱式滴定管→橡皮管向上翘起
(三)滴定管的使用方法
(四)滴定的实验操作
(1)滴定前的准备
①滴定管:
查漏
②锥形瓶:水洗
(2)滴定操作
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
当接近终点时,一滴一摇,甚至半滴一摇,滴定管的尖嘴接触锥形瓶内壁,用锥形瓶内壁“刮”下半滴标准液。
(3)滴定终点判断
当滴入最后半滴标准液时,指示剂变色,且半分钟内不恢复原色,即达到滴定终点;读数并记录。
(4)数据处理
为减少实验误差,滴定时,要求重复实验2~3次,计算每次待测液的物
质的量浓度,然后取平均值。但要注意某个数值与其他数据相差较大时,
应该舍去。
实验操作练习:教材91页《实验活动2》
滴定次数 待测NaOH溶液的体积/mL HCl溶液
滴定前刻度/mL 滴定后刻度/mL 体积/mL
1
2
3
【自我诊断】 校本p78
(1)用酸式滴定管准确量取溶液( )
√
(2)将液面在“0”刻度处的的酸式滴定管中的液体全部放出,液体
的体积为 ( )
×
(3)锥形瓶在水洗后,要用待测液润洗次( )
×
(4)滴定实验中左手控制滴定管的活塞,右手摇动锥形瓶( )
√
(5)当观察到锥形瓶中溶液颜色发生变化时,立即停止滴定并记下滴定
管液面读数( )
×
学以致用 提升关键能力
1.在中和滴定实验中用到的下列仪器,只需用蒸馏水洗净,不能用待盛放
液体润洗的是( )
A.酸式滴定管 B.碱式滴定管 C.移液管 D.锥形瓶
√
校本p78
2.(2023·潍坊高二期末)用已知物质的量浓度的盐酸滴定未知浓度的氢氧化
钠溶液,选择甲基橙作为指示剂。下列操作正确的是( )
A.量取氢氧化钠溶液前,应按图示方式排气泡
B.酸式滴定管检漏、清洗后,直接注入已知物质的量浓度的盐酸
C.滴定前,盛放氢氧化钠溶液的锥形瓶用待装液润洗
D.滴定过程中眼睛注视滴定管中液面的变化
√
校本p79
3.下列有关酸碱中和滴定实验的操作顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否
漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
√
校本p82
3.(2023·咸阳高二检测)某学生欲用的盐酸来滴定未知物
质的量浓度的氢氧化钠溶液时,选择酚酞作为指示剂。
请回答下列问题:
(1)用标准盐酸滴定未知浓度的氢氧化钠溶液时,左手控制酸式滴定管的
活塞,右手摇动锥形瓶,眼睛注视________________________。直到因加入
半滴盐酸后,溶液由粉红色变为无色,并且____________________为止。
锥形瓶内溶液颜色的变化
半分钟内不恢复红色
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,
则起始读数为___ ,终点读数为______ 。
0
26.10
校本p79
(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 液/ 盐酸的体积/
滴定前 滴定后 溶液体积
第一次 25.00 0 26.11 26.11
第二次 25.00 1.56 30.30 28.74
第三次 25.00 0.22 26.31 26.09
该氢氧化钠溶液的物质的量浓度:<________________。
(一)以标准液体积为横坐标,以pH为纵坐标,作图(HCl 滴定NaOH)
二、酸碱中和滴定曲线
中和滴定终点是指示剂颜色发生突变的点,滴定终点只要在突变范围就行
(二)以标准液体积为横坐标,以pH为纵坐标,作图(NaOH滴定HCl)
3.如图所示是常温下盐酸与氢氧化钠溶液的滴定曲线a和b。
请回答下列问题:
(1)曲线a是用______________滴定______;
曲线b是用______滴定______________。
氢氧化钠溶液
盐酸
盐酸
氢氧化钠溶液
(2)P点的纵坐标为___。
7
(3)盐酸的物质的量浓度为___;氢氧化钠溶液的体积为 ____。
0.1
15.00
校本p81
学以致用 提升关键能力
1.如图所示是常温下向的盐酸中逐滴加入溶
液时,溶液的随溶液的体积变化的曲线,下列结论正确的是( )
A.盐酸的初始浓度为
B.
C.溶液时溶液
D.盐酸的初始浓度为
√
校本p80
石蕊:
甲基橙:
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
酚酞:
8.2
10
5
8
3.1
4.4
强碱滴定强酸
强酸滴定强碱
强酸滴定弱碱
强碱滴定弱酸
酚 酞
无→粉红
粉红→无
甲基橙
红→橙
黄→橙
石蕊因变色不明显,通常不用作指示剂
无→粉红
4.3 突跃范围 9.7
黄→橙
无→粉红
(三)指示剂的选择
【问题探究】
1.用溶液滴定未知浓度的盐酸,选用酚酞作为指示剂的终点现象是
什么?若选用甲基橙呢?
选用酚酞作为指示剂时,终点现象为滴入最后半滴溶液时,
溶液颜色由无色变为粉红色,且半分钟内不变色。
选用甲基橙作为指示剂,终点现象为滴入最后半滴溶液时,溶液颜
色由橙色变为黄色,且半分钟内不变色。
校本p80
三、酸碱中和滴定的误差分析
↓
计算
定值
↑
↓
预先量取(定值)
→滴定测得
分析V(标)的变化。
用的盐酸滴定某未知浓度的溶液20.00mL。
步骤 操作
洗涤 酸式滴定管未用标准溶液润洗 ______ ______
碱式滴定管未用标准溶液润洗 ______ ______
锥形瓶用待测溶液润洗 ______ ______
锥形瓶洗净后还留有蒸馏水 ______ ________
取液 放出碱液的滴定管开始有气泡,放出液 体后气泡消失 ______ ______
变大
偏高
变小
偏低
变大
偏高
不变
无影响
变小
偏低
2.常见的误差分析
(以用标准盐酸滴定待测氢氧化钠溶液为例)
c (NaOH)=
c (HCl ) · V[HCl(aq)]
V [NaOH(aq)]
步骤 操作
滴定 酸式滴定管滴定前有气泡,滴定终点时 气泡消失 ______ ______
振荡锥形瓶时部分液体溅出 ______ ______
部分酸液滴出锥形瓶外 ______ ______
溶液颜色较浅时滴入酸液过快,停止滴 定后再加一滴溶液无变化 ______ ______
变大
偏高
变小
偏低
变大
偏高
变大
偏高
c (NaOH)=
c (HCl ) · V[HCl(aq)]
V [NaOH(aq)]
步骤 操作
读数 滴定前读数正确,滴定后俯视读数(或 前仰后俯) ______ ______
滴定前读数正确,滴定后仰视读数(或 前俯后仰) ______ ______
变小
偏低
变大
偏高
c (NaOH)=
c (HCl ) · V[HCl(aq)]
V [NaOH(aq)]
1.量筒和滴定管所盛放液体的凹面都在刻度,若都采用仰视读数,
则前者比后者的读数( )
A.大 B.小 C.相等 D.不能比较
√
校本p82
2.(2023·上海西南位育中学高二期末)中和滴定时,下列操作不会引起误差
的是( )
A.锥形瓶用蒸馏水洗净后,未烘干就注入待测溶液
B.滴定管用蒸馏水洗净后,直接注入标准溶液进行滴定
C.锥形瓶用蒸馏水洗净后,用待测溶液润洗后再加入待测溶液
D.滴定开始时滴定管下端有气泡,滴定结束后气泡消失
√
校本p82
3.下列关于误差分析的判断正确的是( )
A.酸碱中和滴定中,滴定终点读数时滴定管内有气泡,会使测得的浓度偏大
B.用托盘天平称取药品时,药品和砝码位置颠倒,药品质量一定偏小
C.配制的溶液时,未恢复至室温就转移并定容,所得溶液
浓度偏大
D.用湿润的试纸测稀酸溶液的,测定值偏小
√
校本p82
