2.2.1.物质的量浓度课件(共17张PPT)2023-2024学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.2.1.物质的量浓度课件(共17张PPT)2023-2024学年上学期高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 11:24:18 | ||
图片预览





文档简介
(共17张PPT)
专题2 研究物质的基本方法
第二单元 溶液组成的定量研究
第一课时 物质的量浓度
化学实验室表示溶液浓度用的是mol/L
一、物质的量浓度概念
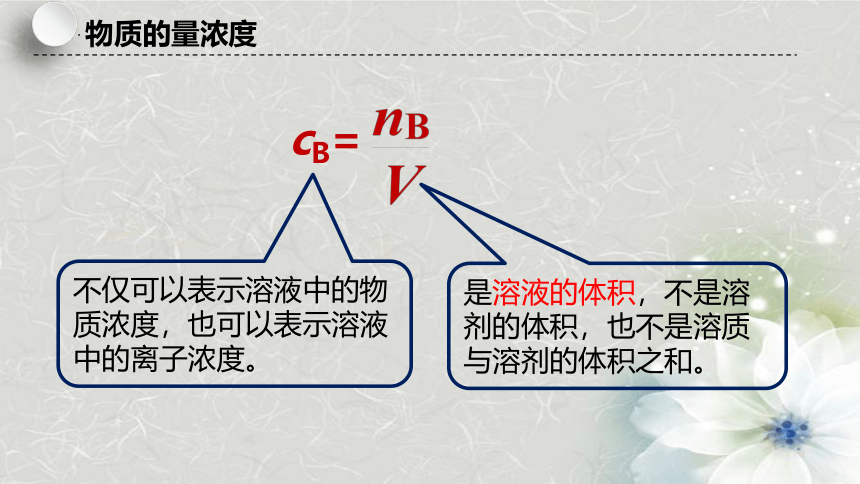
1.定义:以单位体积 所含溶质B的 来表示溶液组成的物理量。
2.符号: 。
溶液
物质的量
cB
3.定义式:cB=___。
即每L溶液中含有多少mol的溶质B。
4.单位:mol·L-1或mol/L。
物质的量浓度
cB=
是溶液的体积,不是溶剂的体积,也不是溶质与溶剂的体积之和。
不仅可以表示溶液中的物质浓度,也可以表示溶液中的离子浓度。
N
NA
n
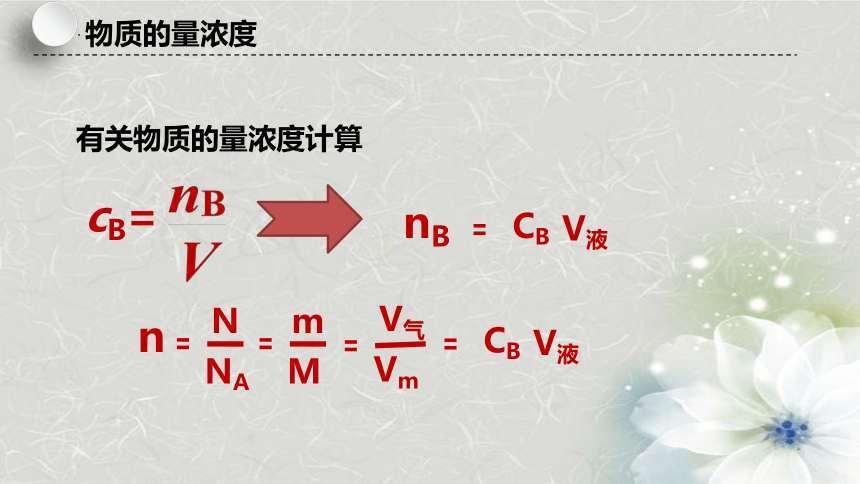
有关物质的量浓度计算
cB=
CB
V液
nB
m
M
V气
Vm
CB
V液
物质的量浓度
问题:什么是 1mol/L 的 NaCl 溶液?
物质的量浓度概念辨析
在每 1L 的溶液中含有 1molNaCl 的溶液。
变式:下列关于0.1 mol/L硝酸钾溶液配制的说法中,错误的是:
A、0.01mol KNO3溶于100ml水配制而成
B、0.05mol KNO3溶于水配制成500ml水溶液
C、0.5mol/L KNO3 100ml稀释成500ml
D、0.1mol KNO3溶于水配制成1L溶液
答案:A,KNO3溶于100ml水后,体积V会变大,CB=,C变小,最后浓度小于0.1 mol/L
例1、下列溶液中溶质的物质的量浓度为1 mol·L-1的是( )
A.将40 g氢氧化钠溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸与9 L水混合
D.将10.6 g碳酸钠溶解于水得到100 mL溶液
答案 D
解析 A项中两种物质混合后,溶液的体积不等于1 L;B项中没有指明氯化氢处于标准状况下;C项中两种溶液混合后的体积不是二者的体积之和。
答案:C
解析:CB===1.5 mol/L
例2.0.3 mol NaCl固体溶于水配成200 mL溶液,溶液浓度为( )
A.0.3 mol·L-1 B.0.15 mol·L-1
C.1.5 mol·L-1 D.0.015 mol·L-1
物质的量浓度的简单计算——课本P39【例1】
将53.0 g Na2CO3溶解在水中,配成500 ml溶液,所得溶液中溶质的物质的量浓度是多少?
解: = ==0.500 mol
===1.00 mol/L
答:所得溶液中溶质的物质的量浓度是1.00 mol/L
【变式1】在 200mL NaOH 溶液中溶有 20gNaOH,则 NaOH 的物质的量浓度为 多少?
强化巩固
c(浓溶液)×V(浓溶液)= c(稀溶液)×V(稀溶液)
物质的量浓度
稀释:
将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
40
学与练
1、用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度 _____ mol·L-1。
(1)若从中取出50 mL溶液,其物质的量浓度为________ mol·L-1;溶质的质量为______ g。
(2)若将这50 mL溶液用水稀释到100 mL,所得溶液的物质的量浓度为________ mol·L-1,溶液中Na+的物质的量浓度为_______ mol·L-1,,SO42-的物质的量浓度为________ mol·L-1。
0.2
0.2
1.42
0.1
0.2
0.1
强化巩固
2、在标准状况下,将V L氨气溶于0.1 L水中,所得溶液的密度为 ρ g·cm-3,则此氨水的物质的量浓度为________ mol·L-1。
解:NH3+H2O=NH3·H2O ,标况下V L NH3的物质的量n=,所以溶质(一水合氨NH3·H2O)物质的量为,溶液的体积V=== L
c氨水=== mol/L
3、配制100mL 0.1mol/L CuSO4 溶液
(1)如果用硫酸铜固体配制,计算需用硫酸铜固体质量是_____ g
(2)如果用五水硫酸铜晶体配制,计算需用五水硫酸铜晶体质量是_____ g
4、已知V L硫酸铁溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________ mol·L-1,溶质的物质的量浓度为________mol·L-1。
1.6
2.5
二、物质的量浓度相关计算
例:某市售盐酸的质量分数为36.5%,密度为1.18 g·cm-3,该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
答案:C
解析:cB==
延时符
课堂小结
1.
2.
物质的量浓度概念
相关计算(稀释和换算)
专题2 研究物质的基本方法
第二单元 溶液组成的定量研究
第一课时 物质的量浓度
化学实验室表示溶液浓度用的是mol/L
一、物质的量浓度概念
1.定义:以单位体积 所含溶质B的 来表示溶液组成的物理量。
2.符号: 。
溶液
物质的量
cB
3.定义式:cB=___。
即每L溶液中含有多少mol的溶质B。
4.单位:mol·L-1或mol/L。
物质的量浓度
cB=
是溶液的体积,不是溶剂的体积,也不是溶质与溶剂的体积之和。
不仅可以表示溶液中的物质浓度,也可以表示溶液中的离子浓度。
N
NA
n
有关物质的量浓度计算
cB=
CB
V液
nB
m
M
V气
Vm
CB
V液
物质的量浓度
问题:什么是 1mol/L 的 NaCl 溶液?
物质的量浓度概念辨析
在每 1L 的溶液中含有 1molNaCl 的溶液。
变式:下列关于0.1 mol/L硝酸钾溶液配制的说法中,错误的是:
A、0.01mol KNO3溶于100ml水配制而成
B、0.05mol KNO3溶于水配制成500ml水溶液
C、0.5mol/L KNO3 100ml稀释成500ml
D、0.1mol KNO3溶于水配制成1L溶液
答案:A,KNO3溶于100ml水后,体积V会变大,CB=,C变小,最后浓度小于0.1 mol/L
例1、下列溶液中溶质的物质的量浓度为1 mol·L-1的是( )
A.将40 g氢氧化钠溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸与9 L水混合
D.将10.6 g碳酸钠溶解于水得到100 mL溶液
答案 D
解析 A项中两种物质混合后,溶液的体积不等于1 L;B项中没有指明氯化氢处于标准状况下;C项中两种溶液混合后的体积不是二者的体积之和。
答案:C
解析:CB===1.5 mol/L
例2.0.3 mol NaCl固体溶于水配成200 mL溶液,溶液浓度为( )
A.0.3 mol·L-1 B.0.15 mol·L-1
C.1.5 mol·L-1 D.0.015 mol·L-1
物质的量浓度的简单计算——课本P39【例1】
将53.0 g Na2CO3溶解在水中,配成500 ml溶液,所得溶液中溶质的物质的量浓度是多少?
解: = ==0.500 mol
===1.00 mol/L
答:所得溶液中溶质的物质的量浓度是1.00 mol/L
【变式1】在 200mL NaOH 溶液中溶有 20gNaOH,则 NaOH 的物质的量浓度为 多少?
强化巩固
c(浓溶液)×V(浓溶液)= c(稀溶液)×V(稀溶液)
物质的量浓度
稀释:
将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
40
学与练
1、用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度 _____ mol·L-1。
(1)若从中取出50 mL溶液,其物质的量浓度为________ mol·L-1;溶质的质量为______ g。
(2)若将这50 mL溶液用水稀释到100 mL,所得溶液的物质的量浓度为________ mol·L-1,溶液中Na+的物质的量浓度为_______ mol·L-1,,SO42-的物质的量浓度为________ mol·L-1。
0.2
0.2
1.42
0.1
0.2
0.1
强化巩固
2、在标准状况下,将V L氨气溶于0.1 L水中,所得溶液的密度为 ρ g·cm-3,则此氨水的物质的量浓度为________ mol·L-1。
解:NH3+H2O=NH3·H2O ,标况下V L NH3的物质的量n=,所以溶质(一水合氨NH3·H2O)物质的量为,溶液的体积V=== L
c氨水=== mol/L
3、配制100mL 0.1mol/L CuSO4 溶液
(1)如果用硫酸铜固体配制,计算需用硫酸铜固体质量是_____ g
(2)如果用五水硫酸铜晶体配制,计算需用五水硫酸铜晶体质量是_____ g
4、已知V L硫酸铁溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________ mol·L-1,溶质的物质的量浓度为________mol·L-1。
1.6
2.5
二、物质的量浓度相关计算
例:某市售盐酸的质量分数为36.5%,密度为1.18 g·cm-3,该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
答案:C
解析:cB==
延时符
课堂小结
1.
2.
物质的量浓度概念
相关计算(稀释和换算)
