第1章 认识化学科学 同步测试(含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第1章 认识化学科学 同步测试(含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 188.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 13:07:29 | ||
图片预览


文档简介
第1章 认识化学科学 同步测试
一、单选题
1.少量钠应保存在( )
A.密闭容器中 B.水中 C.煤油中 D.汽油中
2.下列说法中正确的是( )
A.1molNaOH的质量是40g B.1molCH4体积约为22.4L
C.CO2的摩尔质量为44g D.1molH2O中约含6.02×1023个H
3.下列有关实验中,会导致所配制(或所测定)溶液浓度偏高的是(其它操作均正确)( )
A.用标准NaOH滴定未知浓度的CH3COOH,用甲基橙作指示剂,溶液由红色变橙色立即停止滴定
B.用容量瓶配制100 mL 5 mol/L氯化钠溶液试验中,定容时仰视
C.用标准盐酸滴定待测NaOH溶液试验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定待测盐酸实验中,碱式滴定管开始无气泡,后来有气泡
4.“墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来。”诗人在远处能闻到梅花香味,表明( )
A.分子很小 B.分子可再分
C.分子之间有间隙 D.分子在不停地运动
5.为了配制100 mL 1 mol·L 1 NaOH溶液,其中有下列几个操作:( )
①NaOH用纸盛载进行称量;
②选刚用蒸馏水洗净的100 mL容量瓶进行配制;
③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切。
其中操作错误的是
A.①②④ B.③④⑤ C.②③⑤ D.①③⑤
6.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60g
B.6.02×1023个偏二甲肼分子的质量约为60g
C.1mol偏二甲肼的质量为60g/mol
D.6g偏二甲肼含有1.2NA个偏二甲肼分子
7.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.加热时,金属钠剧烈燃烧,产生黄色火焰
D.金属钠着火可以用泡沫灭火器或用干燥的沙土灭火
8.下列关于金属钠的叙述中,说法正确的是( )
A.金属钠可以保存在少量水中
B.钠长时间暴露在空气中,最终产物是Na2CO3
C.钠是银白色金属,硬度大,熔点高
D.Na与CuSO4溶液反应可以置换出Cu单质
9.在标准状况下①② 个 分子 ③④ ,下列对这四种气体的关系从大到小表达正确的是( )
A.体积 ②>③>①>④ B.密度 ②>③>①>④
C.分子数 ④>③>②>① D.氢原子个数 ①>②>③>④
10.设NA为阿伏加德罗常数的值。下列有关叙述错误的是( )
A.乙烯和环丁烷(C4H8)的混合气体共28 g充分燃烧消耗3NA个O2
B.0.1mol-NH2 (氨基)中所含有的电子数为NA
C.1L0.1mol·L-1Na2S溶液中,S2-、HS-和H2S的微粒数之和为0.1NA
D.在K37ClO3+ 6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中电子转移的数目为5NA
11.下列说法正确的是( )
A.Na的摩尔质量是
B.22 g CO2物质的量为2.2 mol
C.1 mol Cl2中含有的氯原子数约为
D.常温常压下,1 mol N2的体积是22.4 L
12.水的摩尔质量是( )
A.18 B.18 g
C.18 g/mol D.18 mol
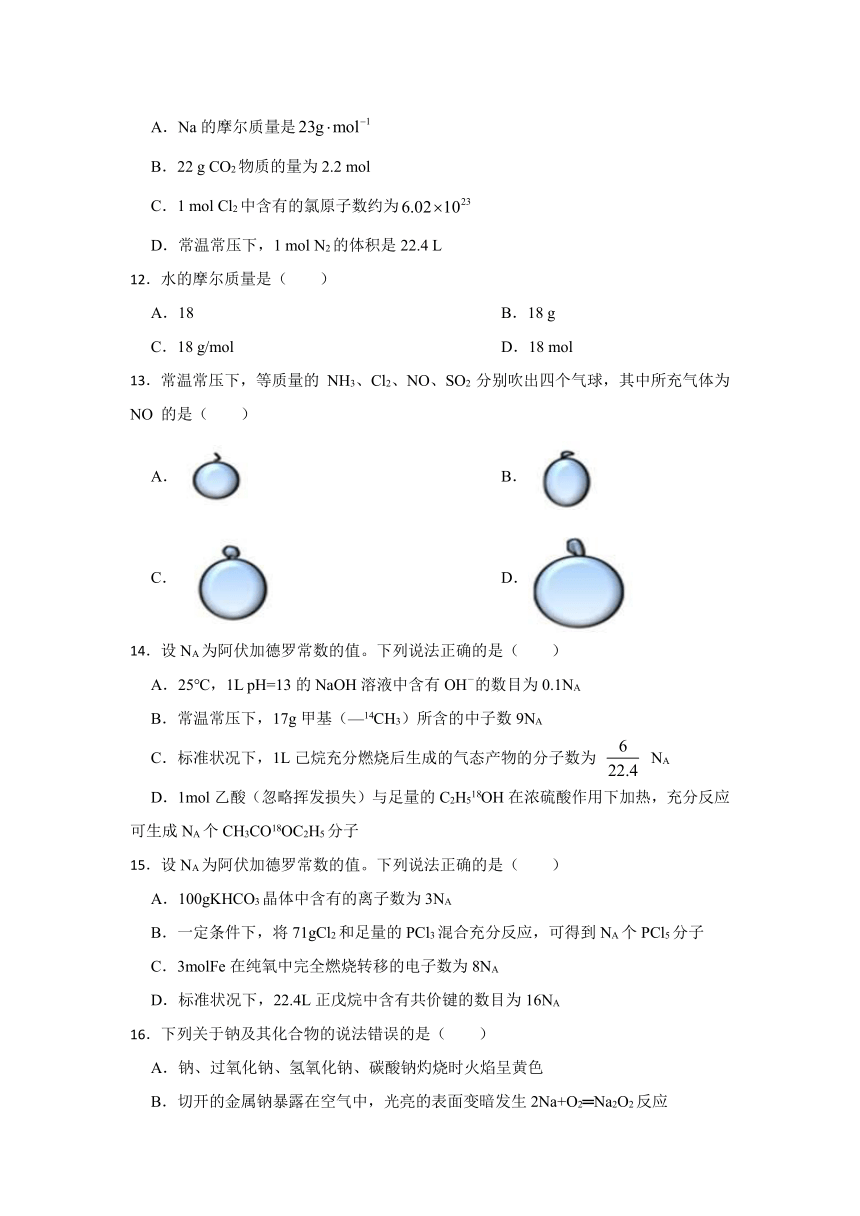
13.常温常压下,等质量的 NH3、Cl2、NO、SO2 分别吹出四个气球,其中所充气体为 NO 的是( )
A. B.
C. D.
14.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B.常温常压下,17g甲基(—14CH3)所含的中子数9NA
C.标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为 NA
D.1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
15.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.100gKHCO3晶体中含有的离子数为3NA
B.一定条件下,将71gCl2和足量的PCl3混合充分反应,可得到NA个PCl5分子
C.3molFe在纯氧中完全燃烧转移的电子数为8NA
D.标准状况下,22.4L正戊烷中含有共价键的数目为16NA
16.下列关于钠及其化合物的说法错误的是( )
A.钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色
B.切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应
C.过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2+2H2O═4NaOH+O2↑
D.过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气
二、实验探究题
17.某班同学用如下实验探究Na2CO3、NaHCO3的性质.回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是 .
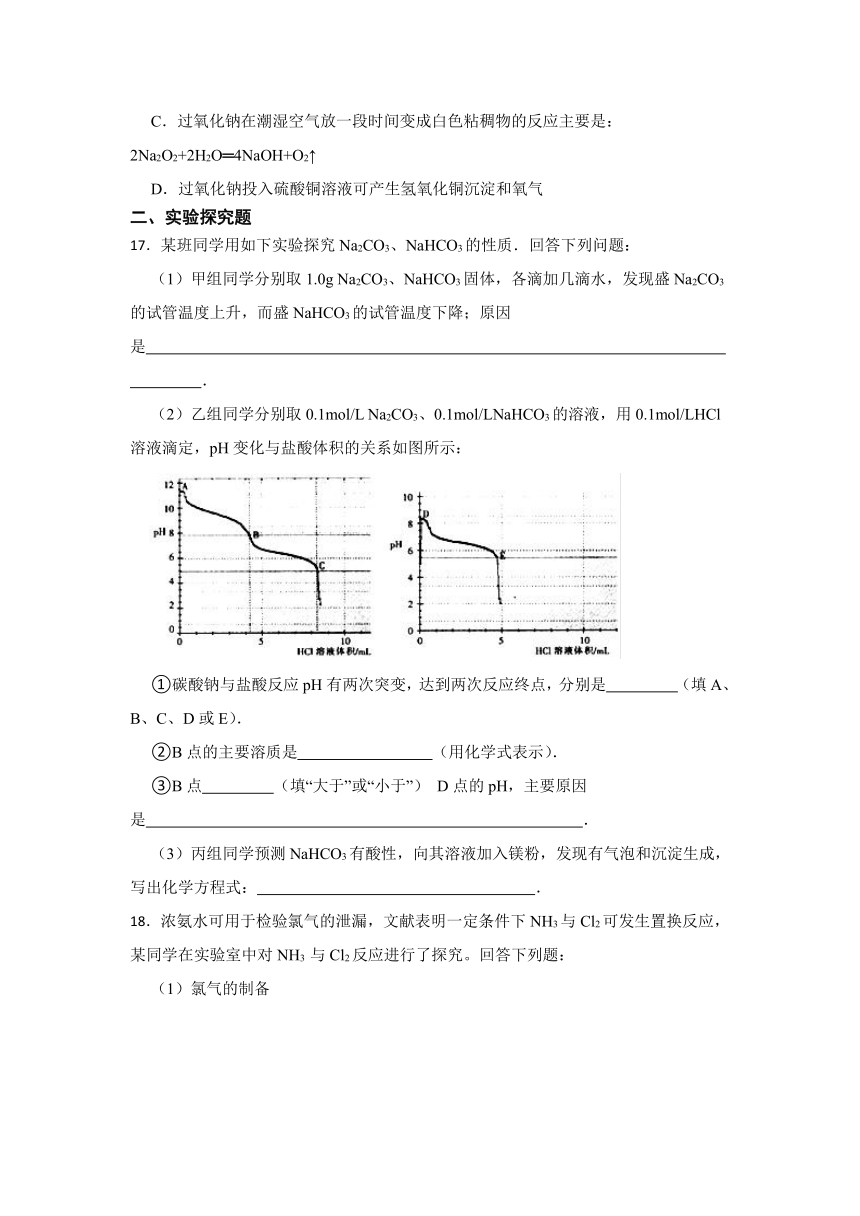
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
①碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是 (填A、B、C、D或E).
②B点的主要溶质是 (用化学式表示).
③B点 (填“大于”或“小于”) D点的pH,主要原因是 .
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式: .
18.浓氨水可用于检验氯气的泄漏,文献表明一定条件下NH3与Cl2可发生置换反应,某同学在实验室中对NH3 与Cl2反应进行了探究。回答下列题:
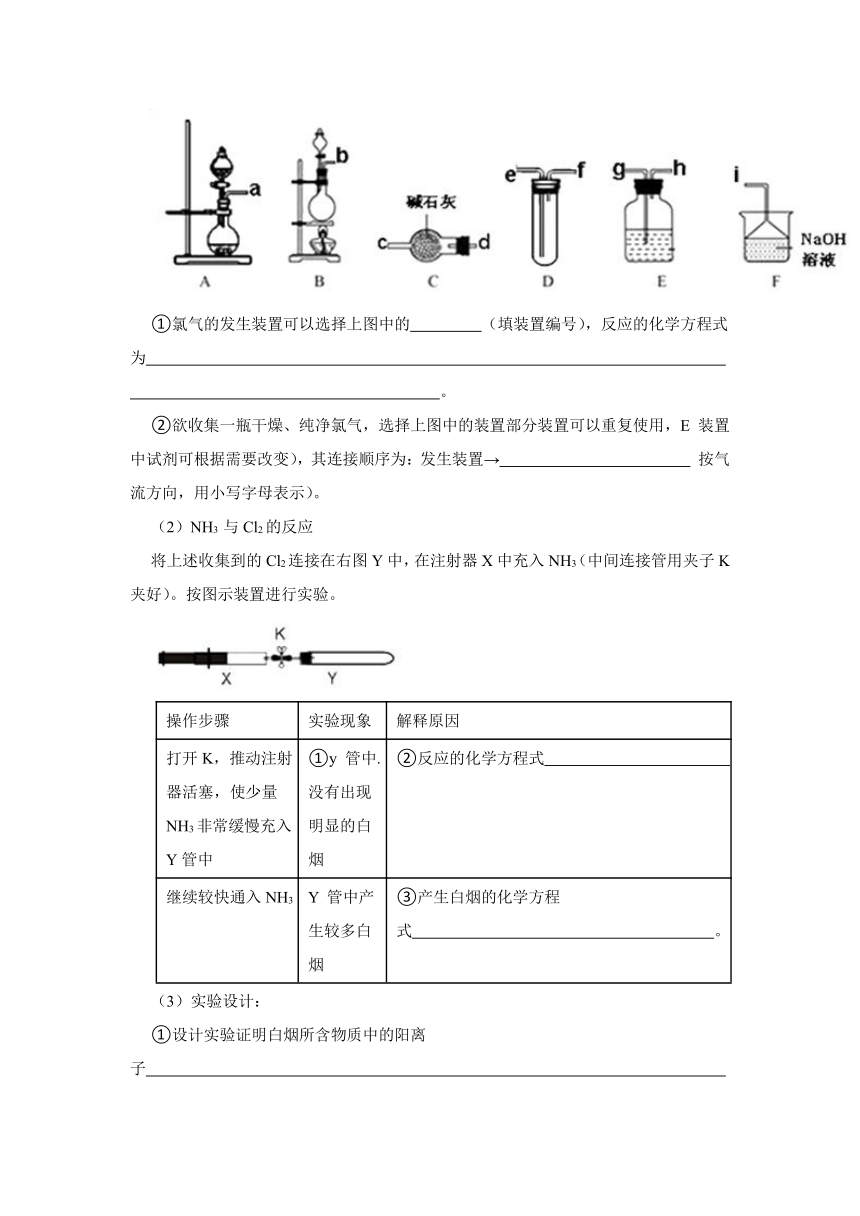
(1)氯气的制备
①氯气的发生装置可以选择上图中的 (填装置编号),反应的化学方程式为 。
②欲收集一瓶干燥、纯净氯气,选择上图中的装置部分装置可以重复使用,E 装置中试剂可根据需要改变),其连接顺序为:发生装置→ 按气流方向,用小写字母表示)。
(2)NH3 与Cl2的反应
将上述收集到的Cl2连接在右图Y中,在注射器X中充入NH3(中间连接管用夹子K 夹好)。按图示装置进行实验。
操作步骤 实验现象 解释原因
打开K,推动注射器活塞,使少量NH3非常缓慢充入Y管中 ①y 管中.没有出现明显的白烟 ②反应的化学方程式
继续较快通入NH3 Y 管中产生较多白烟 ③产生白烟的化学方程式 。
(3)实验设计:
①设计实验证明白烟所含物质中的阳离子 。
②用(2)中装置设计实验证明氯元素比硫元素非金属性强 。
19.某校一化学兴趣小组为研究氯气的一些性质,设计如下装置进行系列实验(夹持及加热仪器已略).
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置 A 中的化学反应方程式: .
(2)装置 B 中长颈漏斗的作用是
(3)装置 C 为研究 Cl2 是否具有漂白性,现有:
①干燥的有色布条
②湿润的有色布条
③碱石灰
④浓硫酸
⑤无水氯化钙,其中Ⅰ处为 Ⅲ处为①,则Ⅱ处为: (填上述物质中的序号)
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性强弱.当向 D 中缓缓通入一定量氯气时,可以 看到 D 中无色溶液逐渐变为橙色,再打开 D 装置的活塞,使 D 中溶液滴入 E 装置,振荡锥形瓶后静置一会儿,可以观察到下层液体呈紫红色.同学们经过认真讨论后认为该实验方案仍有不足,理由是
(5)装置 F 的作用是吸收尾气,在烧杯中发生反应的化学方程式为 .
三、综合题
20.实验室中用二氧化锰和浓盐酸反应制备氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):接 ;接 ;接 ;接 .
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有 .
(3)写出用如图装置制备氯气的离子方程式 :
(4)A、B两组同学分别用两种方法制取氯气:A组用含146g HCl的浓盐酸与足量的二氧化锰反应;B组用87g二氧化锰与足量的浓盐酸反应,则所得氯气的物质的量的关系为A B(填“>”、“<”或“=”)
(5)实验中饱和食盐水的作用是 :
(6)写出氯气尾气吸收的化学方程式: .
(7)如何验证氯气已经收集满?
21.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g mol﹣1.若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 ;
(2)该气体所含原子总数为 个;
(3)该气体在标准状况下的体积为 ;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
22.现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量: 。
(2)混合气体中碳原子的个数: 。(用NA表示阿伏加德罗常数的值)
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体的质量为: ;
②气球中收集到的气体在标准状况下的体积为 ;
③气球中收集到的气体的电子总数为 。(用NA表示阿伏加德罗常数的值)
答案解析部分
1.【答案】C
【解析】【解答】钠的性质活泼,能够与空气中的氧气和水蒸汽反应,故少量钠应保存在煤油中,以隔绝空气,
故答案为:C。
【分析】钠单质是非常活泼的金属单质,暴露在空气中会和氧气、水进行反应,因此应该将钠单质隔离存放,又由于钠的密度大于煤油,因此将钠单质存放在煤油中。
2.【答案】A
【解析】【解答】
A.1molNaOH的质量是1mol×40g/mol=40g。故A符合题意。
B.气体体积与气体所处状态有关。不知温度与压强1molCH4体积无法确定。故B错。
C.摩尔质量单位为g/mol。故C错。
D.1molH2O中约含2×6.02×1023个H。故D错。
【分析】
。
3.【答案】C
【解析】【解答】A、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,若选用甲基橙作指示剂,滴定终点时溶液在酸性范围,标准液的体积偏小,所测定溶液浓度偏低,选项A不符合题意;
B、用容量瓶配制100 mL 5 mol/L氯化钠溶液试验中,定容时仰视则所加蒸馏水偏多,溶液浓度偏低,选项B不符合题意;
C、用标准盐酸滴定待测NaOH溶液试验中,使用碱式滴定管开始平视,后来俯视读数,则所读数体积偏小,滴定消耗的标准盐酸体积偏低,所测定溶液浓度偏低,选项C符合题意;
D、用标准NaOH溶液滴定待测盐酸实验中,碱式滴定管开始无气泡,后来有气泡,则标准液体积偏大,所测定溶液浓度偏高,选项D不符合题意。
故答案为:C。
【分析】A.甲基橙指示变色范围在酸性条件下,会使得标准液的消耗量减少,导致测得的浓度偏小;
B.定容仰视,说明加入的蒸馏水偏多,会导致溶液浓度偏小;
C.仰视读数会使消耗的标准液的已经偏小,这时测得的结果就会偏高;
D.碱式滴定管内一开始有气泡后来气泡消失,这样会导致标准溶液的体积偏大,最终测得的结果偏小。
4.【答案】D
【解析】【解答】诗句中说到在远远的地方就能闻到梅花的香味,是因为梅花中含有香味的分子在不断的运动,飘入到作者鼻孔中的原因.说明了分子中不断地运动,故选D。
故正确答案为:D。
【分析】分子的特点做布朗运动。
5.【答案】D
【解析】【解答】NaOH固体易潮解,具有腐蚀性,应放在烧杯进行称量,①错误;配制100mL溶液,只能选择100mL容量瓶,容量瓶不干燥对所配溶液难度无影响,因最后需加水定容,②正确;NaOH溶于水放热,如果不冷却至室温,立即把溶液转移到容量瓶中配制,溶液固液热胀冷缩性质,冷却后所配溶液体积偏小,导致所配溶液浓度偏高,③错误;烧杯上会沾有少量溶质氢氧化钠,为尽可能将氢氧化钠移入容量瓶中,应用蒸馏水洗涤烧杯内壁及玻璃棒,洗涤液也均转入容量瓶中,④正确;为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,⑤错误;①③⑤错误。
故答案为:D
【分析】①固体的称量大多需垫称量纸,但烧碱易吸水、有腐蚀性,应放在小烧杯中快速称量,
②配制100 mL ,选用100 mL容量瓶,且容量瓶使用前需检漏洗涤
③容量瓶只是用于配置一定浓度的溶液,不能用于溶解溶质,且容量瓶的容积受到温度影响
④为了标定体积精确,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平
⑤容量瓶的容积受到温度影响,所以烧碱溶解放热,应恢复至室温再移液
6.【答案】B
【解析】【解答】解:A.偏二甲肼(C2H8N2)的摩尔质量为(12×2+1×8+14×2)g/mol=60g/mol,故A错误;
B.6.02×1023个偏二甲肼的物质的量为1mol,所以1 mol 偏二甲肼的质量为60 g,故B正确;
C.1mol偏二甲肼的质量为60 g,故C错误;
D.偏二甲肼的物质的量为 =0.1mol,含有的分子数为0.1×NA,故D错误.
故选B.
【分析】A.摩尔质量的单位为g/mol;
B.6.02×1023个偏二甲肼的物质的量为1mol,质量的单位为g;
C.1mol物质的质量再数值上等于摩尔质量,质量的单位为g;
D.利用n= ,N=n×NA来计算分子数.
7.【答案】C
【解析】【解答】A. 钠质地软,可以用小刀切割,A不符合题意;
B. 钠放置在空气中,会迅速被氧化而生成白色的氧化钠,B不符合题意;
C. 加热时,金属钠与氧气发生反应生成过氧化钠,反应放热出现剧烈燃烧,钠焰色反应为黄色,故产生黄色火焰,C符合题意;
D. 钠能与水剧烈反应,不能用泡沫灭火器灭火,只能用干燥的沙土灭火,D不符合题意;
故答案为:C。
【分析】A、根据钠单质为银白色,熔沸点较低,硬度低解答;
B、根据钠常温下与氧气反应生成氧化钠,燃烧时生成过氧化钠,为淡黄色固体解答;
C、根据钠的颜色反应为黄色解答;
D、根据钠着火生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,促进燃烧解答;
8.【答案】B
【解析】【解答】A.因金属钠常温下能与水剧烈反应,故金属钠不能保存在水中,可以保存在煤油中,A不符合题意;
B.因钠与空气中氧气极易反应生成氧化钠,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体二氧化碳反应,生成白色带结晶水的固体Na2CO3·10H2O,十水碳酸钠易风化生成白色粉末碳酸钠,B符合题意;
C.钠是银白色金属,可用小刀进行切割说明硬度小,与水反应时很快熔成闪亮的小球说明熔点低, C不符合题意;
D.钠投入硫酸铜溶液时,钠和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜发生复分解反应生成氢氧化铜蓝色沉淀,所以得不到金属单质铜,D不符合题意;
故答案为:B。
【分析】A.金属钠应保存在煤油中;
B.钠长期暴露在空气中,能与空气中的O2、H2O和CO2反应;
C.钠的硬度小,熔点低;
D.钠不与盐溶液发生置换反应;
9.【答案】A
【解析】【解答】A.相同条件下,气体的体积之比等于物质的量之比,所以体积大小关系:②>③>①>④,A项符合题意;
B.各物质的摩尔质量分别为①CH4为16g/mol,②HCl为36.5g/mol,③H2S 为34g/mol,④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,B项不符合题意;
C.同温同压下,分子数之比等于物质的量之比,所以分子数大小关系:②>③>①>④,C项不符合题意;
D.各物质中H原子的物质的量分别为①CH4为0.3mol×4=1.2mol,②HCl为0.5mol,③H2S 0.4mol×2=0.8mol,④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,D项不符合题意;
故答案为:A。
【分析】A. 相同条件下,气体的体积之比等于物质的量之比,据此分析;
B. 相同条件下,密度之比等于摩尔质量之比,据此分析;
C. 相同条件下,分子数之比等于物质的量之比,只需计算各物质的量进行比较,据此分析;
D. 计算出各物质的物质的量,结合化学式判断H原子的物质的量,据此分析.
10.【答案】B
【解析】【解答】A.乙烯和环丁烷的最简式都是CH2,当混合气体为28g时,可以认为有2molCH2,其燃烧需要的氧气为2×(1+ )=3mol,所以需要的氧气分子为3NA个,选项A不符合题意。
B.一个氨基含有9个电子(N有7个电子,加上两个H的两个电子,注意氨基是不带电的中性基团),所以0.1mol氨基由0.9NA个电子,选项B符合题意。
C.1L0.1mol·L-1Na2S溶液中,含有的S一共为0.1mol,根据元素守恒得到S2-、HS-和H2S的微粒数之和为0.1NA,选项C不符合题意。
D.根据化合价变化最小的基本原理,在K37ClO3+ 6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,氯酸钾中的1个37Cl转化为氯气分子中的0价氯原子,H35Cl中有5个35Cl转化为氯气分子中的0价氯原子,即氯气中的37Cl:35Cl=1:5,得到这样的氯气的分子量为 ,所以212g氯气为3mol。该反应的电子转移数为5,所以每生成3个Cl2应该转移5个电子,得到生成212g氯气(3mol)转移5mol即5NA电子。选项D不符合题意。
【分析】根据摩尔质量、物质的量浓度、氧化还原反应等计算其物质的量,然后与阿伏加德罗常数进行比较即可。
11.【答案】A
【解析】【解答】A.Na相对原子质量是23,所以Na的摩尔质量是23 g/mol,A符合题意;
B.CO2摩尔质量是44 g/mol,则22 g CO2物质的量为n(CO2)==0.5 mol,B 不符合题意;
C.Cl2分子中含有2个Cl原子,则1 mol Cl2中含有的氯原子数约为,C不符合题意;
D.常温常压下的气体摩尔体积大于22.4 L/mol,则1 mol N2的体积大于22.4 L,D不符合题意;
故答案为:A。
【分析】A.依据相对原子质量数值等于摩尔质量(单位为g/mol);
B.依据n=计算;
C.Cl2分子中含有2个Cl原子;
D.常温常压下的气体摩尔体积大于22.4 L/mol。
12.【答案】C
【解析】【解答】摩尔质量以g/mol为单位时,在数值上等于粒子的相对原子质量或相对分子质量,所以水的摩尔质量为18g/mol,
故答案为:C。
【分析】注意摩尔质量是有单位的,其数值上与相对分子质量相同。
13.【答案】C
【解析】【解答】同温同压下,相同质量的气体,体积之比与摩尔质量成反比,即摩尔质量越大,气体占有的体积越小。Cl2的摩尔质量为71g/mol,NO的摩尔质量为30g/mol,NH3的摩尔质量为17g/mol,SO2的摩尔质量为64g/mol,故同温同压下,等质量的NH3、Cl2、NO、SO2占有体积大小为:NH3> NO> SO2>Cl2,所以其中所充气体为 NO,C符合题意;
故答案为:C
【分析】根据公式和公式V=n×Vm确定等质量的四种气体的体积,从而确定答案。
14.【答案】A
【解析】【解答】A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA,A符合题意;
B. 常温常压下,17g甲基(—14CH3)是1mol,所含的中子数8NA,B不符合题意;
C. 标准状况下己烷不是气态,不能利用气体摩尔体积计算物质的量,C不符合题意;
D. 酯化反应是可逆反应,1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成CH3CO18OC2H5分子的个数小于NA个,D不符合题意,故答案为:A。
【分析】A、通过pH和水的离子积常数计算溶液中含有OH-的浓度;
B、—14CH3所含的中子数为14-6=8
C、标准状况下,苯、H2O、SO3、HF、CCl4、Br2是非气体;
D、 酯化反应是可逆反应,反应不能进行完全;
15.【答案】C
【解析】【解答】A.KHCO3为离子化合物,1molKHCO3晶体含有2mol离子;100gKHCO3晶体即为1mol,含有的离子数为2NA;A不符合题意;
B.由于Cl2+PCl3 PCl5 为可逆反应,反应物转化率小于100%,所以1molCl2和足量的PCl3混合充分反应,PCl5分子数目小于NA;B不符合题意;
C.铁在氧气中燃烧生成四氧化三铁,铁元素化合价由0价升高到+8/3价,1mol铁失去电子8/3mol,3molFe在纯氧中完全燃烧转移的电子数为8NA,C符合题意;
D.标准状况下,正戊烷不是气态,不能用气体摩尔体积计算22.4L正戊烷中含有共价键的数目,D不符合题意;
故答案为:C。
【分析】根据物质的量与摩尔质量、气体摩尔体积等的关系分析与阿伏加德罗常数的关系即可。
16.【答案】B
【解析】【解答】解:A.焰色反应为元素性质,钠的焰色为黄色,故A正确;
B.钠与氧气常温下反应生成氧化钠,故B错误;
C.过氧化钠与水反应生成氢氧化钠2Na2O2+2H2O═4NaOH+O2↑,氢氧化钠潮解得到氢氧化钠溶液,故C正确;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气,所以看到现象,产生氢氧化铜沉淀和氧气,故D正确;
故选:B.
【分析】A.钠的焰色为黄色,焰色反应为元素性质;
B.钠与氧气常温下反应生成氧化钠;
C.过氧化钠与水反应生成氢氧化钠;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气.
17.【答案】(1)碳酸钠与水反应生成Na2CO3 xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量
(2)BC;NaCl和NaHCO3;小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点
(3)2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑
【解析】【解答】解:(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程,故答案为:碳酸钠与水反应生成Na2CO3 xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,所以第一次溶液呈碱性,达到两次反应终点是B,然后碳酸氢钠与盐酸反应生成氯化钠,呈中性,达到两次反应终点是C,故选:BC;②由①知B点的主要溶质是NaCl和NaHCO3,故答案为:NaCl和NaHCO3;③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的pH小于D点的pH,故答案为:小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,所以反应方程式为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑,故答案为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑.
【分析】(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程;(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,然后碳酸氢钠与盐酸反应生成氯化钠;②由①知B点的主要溶质是NaCl和NaHCO3;③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的pH小于D点的pH;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,由此分析解答.
18.【答案】(1)A或选B;16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O或NaClO+HCl(浓)=NaCl+Cl2↑+H2O;4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;g→h→g→h→e→f→i
(2)黄绿气体颜色慢慢变浅;2NH3+3Cl2=N2+6HCl、NH3+HCl =NH4Cl
(3)取少量白烟固体样品于试管中,加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝证明有NH4+;将X中的氨气改为H2S,进行同样的实验,观察到Y试管中产生淡黄色固体
【解析】【解答】(1)①若用浓盐酸与二氧化锰加热生成氯气,实验需要用装置B,反应方程式是4HCl(浓)+MnO2= MnCl2+Cl2↑+2H2O;若用高锰酸钾与浓盐酸反应制取氯气,实验需要用装置A,反应方程式是16HCl(浓)+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O;②欲收集一瓶干燥、纯净氯气,需要用饱和食盐水除去氯气中的氯化氢气体,并用浓硫酸干燥,用向下排空气法收集,并进行尾气处理,所以连接顺序为:发生装置g→h→g→h→e→f→i ;(2)少量NH3非常缓慢充入Y管中,少量氨气与氯气反应生成氮气和氯化氢气体,现象是黄绿气体颜色慢慢变浅,反应方程式是2NH3+3Cl2==N2+6HCl;继续较快通入NH3,过量的氨气与氯化氢反应生成氯化铵,反应方程式是NH3+HCl ==NH4Cl;(3)①白烟所含物质是氯化铵,取少量白烟固体样品于试管中,加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝证明有NH4+;②非金属性越强,单质氧化性越强,将X中的氨气改为H2S,进行同样的实验,观察到Y试管中产生淡黄色固体,证明氯气氧化性大于S,所以氯元素比硫元素非金属性强。
答案为:(1)①A或选B、16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O或NaClO+HCl(浓)=NaCl+Cl2↑+H2O;4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;②g→h→g→h→e→f→i ; (2)黄绿气体颜色慢慢变浅、2NH3+3Cl2=N2+6HCl、NH3+HCl =NH4Cl; (3)①取少量白烟固体样品于试管中,加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝证明有NH4+;②将X中的氨气改为H2S,进行同样的实验,观察到Y试管中产生淡黄色固体;
【分析】本实验对NH3 与Cl2反应进行了探究。(1)考查氯气的实验室制备,因为浓盐酸易挥发,在加热条件下有水蒸气,所以需要用饱和食盐水除去氯气中的氯化氢气体,并用浓硫酸干燥;(2)氨气与氯气发生氧化还原反应;(3)①NH4+的检验:使湿润红色石蕊试纸变蓝;②根据非金属性越强,单质氧化性越强进行分析
19.【答案】(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)平衡装置中压强,防止玻璃仪器破裂
(3)②;⑤
(4)氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】【解答】(1)固体二氧化锰和浓盐酸,加热反应生成氯化锰、氯气、水的化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;装置B是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱,所以B中长颈漏斗起到平衡压强的作用;(2)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,所以I处放湿润的有色布条,Ⅱ中的干燥剂必须是固体干燥剂,且不能与氯气反应,所以选无水氯化钙,再通过干燥的有色布条验证氯气没有漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条;
(3)氧化性Cl2>Br2>I2,所以氯气能置换出碘;若通入Cl2过量,可能是过量氯气置换出I2 ;
(4)装置F中用足量的NaOH溶液吸收余氯反应,化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O。
【分析】实验中首先要注意的是实验目的,在实验装置中注意先应是发生装置,后是除杂装置,所后反应,性质验证及尾气处理装置。
20.【答案】(1)E﹣C;D﹣A;B﹣H;G﹣F
(2)圆底烧瓶、分液漏斗
(3)MnO2+2Cl﹣+4H+ Mn2++Cl2↑+2H2O
(4)<
(5)除去挥发出的HCl气体,抑制Cl2在水中的溶解
(6)Cl2+2NaOH=NaCl+NaClO+H2O
(7)氯气为黄绿色气体,密度大于空气密度,依据集气瓶是否充满黄绿色气体判断
【解析】【解答】解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;除杂装置中长导管进气、短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接盛有饱和食盐水的装置后连接盛浓硫酸的装置;收集装置中,氯气的密度大于空气的,应该采用长进短出的方式,故导管连接顺序为:E﹣C﹣D﹣A﹣B﹣H﹣G﹣F,故答案为:E﹣C;D﹣A;B﹣H;G﹣F;(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有反应容器圆底烧瓶、添加浓盐酸的分液漏斗、加热需要的酒精灯等,所以用到的玻璃仪器除酒精灯外,还有圆底烧瓶、分液漏斗,故答案为:圆底烧瓶、分液漏斗;(3)气体发生装置中进行的反应是氯气的实验室制备,反应的离子方程式为:MnO2+2Cl﹣+4H+ Mn2++Cl2↑+2H2O,故答案为:MnO2+2Cl﹣+4H+ Mn2++Cl2↑+2H2O;(4)反应的化学方程式为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,A.n(HCl)= =4mol,n(MnO2)= =2mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol;B.n(MnO2)= =1mol,由于浓盐酸足量,生成的n(Cl2)=1mol,所以所得Cl2 的物质的量的关系,A<B,故答案为:<;(5)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl﹣+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,故答案为:除去挥发出的HCl气体,抑制Cl2在水中的溶解;(6)氯气是有毒的气体,氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收多余的氯气,防止污染空气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;(7)氯气为黄绿色气体,密度大于空气密度,所以当收集满氯气时,集气瓶充满黄绿色气体,观察集气瓶是否充满黄绿色气体验证,答:集气瓶充满黄绿色气体;
【分析】(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;(2)发生装置是制备氯气的装置,需要圆底烧瓶、分液漏斗和酒精灯等;(3)实验制备氯气气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;(4)浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题;(5)根据氯气、氯化氢的溶解性大小分析;(6)氯气有毒,多余的氯气需要用氢氧化钠吸收;(7)氯气为黄绿色气体,密度大于空气密度,依据集气瓶是否充满黄绿色气体判断;
21.【答案】(1)
(2)
(3)
(4) %
【解析】【解答】解:(1)m g某气体的物质的量为 = mol,
故答案为: ;(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2× mol×NAmol﹣1= ,故答案为: ;(3)该体积的体积为 mol×22.4L/mol= L,故答案为: ;(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω= ×100%= %,故答案为: %.
【分析】(1)据n= 计算;(2)根据每个分子中含有的原子数计算总原子数;3)根据V=nVm计算;(4)计算溶液和溶质的质量,可计算质量分数.
22.【答案】(1)36 g·mol-1
(2)0.4NA
(3)5.6 g;4.48 L;2.8NA
【解析】【解答】
(1)n(混合气体)=8.96L22.4L/mol=0.4mol,混合气体的平均摩尔质量为14.4g0.4mol=36g/mol。
(2)1个CO、CO2中都含1个碳原子,则混合气体中碳原子物质的量为0.4mol,碳原子数为0.4NA。
(3)根据题意可列式:n(CO)+n(CO2)=0.4mol,28g/mol× n(CO)+44g/mol×n(CO2)=14.4g,解得n(CO)=0.2mol,n(CO2)=0.2mol;一氧化碳的质量为5.6g,标准状况下气球中收集到的CO的体积为0.2mol×22.4L/mol=4.48L。1个CO分子中含14个电子,则气球中收集到的CO气体所含电子物质的量为0.2mol×14=2.8mol,电子数为2.8NA。
【分析】(1)根据、计算;
(2)1个CO、CO2中都含1个碳原子;
(3)气体通过NaOH溶液时CO2被吸收,通过浓硫酸时H2O(g)被吸收,最后收集在气球中的气体为CO
一、单选题
1.少量钠应保存在( )
A.密闭容器中 B.水中 C.煤油中 D.汽油中
2.下列说法中正确的是( )
A.1molNaOH的质量是40g B.1molCH4体积约为22.4L
C.CO2的摩尔质量为44g D.1molH2O中约含6.02×1023个H
3.下列有关实验中,会导致所配制(或所测定)溶液浓度偏高的是(其它操作均正确)( )
A.用标准NaOH滴定未知浓度的CH3COOH,用甲基橙作指示剂,溶液由红色变橙色立即停止滴定
B.用容量瓶配制100 mL 5 mol/L氯化钠溶液试验中,定容时仰视
C.用标准盐酸滴定待测NaOH溶液试验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定待测盐酸实验中,碱式滴定管开始无气泡,后来有气泡
4.“墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来。”诗人在远处能闻到梅花香味,表明( )
A.分子很小 B.分子可再分
C.分子之间有间隙 D.分子在不停地运动
5.为了配制100 mL 1 mol·L 1 NaOH溶液,其中有下列几个操作:( )
①NaOH用纸盛载进行称量;
②选刚用蒸馏水洗净的100 mL容量瓶进行配制;
③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切。
其中操作错误的是
A.①②④ B.③④⑤ C.②③⑤ D.①③⑤
6.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60g
B.6.02×1023个偏二甲肼分子的质量约为60g
C.1mol偏二甲肼的质量为60g/mol
D.6g偏二甲肼含有1.2NA个偏二甲肼分子
7.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.加热时,金属钠剧烈燃烧,产生黄色火焰
D.金属钠着火可以用泡沫灭火器或用干燥的沙土灭火
8.下列关于金属钠的叙述中,说法正确的是( )
A.金属钠可以保存在少量水中
B.钠长时间暴露在空气中,最终产物是Na2CO3
C.钠是银白色金属,硬度大,熔点高
D.Na与CuSO4溶液反应可以置换出Cu单质
9.在标准状况下①② 个 分子 ③④ ,下列对这四种气体的关系从大到小表达正确的是( )
A.体积 ②>③>①>④ B.密度 ②>③>①>④
C.分子数 ④>③>②>① D.氢原子个数 ①>②>③>④
10.设NA为阿伏加德罗常数的值。下列有关叙述错误的是( )
A.乙烯和环丁烷(C4H8)的混合气体共28 g充分燃烧消耗3NA个O2
B.0.1mol-NH2 (氨基)中所含有的电子数为NA
C.1L0.1mol·L-1Na2S溶液中,S2-、HS-和H2S的微粒数之和为0.1NA
D.在K37ClO3+ 6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中电子转移的数目为5NA
11.下列说法正确的是( )
A.Na的摩尔质量是
B.22 g CO2物质的量为2.2 mol
C.1 mol Cl2中含有的氯原子数约为
D.常温常压下,1 mol N2的体积是22.4 L
12.水的摩尔质量是( )
A.18 B.18 g
C.18 g/mol D.18 mol
13.常温常压下,等质量的 NH3、Cl2、NO、SO2 分别吹出四个气球,其中所充气体为 NO 的是( )
A. B.
C. D.
14.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B.常温常压下,17g甲基(—14CH3)所含的中子数9NA
C.标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为 NA
D.1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
15.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.100gKHCO3晶体中含有的离子数为3NA
B.一定条件下,将71gCl2和足量的PCl3混合充分反应,可得到NA个PCl5分子
C.3molFe在纯氧中完全燃烧转移的电子数为8NA
D.标准状况下,22.4L正戊烷中含有共价键的数目为16NA
16.下列关于钠及其化合物的说法错误的是( )
A.钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色
B.切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应
C.过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2+2H2O═4NaOH+O2↑
D.过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气
二、实验探究题
17.某班同学用如下实验探究Na2CO3、NaHCO3的性质.回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是 .
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
①碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是 (填A、B、C、D或E).
②B点的主要溶质是 (用化学式表示).
③B点 (填“大于”或“小于”) D点的pH,主要原因是 .
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式: .
18.浓氨水可用于检验氯气的泄漏,文献表明一定条件下NH3与Cl2可发生置换反应,某同学在实验室中对NH3 与Cl2反应进行了探究。回答下列题:
(1)氯气的制备
①氯气的发生装置可以选择上图中的 (填装置编号),反应的化学方程式为 。
②欲收集一瓶干燥、纯净氯气,选择上图中的装置部分装置可以重复使用,E 装置中试剂可根据需要改变),其连接顺序为:发生装置→ 按气流方向,用小写字母表示)。
(2)NH3 与Cl2的反应
将上述收集到的Cl2连接在右图Y中,在注射器X中充入NH3(中间连接管用夹子K 夹好)。按图示装置进行实验。
操作步骤 实验现象 解释原因
打开K,推动注射器活塞,使少量NH3非常缓慢充入Y管中 ①y 管中.没有出现明显的白烟 ②反应的化学方程式
继续较快通入NH3 Y 管中产生较多白烟 ③产生白烟的化学方程式 。
(3)实验设计:
①设计实验证明白烟所含物质中的阳离子 。
②用(2)中装置设计实验证明氯元素比硫元素非金属性强 。
19.某校一化学兴趣小组为研究氯气的一些性质,设计如下装置进行系列实验(夹持及加热仪器已略).
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置 A 中的化学反应方程式: .
(2)装置 B 中长颈漏斗的作用是
(3)装置 C 为研究 Cl2 是否具有漂白性,现有:
①干燥的有色布条
②湿润的有色布条
③碱石灰
④浓硫酸
⑤无水氯化钙,其中Ⅰ处为 Ⅲ处为①,则Ⅱ处为: (填上述物质中的序号)
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性强弱.当向 D 中缓缓通入一定量氯气时,可以 看到 D 中无色溶液逐渐变为橙色,再打开 D 装置的活塞,使 D 中溶液滴入 E 装置,振荡锥形瓶后静置一会儿,可以观察到下层液体呈紫红色.同学们经过认真讨论后认为该实验方案仍有不足,理由是
(5)装置 F 的作用是吸收尾气,在烧杯中发生反应的化学方程式为 .
三、综合题
20.实验室中用二氧化锰和浓盐酸反应制备氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):接 ;接 ;接 ;接 .
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有 .
(3)写出用如图装置制备氯气的离子方程式 :
(4)A、B两组同学分别用两种方法制取氯气:A组用含146g HCl的浓盐酸与足量的二氧化锰反应;B组用87g二氧化锰与足量的浓盐酸反应,则所得氯气的物质的量的关系为A B(填“>”、“<”或“=”)
(5)实验中饱和食盐水的作用是 :
(6)写出氯气尾气吸收的化学方程式: .
(7)如何验证氯气已经收集满?
21.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g mol﹣1.若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 ;
(2)该气体所含原子总数为 个;
(3)该气体在标准状况下的体积为 ;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
22.现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量: 。
(2)混合气体中碳原子的个数: 。(用NA表示阿伏加德罗常数的值)
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体的质量为: ;
②气球中收集到的气体在标准状况下的体积为 ;
③气球中收集到的气体的电子总数为 。(用NA表示阿伏加德罗常数的值)
答案解析部分
1.【答案】C
【解析】【解答】钠的性质活泼,能够与空气中的氧气和水蒸汽反应,故少量钠应保存在煤油中,以隔绝空气,
故答案为:C。
【分析】钠单质是非常活泼的金属单质,暴露在空气中会和氧气、水进行反应,因此应该将钠单质隔离存放,又由于钠的密度大于煤油,因此将钠单质存放在煤油中。
2.【答案】A
【解析】【解答】
A.1molNaOH的质量是1mol×40g/mol=40g。故A符合题意。
B.气体体积与气体所处状态有关。不知温度与压强1molCH4体积无法确定。故B错。
C.摩尔质量单位为g/mol。故C错。
D.1molH2O中约含2×6.02×1023个H。故D错。
【分析】
。
3.【答案】C
【解析】【解答】A、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,若选用甲基橙作指示剂,滴定终点时溶液在酸性范围,标准液的体积偏小,所测定溶液浓度偏低,选项A不符合题意;
B、用容量瓶配制100 mL 5 mol/L氯化钠溶液试验中,定容时仰视则所加蒸馏水偏多,溶液浓度偏低,选项B不符合题意;
C、用标准盐酸滴定待测NaOH溶液试验中,使用碱式滴定管开始平视,后来俯视读数,则所读数体积偏小,滴定消耗的标准盐酸体积偏低,所测定溶液浓度偏低,选项C符合题意;
D、用标准NaOH溶液滴定待测盐酸实验中,碱式滴定管开始无气泡,后来有气泡,则标准液体积偏大,所测定溶液浓度偏高,选项D不符合题意。
故答案为:C。
【分析】A.甲基橙指示变色范围在酸性条件下,会使得标准液的消耗量减少,导致测得的浓度偏小;
B.定容仰视,说明加入的蒸馏水偏多,会导致溶液浓度偏小;
C.仰视读数会使消耗的标准液的已经偏小,这时测得的结果就会偏高;
D.碱式滴定管内一开始有气泡后来气泡消失,这样会导致标准溶液的体积偏大,最终测得的结果偏小。
4.【答案】D
【解析】【解答】诗句中说到在远远的地方就能闻到梅花的香味,是因为梅花中含有香味的分子在不断的运动,飘入到作者鼻孔中的原因.说明了分子中不断地运动,故选D。
故正确答案为:D。
【分析】分子的特点做布朗运动。
5.【答案】D
【解析】【解答】NaOH固体易潮解,具有腐蚀性,应放在烧杯进行称量,①错误;配制100mL溶液,只能选择100mL容量瓶,容量瓶不干燥对所配溶液难度无影响,因最后需加水定容,②正确;NaOH溶于水放热,如果不冷却至室温,立即把溶液转移到容量瓶中配制,溶液固液热胀冷缩性质,冷却后所配溶液体积偏小,导致所配溶液浓度偏高,③错误;烧杯上会沾有少量溶质氢氧化钠,为尽可能将氢氧化钠移入容量瓶中,应用蒸馏水洗涤烧杯内壁及玻璃棒,洗涤液也均转入容量瓶中,④正确;为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,⑤错误;①③⑤错误。
故答案为:D
【分析】①固体的称量大多需垫称量纸,但烧碱易吸水、有腐蚀性,应放在小烧杯中快速称量,
②配制100 mL ,选用100 mL容量瓶,且容量瓶使用前需检漏洗涤
③容量瓶只是用于配置一定浓度的溶液,不能用于溶解溶质,且容量瓶的容积受到温度影响
④为了标定体积精确,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平
⑤容量瓶的容积受到温度影响,所以烧碱溶解放热,应恢复至室温再移液
6.【答案】B
【解析】【解答】解:A.偏二甲肼(C2H8N2)的摩尔质量为(12×2+1×8+14×2)g/mol=60g/mol,故A错误;
B.6.02×1023个偏二甲肼的物质的量为1mol,所以1 mol 偏二甲肼的质量为60 g,故B正确;
C.1mol偏二甲肼的质量为60 g,故C错误;
D.偏二甲肼的物质的量为 =0.1mol,含有的分子数为0.1×NA,故D错误.
故选B.
【分析】A.摩尔质量的单位为g/mol;
B.6.02×1023个偏二甲肼的物质的量为1mol,质量的单位为g;
C.1mol物质的质量再数值上等于摩尔质量,质量的单位为g;
D.利用n= ,N=n×NA来计算分子数.
7.【答案】C
【解析】【解答】A. 钠质地软,可以用小刀切割,A不符合题意;
B. 钠放置在空气中,会迅速被氧化而生成白色的氧化钠,B不符合题意;
C. 加热时,金属钠与氧气发生反应生成过氧化钠,反应放热出现剧烈燃烧,钠焰色反应为黄色,故产生黄色火焰,C符合题意;
D. 钠能与水剧烈反应,不能用泡沫灭火器灭火,只能用干燥的沙土灭火,D不符合题意;
故答案为:C。
【分析】A、根据钠单质为银白色,熔沸点较低,硬度低解答;
B、根据钠常温下与氧气反应生成氧化钠,燃烧时生成过氧化钠,为淡黄色固体解答;
C、根据钠的颜色反应为黄色解答;
D、根据钠着火生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,促进燃烧解答;
8.【答案】B
【解析】【解答】A.因金属钠常温下能与水剧烈反应,故金属钠不能保存在水中,可以保存在煤油中,A不符合题意;
B.因钠与空气中氧气极易反应生成氧化钠,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体二氧化碳反应,生成白色带结晶水的固体Na2CO3·10H2O,十水碳酸钠易风化生成白色粉末碳酸钠,B符合题意;
C.钠是银白色金属,可用小刀进行切割说明硬度小,与水反应时很快熔成闪亮的小球说明熔点低, C不符合题意;
D.钠投入硫酸铜溶液时,钠和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜发生复分解反应生成氢氧化铜蓝色沉淀,所以得不到金属单质铜,D不符合题意;
故答案为:B。
【分析】A.金属钠应保存在煤油中;
B.钠长期暴露在空气中,能与空气中的O2、H2O和CO2反应;
C.钠的硬度小,熔点低;
D.钠不与盐溶液发生置换反应;
9.【答案】A
【解析】【解答】A.相同条件下,气体的体积之比等于物质的量之比,所以体积大小关系:②>③>①>④,A项符合题意;
B.各物质的摩尔质量分别为①CH4为16g/mol,②HCl为36.5g/mol,③H2S 为34g/mol,④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,B项不符合题意;
C.同温同压下,分子数之比等于物质的量之比,所以分子数大小关系:②>③>①>④,C项不符合题意;
D.各物质中H原子的物质的量分别为①CH4为0.3mol×4=1.2mol,②HCl为0.5mol,③H2S 0.4mol×2=0.8mol,④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,D项不符合题意;
故答案为:A。
【分析】A. 相同条件下,气体的体积之比等于物质的量之比,据此分析;
B. 相同条件下,密度之比等于摩尔质量之比,据此分析;
C. 相同条件下,分子数之比等于物质的量之比,只需计算各物质的量进行比较,据此分析;
D. 计算出各物质的物质的量,结合化学式判断H原子的物质的量,据此分析.
10.【答案】B
【解析】【解答】A.乙烯和环丁烷的最简式都是CH2,当混合气体为28g时,可以认为有2molCH2,其燃烧需要的氧气为2×(1+ )=3mol,所以需要的氧气分子为3NA个,选项A不符合题意。
B.一个氨基含有9个电子(N有7个电子,加上两个H的两个电子,注意氨基是不带电的中性基团),所以0.1mol氨基由0.9NA个电子,选项B符合题意。
C.1L0.1mol·L-1Na2S溶液中,含有的S一共为0.1mol,根据元素守恒得到S2-、HS-和H2S的微粒数之和为0.1NA,选项C不符合题意。
D.根据化合价变化最小的基本原理,在K37ClO3+ 6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,氯酸钾中的1个37Cl转化为氯气分子中的0价氯原子,H35Cl中有5个35Cl转化为氯气分子中的0价氯原子,即氯气中的37Cl:35Cl=1:5,得到这样的氯气的分子量为 ,所以212g氯气为3mol。该反应的电子转移数为5,所以每生成3个Cl2应该转移5个电子,得到生成212g氯气(3mol)转移5mol即5NA电子。选项D不符合题意。
【分析】根据摩尔质量、物质的量浓度、氧化还原反应等计算其物质的量,然后与阿伏加德罗常数进行比较即可。
11.【答案】A
【解析】【解答】A.Na相对原子质量是23,所以Na的摩尔质量是23 g/mol,A符合题意;
B.CO2摩尔质量是44 g/mol,则22 g CO2物质的量为n(CO2)==0.5 mol,B 不符合题意;
C.Cl2分子中含有2个Cl原子,则1 mol Cl2中含有的氯原子数约为,C不符合题意;
D.常温常压下的气体摩尔体积大于22.4 L/mol,则1 mol N2的体积大于22.4 L,D不符合题意;
故答案为:A。
【分析】A.依据相对原子质量数值等于摩尔质量(单位为g/mol);
B.依据n=计算;
C.Cl2分子中含有2个Cl原子;
D.常温常压下的气体摩尔体积大于22.4 L/mol。
12.【答案】C
【解析】【解答】摩尔质量以g/mol为单位时,在数值上等于粒子的相对原子质量或相对分子质量,所以水的摩尔质量为18g/mol,
故答案为:C。
【分析】注意摩尔质量是有单位的,其数值上与相对分子质量相同。
13.【答案】C
【解析】【解答】同温同压下,相同质量的气体,体积之比与摩尔质量成反比,即摩尔质量越大,气体占有的体积越小。Cl2的摩尔质量为71g/mol,NO的摩尔质量为30g/mol,NH3的摩尔质量为17g/mol,SO2的摩尔质量为64g/mol,故同温同压下,等质量的NH3、Cl2、NO、SO2占有体积大小为:NH3> NO> SO2>Cl2,所以其中所充气体为 NO,C符合题意;
故答案为:C
【分析】根据公式和公式V=n×Vm确定等质量的四种气体的体积,从而确定答案。
14.【答案】A
【解析】【解答】A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA,A符合题意;
B. 常温常压下,17g甲基(—14CH3)是1mol,所含的中子数8NA,B不符合题意;
C. 标准状况下己烷不是气态,不能利用气体摩尔体积计算物质的量,C不符合题意;
D. 酯化反应是可逆反应,1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成CH3CO18OC2H5分子的个数小于NA个,D不符合题意,故答案为:A。
【分析】A、通过pH和水的离子积常数计算溶液中含有OH-的浓度;
B、—14CH3所含的中子数为14-6=8
C、标准状况下,苯、H2O、SO3、HF、CCl4、Br2是非气体;
D、 酯化反应是可逆反应,反应不能进行完全;
15.【答案】C
【解析】【解答】A.KHCO3为离子化合物,1molKHCO3晶体含有2mol离子;100gKHCO3晶体即为1mol,含有的离子数为2NA;A不符合题意;
B.由于Cl2+PCl3 PCl5 为可逆反应,反应物转化率小于100%,所以1molCl2和足量的PCl3混合充分反应,PCl5分子数目小于NA;B不符合题意;
C.铁在氧气中燃烧生成四氧化三铁,铁元素化合价由0价升高到+8/3价,1mol铁失去电子8/3mol,3molFe在纯氧中完全燃烧转移的电子数为8NA,C符合题意;
D.标准状况下,正戊烷不是气态,不能用气体摩尔体积计算22.4L正戊烷中含有共价键的数目,D不符合题意;
故答案为:C。
【分析】根据物质的量与摩尔质量、气体摩尔体积等的关系分析与阿伏加德罗常数的关系即可。
16.【答案】B
【解析】【解答】解:A.焰色反应为元素性质,钠的焰色为黄色,故A正确;
B.钠与氧气常温下反应生成氧化钠,故B错误;
C.过氧化钠与水反应生成氢氧化钠2Na2O2+2H2O═4NaOH+O2↑,氢氧化钠潮解得到氢氧化钠溶液,故C正确;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气,所以看到现象,产生氢氧化铜沉淀和氧气,故D正确;
故选:B.
【分析】A.钠的焰色为黄色,焰色反应为元素性质;
B.钠与氧气常温下反应生成氧化钠;
C.过氧化钠与水反应生成氢氧化钠;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气.
17.【答案】(1)碳酸钠与水反应生成Na2CO3 xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量
(2)BC;NaCl和NaHCO3;小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点
(3)2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑
【解析】【解答】解:(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程,故答案为:碳酸钠与水反应生成Na2CO3 xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,所以第一次溶液呈碱性,达到两次反应终点是B,然后碳酸氢钠与盐酸反应生成氯化钠,呈中性,达到两次反应终点是C,故选:BC;②由①知B点的主要溶质是NaCl和NaHCO3,故答案为:NaCl和NaHCO3;③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的pH小于D点的pH,故答案为:小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,所以反应方程式为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑,故答案为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑.
【分析】(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程;(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,然后碳酸氢钠与盐酸反应生成氯化钠;②由①知B点的主要溶质是NaCl和NaHCO3;③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的pH小于D点的pH;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,由此分析解答.
18.【答案】(1)A或选B;16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O或NaClO+HCl(浓)=NaCl+Cl2↑+H2O;4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;g→h→g→h→e→f→i
(2)黄绿气体颜色慢慢变浅;2NH3+3Cl2=N2+6HCl、NH3+HCl =NH4Cl
(3)取少量白烟固体样品于试管中,加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝证明有NH4+;将X中的氨气改为H2S,进行同样的实验,观察到Y试管中产生淡黄色固体
【解析】【解答】(1)①若用浓盐酸与二氧化锰加热生成氯气,实验需要用装置B,反应方程式是4HCl(浓)+MnO2= MnCl2+Cl2↑+2H2O;若用高锰酸钾与浓盐酸反应制取氯气,实验需要用装置A,反应方程式是16HCl(浓)+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O;②欲收集一瓶干燥、纯净氯气,需要用饱和食盐水除去氯气中的氯化氢气体,并用浓硫酸干燥,用向下排空气法收集,并进行尾气处理,所以连接顺序为:发生装置g→h→g→h→e→f→i ;(2)少量NH3非常缓慢充入Y管中,少量氨气与氯气反应生成氮气和氯化氢气体,现象是黄绿气体颜色慢慢变浅,反应方程式是2NH3+3Cl2==N2+6HCl;继续较快通入NH3,过量的氨气与氯化氢反应生成氯化铵,反应方程式是NH3+HCl ==NH4Cl;(3)①白烟所含物质是氯化铵,取少量白烟固体样品于试管中,加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝证明有NH4+;②非金属性越强,单质氧化性越强,将X中的氨气改为H2S,进行同样的实验,观察到Y试管中产生淡黄色固体,证明氯气氧化性大于S,所以氯元素比硫元素非金属性强。
答案为:(1)①A或选B、16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O或NaClO+HCl(浓)=NaCl+Cl2↑+H2O;4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;②g→h→g→h→e→f→i ; (2)黄绿气体颜色慢慢变浅、2NH3+3Cl2=N2+6HCl、NH3+HCl =NH4Cl; (3)①取少量白烟固体样品于试管中,加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝证明有NH4+;②将X中的氨气改为H2S,进行同样的实验,观察到Y试管中产生淡黄色固体;
【分析】本实验对NH3 与Cl2反应进行了探究。(1)考查氯气的实验室制备,因为浓盐酸易挥发,在加热条件下有水蒸气,所以需要用饱和食盐水除去氯气中的氯化氢气体,并用浓硫酸干燥;(2)氨气与氯气发生氧化还原反应;(3)①NH4+的检验:使湿润红色石蕊试纸变蓝;②根据非金属性越强,单质氧化性越强进行分析
19.【答案】(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)平衡装置中压强,防止玻璃仪器破裂
(3)②;⑤
(4)氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】【解答】(1)固体二氧化锰和浓盐酸,加热反应生成氯化锰、氯气、水的化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;装置B是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱,所以B中长颈漏斗起到平衡压强的作用;(2)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,所以I处放湿润的有色布条,Ⅱ中的干燥剂必须是固体干燥剂,且不能与氯气反应,所以选无水氯化钙,再通过干燥的有色布条验证氯气没有漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条;
(3)氧化性Cl2>Br2>I2,所以氯气能置换出碘;若通入Cl2过量,可能是过量氯气置换出I2 ;
(4)装置F中用足量的NaOH溶液吸收余氯反应,化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O。
【分析】实验中首先要注意的是实验目的,在实验装置中注意先应是发生装置,后是除杂装置,所后反应,性质验证及尾气处理装置。
20.【答案】(1)E﹣C;D﹣A;B﹣H;G﹣F
(2)圆底烧瓶、分液漏斗
(3)MnO2+2Cl﹣+4H+ Mn2++Cl2↑+2H2O
(4)<
(5)除去挥发出的HCl气体,抑制Cl2在水中的溶解
(6)Cl2+2NaOH=NaCl+NaClO+H2O
(7)氯气为黄绿色气体,密度大于空气密度,依据集气瓶是否充满黄绿色气体判断
【解析】【解答】解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;除杂装置中长导管进气、短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接盛有饱和食盐水的装置后连接盛浓硫酸的装置;收集装置中,氯气的密度大于空气的,应该采用长进短出的方式,故导管连接顺序为:E﹣C﹣D﹣A﹣B﹣H﹣G﹣F,故答案为:E﹣C;D﹣A;B﹣H;G﹣F;(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有反应容器圆底烧瓶、添加浓盐酸的分液漏斗、加热需要的酒精灯等,所以用到的玻璃仪器除酒精灯外,还有圆底烧瓶、分液漏斗,故答案为:圆底烧瓶、分液漏斗;(3)气体发生装置中进行的反应是氯气的实验室制备,反应的离子方程式为:MnO2+2Cl﹣+4H+ Mn2++Cl2↑+2H2O,故答案为:MnO2+2Cl﹣+4H+ Mn2++Cl2↑+2H2O;(4)反应的化学方程式为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,A.n(HCl)= =4mol,n(MnO2)= =2mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol;B.n(MnO2)= =1mol,由于浓盐酸足量,生成的n(Cl2)=1mol,所以所得Cl2 的物质的量的关系,A<B,故答案为:<;(5)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl﹣+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,故答案为:除去挥发出的HCl气体,抑制Cl2在水中的溶解;(6)氯气是有毒的气体,氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收多余的氯气,防止污染空气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;(7)氯气为黄绿色气体,密度大于空气密度,所以当收集满氯气时,集气瓶充满黄绿色气体,观察集气瓶是否充满黄绿色气体验证,答:集气瓶充满黄绿色气体;
【分析】(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;(2)发生装置是制备氯气的装置,需要圆底烧瓶、分液漏斗和酒精灯等;(3)实验制备氯气气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;(4)浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题;(5)根据氯气、氯化氢的溶解性大小分析;(6)氯气有毒,多余的氯气需要用氢氧化钠吸收;(7)氯气为黄绿色气体,密度大于空气密度,依据集气瓶是否充满黄绿色气体判断;
21.【答案】(1)
(2)
(3)
(4) %
【解析】【解答】解:(1)m g某气体的物质的量为 = mol,
故答案为: ;(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2× mol×NAmol﹣1= ,故答案为: ;(3)该体积的体积为 mol×22.4L/mol= L,故答案为: ;(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω= ×100%= %,故答案为: %.
【分析】(1)据n= 计算;(2)根据每个分子中含有的原子数计算总原子数;3)根据V=nVm计算;(4)计算溶液和溶质的质量,可计算质量分数.
22.【答案】(1)36 g·mol-1
(2)0.4NA
(3)5.6 g;4.48 L;2.8NA
【解析】【解答】
(1)n(混合气体)=8.96L22.4L/mol=0.4mol,混合气体的平均摩尔质量为14.4g0.4mol=36g/mol。
(2)1个CO、CO2中都含1个碳原子,则混合气体中碳原子物质的量为0.4mol,碳原子数为0.4NA。
(3)根据题意可列式:n(CO)+n(CO2)=0.4mol,28g/mol× n(CO)+44g/mol×n(CO2)=14.4g,解得n(CO)=0.2mol,n(CO2)=0.2mol;一氧化碳的质量为5.6g,标准状况下气球中收集到的CO的体积为0.2mol×22.4L/mol=4.48L。1个CO分子中含14个电子,则气球中收集到的CO气体所含电子物质的量为0.2mol×14=2.8mol,电子数为2.8NA。
【分析】(1)根据、计算;
(2)1个CO、CO2中都含1个碳原子;
(3)气体通过NaOH溶液时CO2被吸收,通过浓硫酸时H2O(g)被吸收,最后收集在气球中的气体为CO
