2.1化学反应速率 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1化学反应速率 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 902.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 13:20:49 | ||
图片预览



文档简介
2.1化学反应速率同步练习题
一、选择题
1.下列做法与改变化学反应速率无关的是
A.在糕点包装内放置除氧剂 B.未成熟的猕猴桃与成熟的苹果一起密封
C.牛奶在冰箱里保存 D.高炉炼铁增加高炉的高度
2.在100mL稀盐酸中加入足量的锌粉,为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液,你认为可行的是
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
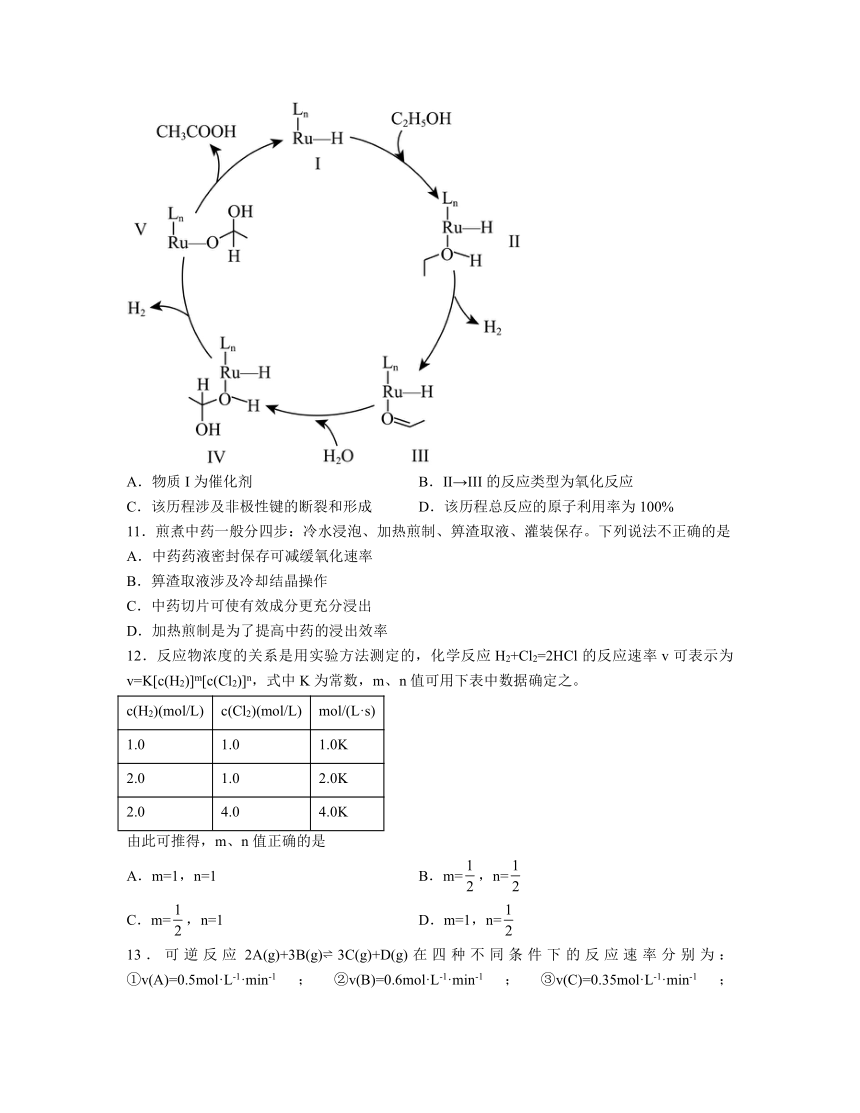
3.铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法正确的是
A.该过程的总反应速率由Ⅳ→Ⅰ步骤决定,最大能垒为89.7
B.该反应过程中浓度不变
C.与均在该反应过程中起催化作用
D.甲酸在作用下的分解反应放出热量
4.某反应分两步进行,其能量变化如图所示。下列说法正确的是
A.反应①的活化能
B.该反应过程中,反应速率由反应②决定
C.总反应的热化学方程式为
D.增大的浓度,可以增大活化分子百分数,提高化学反应速率
5.某温度下,在2L恒容密闭容器中4molNH2COONH4(s),发生如下反应,在0-1min内,CO2的生成速率为0.4mol L-1 min-1,0-2min内,CO2的生成速率为0.3mol L-1 min-1,0-3min内,CO2的生成速率为0.2mol L-1 min-1,下列说法错误的是
A.当混合气体的平均摩尔质量不变时,标志此反应达到了平衡状态
B.0-1min内,NH2COONH4(s)的反应速率为62.4g/min
C.30秒时,CO2的浓度大于0.2mol/L
D.2min时,再加入2molNH3,此时反应的V逆>V正
6.下列有关催化剂的说法错误的是
A.改变反应历程 B.改变基元反应的活化能
C.可能提高主反应选择性 D.不能提高反应物转化率
7.下列有关化学反应速率的说法正确的是
A.用锌粒和稀硫酸反应制取氢气时,增大硫酸的浓度一定能加快产生氢气的速率
B.的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.合成氨的反应是一个放热反应,所以升高反应温度,反应速率减慢
D.汽车尾气中的和可以缓慢反应生成和,减小压强,反应速率减慢
8.常温下,分别将四块形状相同、质量均为7 g的铁块同时投入下列四种溶液中,铁块溶解较快的是
A.250 mL 2 mol·L-1的盐酸 B.150 mL 2 mol·L-1的硫酸
C.500 mL 3 mol·L-1的盐酸 D.20 mL 18 mol·L-1的硫酸
9.反应,在不同情况下测得反应速率,其中反应速率最快的是
A. B.
C. D.
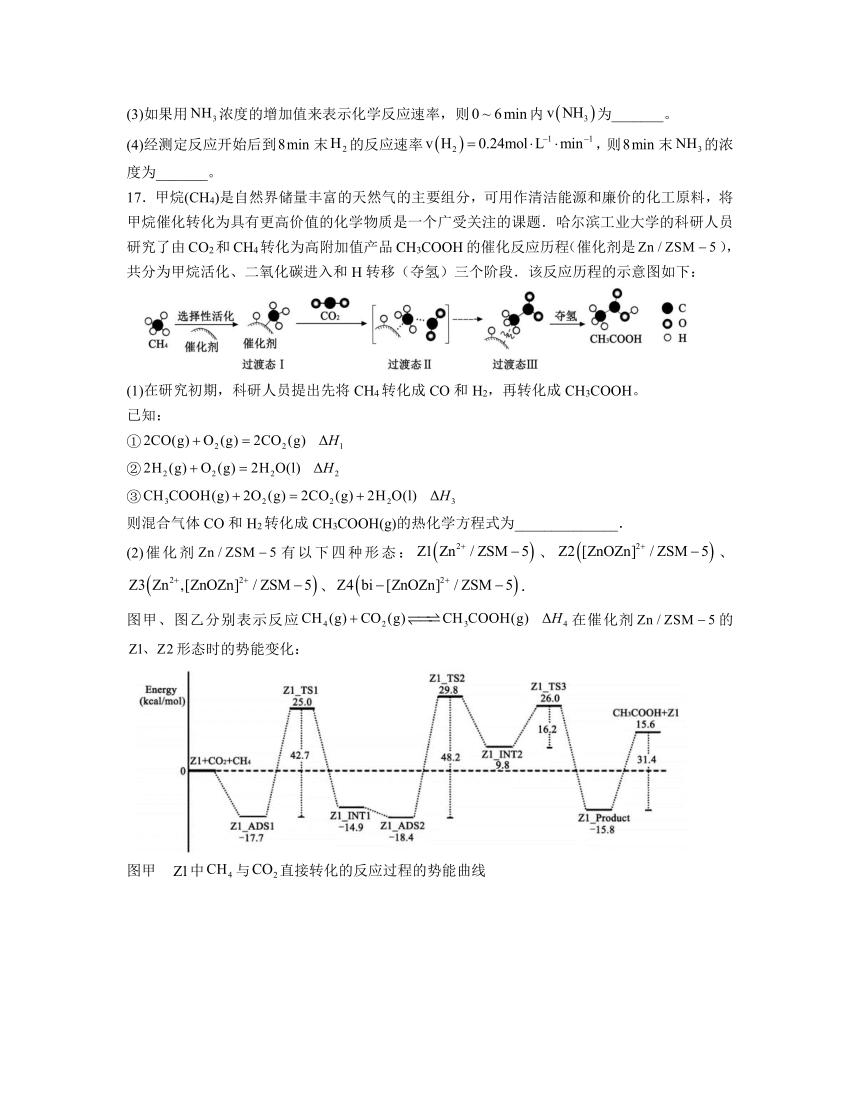
10.某新型催化剂能将乙醇催化转化为乙酸和氢气,其反应历程如图所示。下列说法错误
A.物质I为催化剂 B.II→III的反应类型为氧化反应
C.该历程涉及非极性键的断裂和形成 D.该历程总反应的原子利用率为100%
11.煎煮中药一般分四步:冷水浸泡、加热煎制、箅渣取液、灌装保存。下列说法不正确的是
A.中药药液密封保存可减缓氧化速率
B.箅渣取液涉及冷却结晶操作
C.中药切片可使有效成分更充分浸出
D.加热煎制是为了提高中药的浸出效率
12.反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2=2HCl的反应速率v可表示为v=K[c(H2)]m[c(Cl2)]n,式中K为常数,m、n值可用下表中数据确定之。
c(H2)(mol/L) c(Cl2)(mol/L) mol/(L·s)
1.0 1.0 1.0K
2.0 1.0 2.0K
2.0 4.0 4.0K
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=,n=
C.m=,n=1 D.m=1,n=
13.可逆反应2A(g)+3B(g) 3C(g)+D(g)在四种不同条件下的反应速率分别为:①v(A)=0.5mol·L-1·min-1;②v(B)=0.6mol·L-1·min-1;③v(C)=0.35mol·L-1·min-1;④v(D)=0.4mol·L-1·s-1。下列有关反应速率的比较中正确的是
A.④>①>②>③ B.④>①>③>②
C.①>②>③>④ D.②>①>③>④
14.下列有关说法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.已知C(石墨,s)=C(金刚石,s) ,故金刚石比石墨稳定
C.气态水比液态水稳定
D.升高温度能增大单位体积内的活化分子数,加快反应速率
15.我国科学家实现了在铜催化剂条件下将转化为三甲胺。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示(其中吸附在催化剂表面上的物种用*标注)。
下列说法错误的是
A.2个分子断键所吸收的能量低于1个DMF分子和4个H原子在铜催化剂表面吸附所释放的能量
B.该反应的热化学方程式为:
C.增大压强可以提高该反应的活化分子百分数,进而加快反应速率
D.该反应在低温下能正向自发进行
二、填空题
16.下表是实验室模拟合成氨反应:的部分数据。请分析后回答下列问题。
浓度
反应开始时的浓度() 2.5 2 0
时的浓度() 1.9
(1)内该反应的化学反应速率_______。
(2)在上表空格中填入合适数据_______、_______。
(3)如果用浓度的增加值来表示化学反应速率,则内为_______。
(4)经测定反应开始后到末的反应速率,则末的浓度为_______。
17.甲烷(CH4)是自然界储量丰富的天然气的主要组分,可用作清洁能源和廉价的化工原料,将甲烷催化转化为具有更高价值的化学物质是一个广受关注的课题.哈尔滨工业大学的科研人员研究了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程(催化剂是),共分为甲烷活化、二氧化碳进入和H转移(夺氢)三个阶段.该反应历程的示意图如下:
(1)在研究初期,科研人员提出先将CH4转化成CO和H2,再转化成CH3COOH。
已知:
①
②
③
则混合气体CO和H2转化成CH3COOH(g)的热化学方程式为______________.
(2)催化剂有以下四种形态:、、、.
图甲、图乙分别表示反应在催化剂的形态时的势能变化:
图甲 中与直接转化的反应过程的势能曲线
图乙 CH4与CO2在中同时发生活化的反应路线的势能曲线
由图甲、图乙可知_______0(填“>”“<”或“=”);不同形态的对_________(填“有”或“无”)影响.
(3)从CH4到过渡态Ⅰ断裂的是_______键(填“碳氢”“碳碳”“氧氢”或“碳氧”,下同),最后一步“夺氢”过程中有________键形成.
18.某化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)→B(g)+nC(g),反应到第3秒时,容器内A的浓度变为0.8mol·L-1,测得这段时间内,平均速率v(C)=0.6mol·L-1·s-1,则化学反应方程式中n值为___________,v(B)=___________mol·L-1·s-1。
19.碘在科研与生活中有重要应用,某兴趣小组用0.50mol/L KI、0.2%淀粉溶液、0.20mol/L K2S2O8、0.10mol/L Na2S2O3,等试剂,探究反应条件对化学反应速率的影响。
已知:S2O+2I-=2SO+I2(慢) I2+2S2O=2I-+S4O(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___________耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O与S2O初始的物质的量需满足的关系为:n(S2O):n(S2O)___________。
(2)已知:
实验序号 体积V/mL
K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液
① 10.0 0.0 4.0 4.0 2.0
② 9.0 VX 4.0 4.0 2.0
③ 8.0 2.0 4.0 4.0 VY
则,表中VX=___________mL,VY=___________mL;理由是___________。
(3)已知某条件下,浓度c(S2O)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O)-t的变化曲线示意图(进行相应的标注)。___________
20.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验过程】
用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
【实验数据】
实验编号 H2O2溶液 Fe2+溶液 蒸馏水 pH 温度
c/(10-3mol·L-1) V/mL c/(10-3mol·L-1) V/mL V/mL T/K
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
图2实验测得p-CP的浓度随时间的变化
【分析与解释】
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。
【参考答案】
一、选择题
1.D
【分析】改变反应物浓度、改变温度、改变反应物接触面积、改变压强(有气体参加或生成的反应)、催化剂都能改变化学反应速率,以此解答该题。
解析:A.在糕点包装内放置小包除氧剂的目的是防止食品变质,减慢糕点腐败变质的速度,故A不符合题意;
B.未成熟的猕猴桃与成熟苹果一起密封放置,加快猕猴桃成熟的速率,故B不符合题意;
C.牛奶在冰箱里保存,降低温度,减缓食物变质的速率,故C不符合题意;
D.高炉炼铁增加高炉的高度对反应速率没有影响,故D符合题意;
故答案选D。
【点睛】本题考查化学反应速率影响因素,侧重考查基础知识的灵活运用,明确外界条件对化学反应速率影响原理是解本题关键,题目难度不大。
2.B
【分析】锌粉与稀盐酸反应的实质是,据此分析。
解析:A.Na2CO3溶液会消耗使和都减小,所以既减缓了反应速率又减少产生氢气的量,故A错误;
B.加入Na2SO4溶液相当于稀释了稀盐酸,所以能减缓反应速率但不减少产生氢气的量,故B正确;
C.加入NaNO3溶液后因为引入了,此时发生的反应是:,不能再产生氢气,故C错误;
D.少量CuSO4溶液与锌粉发生置换反应置换出的Cu析出在锌表面,从而形成锌铜原电池,加快反应速率,故D错误;
故选B。
3.D
【分析】由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应;整个过程中有两个过渡态,过渡态Ⅰ的正反应的活化能为45.3+31.8=77.1kJ/mol;过渡态Ⅱ的正反应的活化能为43.5+42.6=86.1kJ/mol,过渡态Ⅱ的活化能大,为反应的决速步骤。根据第一张图可以看出,反应物为HCOOH,生成物为二氧化碳和氢气,故总反应为。
解析:A.根据分析,过渡态Ⅱ的活化能大,由Ⅳ→Ⅰ步骤为反应的决速步骤,最大能垒为43.5 kJ/mol -(-42.6 kJ/mol) =86.1kJ/mol,A错误;
B.反应过程存在甲酸电离出氢离子,然后氢离子再生成氢气的过程,浓度先增大,后减小,B错误;
C.为反应的催化剂,为中间产物,C错误;
D.由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应,D正确;
故选D。
4.B
解析:A.由图可知,活化能,A错误;
B.慢反应控制总反应速率,反应②的活化能,故反应速率由反应②决定,B正确;
C.总反应的,热化学方程式为 ,C错误;
D.增大反应物浓度,可增大活化分子的数目,但活化能不变,活化分子百分数不变,增大浓度可加快反应速率,D错误;
故选B。
5.A
解析:A.此反应开始时只加入了,生成的和始终是2∶1,所以当混合气体的平均摩尔质量不变时,不可以标志此反应达到了平衡状态,A错误;
通过三段式计算,
1min内消耗0.8mol,质量为62.4g,故反应速率为62.4g/min,B正确;
C.由于反应速率越来越慢,故30秒时,的浓度大于0.2mol/L,C正确;
D.由于反应2min已经达到平衡,当再加入2mo时,平衡逆移,故,D正确;
故选A。
6.D
解析:A.催化剂参与化学反应,改变反应历程,故A正确;
B.催化剂能降低基元反应的活化能,加快反应速率,故B正确;
C.催化剂可提高主反应速率,提高主反应选择性,故C正确;
D.转化率可分为时空转化率和平衡转化率,催化剂不改变平衡转化率,但是可以提高单位时间内反应物的转化率,故D错误;
选D。
7.D
解析:A.锌和稀硫酸反应生成氢气,增大硫酸的浓度,锌与浓硫酸反应生成二氧化硫不生成氢气,A错误;
B.加入氯化钠溶液后,氯化钠不参与反应,但溶液体积增大,相当于稀释,导致盐酸浓度减小,反应速率减小,B错误;
C.升高温度,活化分子百分数增加,化学反应速率加快,C错误;
D.减小压强,反应物浓度减小,反应速率减慢,D正确;
答案选D。
8.B
解析:常温下,铁在18 mol·L-1的浓硫酸中钝化;250 mL 2 mol·L-1的盐酸中氢离子浓度为2 mol·L-1;150 mL 2 mol·L-1的硫酸中氢离子浓度为4 mol·L-1; 500 mL 3 mol·L-1的盐酸中氢离子浓度为3 mol·L-1;氢离子浓度越大反应速率越快,所以铁块在150 mL 2 mol·L-1的硫酸中溶解最快,故选B。
9.C
解析:由化学反应速率之比等于化学计量数之比可知,物质的化学反应速率与化学计量数的比值越大,化学反应速率越快,由题给数据可得:=0.15mol/(L·s)、=0.2mol/(L·s)、=0.25mol/(L·s)、=0.2mol/(L·s),则为测得反应速率中最快的,故选C。
10.C
解析:A.由图可知,反应中物质I消耗又生成,为反应的催化剂,A正确;
B.II→III为去氢生成碳氧双键的反应,反应类型为氧化反应,B正确;
C.该历程只涉及氢分子中氢氢非极性键的生成,不涉及非极性键的断裂,C错误;
D.反应目的是乙醇催化转化为乙酸和氢气,该总反应为乙醇和水生成氢气和乙酸,反应为C2H5OH+H2O CH3COOH+2H2↑,反应中原子全部转化到期望产品中,故原子利用率为100%,D正确;
故选C。
11.B
解析:A.中药药液密封保存减少与流动空气的接触可减缓氧化速率,A正确;
B.箅渣取液涉及过滤操作,B错误;
C.中药切片可增加接触面积,使有效成分更充分浸出,C正确;
D.升高温度,加热煎制是为了提高中药的浸出效率,D正确;
故选B。
12.D
解析:根据实验数据,,,,,故选D。
13.A
解析:反应2A(g)+3B(g) 3C(g)+D(g),根据化学反应速率之比=方程式的系数之比,转化为用D表示的反应速率分别为:①v(D)=0.25mol/(L·min);②v(D)=0.2mol/(L·min); ③v(D)=0.117mol/(L·min);④v(D)=24mol/(L·min),因此反应速率:④>①>②>③,故选A;
答案选A。
14.D
解析:A.因为硫固体变为硫蒸气要吸热,所以等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,故A错误;
B.比较稳定性应比较其能量的高低,由C(石墨,s)=C(金刚石,s) ΔH>0可知,金刚石能量高,不稳定,故B错误;
C.比较稳定性应比较其能量的高低,气态水比液态水能量高,液态水稳定,故C错误;
D.升高温度能增大单位体积内的活化分子数,加快反应速率,故D正确;
故选:D。
15.C
解析:A.根据反应历程的相对能量大小可知, 2个分子断键所吸收的能量低于1个DMF分子和4个H原子在铜催化剂表面吸附所释放的能量,选项A正确;
B.该反应的总反应为(CH3)2NCHO(g)和H2(g)转化为N(CH3)3(g),1.02eV为单个(CH3)2NCHO(g)反应时放出的热量,所以热化学方程式为,选项B正确;
C.对有气体参加的可逆反应,增大压强增大单位体积内活化分子个数,活化分子百分数不变,选项C错误;
D.该反应△H<0,△S<0,要使△G=△H-T△S<0,则应在低温下,故该反应在低温下能正向自发进行,选项D正确;
答案选C。
二、填空题
16.(1)
(2) 0.2mol/L 1.2mol/L
(3)0.2
(4)1.28mol/L
解析:(1)内N2的浓度减小(2.5-1.9)mol/L,该反应的化学反应速率;
(2)化学反应中各物质浓度的变化量比等于系数比,内N2的浓度减小0.6mol/L,则H2的浓度降低0.6mol/L×3=1.8mol/L、NH3的浓度增加0.6mol/L×2=1.2mol/L,时H2的浓度为2mol/L-1.8mol/L=0.2mol/L、NH3的浓度为0+1.2mol/L=1.2mol/L;
(3)NH3的浓度增加1.2mol/L,则内=;
(4)经测定反应开始后到末的反应速率,则8min内H2的浓度减小,的浓度增加,则末的浓度为0+1.28mol/L=1.28mol/L。
17.(1)
(2) > 无
(3) 碳氢 氧氢
解析:(1)根据盖斯定律,将热化学方程式①+②-③,整理可得热化学方程式:;
(2)由图甲、图乙得知,不同形态的对无影响,因为催化剂只改变反应的路径和速率,不能改变反应物、生成物的能量,因此对反应热无影响;
(3)从CH4到过渡态Ⅰ断裂的是碳氢键,最后一步“夺氢”过程中夺得的氢原子接在氧原子上形成羟基,形成的是氧氢键。
18.0.2
解析:A物质的初始浓度为:=2mol·L-1,则浓度变化量为:2mol·L-1-0.8mol·L-1=1.2mol·L-1,反应速率为:=0.4mol·L-1·s-1,相同时间内反应速率之比等于化学计量数之比,则有,解得n=3,v(A):v(B)=2:1,则v(B)=0.2mol·L-1·s-1。
19.(1) Na2S2O3 <2
(2) 1.0 2.0 保证反应物K2S2O8浓度改变,而其它的条件不变,才能达到实验目的
(3)
解析:本实验通过用不同浓度、不同的试剂,探究反应条件对化学反应速率的影响,据此分析回答问题。
(1)已知S2O+2I-=2SO+I2(慢)、 I2+2S2O= 2I-+S4O (快),所以当Na2S2O3耗尽时,S2O与I-反应生成碘单质,淀粉遇到碘显蓝色,根据方程式,n(S2O)∶n(S2O)=2:1时恰好完全反应,为保证能观察到蓝色,碘需有剩余,则n(S2O):n(S2O)<2;
(2)为便于比较,应保证溶液的总体积相同,所以表中Vx=1.0,Vy=2.0,淀粉溶液体积不变,理由是保持三次实验中溶液总体积相同,仅改变S2O的浓度而其他物质浓度不变,才能达到实验目的;
(3)降低温度时,反应速率减慢,反应结束所需时间较长;加入催化剂时,反应速率加快,反应结束所需时间较短。为便于比较,我们选择三种情况下c(S2O)相等,所以c(S2O)与反应时间t的变化曲线为。
20.探究pH对P-CP降解速率的影响 温度高H2O2分解 pH=10时, Fe2+与H2O2反应生成的Fe(OH)3,催化作用降低,抑制了羟基自由基产生的,进而无法氧化降解污染物
【分析】实验①为对照组,实验②是探究温度对降解速率的影响,实验③、④是探究浓度对降解速率的影响,实验⑤是探究pH对降解速率的影响。
解析:(1)实验①为对照组,实验②是探究温度对降解速率的影响,实验③是探究浓度对降解速率的影响,应保持单一变量,溶液总体积应为15mL,故x=8,本题答案为:8;
(2)实验①、⑤所加试剂的体积、浓度均相同,只有pH不同,故实验①、⑤是探究pH对P-CP降解速率的影响,本题答案为:探究pH对P-CP降解速率的影响;
(3)反应温度在较低范围时,随着温度升高,过氧化氢产生羟基自由基的速率增加,使P-CP降解速率提高;反应温度过高时,过氧化氢分解产生氧气,几乎不产生羟基自由基,导致P-CP降解速率减少,故本题答案为:温度高H2O2分解;
(4)由图中曲线可以看出,在pH等于10时,P-CP的浓度几乎没有变化,说明pH=10时,该降解反应趋于停止,是因为在碱性较强的时候,Fe2+与H2O2反应生成的Fe(OH)3,催化作用降低,抑制了羟基自由基产生的,故本题答案为:pH=10时, Fe2+与H2O2反应生成的Fe(OH)3,催化作用降低,抑制了羟基自由基产生的,进而无法氧化降解污染物
一、选择题
1.下列做法与改变化学反应速率无关的是
A.在糕点包装内放置除氧剂 B.未成熟的猕猴桃与成熟的苹果一起密封
C.牛奶在冰箱里保存 D.高炉炼铁增加高炉的高度
2.在100mL稀盐酸中加入足量的锌粉,为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液,你认为可行的是
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
3.铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法正确的是
A.该过程的总反应速率由Ⅳ→Ⅰ步骤决定,最大能垒为89.7
B.该反应过程中浓度不变
C.与均在该反应过程中起催化作用
D.甲酸在作用下的分解反应放出热量
4.某反应分两步进行,其能量变化如图所示。下列说法正确的是
A.反应①的活化能
B.该反应过程中,反应速率由反应②决定
C.总反应的热化学方程式为
D.增大的浓度,可以增大活化分子百分数,提高化学反应速率
5.某温度下,在2L恒容密闭容器中4molNH2COONH4(s),发生如下反应,在0-1min内,CO2的生成速率为0.4mol L-1 min-1,0-2min内,CO2的生成速率为0.3mol L-1 min-1,0-3min内,CO2的生成速率为0.2mol L-1 min-1,下列说法错误的是
A.当混合气体的平均摩尔质量不变时,标志此反应达到了平衡状态
B.0-1min内,NH2COONH4(s)的反应速率为62.4g/min
C.30秒时,CO2的浓度大于0.2mol/L
D.2min时,再加入2molNH3,此时反应的V逆>V正
6.下列有关催化剂的说法错误的是
A.改变反应历程 B.改变基元反应的活化能
C.可能提高主反应选择性 D.不能提高反应物转化率
7.下列有关化学反应速率的说法正确的是
A.用锌粒和稀硫酸反应制取氢气时,增大硫酸的浓度一定能加快产生氢气的速率
B.的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.合成氨的反应是一个放热反应,所以升高反应温度,反应速率减慢
D.汽车尾气中的和可以缓慢反应生成和,减小压强,反应速率减慢
8.常温下,分别将四块形状相同、质量均为7 g的铁块同时投入下列四种溶液中,铁块溶解较快的是
A.250 mL 2 mol·L-1的盐酸 B.150 mL 2 mol·L-1的硫酸
C.500 mL 3 mol·L-1的盐酸 D.20 mL 18 mol·L-1的硫酸
9.反应,在不同情况下测得反应速率,其中反应速率最快的是
A. B.
C. D.
10.某新型催化剂能将乙醇催化转化为乙酸和氢气,其反应历程如图所示。下列说法错误
A.物质I为催化剂 B.II→III的反应类型为氧化反应
C.该历程涉及非极性键的断裂和形成 D.该历程总反应的原子利用率为100%
11.煎煮中药一般分四步:冷水浸泡、加热煎制、箅渣取液、灌装保存。下列说法不正确的是
A.中药药液密封保存可减缓氧化速率
B.箅渣取液涉及冷却结晶操作
C.中药切片可使有效成分更充分浸出
D.加热煎制是为了提高中药的浸出效率
12.反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2=2HCl的反应速率v可表示为v=K[c(H2)]m[c(Cl2)]n,式中K为常数,m、n值可用下表中数据确定之。
c(H2)(mol/L) c(Cl2)(mol/L) mol/(L·s)
1.0 1.0 1.0K
2.0 1.0 2.0K
2.0 4.0 4.0K
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=,n=
C.m=,n=1 D.m=1,n=
13.可逆反应2A(g)+3B(g) 3C(g)+D(g)在四种不同条件下的反应速率分别为:①v(A)=0.5mol·L-1·min-1;②v(B)=0.6mol·L-1·min-1;③v(C)=0.35mol·L-1·min-1;④v(D)=0.4mol·L-1·s-1。下列有关反应速率的比较中正确的是
A.④>①>②>③ B.④>①>③>②
C.①>②>③>④ D.②>①>③>④
14.下列有关说法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.已知C(石墨,s)=C(金刚石,s) ,故金刚石比石墨稳定
C.气态水比液态水稳定
D.升高温度能增大单位体积内的活化分子数,加快反应速率
15.我国科学家实现了在铜催化剂条件下将转化为三甲胺。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示(其中吸附在催化剂表面上的物种用*标注)。
下列说法错误的是
A.2个分子断键所吸收的能量低于1个DMF分子和4个H原子在铜催化剂表面吸附所释放的能量
B.该反应的热化学方程式为:
C.增大压强可以提高该反应的活化分子百分数,进而加快反应速率
D.该反应在低温下能正向自发进行
二、填空题
16.下表是实验室模拟合成氨反应:的部分数据。请分析后回答下列问题。
浓度
反应开始时的浓度() 2.5 2 0
时的浓度() 1.9
(1)内该反应的化学反应速率_______。
(2)在上表空格中填入合适数据_______、_______。
(3)如果用浓度的增加值来表示化学反应速率,则内为_______。
(4)经测定反应开始后到末的反应速率,则末的浓度为_______。
17.甲烷(CH4)是自然界储量丰富的天然气的主要组分,可用作清洁能源和廉价的化工原料,将甲烷催化转化为具有更高价值的化学物质是一个广受关注的课题.哈尔滨工业大学的科研人员研究了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程(催化剂是),共分为甲烷活化、二氧化碳进入和H转移(夺氢)三个阶段.该反应历程的示意图如下:
(1)在研究初期,科研人员提出先将CH4转化成CO和H2,再转化成CH3COOH。
已知:
①
②
③
则混合气体CO和H2转化成CH3COOH(g)的热化学方程式为______________.
(2)催化剂有以下四种形态:、、、.
图甲、图乙分别表示反应在催化剂的形态时的势能变化:
图甲 中与直接转化的反应过程的势能曲线
图乙 CH4与CO2在中同时发生活化的反应路线的势能曲线
由图甲、图乙可知_______0(填“>”“<”或“=”);不同形态的对_________(填“有”或“无”)影响.
(3)从CH4到过渡态Ⅰ断裂的是_______键(填“碳氢”“碳碳”“氧氢”或“碳氧”,下同),最后一步“夺氢”过程中有________键形成.
18.某化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)→B(g)+nC(g),反应到第3秒时,容器内A的浓度变为0.8mol·L-1,测得这段时间内,平均速率v(C)=0.6mol·L-1·s-1,则化学反应方程式中n值为___________,v(B)=___________mol·L-1·s-1。
19.碘在科研与生活中有重要应用,某兴趣小组用0.50mol/L KI、0.2%淀粉溶液、0.20mol/L K2S2O8、0.10mol/L Na2S2O3,等试剂,探究反应条件对化学反应速率的影响。
已知:S2O+2I-=2SO+I2(慢) I2+2S2O=2I-+S4O(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___________耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O与S2O初始的物质的量需满足的关系为:n(S2O):n(S2O)___________。
(2)已知:
实验序号 体积V/mL
K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液
① 10.0 0.0 4.0 4.0 2.0
② 9.0 VX 4.0 4.0 2.0
③ 8.0 2.0 4.0 4.0 VY
则,表中VX=___________mL,VY=___________mL;理由是___________。
(3)已知某条件下,浓度c(S2O)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O)-t的变化曲线示意图(进行相应的标注)。___________
20.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验过程】
用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
【实验数据】
实验编号 H2O2溶液 Fe2+溶液 蒸馏水 pH 温度
c/(10-3mol·L-1) V/mL c/(10-3mol·L-1) V/mL V/mL T/K
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
图2实验测得p-CP的浓度随时间的变化
【分析与解释】
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。
【参考答案】
一、选择题
1.D
【分析】改变反应物浓度、改变温度、改变反应物接触面积、改变压强(有气体参加或生成的反应)、催化剂都能改变化学反应速率,以此解答该题。
解析:A.在糕点包装内放置小包除氧剂的目的是防止食品变质,减慢糕点腐败变质的速度,故A不符合题意;
B.未成熟的猕猴桃与成熟苹果一起密封放置,加快猕猴桃成熟的速率,故B不符合题意;
C.牛奶在冰箱里保存,降低温度,减缓食物变质的速率,故C不符合题意;
D.高炉炼铁增加高炉的高度对反应速率没有影响,故D符合题意;
故答案选D。
【点睛】本题考查化学反应速率影响因素,侧重考查基础知识的灵活运用,明确外界条件对化学反应速率影响原理是解本题关键,题目难度不大。
2.B
【分析】锌粉与稀盐酸反应的实质是,据此分析。
解析:A.Na2CO3溶液会消耗使和都减小,所以既减缓了反应速率又减少产生氢气的量,故A错误;
B.加入Na2SO4溶液相当于稀释了稀盐酸,所以能减缓反应速率但不减少产生氢气的量,故B正确;
C.加入NaNO3溶液后因为引入了,此时发生的反应是:,不能再产生氢气,故C错误;
D.少量CuSO4溶液与锌粉发生置换反应置换出的Cu析出在锌表面,从而形成锌铜原电池,加快反应速率,故D错误;
故选B。
3.D
【分析】由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应;整个过程中有两个过渡态,过渡态Ⅰ的正反应的活化能为45.3+31.8=77.1kJ/mol;过渡态Ⅱ的正反应的活化能为43.5+42.6=86.1kJ/mol,过渡态Ⅱ的活化能大,为反应的决速步骤。根据第一张图可以看出,反应物为HCOOH,生成物为二氧化碳和氢气,故总反应为。
解析:A.根据分析,过渡态Ⅱ的活化能大,由Ⅳ→Ⅰ步骤为反应的决速步骤,最大能垒为43.5 kJ/mol -(-42.6 kJ/mol) =86.1kJ/mol,A错误;
B.反应过程存在甲酸电离出氢离子,然后氢离子再生成氢气的过程,浓度先增大,后减小,B错误;
C.为反应的催化剂,为中间产物,C错误;
D.由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应,D正确;
故选D。
4.B
解析:A.由图可知,活化能,A错误;
B.慢反应控制总反应速率,反应②的活化能,故反应速率由反应②决定,B正确;
C.总反应的,热化学方程式为 ,C错误;
D.增大反应物浓度,可增大活化分子的数目,但活化能不变,活化分子百分数不变,增大浓度可加快反应速率,D错误;
故选B。
5.A
解析:A.此反应开始时只加入了,生成的和始终是2∶1,所以当混合气体的平均摩尔质量不变时,不可以标志此反应达到了平衡状态,A错误;
通过三段式计算,
1min内消耗0.8mol,质量为62.4g,故反应速率为62.4g/min,B正确;
C.由于反应速率越来越慢,故30秒时,的浓度大于0.2mol/L,C正确;
D.由于反应2min已经达到平衡,当再加入2mo时,平衡逆移,故,D正确;
故选A。
6.D
解析:A.催化剂参与化学反应,改变反应历程,故A正确;
B.催化剂能降低基元反应的活化能,加快反应速率,故B正确;
C.催化剂可提高主反应速率,提高主反应选择性,故C正确;
D.转化率可分为时空转化率和平衡转化率,催化剂不改变平衡转化率,但是可以提高单位时间内反应物的转化率,故D错误;
选D。
7.D
解析:A.锌和稀硫酸反应生成氢气,增大硫酸的浓度,锌与浓硫酸反应生成二氧化硫不生成氢气,A错误;
B.加入氯化钠溶液后,氯化钠不参与反应,但溶液体积增大,相当于稀释,导致盐酸浓度减小,反应速率减小,B错误;
C.升高温度,活化分子百分数增加,化学反应速率加快,C错误;
D.减小压强,反应物浓度减小,反应速率减慢,D正确;
答案选D。
8.B
解析:常温下,铁在18 mol·L-1的浓硫酸中钝化;250 mL 2 mol·L-1的盐酸中氢离子浓度为2 mol·L-1;150 mL 2 mol·L-1的硫酸中氢离子浓度为4 mol·L-1; 500 mL 3 mol·L-1的盐酸中氢离子浓度为3 mol·L-1;氢离子浓度越大反应速率越快,所以铁块在150 mL 2 mol·L-1的硫酸中溶解最快,故选B。
9.C
解析:由化学反应速率之比等于化学计量数之比可知,物质的化学反应速率与化学计量数的比值越大,化学反应速率越快,由题给数据可得:=0.15mol/(L·s)、=0.2mol/(L·s)、=0.25mol/(L·s)、=0.2mol/(L·s),则为测得反应速率中最快的,故选C。
10.C
解析:A.由图可知,反应中物质I消耗又生成,为反应的催化剂,A正确;
B.II→III为去氢生成碳氧双键的反应,反应类型为氧化反应,B正确;
C.该历程只涉及氢分子中氢氢非极性键的生成,不涉及非极性键的断裂,C错误;
D.反应目的是乙醇催化转化为乙酸和氢气,该总反应为乙醇和水生成氢气和乙酸,反应为C2H5OH+H2O CH3COOH+2H2↑,反应中原子全部转化到期望产品中,故原子利用率为100%,D正确;
故选C。
11.B
解析:A.中药药液密封保存减少与流动空气的接触可减缓氧化速率,A正确;
B.箅渣取液涉及过滤操作,B错误;
C.中药切片可增加接触面积,使有效成分更充分浸出,C正确;
D.升高温度,加热煎制是为了提高中药的浸出效率,D正确;
故选B。
12.D
解析:根据实验数据,,,,,故选D。
13.A
解析:反应2A(g)+3B(g) 3C(g)+D(g),根据化学反应速率之比=方程式的系数之比,转化为用D表示的反应速率分别为:①v(D)=0.25mol/(L·min);②v(D)=0.2mol/(L·min); ③v(D)=0.117mol/(L·min);④v(D)=24mol/(L·min),因此反应速率:④>①>②>③,故选A;
答案选A。
14.D
解析:A.因为硫固体变为硫蒸气要吸热,所以等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,故A错误;
B.比较稳定性应比较其能量的高低,由C(石墨,s)=C(金刚石,s) ΔH>0可知,金刚石能量高,不稳定,故B错误;
C.比较稳定性应比较其能量的高低,气态水比液态水能量高,液态水稳定,故C错误;
D.升高温度能增大单位体积内的活化分子数,加快反应速率,故D正确;
故选:D。
15.C
解析:A.根据反应历程的相对能量大小可知, 2个分子断键所吸收的能量低于1个DMF分子和4个H原子在铜催化剂表面吸附所释放的能量,选项A正确;
B.该反应的总反应为(CH3)2NCHO(g)和H2(g)转化为N(CH3)3(g),1.02eV为单个(CH3)2NCHO(g)反应时放出的热量,所以热化学方程式为,选项B正确;
C.对有气体参加的可逆反应,增大压强增大单位体积内活化分子个数,活化分子百分数不变,选项C错误;
D.该反应△H<0,△S<0,要使△G=△H-T△S<0,则应在低温下,故该反应在低温下能正向自发进行,选项D正确;
答案选C。
二、填空题
16.(1)
(2) 0.2mol/L 1.2mol/L
(3)0.2
(4)1.28mol/L
解析:(1)内N2的浓度减小(2.5-1.9)mol/L,该反应的化学反应速率;
(2)化学反应中各物质浓度的变化量比等于系数比,内N2的浓度减小0.6mol/L,则H2的浓度降低0.6mol/L×3=1.8mol/L、NH3的浓度增加0.6mol/L×2=1.2mol/L,时H2的浓度为2mol/L-1.8mol/L=0.2mol/L、NH3的浓度为0+1.2mol/L=1.2mol/L;
(3)NH3的浓度增加1.2mol/L,则内=;
(4)经测定反应开始后到末的反应速率,则8min内H2的浓度减小,的浓度增加,则末的浓度为0+1.28mol/L=1.28mol/L。
17.(1)
(2) > 无
(3) 碳氢 氧氢
解析:(1)根据盖斯定律,将热化学方程式①+②-③,整理可得热化学方程式:;
(2)由图甲、图乙得知,不同形态的对无影响,因为催化剂只改变反应的路径和速率,不能改变反应物、生成物的能量,因此对反应热无影响;
(3)从CH4到过渡态Ⅰ断裂的是碳氢键,最后一步“夺氢”过程中夺得的氢原子接在氧原子上形成羟基,形成的是氧氢键。
18.0.2
解析:A物质的初始浓度为:=2mol·L-1,则浓度变化量为:2mol·L-1-0.8mol·L-1=1.2mol·L-1,反应速率为:=0.4mol·L-1·s-1,相同时间内反应速率之比等于化学计量数之比,则有,解得n=3,v(A):v(B)=2:1,则v(B)=0.2mol·L-1·s-1。
19.(1) Na2S2O3 <2
(2) 1.0 2.0 保证反应物K2S2O8浓度改变,而其它的条件不变,才能达到实验目的
(3)
解析:本实验通过用不同浓度、不同的试剂,探究反应条件对化学反应速率的影响,据此分析回答问题。
(1)已知S2O+2I-=2SO+I2(慢)、 I2+2S2O= 2I-+S4O (快),所以当Na2S2O3耗尽时,S2O与I-反应生成碘单质,淀粉遇到碘显蓝色,根据方程式,n(S2O)∶n(S2O)=2:1时恰好完全反应,为保证能观察到蓝色,碘需有剩余,则n(S2O):n(S2O)<2;
(2)为便于比较,应保证溶液的总体积相同,所以表中Vx=1.0,Vy=2.0,淀粉溶液体积不变,理由是保持三次实验中溶液总体积相同,仅改变S2O的浓度而其他物质浓度不变,才能达到实验目的;
(3)降低温度时,反应速率减慢,反应结束所需时间较长;加入催化剂时,反应速率加快,反应结束所需时间较短。为便于比较,我们选择三种情况下c(S2O)相等,所以c(S2O)与反应时间t的变化曲线为。
20.探究pH对P-CP降解速率的影响 温度高H2O2分解 pH=10时, Fe2+与H2O2反应生成的Fe(OH)3,催化作用降低,抑制了羟基自由基产生的,进而无法氧化降解污染物
【分析】实验①为对照组,实验②是探究温度对降解速率的影响,实验③、④是探究浓度对降解速率的影响,实验⑤是探究pH对降解速率的影响。
解析:(1)实验①为对照组,实验②是探究温度对降解速率的影响,实验③是探究浓度对降解速率的影响,应保持单一变量,溶液总体积应为15mL,故x=8,本题答案为:8;
(2)实验①、⑤所加试剂的体积、浓度均相同,只有pH不同,故实验①、⑤是探究pH对P-CP降解速率的影响,本题答案为:探究pH对P-CP降解速率的影响;
(3)反应温度在较低范围时,随着温度升高,过氧化氢产生羟基自由基的速率增加,使P-CP降解速率提高;反应温度过高时,过氧化氢分解产生氧气,几乎不产生羟基自由基,导致P-CP降解速率减少,故本题答案为:温度高H2O2分解;
(4)由图中曲线可以看出,在pH等于10时,P-CP的浓度几乎没有变化,说明pH=10时,该降解反应趋于停止,是因为在碱性较强的时候,Fe2+与H2O2反应生成的Fe(OH)3,催化作用降低,抑制了羟基自由基产生的,故本题答案为:pH=10时, Fe2+与H2O2反应生成的Fe(OH)3,催化作用降低,抑制了羟基自由基产生的,进而无法氧化降解污染物
