3.2.分子晶体与共价晶体 同步训练 (含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.分子晶体与共价晶体 同步训练 (含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 511.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 13:23:01 | ||
图片预览




文档简介
3.2.分子晶体与共价晶体同步训练2023-2024学年下学期高二化学人教版(2019)选择性必修2
一、单选题
1.单质碘的熔、沸点较低,其原因是
A.碘的非金属性较弱 B.碘分子中键能较小
C.固态碘单质中碘分子间以范德华力结合 D.I-I 共价键的键长较长
2.已知氯化铝易溶于苯,其熔点为190℃,则下列说法不正确的是
A.氯化铝是电解质 B.固态氯化铝是分子晶体
C.氯化铝是极性分子 D.氯化铝是非极性分子
3.已知金刚石的晶胞如图所示,由此可看出在含有共价键形成的碳原子环中,其中一个碳原子共参与形成的六元环个数及任意两个C—C键间的夹角是
A.6个120° B.12个120°
C.6个109°28' D.12个109°28'
4.下列事实能说明刚玉(α—Al2O3)是一种共价晶体的是
①Al2O3是两性氧化物;②硬度很大;③熔点为2045℃;④几乎不溶于水;⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
5.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 氮原子的第一电离能大于氧原子 氮原子2p能级半充满
B CO2为直线形分子 CO2分子中C=O之间的夹角为180°
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
6.下列各组物质各自形成晶体,均属于分子晶体的化合物是
A.NH3、HD、C2H20 B.PCl3、CO2、H2SO4
C.SO2、BN、P2O5 D.CCl4、Na2S、H2O2
7.科学家在实验室成功地在高温、高压下将CO2转化为类似SiO2的原子晶体。下列有关这种 CO2晶体的叙述中错误的是
A.该晶体熔点、沸点高,硬度大
B.晶体中碳、氧原子个数比为1: 2
C.晶体中碳、氧原子均成直线型排列
D.晶体中各原子最外层均满足8电子稳定结构
8.NA表示阿伏加德罗常数的值。下列说法中正确的是
A.常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
B.12 g石墨中含有C个数与C—C键的个数比为1:2
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
D.9.2gNO2、N2O4的混合气体中,含有的N原子总数为2NA
9.下列表示正确的是
A.乙炔的结构式:CH≡CH B.的空间填充模型:
C.液态中存在的氢键:F-H…F D.石英的分子式:
10.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(如图1)中含氢键数目为4NA
B.88 g干冰(如图2)中含有0.5NA个晶胞结构单元
C.25℃,1L pH=4的0.1 mol L 1 K2Cr2O7溶液中Cr2O离子数为0.1NA
D.100 mL 0.1 mol L 1的NaOH水溶液中含有氧原子数为0.01NA
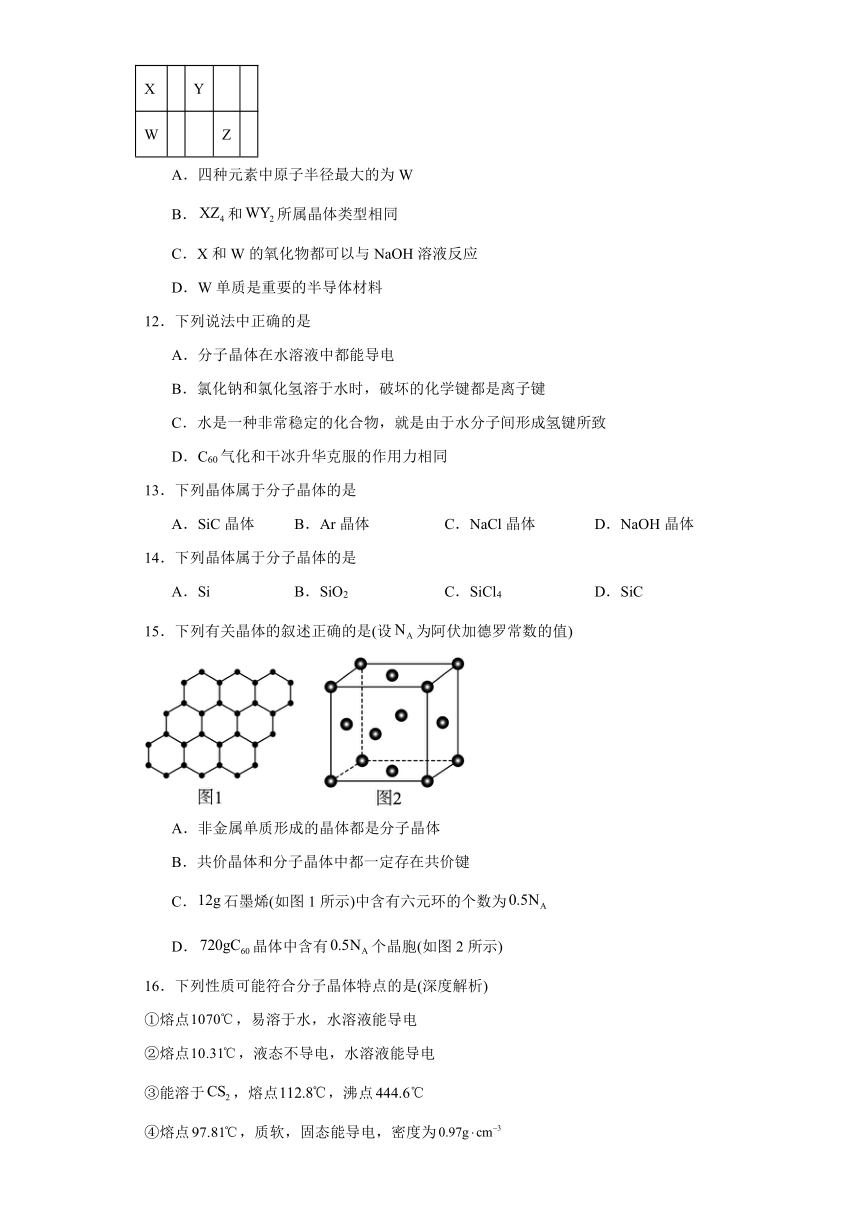
11.W、X、Y、Z四种短周期元素在周期表中位置如图所示,下列说法错误的是
X Y
W Z
A.四种元素中原子半径最大的为W
B.和所属晶体类型相同
C.X和W的氧化物都可以与NaOH溶液反应
D.W单质是重要的半导体材料
12.下列说法中正确的是
A.分子晶体在水溶液中都能导电
B.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
C.水是一种非常稳定的化合物,就是由于水分子间形成氢键所致
D.C60气化和干冰升华克服的作用力相同
13.下列晶体属于分子晶体的是
A.SiC晶体 B.Ar晶体 C.NaCl晶体 D.NaOH晶体
14.下列晶体属于分子晶体的是
A.Si B.SiO2 C.SiCl4 D.SiC
15.下列有关晶体的叙述正确的是(设为阿伏加德罗常数的值)
A.非金属单质形成的晶体都是分子晶体
B.共价晶体和分子晶体中都一定存在共价键
C.石墨烯(如图1所示)中含有六元环的个数为
D.晶体中含有个晶胞(如图2所示)
16.下列性质可能符合分子晶体特点的是(深度解析)
①熔点,易溶于水,水溶液能导电
②熔点,液态不导电,水溶液能导电
③能溶于,熔点,沸点
④熔点,质软,固态能导电,密度为
A.①④ B.②③ C.①② D.②④
17.关于乙烯的说法正确的是
A.属于原子晶体 B.所有原子在一直线上
C.既有极性键又有非极性键 D.属于极性分子
18.如图,是由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。科研人员用电子计算机模拟出类似的新物质,下列有关的叙述正确的是
A.分子中含有的键是键的2倍
B.属于原子晶体
C.分子是由非极性键构成的非极性分子
D.的熔点比的低
19.下列各组性质的比较中,正确的是
A.沸点:Li<Na<<K B.熔点:金刚石>晶体硅>碳化硅
C.第一电离能:S<P<Cl D.元素的电负性:N>O>F
20.有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的核外电子总数等于Q原子的最外层电子数;Q原子的L电子层的p能级上只有一对成对电子;T原子有1个3p空轨道。下列叙述错误的是
A.元素Y和Q可形成化合物Y2Q3
B.气态氢化物的稳定性:Q>T>Z
C.X和Q结合生成的化合物晶体类型为分子晶体
D.T和Z的最高价氧化物均为酸性氧化物
21.下列表达方式或说法正确的是
A.NH3、H2O、CO2、HCl四种分子中孤电子对最多的是CO2
B.晶体熔点由低到高:F2>Cl2>Br2>I2
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.基态到激发态产生的光谱是发射光谱
22.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.28g晶体硅中含有Si—Si键的个数为2NA
B.124g白磷(P4)晶体中含有P—P键的个数为4NA
C.12g石墨中含有C—C键的个数为4NA
D.SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键(Si—O键)
23.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,易与水发生氧化还原反应,可利用反应CS2+3Cl2CCl4+S2Cl2进行制备。下列说法不正确的是
物质的熔沸点
物质 CS2 CCl4 S2Cl2
沸点/℃ 47 77 137
熔点/℃ -109 -23 -77
A.制备反应中各物质在固态时晶体类型完全相同
B.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
C.CS2、CCl4、S2Cl2熔沸点的高低是由共价键的键能决定
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
24.下列关于物质使用及其解释均正确的是
选项 物质使用 解释
A 可用作净水剂 有氧化性
B 高纯硅用于光导纤维、太阳能电池、计算机芯片 硅具有半导体性能
C 液晶可作电视显示屏 液晶分子可沿电场方向有序排列
D 可用于钡餐 无毒
A.A B.B C.C D.D
25.A、B为原子序数依次增大的短周期主族元素,基态原子的最外层均有2个未成对电子,A、B形成的二元化合物在自然界中普遍存在,并有多种结构,如图是其中一种结构的晶胞示意图。下列说法正确的是
A.该二元化合物是分子晶体
B.每个晶胞拥有A原子的数目为6个
C.该二元化合物A、B两原子的杂化方式不同
D.该二元化合物中只有B原子满足8电子稳定结构
二、填空题
26.有下列物质:①水晶;②冰醋酸;③氧化钙;④白磷;⑤晶体氩;⑥氢氧化钠;⑦氧化铝;⑧金刚石;⑨过氧化钠;⑩碳化钙; 碳化硅; 干冰; 过氧化氢。
根据要求填空:
(1)属于共价晶体的化合物是 。
(2)直接由原子构成的晶体是 。
(3)直接由原子构成的分子晶体是 。
(4)由极性分子构成的晶体是 。属于分子晶体的单质是 。
27.单质Sn与干燥的Cl2反应生成SnCl4,常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。
28.非金属元素及其化合物应用广泛,回答下列问题:
(1)元素的第一电离能:Al Si(填“>”或“<”)。
(2)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 ,该材料的化学式为 。
(5)如图EMIM+离子中,碳原子的杂化轨道类型为 。分子中的大π键可用符号π表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则EMIM+离子中的大π键应表示为 。
试卷第1页,共3页
参考答案:
1.C
【详解】碘单质是分子晶体,碘分子间以范德华力结合,影响分子晶体熔沸点的是范德华力,范德华力较弱,故单质碘的熔、沸点较低,C符合题意;
答案选C。
2.C
【详解】由“相似相溶”规律可推知为非极性分子,故C项错误。
3.D
【详解】由金刚石的晶胞结构可知,碳原子间以共价键相互结合,形成三维的空间网状结构。在金刚石晶体里,每个碳原子以四个共价键对称的与相邻的4个碳原子结合,碳原子采取sp3杂化方式形成共价键,所以碳原子与其周围的4个碳原子形成正四面体结构,一个碳原子共参与形成的六元环个数为12,C-C键的夹角都是 109°28′。
故选D。
4.B
【详解】是两性氧化物,属于物质的分类,与晶体类型无关,①错误;硬度很大、熔点为2045℃(很高),都是共价晶体的物理性质,②③正确;由于共价晶体中原子间都以共价键相结合形成三维骨架结构,故几乎不溶于水,④正确;红宝石、蓝宝石是刚玉在自然界中的存在形式,与晶体类型无关,⑤错误,正确的组合是②③④;
故选:B;
5.A
【详解】A.氮原子2p能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A正确;
B.理论解释不对,CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子是直线型,故B错误;
C.金刚石是原子晶体,故C错误;
D.理论解释不对,HF分子中含有氢键,故HF的沸点高于HCl,故D错误;
答案选A。
6.B
【详解】A.分子晶体的构成微粒为分子,分子内部以共价键结合,分子间存在分子间作用力,HD属于分子晶体,但为单质,A错误;
B.PCl3、CO2、H2SO4均属于分子晶体,且均为化合物,B正确;
C.BN属于原子晶体,但为单质,C错误;
D.Na2S中含有离子键,不属于分子晶体,D错误;
故选B。
7.C
【详解】A.CO2转化为类似SiO2的原子晶体,原子晶体熔点、沸点高,硬度大,A正确;
B.因为该晶体与SiO2晶体结构相似,每个碳原子与4个氧原子通过1对共用电子对连接,每个氧原子与2个碳原子通过1对共用电子对连接,B正确;
C.该晶体中每个碳原子和4个氧原子形成正四面体结构,C错误;
D.每个碳原子与4个氧原子通过1对共用电子对连接,每个氧原子与2个碳原子通过1对共用电子对连接,晶体中各原子最外层均满足8电子稳定结构,D正确;
答案选C。
8.C
【详解】A. 常温下,0.1molCl2与足量NaOH溶液反应生成氯化钠、次氯酸钠和水,转移的电子数目为0.1NA,A错误;
B. 12 g石墨的物质的量是1mol,其中含有C个数与C-C键的个数比为1:1.5=2:3,B错误;
C. 在反应KIO3+6HI=KI+3I2+3H2O中碘酸钾是氧化剂,碘元素化合价从+5价降低到0价,每生成3 mol I2转移的电子数为5NA,C正确;
D. NO2、N2O4的最简式是“NO2”,9.2gNO2、N2O4的混合气体中含“NO2”的物质的量是0.2mol,含有的N原子总数为0.2NA,D错误;答案选C。
9.C
【详解】A.CH≡CH为乙炔的结构简式,乙炔的结构式为H-C≡C-H,故A错误;
B.CO2的结构简式为O=C=O,C、O属于同周期,且C的原子半径大于O原子半径,黑球比灰球大,故B错误;
C.氢键的表示形式为X-H…Y-,HF分子间存在氢键,氢键表示形式为F-H…F,故C正确;
D.SiO2为共价晶体,是由Si原子和氧原子组成,不存在二氧化硅分子,故D错误;
答案为C。
10.B
【详解】A.冰中1个水分子与周围4个水分子以氢键结合形成四面体结构,因此1mol冰有2mol氢键,18 g冰中含氢键数目为2NA,故A错误;
B.1个干冰晶胞中含有个干冰,88 g干冰(物质的量为2mol)(如图2)中含有0.5NA个晶胞结构单元,故B正确;
C.25℃,1L pH=4的0.1 mol L 1 K2Cr2O7溶液中K2Cr2O7物质的量为0.1mol,由于2CrO +2H+Cr2O+H2O,因此Cr2O离子数小于0.1NA,故C错误;
D.100 mL 0.1 mol L 1的NaOH水溶液中NaOH物质的量为0.01mol,溶液中水含有氧原子,因此溶液中含有氧原子数大于0.01NA,故D错误。
综上所述,答案为B。
11.B
【分析】根据元素在周期表中的位置可知, X为C元素,Y为O元素,W为Si元素,Z为Cl元素。
【详解】A.同周期元素从左到右半径依次减小,同主族元素从上到下半径依次增大,四种元素中原子半径最大的是Si,即W,A正确;
B.CCl4是分子晶体,SiO2是共价晶体,晶体类型不同,B错误;
C.CO2和SiO2都能与NaOH反应,CO2+2NaOH = Na2CO3+H2O、SiO2+2NaOH = Na2SiO3+H2O,C正确;
D.Si是重要的半导体材料,用于计算机芯片、太阳能电池等多项领域,D正确;
故选B。
12.D
【详解】A.有的分子晶体不溶于水,不发生电离,如氧气、乙醇形成的分子晶体,则不能导电,故A错误;
B.氯化钠为离子晶体,氯化氢为分子晶体,氯化钠溶于水破坏离子键,氯化氢溶于水破坏共价键,故B错误;
C.氢键只影响物质的物理性质,水是一种非常稳定的化合物,是因为H-O键的稳定性强,故C错误;
D.分子晶体由固体变为气体,克服分子间作用力,C60和干冰均为分子晶体,则C60气化和干冰升华克服的作用力相同,故D正确;
答案选D。
13.B
【详解】A.为原子晶体,A错误;
B.Ar晶体为分子晶体,B正确;
C.晶体为离子晶体,C错误;
D.NaOH晶体为离子晶体,D错误;
故选B。
14.C
【详解】A.Si为共价晶体,A错误;
B.SiO2为共价晶体,B错误;
C.SiCl4为分子晶体,C正确;
D.SiC为共价晶体,D错误;
故答案选C。
15.C
【详解】A.单质硅属于非金属单质,但是其形成的晶体是共价晶体,A错误;
B.稀有气体形成的分子晶体中,不存在共价键,B错误;
C.根据石墨烯的结构分析一个六元环含有个碳原子,则12g石墨烯(物质的量为1mol)中含有六元环的物质的量为0.5mol即六元环的个数为,C正确;
D.根据C60晶体分析得到一个C60晶体个C60,含有720g C60(物质的量为1mol)晶体中含有个晶胞,D错误;
故选C。
16.B
【详解】在分子晶体中,相邻分子靠分子间作用力相互吸引。分子晶体熔化时,只需克服分子间作用力,不破坏化学键,所以分子晶体一般具有较低的熔点。此外,分子晶体还具有硬度小、易升华、有较强的挥发性、一般不导电等特点。
①熔点高,不是分子晶体的性质;
②熔点低,不导电,可能是分子晶体的性质;
③熔沸点不高,可能是分子晶体的性质;
④固态能导电,不是分子晶体的性质;
故选B。
17.C
【详解】A.乙烯是共价型分子,晶体类型应该为分子晶体,故A错误;
B.乙烯分子是平面结构,6个原子共平面,不是直线型分子,故B错误;
C.乙烯分子结构式为,则分子内既有极性键又有非极性键,故C正确;
D.乙烯分子结构是轴对称结构,正负电荷中心重合,是非极性分子,故D错误;
故答案为C。
18.C
【详解】A. N原子核外有3个未成对电子,在分子中,N原子形成3个σ键,一对孤电子对,分子中不含有键,A错误;
B. 属于分子晶体,B错误;
C. 分子是由非极性键构成的非极性分子,C正确;
D. 、都是非极性分子,的分子量更大,范德华力更大,故熔点更高,D错误;
故选C。
19.C
【详解】A.碱金属元素随电子层数增多,单质的沸点降低,沸点Li>Na>K,故A错误;
B.金刚石、晶体硅、碳化硅都是原子晶体,原子半径越小键长越短,键能越大,熔沸点越高,Si原子半径小于C,熔点:金刚石>碳化硅>晶体硅,故B错误;
C.P原子3p能级半充满,结构稳定,第一电离能大于同周期相邻元素,第一电离能:S<P<Cl,故C正确;
D.同周期元素从左到右电负性依次增大,元素的电负性:N选C。
20.B
【分析】由X原子M层上有2个未成对电子且无空轨道可知,X为S元素;Y原子的特征电子构型为3d64s2,则Y为Fe元素;Q原子的L电子层的p能级上只有一对成对电子,则Q是O元素;由Z原子的核外电子总数等于O原子的最外层电子数可知,Z为C元素;由T原子有1个3p空轨道可知,T是Si元素。
【详解】A.Fe元素和O元素能形成化合物Fe2O3,A项正确;
B.元素的非金属性越强,气态氢化物的稳定性越强,非金属性:Q>Z>T,则气态氢化物的稳定性:Q>Z>T,B项错误;
C.硫元素和氧元素结合生成的化合物可以是二氧化硫或三氧化硫,二氧化硫和三氧化硫都是共价化合物,形成的晶体为分子晶体,C项正确;
D.Si元素和C元素的最高价氧化物二氧化硅和二氧化碳均为酸性氧化物,D项正确;
答案选B。
21.A
【详解】A.NH3、H2O、CO2、HCl分子中含有的孤电子对分别为1、2、4、3,所以二氧化碳分子中含有的孤电子对最多,故A正确;
B.卤素单质形成的晶体类型是分子晶体,熔点和相对分子质量成正比,则晶体熔点由低到高:F2<Cl2<Br2<I2,故B错误;
C.硫离子最外层达到8电子稳定结构,其正确的核外电子排布式为:1s22s22p63s23p6,故C错误;
D.在一定条件下,原子的核外电子从基态跃迁到激发态,需要吸收能量,产生的光谱属于吸收光谱,故D错误;
故选A。
22.A
【详解】A.28g晶体硅中含有Si—Si键的个数为=2NA,A正确;
B.124g白磷(P4)晶体中含有P—P键的个数为=6NA,B错误;
C.12g石墨中含有C—C键的个数为=1.5NA,C错误;
D.SiO2晶体中每摩尔硅原子可与氧原子形成4NA个共价键(Si—O键),D错误;
故答案为:A。
23.C
【详解】A.CS2、CCl4、S2Cl2都由分子构成,它们在固态时都形成分子晶体,A正确;
B.S2Br2与S2Cl2结构式分别为Br-S-S-Br、Cl-S-S-Cl,分子结构相似,分子间只存在范德华力,相对分子质量S2Br2>S2Cl2,则熔沸点:S2Br2>S2Cl2,B正确;
C.CS2、CCl4、S2Cl2在固态时都形成分子晶体,熔沸点的高低受分子间范德华力的影响,与共价键的键能无关,C不正确;
D.S2Cl2中,Cl显-1价,S显+1价,若S发生歧化反应,则产物中S的价态应在+1价的两侧,可能为0价和+4价,所以与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,D正确;
故选C。
24.C
【详解】A.FeCl3可作净水剂是因为Fe3+水解生成Fe(OH)3胶体,胶体具有净水的作用,与氯化铁的氧化性无关,A错误;
B.用于制造光导纤维的是二氧化硅不是单质硅,B错误;
C.液晶分子可沿电场方向有序排列,故液晶可作电视显示屏,C正确;
D.Ba2+属于重金属离子有毒,BaSO4为不溶于胃酸的沉淀,故可用作钡餐,D错误;
故答案选C。
25.B
【分析】周期表中基态原子的最外层均有2个未成对电子的元素在第IVA族和第VIA族,短周期中符合此条件的有碳、硅、氧、硫四种元素,由图中看出,一个A周围有2个B,一个B原子周围有四个A,AB原子个数比应该是2:1,可以形成CO2,CS2,SiO2等物质,又知A、B原子序数依次增大,只有A是O元素,B是Si元素符合,形成的化合物是SiO2。
【详解】A.SiO2是原子晶体,故A错误;
B.由图可知晶胞中B原子(即Si原子)所在位置有4个在棱上,2个在面上,1个在晶胞内该晶胞中含有Si原子个数为 +2 +1=3,按照Si与O原子1:2,所以含有6个氧原子,故B正确;
C.SiO2中Si原子和O原子都是sp3杂化,杂化方式相同,故C错误;
D.硅最外层四个电子,一个硅与周围4个氧原子形成共价键,O原子最外层有6个电子,与2个硅形成共价键,因此Si原子和O原子都满足8电子稳定结构,故D错误;
答案选B。
【点睛】基态原子的最外层均有2个未成对电子是本题解题的关键。
26. ①⑤⑧ ⑤ ② ④⑤
【详解】共价晶体
分子晶体
故答案为: ;①⑤⑧ ;⑤;② ;④⑤;
27. 正四面体形 分子晶体
【详解】四氯化锡分子中锡原子的价层电子对数为4,孤对电子对数为0,分子的空间构型为正四面体形;由常温常压下四氯化锡为无色液体可知,四氯化锡的固体为熔沸点低的分子晶体。
28.(1)<
(2) M 9
(3)硅烷的相对分子质量越大,分子间范德华力越强
(4) 12 M3C60
(5) sp2、sp3
【详解】(1)同一周期主族元素第一电离能从左向右呈增大趋势,第IIA族和第VA族第一电离能比同周期相邻元素大,因此第一电离能:Al(2)Si的原子序数为14,基态硅原子的核外电子排布式为:1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数有1+3+5=9。
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越强,沸点越高。
(4)M原子位于晶胞的棱上与内部,内部有9个M原子,棱上有12=3个,M原子的个数为9+3=12,C60位于顶点和面心,其个数为8+6=4,M和C60的个数比为3:1,该材料的化学式为M3C60。
(5)由EMIM+离子的结构可知,环外的3个碳原子都是形成4个σ键,采取sp3杂化,环上的3个碳原子都是形成3个σ键和1个大π键,采取sp2杂化,依据EMIM+离子的结构,可知形成大π键的原子数为5,电子数为6,因此大π键可表示为:
一、单选题
1.单质碘的熔、沸点较低,其原因是
A.碘的非金属性较弱 B.碘分子中键能较小
C.固态碘单质中碘分子间以范德华力结合 D.I-I 共价键的键长较长
2.已知氯化铝易溶于苯,其熔点为190℃,则下列说法不正确的是
A.氯化铝是电解质 B.固态氯化铝是分子晶体
C.氯化铝是极性分子 D.氯化铝是非极性分子
3.已知金刚石的晶胞如图所示,由此可看出在含有共价键形成的碳原子环中,其中一个碳原子共参与形成的六元环个数及任意两个C—C键间的夹角是
A.6个120° B.12个120°
C.6个109°28' D.12个109°28'
4.下列事实能说明刚玉(α—Al2O3)是一种共价晶体的是
①Al2O3是两性氧化物;②硬度很大;③熔点为2045℃;④几乎不溶于水;⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
5.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 氮原子的第一电离能大于氧原子 氮原子2p能级半充满
B CO2为直线形分子 CO2分子中C=O之间的夹角为180°
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
6.下列各组物质各自形成晶体,均属于分子晶体的化合物是
A.NH3、HD、C2H20 B.PCl3、CO2、H2SO4
C.SO2、BN、P2O5 D.CCl4、Na2S、H2O2
7.科学家在实验室成功地在高温、高压下将CO2转化为类似SiO2的原子晶体。下列有关这种 CO2晶体的叙述中错误的是
A.该晶体熔点、沸点高,硬度大
B.晶体中碳、氧原子个数比为1: 2
C.晶体中碳、氧原子均成直线型排列
D.晶体中各原子最外层均满足8电子稳定结构
8.NA表示阿伏加德罗常数的值。下列说法中正确的是
A.常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
B.12 g石墨中含有C个数与C—C键的个数比为1:2
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
D.9.2gNO2、N2O4的混合气体中,含有的N原子总数为2NA
9.下列表示正确的是
A.乙炔的结构式:CH≡CH B.的空间填充模型:
C.液态中存在的氢键:F-H…F D.石英的分子式:
10.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(如图1)中含氢键数目为4NA
B.88 g干冰(如图2)中含有0.5NA个晶胞结构单元
C.25℃,1L pH=4的0.1 mol L 1 K2Cr2O7溶液中Cr2O离子数为0.1NA
D.100 mL 0.1 mol L 1的NaOH水溶液中含有氧原子数为0.01NA
11.W、X、Y、Z四种短周期元素在周期表中位置如图所示,下列说法错误的是
X Y
W Z
A.四种元素中原子半径最大的为W
B.和所属晶体类型相同
C.X和W的氧化物都可以与NaOH溶液反应
D.W单质是重要的半导体材料
12.下列说法中正确的是
A.分子晶体在水溶液中都能导电
B.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
C.水是一种非常稳定的化合物,就是由于水分子间形成氢键所致
D.C60气化和干冰升华克服的作用力相同
13.下列晶体属于分子晶体的是
A.SiC晶体 B.Ar晶体 C.NaCl晶体 D.NaOH晶体
14.下列晶体属于分子晶体的是
A.Si B.SiO2 C.SiCl4 D.SiC
15.下列有关晶体的叙述正确的是(设为阿伏加德罗常数的值)
A.非金属单质形成的晶体都是分子晶体
B.共价晶体和分子晶体中都一定存在共价键
C.石墨烯(如图1所示)中含有六元环的个数为
D.晶体中含有个晶胞(如图2所示)
16.下列性质可能符合分子晶体特点的是(深度解析)
①熔点,易溶于水,水溶液能导电
②熔点,液态不导电,水溶液能导电
③能溶于,熔点,沸点
④熔点,质软,固态能导电,密度为
A.①④ B.②③ C.①② D.②④
17.关于乙烯的说法正确的是
A.属于原子晶体 B.所有原子在一直线上
C.既有极性键又有非极性键 D.属于极性分子
18.如图,是由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。科研人员用电子计算机模拟出类似的新物质,下列有关的叙述正确的是
A.分子中含有的键是键的2倍
B.属于原子晶体
C.分子是由非极性键构成的非极性分子
D.的熔点比的低
19.下列各组性质的比较中,正确的是
A.沸点:Li<Na<<K B.熔点:金刚石>晶体硅>碳化硅
C.第一电离能:S<P<Cl D.元素的电负性:N>O>F
20.有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的核外电子总数等于Q原子的最外层电子数;Q原子的L电子层的p能级上只有一对成对电子;T原子有1个3p空轨道。下列叙述错误的是
A.元素Y和Q可形成化合物Y2Q3
B.气态氢化物的稳定性:Q>T>Z
C.X和Q结合生成的化合物晶体类型为分子晶体
D.T和Z的最高价氧化物均为酸性氧化物
21.下列表达方式或说法正确的是
A.NH3、H2O、CO2、HCl四种分子中孤电子对最多的是CO2
B.晶体熔点由低到高:F2>Cl2>Br2>I2
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.基态到激发态产生的光谱是发射光谱
22.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.28g晶体硅中含有Si—Si键的个数为2NA
B.124g白磷(P4)晶体中含有P—P键的个数为4NA
C.12g石墨中含有C—C键的个数为4NA
D.SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键(Si—O键)
23.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,易与水发生氧化还原反应,可利用反应CS2+3Cl2CCl4+S2Cl2进行制备。下列说法不正确的是
物质的熔沸点
物质 CS2 CCl4 S2Cl2
沸点/℃ 47 77 137
熔点/℃ -109 -23 -77
A.制备反应中各物质在固态时晶体类型完全相同
B.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
C.CS2、CCl4、S2Cl2熔沸点的高低是由共价键的键能决定
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
24.下列关于物质使用及其解释均正确的是
选项 物质使用 解释
A 可用作净水剂 有氧化性
B 高纯硅用于光导纤维、太阳能电池、计算机芯片 硅具有半导体性能
C 液晶可作电视显示屏 液晶分子可沿电场方向有序排列
D 可用于钡餐 无毒
A.A B.B C.C D.D
25.A、B为原子序数依次增大的短周期主族元素,基态原子的最外层均有2个未成对电子,A、B形成的二元化合物在自然界中普遍存在,并有多种结构,如图是其中一种结构的晶胞示意图。下列说法正确的是
A.该二元化合物是分子晶体
B.每个晶胞拥有A原子的数目为6个
C.该二元化合物A、B两原子的杂化方式不同
D.该二元化合物中只有B原子满足8电子稳定结构
二、填空题
26.有下列物质:①水晶;②冰醋酸;③氧化钙;④白磷;⑤晶体氩;⑥氢氧化钠;⑦氧化铝;⑧金刚石;⑨过氧化钠;⑩碳化钙; 碳化硅; 干冰; 过氧化氢。
根据要求填空:
(1)属于共价晶体的化合物是 。
(2)直接由原子构成的晶体是 。
(3)直接由原子构成的分子晶体是 。
(4)由极性分子构成的晶体是 。属于分子晶体的单质是 。
27.单质Sn与干燥的Cl2反应生成SnCl4,常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。
28.非金属元素及其化合物应用广泛,回答下列问题:
(1)元素的第一电离能:Al Si(填“>”或“<”)。
(2)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 ,该材料的化学式为 。
(5)如图EMIM+离子中,碳原子的杂化轨道类型为 。分子中的大π键可用符号π表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则EMIM+离子中的大π键应表示为 。
试卷第1页,共3页
参考答案:
1.C
【详解】碘单质是分子晶体,碘分子间以范德华力结合,影响分子晶体熔沸点的是范德华力,范德华力较弱,故单质碘的熔、沸点较低,C符合题意;
答案选C。
2.C
【详解】由“相似相溶”规律可推知为非极性分子,故C项错误。
3.D
【详解】由金刚石的晶胞结构可知,碳原子间以共价键相互结合,形成三维的空间网状结构。在金刚石晶体里,每个碳原子以四个共价键对称的与相邻的4个碳原子结合,碳原子采取sp3杂化方式形成共价键,所以碳原子与其周围的4个碳原子形成正四面体结构,一个碳原子共参与形成的六元环个数为12,C-C键的夹角都是 109°28′。
故选D。
4.B
【详解】是两性氧化物,属于物质的分类,与晶体类型无关,①错误;硬度很大、熔点为2045℃(很高),都是共价晶体的物理性质,②③正确;由于共价晶体中原子间都以共价键相结合形成三维骨架结构,故几乎不溶于水,④正确;红宝石、蓝宝石是刚玉在自然界中的存在形式,与晶体类型无关,⑤错误,正确的组合是②③④;
故选:B;
5.A
【详解】A.氮原子2p能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A正确;
B.理论解释不对,CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子是直线型,故B错误;
C.金刚石是原子晶体,故C错误;
D.理论解释不对,HF分子中含有氢键,故HF的沸点高于HCl,故D错误;
答案选A。
6.B
【详解】A.分子晶体的构成微粒为分子,分子内部以共价键结合,分子间存在分子间作用力,HD属于分子晶体,但为单质,A错误;
B.PCl3、CO2、H2SO4均属于分子晶体,且均为化合物,B正确;
C.BN属于原子晶体,但为单质,C错误;
D.Na2S中含有离子键,不属于分子晶体,D错误;
故选B。
7.C
【详解】A.CO2转化为类似SiO2的原子晶体,原子晶体熔点、沸点高,硬度大,A正确;
B.因为该晶体与SiO2晶体结构相似,每个碳原子与4个氧原子通过1对共用电子对连接,每个氧原子与2个碳原子通过1对共用电子对连接,B正确;
C.该晶体中每个碳原子和4个氧原子形成正四面体结构,C错误;
D.每个碳原子与4个氧原子通过1对共用电子对连接,每个氧原子与2个碳原子通过1对共用电子对连接,晶体中各原子最外层均满足8电子稳定结构,D正确;
答案选C。
8.C
【详解】A. 常温下,0.1molCl2与足量NaOH溶液反应生成氯化钠、次氯酸钠和水,转移的电子数目为0.1NA,A错误;
B. 12 g石墨的物质的量是1mol,其中含有C个数与C-C键的个数比为1:1.5=2:3,B错误;
C. 在反应KIO3+6HI=KI+3I2+3H2O中碘酸钾是氧化剂,碘元素化合价从+5价降低到0价,每生成3 mol I2转移的电子数为5NA,C正确;
D. NO2、N2O4的最简式是“NO2”,9.2gNO2、N2O4的混合气体中含“NO2”的物质的量是0.2mol,含有的N原子总数为0.2NA,D错误;答案选C。
9.C
【详解】A.CH≡CH为乙炔的结构简式,乙炔的结构式为H-C≡C-H,故A错误;
B.CO2的结构简式为O=C=O,C、O属于同周期,且C的原子半径大于O原子半径,黑球比灰球大,故B错误;
C.氢键的表示形式为X-H…Y-,HF分子间存在氢键,氢键表示形式为F-H…F,故C正确;
D.SiO2为共价晶体,是由Si原子和氧原子组成,不存在二氧化硅分子,故D错误;
答案为C。
10.B
【详解】A.冰中1个水分子与周围4个水分子以氢键结合形成四面体结构,因此1mol冰有2mol氢键,18 g冰中含氢键数目为2NA,故A错误;
B.1个干冰晶胞中含有个干冰,88 g干冰(物质的量为2mol)(如图2)中含有0.5NA个晶胞结构单元,故B正确;
C.25℃,1L pH=4的0.1 mol L 1 K2Cr2O7溶液中K2Cr2O7物质的量为0.1mol,由于2CrO +2H+Cr2O+H2O,因此Cr2O离子数小于0.1NA,故C错误;
D.100 mL 0.1 mol L 1的NaOH水溶液中NaOH物质的量为0.01mol,溶液中水含有氧原子,因此溶液中含有氧原子数大于0.01NA,故D错误。
综上所述,答案为B。
11.B
【分析】根据元素在周期表中的位置可知, X为C元素,Y为O元素,W为Si元素,Z为Cl元素。
【详解】A.同周期元素从左到右半径依次减小,同主族元素从上到下半径依次增大,四种元素中原子半径最大的是Si,即W,A正确;
B.CCl4是分子晶体,SiO2是共价晶体,晶体类型不同,B错误;
C.CO2和SiO2都能与NaOH反应,CO2+2NaOH = Na2CO3+H2O、SiO2+2NaOH = Na2SiO3+H2O,C正确;
D.Si是重要的半导体材料,用于计算机芯片、太阳能电池等多项领域,D正确;
故选B。
12.D
【详解】A.有的分子晶体不溶于水,不发生电离,如氧气、乙醇形成的分子晶体,则不能导电,故A错误;
B.氯化钠为离子晶体,氯化氢为分子晶体,氯化钠溶于水破坏离子键,氯化氢溶于水破坏共价键,故B错误;
C.氢键只影响物质的物理性质,水是一种非常稳定的化合物,是因为H-O键的稳定性强,故C错误;
D.分子晶体由固体变为气体,克服分子间作用力,C60和干冰均为分子晶体,则C60气化和干冰升华克服的作用力相同,故D正确;
答案选D。
13.B
【详解】A.为原子晶体,A错误;
B.Ar晶体为分子晶体,B正确;
C.晶体为离子晶体,C错误;
D.NaOH晶体为离子晶体,D错误;
故选B。
14.C
【详解】A.Si为共价晶体,A错误;
B.SiO2为共价晶体,B错误;
C.SiCl4为分子晶体,C正确;
D.SiC为共价晶体,D错误;
故答案选C。
15.C
【详解】A.单质硅属于非金属单质,但是其形成的晶体是共价晶体,A错误;
B.稀有气体形成的分子晶体中,不存在共价键,B错误;
C.根据石墨烯的结构分析一个六元环含有个碳原子,则12g石墨烯(物质的量为1mol)中含有六元环的物质的量为0.5mol即六元环的个数为,C正确;
D.根据C60晶体分析得到一个C60晶体个C60,含有720g C60(物质的量为1mol)晶体中含有个晶胞,D错误;
故选C。
16.B
【详解】在分子晶体中,相邻分子靠分子间作用力相互吸引。分子晶体熔化时,只需克服分子间作用力,不破坏化学键,所以分子晶体一般具有较低的熔点。此外,分子晶体还具有硬度小、易升华、有较强的挥发性、一般不导电等特点。
①熔点高,不是分子晶体的性质;
②熔点低,不导电,可能是分子晶体的性质;
③熔沸点不高,可能是分子晶体的性质;
④固态能导电,不是分子晶体的性质;
故选B。
17.C
【详解】A.乙烯是共价型分子,晶体类型应该为分子晶体,故A错误;
B.乙烯分子是平面结构,6个原子共平面,不是直线型分子,故B错误;
C.乙烯分子结构式为,则分子内既有极性键又有非极性键,故C正确;
D.乙烯分子结构是轴对称结构,正负电荷中心重合,是非极性分子,故D错误;
故答案为C。
18.C
【详解】A. N原子核外有3个未成对电子,在分子中,N原子形成3个σ键,一对孤电子对,分子中不含有键,A错误;
B. 属于分子晶体,B错误;
C. 分子是由非极性键构成的非极性分子,C正确;
D. 、都是非极性分子,的分子量更大,范德华力更大,故熔点更高,D错误;
故选C。
19.C
【详解】A.碱金属元素随电子层数增多,单质的沸点降低,沸点Li>Na>K,故A错误;
B.金刚石、晶体硅、碳化硅都是原子晶体,原子半径越小键长越短,键能越大,熔沸点越高,Si原子半径小于C,熔点:金刚石>碳化硅>晶体硅,故B错误;
C.P原子3p能级半充满,结构稳定,第一电离能大于同周期相邻元素,第一电离能:S<P<Cl,故C正确;
D.同周期元素从左到右电负性依次增大,元素的电负性:N
20.B
【分析】由X原子M层上有2个未成对电子且无空轨道可知,X为S元素;Y原子的特征电子构型为3d64s2,则Y为Fe元素;Q原子的L电子层的p能级上只有一对成对电子,则Q是O元素;由Z原子的核外电子总数等于O原子的最外层电子数可知,Z为C元素;由T原子有1个3p空轨道可知,T是Si元素。
【详解】A.Fe元素和O元素能形成化合物Fe2O3,A项正确;
B.元素的非金属性越强,气态氢化物的稳定性越强,非金属性:Q>Z>T,则气态氢化物的稳定性:Q>Z>T,B项错误;
C.硫元素和氧元素结合生成的化合物可以是二氧化硫或三氧化硫,二氧化硫和三氧化硫都是共价化合物,形成的晶体为分子晶体,C项正确;
D.Si元素和C元素的最高价氧化物二氧化硅和二氧化碳均为酸性氧化物,D项正确;
答案选B。
21.A
【详解】A.NH3、H2O、CO2、HCl分子中含有的孤电子对分别为1、2、4、3,所以二氧化碳分子中含有的孤电子对最多,故A正确;
B.卤素单质形成的晶体类型是分子晶体,熔点和相对分子质量成正比,则晶体熔点由低到高:F2<Cl2<Br2<I2,故B错误;
C.硫离子最外层达到8电子稳定结构,其正确的核外电子排布式为:1s22s22p63s23p6,故C错误;
D.在一定条件下,原子的核外电子从基态跃迁到激发态,需要吸收能量,产生的光谱属于吸收光谱,故D错误;
故选A。
22.A
【详解】A.28g晶体硅中含有Si—Si键的个数为=2NA,A正确;
B.124g白磷(P4)晶体中含有P—P键的个数为=6NA,B错误;
C.12g石墨中含有C—C键的个数为=1.5NA,C错误;
D.SiO2晶体中每摩尔硅原子可与氧原子形成4NA个共价键(Si—O键),D错误;
故答案为:A。
23.C
【详解】A.CS2、CCl4、S2Cl2都由分子构成,它们在固态时都形成分子晶体,A正确;
B.S2Br2与S2Cl2结构式分别为Br-S-S-Br、Cl-S-S-Cl,分子结构相似,分子间只存在范德华力,相对分子质量S2Br2>S2Cl2,则熔沸点:S2Br2>S2Cl2,B正确;
C.CS2、CCl4、S2Cl2在固态时都形成分子晶体,熔沸点的高低受分子间范德华力的影响,与共价键的键能无关,C不正确;
D.S2Cl2中,Cl显-1价,S显+1价,若S发生歧化反应,则产物中S的价态应在+1价的两侧,可能为0价和+4价,所以与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,D正确;
故选C。
24.C
【详解】A.FeCl3可作净水剂是因为Fe3+水解生成Fe(OH)3胶体,胶体具有净水的作用,与氯化铁的氧化性无关,A错误;
B.用于制造光导纤维的是二氧化硅不是单质硅,B错误;
C.液晶分子可沿电场方向有序排列,故液晶可作电视显示屏,C正确;
D.Ba2+属于重金属离子有毒,BaSO4为不溶于胃酸的沉淀,故可用作钡餐,D错误;
故答案选C。
25.B
【分析】周期表中基态原子的最外层均有2个未成对电子的元素在第IVA族和第VIA族,短周期中符合此条件的有碳、硅、氧、硫四种元素,由图中看出,一个A周围有2个B,一个B原子周围有四个A,AB原子个数比应该是2:1,可以形成CO2,CS2,SiO2等物质,又知A、B原子序数依次增大,只有A是O元素,B是Si元素符合,形成的化合物是SiO2。
【详解】A.SiO2是原子晶体,故A错误;
B.由图可知晶胞中B原子(即Si原子)所在位置有4个在棱上,2个在面上,1个在晶胞内该晶胞中含有Si原子个数为 +2 +1=3,按照Si与O原子1:2,所以含有6个氧原子,故B正确;
C.SiO2中Si原子和O原子都是sp3杂化,杂化方式相同,故C错误;
D.硅最外层四个电子,一个硅与周围4个氧原子形成共价键,O原子最外层有6个电子,与2个硅形成共价键,因此Si原子和O原子都满足8电子稳定结构,故D错误;
答案选B。
【点睛】基态原子的最外层均有2个未成对电子是本题解题的关键。
26. ①⑤⑧ ⑤ ② ④⑤
【详解】共价晶体
分子晶体
故答案为: ;①⑤⑧ ;⑤;② ;④⑤;
27. 正四面体形 分子晶体
【详解】四氯化锡分子中锡原子的价层电子对数为4,孤对电子对数为0,分子的空间构型为正四面体形;由常温常压下四氯化锡为无色液体可知,四氯化锡的固体为熔沸点低的分子晶体。
28.(1)<
(2) M 9
(3)硅烷的相对分子质量越大,分子间范德华力越强
(4) 12 M3C60
(5) sp2、sp3
【详解】(1)同一周期主族元素第一电离能从左向右呈增大趋势,第IIA族和第VA族第一电离能比同周期相邻元素大,因此第一电离能:Al
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越强,沸点越高。
(4)M原子位于晶胞的棱上与内部,内部有9个M原子,棱上有12=3个,M原子的个数为9+3=12,C60位于顶点和面心,其个数为8+6=4,M和C60的个数比为3:1,该材料的化学式为M3C60。
(5)由EMIM+离子的结构可知,环外的3个碳原子都是形成4个σ键,采取sp3杂化,环上的3个碳原子都是形成3个σ键和1个大π键,采取sp2杂化,依据EMIM+离子的结构,可知形成大π键的原子数为5,电子数为6,因此大π键可表示为:
