2.2 电解质的电离 离子反应 同步练习(含解析) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2 电解质的电离 离子反应 同步练习(含解析) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 104.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 13:23:39 | ||
图片预览




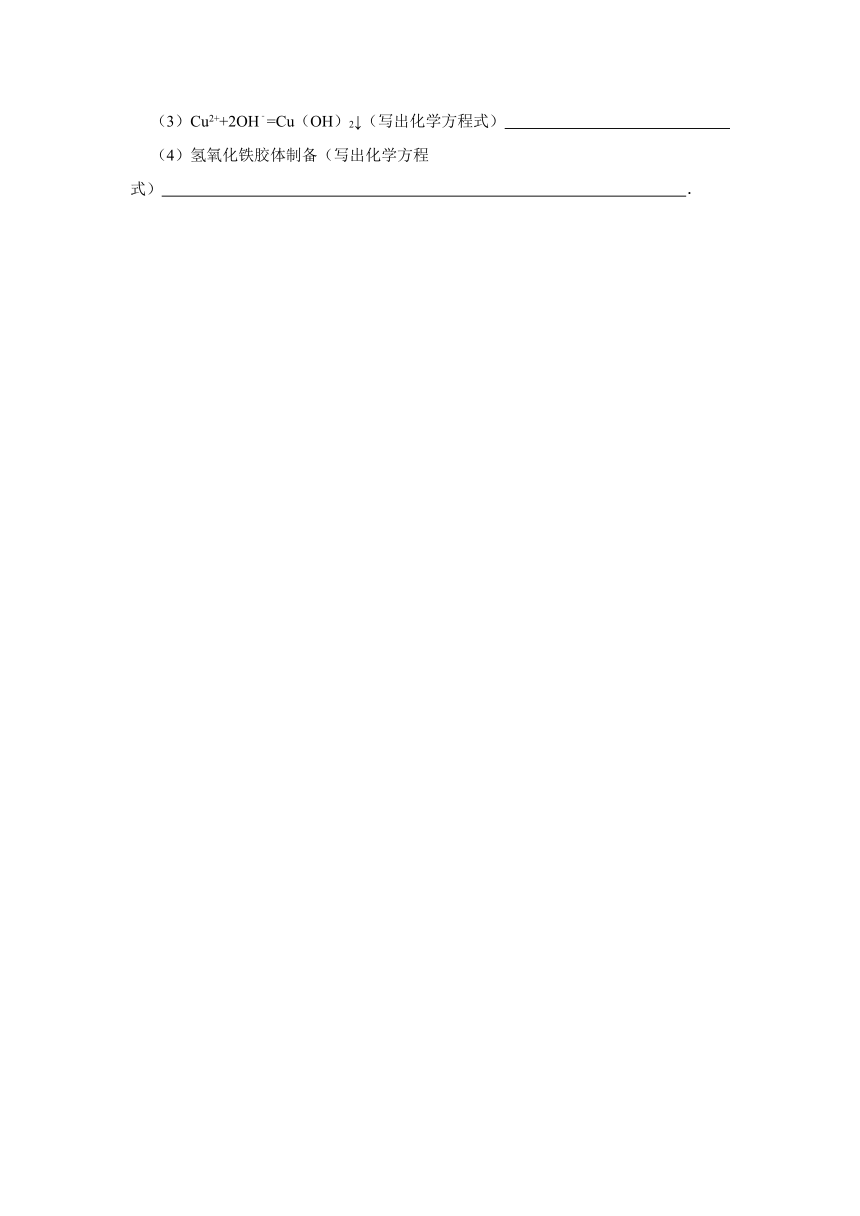
文档简介
2.2 电解质的电离 离子反应 同步练习
一、单选题
1.下列物质不属于电解质的是( )
A.Na B.H2SO4 C.NaOH D.Na2SO4
2.下列物质属于电解质的是( )
A.铝制导线 B.氨水
C.稀硫酸 D.硝酸钠
3.下列属于电解质并能导电的物质是()
A.熔融的NaCl B.KNO3溶液
C.Na D.NH3的水溶液
4.下列物质属于电解质的是( )
A.CO2 B.H2SO4溶液
C.Na2SO4固体 D.C2H5OH(乙醇)
5.室温下,下列各组离子在指定溶液中能大量共存的是
A.溶液:、、
B.溶液:、、
C.加入甲基橙后变红的溶液:、、
D.溶液:、、
6.下列反应的离子方程式书写错误的是( )
A.向氯化铝溶液中加入过量的氨水:Al3++3NH3·H2O= Al(OH)3↓+3NH4+
B.用氨水吸收过量的二氧化硫:NH3·H2O+SO2 = NH4+ +HSO3-
C.向偏铝酸钠溶液中加入过量的稀盐酸:AlO2-+H++H2O= Al(OH)3↓
D.向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO +CO32-
7.下列物质属于电解质的是( )
A.食盐水 B.铜 C.二氧化硫 D.氢氧化钠
8.粗盐含有K+、Ca2+、Mg2+、Fe3+、SO 等杂质离子,实验室提纯NaCl的流程如图:
下列说法错误的是( )
A.试剂a的滴加顺序依次为NaOH、Na2CO3、BaCl2
B.过滤所用到的玻璃仪器主要有烧杯、玻璃棒、漏斗
C.加入盐酸调pH的目的是将过量的NaOH和Na2CO3转化为NaCl
D.除去NaCl晶体中混有的少量KCl可用重结晶的方法
9.下列化学反应的离子方程式书写正确的是( )
A.把金属铁放入稀硫酸中:Fe+2H+═Fe3++H2↑
B.往碳酸镁中滴加稀盐酸:CO32﹣+2H+═CO2↑+H2O
C.氢氧化铜加到盐酸中:Cu(OH)2+2H+═Cu2++2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣+H++OH﹣═Ba SO4↓+H2O
10.在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是( )
A.K+、Ba2+、Cl–、NO3– B.Na+、Ca2+、I–、NO3–
C.NH4+、Al3+、Br–、SO42– D.K+、Na+、HCO3–、SO42–
11.某溶液中由水电离产生的C(H+)=1.0×10-10mol/L,则下列各组离子在该溶液中肯定能大量共存的是:( )
A.K+、Na+、HCO3-、Cl- B.Na+、K+、NO3-、Cl-
C.K+、Na+、S2-、NO3- D.Mg2+、Na+、SO32-、CO32-
12.下列各组离子在选项条件下一定能大量共存的是( )
A.无色溶液:Na+、Cu2+、Cl-、 、
B.酸性溶液: 、Fe3+、S2 、
C.遇酚酞变红的溶液:Na+、K+、 、
D.碱性溶液:K+、Al3+、 、
13.下列关于铝及其化合物反应的离子方程式书写正确的是
A.铝与NaOH溶液反应:
B.与NaOH溶液反应:
C.明矾净水原理:
D.与过量氨水反应:
14.常温下,下列各组离子在指定条件下能大量共存的是( )
A.弱碱性溶液中:Na+、K+、Cl﹣、HCO3﹣
B.无色透明的酸性溶液中:Al3+、NH4+、Cl 、HCO3
C.pH=1的溶液中:ClO﹣、SO42﹣、Fe2+、K+
D.由水电离的c(OH﹣)=10﹣14mol L﹣1的溶液中:CH3 COO﹣、SO42﹣、Na+、NH4+
15.下列电离方程式错误的是( )
A.NaHCO3=Na++H++CO32﹣ B.NaHSO4=Na++H++SO42﹣
C.H2SO4=2H++SO42﹣ D.CH3COOH CH3COO﹣+H+
16.下列各组中的离子,能在溶液中大量共存的是( )
A.Cl-、Na+、 、Ca2+ B.H+、 、Cl-、K+
C.K+、Ba2+、Cl-、 D.Fe2+、 、 、H+
二、综合题
17.按要求写出下列方程式
(1)Fe2(SO4)3(写出电离方程式)
(2)Ba(OH)2和H2SO4溶液:(写出化学方程式) .
18.以下12种为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4④SO3⑤H2SO4⑥C2H5OH ⑦CaCO3⑧BaSO4⑨Cu(OH)2⑩Fe(OH)3 NaOH NH3 H2O
请按下列分类标准回答问题.(用序号填空)
(1)属于非电解质的是 .
(2)能电离出H+的是 ,属于酸的是 .
(3)属于碱的是 ,其中属于难溶性碱的是 .
(4)属于难溶的盐是 .
19.氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。
提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②用离子方程式表示加盐酸的作用是 ; ;
(2)实验所得纯NaCl的质量大于粗盐中NaCl的质量,原因是 。
20.今有10种物质:①Na ②稀硝酸 ③纯醋酸 ④NH3 ⑤空气 ⑥CO2⑦Fe(OH)3胶体 ⑧NaCl晶体 ⑨BaCO3 ⑩碘酒,(1)至(4)小题按信息用番号填空.
(1)能导电的物质 ;
(2)电解质,但熔融状态下并不导电 .
(3)强电解质 ;
(4)非电解质 ;
(5)区分Fe(OH)3胶体和FeCl3溶液实验方法 ;
(6)实验室中①通常保存在 中;
(7)写出②和⑨反应的离子方程式 .
21.按要求填空
(1)稀硫酸跟氧化镁反应(写出离子方程式)
(2)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(3)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式)
(4)氢氧化铁胶体制备(写出化学方程式) .
答案解析部分
1.【答案】A
【解析】【解答】A. Na是单质,电解质和非电解质都是化合物,所以钠既不属于电解质,也不属于非电解质,故A符合题意;
B. 在水溶液中,H2SO4电离出自由移动的离子导电,H2SO4是电解质,故B不符合题意;
C. NaOH是化合物,在水溶液或熔融状态下能够导电,属于电解质,故C不符合题意;
D. Na2SO4是化合物,在水溶液在熔融状态下能够导电,属于电解质,故D不符合题意;
故答案为:A。
【分析】易错点:电解质及非电解质都是化合物,所以单质和混合物既不是电解质也不是非电解质
2.【答案】D
【解析】【解答】A.铝是单质不是化合物,不是电解质,也不是非电解质,故A不符合题意;
B.氨水是氨气溶于水形成的一水合氨溶液,属于混合物,不是电解质,也不是非电解质,故B不符合题意;
C.稀硫酸是混合物,不是化合物,既不是电解质,也不是非电解质,故C不符合题意;
D.硝酸钠的水溶液或熔融状态都能导电,所以硝酸钠是电解质,故D符合题意;
故答案为:D。
【分析】电解质是在水溶液里或熔融状态下能导电的化合物;在水溶液里或熔融状态下都不能导电的化合物是非电解质
3.【答案】A
【解析】【解答】A.NaCl为电解质,在熔融状态下能导电,A符合题意;
B.KNO3溶液能导电,但属于混合物,不是电解质,B不符合题意;
C.Na为单质,不是电解质,也不是非电解质,C不符合题意;
D.NH3的水溶液能导电,氨气是非电解质,D不符合题意。
故答案为:A
【分析】电解质:在水溶液或熔融状态能够导电的化合物;
非电解质:在水溶液和熔融状态均不能导电的化合物;
所以混合物和单质既不是电解质,也不是非电解质。
4.【答案】C
【解析】【解答】
A. CO2的水溶液虽然可以导电,但是溶液中的离子是由碳酸电离产生的,并非CO2自身电离产生的,因此CO2属于非电解质,故A不符合题意;
B. H2SO4溶液是混合物,既不是电解质也不是非电解质,故B不符合题意;
C. Na2SO4固体溶于水和熔融态均可以导电,故其是电解质,故C符合题意;
D. C2H5OH(乙醇)在水溶液里和熔融状态下均不能导电,是非电解质,故D不符合题意;
故答案为:C。
【分析】电解质是在水溶液里或熔融状态下能导电的化合物,非电解质是在水溶液里和熔融状态下均不能导电的化合物。
5.【答案】D
【解析】【解答】A.偏铝酸根离子与氢离子会生成氢氧化铝沉淀或铝离子,两者不能大量共存,A不符合题意;
B.铁离子与碳酸根离子会发生双水解生成氢氧化铁沉淀和二氧化碳,不能大量共存,B不符合题意;
C.加入甲基橙后变红的溶液存在氢离子,氢离子与氟离子会反应生成弱电解质HF,氢离子和碳酸根离子反应生成二氧化碳,C不符合题意;
D.限定溶液中,离子均不反应,能大量共存,D符合题意;
故答案为:D
【分析】能发生反应的离子不能大量共存。复分解型离子反应中,生成难溶物、易挥发的物质、弱电解质均不能共存。
6.【答案】C
【解析】【解答】A.氯化铝溶液中加入过量的氨水,反应的离子方程式为:Al3++3NH3·H2O= Al(OH)3↓+3NH4+,所以A选项是不符合题意的;
B.用氨水吸收过量的二氧化硫,反应生成亚硫酸氢铵,反应的离子方程式为:NH3·H2O+SO2 = NH4+ +HSO3-,所以B选项是不符合题意的;
C.向偏铝酸钠溶液中加入过量稀盐酸,反应生成氯化铝和水,符合题意的离子方程式为:AlO2-+4H+= Al3++2H2O,故C符合题意;
D.次氯酸钠溶液中通入少量的二氧化碳,反应生成碳酸钠和次氯酸,反应的离子方程式为:2ClO-+CO2+H2O=2HClO +CO32-,所以D选项是不符合题意的。
故答案为:C。
【分析】离子方程式,即用实际参加反应的离子符号表示离子反应的式子。是指可溶性物质可拆的反应。多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三特殊,四反应。
7.【答案】D
【解析】【解答】电解质是指在水溶液或熔融状态下能导电的化合物,A项食盐水是混合物,不是电解质;B项铜是单质,不是电解质;C项二氧化硫本身不能导电,不是电解质,D项氢氧化钠是电解质,
故答案为:D。
【分析】电解质是指在水溶液或熔融状态下能导电的化合物,二氧化硫本身不能电离出离子,不是电解质。
8.【答案】A
【解析】【解答】A.氢氧化钠除去Mg2+、Fe3+,氯化钡除去硫酸根离子,碳酸钠除去钙离子和过量的钡离子,则试剂a的滴加顺序依次为NaOH、BaCl2、Na2CO3,A符合题意;
B.过滤所用到的玻璃仪器主要有烧杯、玻璃棒、漏斗,B不符符合题意;
C.根据流程图可知氢氧化钠和碳酸钠过量,则加入盐酸调pH的目的是将过量的NaOH和Na2CO3转化为NaCl,C不符符合题意;
D.氯化钠和氯化钾的溶解度受温度影响不同,则除去NaCl晶体中混有的少量KCl可用重结晶的方法,D不符符合题意;
故答案为:A。
【分析】此实验是氯化钠的提纯,加入的试剂时氢氧化钠、碳酸钠、氯化钡溶液,一定要注意碳酸钠需要在氯化钡溶液之后加入,碳酸钠的作用不仅要除去钙离子还要除去钡离子,过滤是需要的玻璃仪器是烧杯、漏斗、玻璃棒,加入稀盐酸的目的是除去多余的碳酸钠和氢氧化钠,氯化钾和氯化钠均在溶液中,应该采取结晶的方式进行除杂
9.【答案】C
【解析】【解答】解:A.把金属铁放入稀硫酸中,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.往碳酸镁中滴加稀盐酸,离子方程式:MgCO3+2H+═CO2↑+H2O+Mg2+,故B错误;
C.氢氧化铜加到盐酸中发生酸碱中和反应离子方程式为:Cu(OH)2+2H+═Cu2++2H2O,故C正确;
D.氢氧化钡溶液与稀硫酸反应,离子方程式:Ba2++SO42﹣+2H++2OH﹣═Ba SO4↓+2H2O,故D错误;
故选:C.
【分析】A.不符合反应客观事实,二者反应生成硫酸亚铁和氢气;
B.碳酸镁为沉淀,保留化学式;
C.二者反应生成氯化铜和水;
D.离子个数配比不符合物质结构.
10.【答案】A
【解析】【解答】由水电离产生的c(H+)=1×10–14mol/L,此溶液为酸或碱,A、在酸或碱中能大量共存,故A正确;
B、NO3-在酸性溶液具有强氧化性,能把Fe2+氧化成Fe3+,在酸中不能大量共存,在碱中Ca2+和Fe2+与OH-不能大量共存,故B错误;
C、NH4+和Al3+在碱中不能大量共存,生成NH3·H2O和Al(OH)3,因此不能大量共存,故C错误;
D、HCO3-既不能存在酸中,也不能存在于碱中,因此不能大量共存,故D错误。
【分析】产生水:OH-和H+、HCO3-、HS-、HCO3-不能共存;
产生气体:NH4+和OH-不能共存、H+和CO32-、HCO3-、S2-、HS-、SO32-、HSO3-不能共存;
产生固体:OH-只能和K+、Na+、Ba2+大量共存;
CO32-只能和K+、Na+共存;
SO42-只和Ba2+、Ca2+、Ag+不能共存;
Cl-只和Ag+不能共存
11.【答案】B
【解析】【解答】A、溶液可能是酸性或碱性,碳酸氢根离子在酸性或碱性条件下不存在,不选A;
B、四种离子在酸性或碱性溶液中存在,选B;
C、硫离子在酸性条件下反应而不共存,不选C;
D、镁离子在碱性条件下反应不存在,亚硫酸根离子和碳酸根离子在酸性条件下反应不存在,不选D。
故答案为:B。
【分析】水电离产生的c(H+)=1.0×10-10mol/L的溶液可能是酸溶液,也可能是碱溶液。
12.【答案】C
【解析】【解答】A.Cu2+的水溶液显蓝色,在无色溶液中不能大量存在,A不符合题意;
B.酸性溶液中含有大量H+,H+与S2 会发生反应产生硫化氢,Fe3+具有氧化性,S2 具有还原性,Fe3+、S2-会发生氧化还原反应,不能大量共存,B不符合题意;
C.遇酚酞变红的溶液显碱性,含大量OH-,OH-与选项离子之间不能发生任何反应,可以大量共存,C符合题意;
D.碱性溶液含大量OH-,OH-与Al3+会发生离子反应生成氢氧化铝或偏铝酸根及H2O,不能大量共存,D不符合题意;
故答案为:C。
【分析】A.铜离子为有色离子;
B.铁离子、氢离子与硫离子反应;
C.该溶液呈碱性,四种离子之间不反应,都不与氢氧根离子反应;
D.铝离子与氢氧根离子反应。
13.【答案】C
【解析】【解答】A.铝与NaOH溶液反应的氧化剂是水,故其离子反应方程式为:,A不符合题意;
B.与NaOH溶液反应的离子方程式未配平,配平后的离子方程式为:,B不符合题意;
C.明矾溶于水后电离产生的铝离子发生水解产生的氢氧化铝胶体,吸附悬浮物,起到净水作用,C符合题意;
D.一水合氨为弱碱,故氢氧化铝无法与一水合氨发生反应,与过量氨水反应为:,D不符合题意;
故答案为:C。
【分析】A.电荷不守恒;
B.原子不守恒;
C.依据盐类水解规律分析;
D.一水合氨为弱碱,氢氧化铝无法与一水合氨反应。
14.【答案】A
【解析】【解答】解:A.HCO3﹣在溶液中发生水解,溶液呈弱碱性,四种离子之间不发生反应,能够大量共存,故A正确;
B.酸性溶液中存在大量氢离子,HCO3 与氢离子反应,Al3+、HCO3 之间发生双水解反应,在溶液中一定不能大量共存,故B错误;
C.pH=1的溶液中存在大量氢离子,ClO﹣、Fe2+之间发生氧化还原反应,ClO﹣与氢离子反应,在溶液中一定不能大量共存,故C错误;
D.由水电离的c(OH﹣)=10﹣14mol L﹣1的溶液中存在大量氢离子或氢氧根离子,CH3COO﹣、与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
【分析】A.碳酸氢根离子水解,溶液呈弱碱性;
B.铝离子与碳酸氢根离子发生双水解反应,碳酸氢根离子与酸性溶液中的氢离子反应;
C.pH=1的溶液中存在大量氢离子,次氯酸根离子与氢离子反应,次氯酸根离子能够氧化亚铁离子;
D.由水电离的c(OH﹣)=10﹣14mol L﹣1的溶液中存在大量氢离子或氢氧根离子,醋酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
15.【答案】A
【解析】【解答】解:A.碳酸氢根离子为弱酸的酸式根离子不能拆,碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3﹣,故A错误;
B.NaHSO4在溶液中电离生成Na+和H+、SO42﹣,电离方程式为:NaHSO4=Na++H++SO42﹣,故B正确;
C.硫酸为强电解质,完全电离出氢离子与硫酸根离子,电离方程式:H2SO4=2H++SO42﹣,故C正确;
D.乙酸为弱电解质,部分电离,电离方程式:CH3COOH CH3COO﹣+H+,故D正确;
故选A.
【分析】A.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆;
B.硫酸氢钠是强电解质,能完全电离出Na+和H+、SO42﹣,溶液有强的酸性;
C.硫酸为强电解质,一步完全电离出氢离子与硫酸根离子;
D.CH3COOH为弱电解质,部分电离,用可逆符号.
16.【答案】A
【解析】【解答】A. Cl-、Na+、NO3-、Ca2+之间不反应,能在溶液中大量共存,A符合题意;
B. H+、HCO3-反应生成二氧化碳和水,不能大量共存,B不符合题意;
C. Ba2+、SO42-反应生成硫酸钡沉淀,不能大量共存,C不符合题意;
D. Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,D不符合题意,
故答案为:A
【分析】溶液中离子能大量共存,则相互间不发生反应,即不形成弱电解质、易挥发性物质、不形成难溶(或微溶)性物质;据此结合选项所给离子进行分析。
17.【答案】(1)Fe2(SO4)3═2Fe3++3SO42﹣
(2)Ba(OH)2+H2SO4═2H2O+BaSO4↑
【解析】【解答】解:(1)硫酸铁为强电解质,完全电离出三价铁离子与硫酸根离子,电离方程式:Fe2(SO4)3═2Fe3++3SO42﹣;
故答案为:Fe2(SO4)3═2Fe3++3SO42﹣;(2)Ba(OH)2和H2SO4溶液,二者反应生成硫酸钡沉淀和氢氧化铜沉淀,化学方程式:Ba(OH)2+H2SO4═2H2O+BaSO4↓;
故答案为:Ba(OH)2+H2SO4═2H2O+BaSO4↓.
【分析】(1)硫酸铁为强电解质,完全电离出三价铁离子与硫酸根离子;(2)二者反应生成硫酸钡沉淀和氢氧化铜沉淀.
18.【答案】(1)④⑥
(2)③⑤;⑤
(3)⑨⑩ ;⑨⑩
(4)⑦⑧
【解析】【解答】解:(1)④SO3、⑥C2H5OH在溶液中或液态时本身不能电离出离子,二者属于非电解质,
故答案为:④⑥;(2)③NaHSO4⑤H2SO4 能电离出氢离子;电离出的阳离子全部是氢离子的化合物为酸,故⑤为酸,
故答案为:③⑤;⑤;(3)⑨Cu(OH)2⑩Fe(OH)3 NaOH NH3 H2O电离出的阴离子全是氢氧根离子属于碱,其中⑨Cu(OH)2⑩Fe(OH)3
难溶于水,属于难溶性碱,
故答案为:⑨⑩ ;⑨⑩;(4)碳酸钙、硫酸钡不溶于水,都属于难溶性盐,
故答案为:⑦⑧.
【分析】(1)非电解质是在水溶液中和熔融状态下都不能导电的化合物,根据电解质的定义分析;(2)酸或酸式盐能电离出氢离子;(3)电离出阴离子全是氢氧根离子的化合物为碱;根据物质的溶解性分析;(4)根据常见物质的溶解性大小分析.
19.【答案】(1)BaCl2;Na2CO3;H++OH-=H2O;2H++CO32-=H2O+CO2↑
(2)除去杂质的同时试剂之间反应,会发生反应生成NaCl
【解析】【解答】(1)①依次滴加过量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液时,可以依次除去氯化镁、硫酸钠、氯化钙和过量的氯化钡;
②加入盐酸是为了中和氢氧化钠、与碳酸钠反应,从而把过量的氢氧化钠、碳酸钠除去,故填:H++OH-=H2O;2H++CO32-=H2O+CO2↑;
(2)除去杂质的同时试剂之间反应,会生成NaCl,,所以,纯NaCl的质量大于粗盐中NaCl的质量。
故填:除去杂质的同时试剂之间反应,会生成NaCl。
【分析】(1)粗盐提纯时,先BaCl2,再加Na2CO3,两者顺序不能颠倒;盐酸的作用是除去过量的氢氧化钠和碳酸钠;
(2)除杂试剂中含有钠离子,均生成了氯化钠。
20.【答案】(1)①②⑦
(2)③
(3)⑧⑨
(4)④⑥
(5)用一束可见光线通过Fe(OH)3胶体和FeCl3溶液,在氢氧化铁胶体中会出现光亮的通路
(6)煤油
(7)BaCO3+2H+=Ba2++CO2↑+H2O
【解析】【解答】解:(1)能导电的物质有①Na,②稀硝酸、⑦Fe(OH)3胶体,故答案为:①②⑦;(2)属于电解质,但熔融状态下并不导电的化合物为:③纯醋酸,故答案为:③;(3)强电解质是⑧NaCl晶体,⑨BaCO3,故答案为:⑧⑨;(4)非电解质是④NH3,⑥CO2 ,故答案为:④⑥;(5)区分Fe(OH)3胶体和FeCl3溶液实验方法是用一束可见光线通过Fe(OH)3胶体和FeCl3溶液,在氢氧化铁胶体中会出现光亮的通路,氯化铁溶液无此现象,
故答案为:用一束可见光线通过Fe(OH)3胶体和FeCl3溶液,在氢氧化铁胶体中会出现光亮的通路;(6)钠是活泼金属和空气中的氧气、水蒸气等方式反应,实验室中保存在煤油中,故答案为:煤油;(7)②和⑨反应是稀硝酸和BaCO3反应生成硝酸钡、水和二氧化碳,反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
【分析】(1)当物质中有自由移动的离子或自由移动的电子时,则物质能导电,据此分析;(2)熔融状态下不导电的电解质说明化合物为共价化合物;(3)在水溶液中或熔融状态下能完全电离的化合物为强电解质;(4)在水溶液中和熔融状态下都不能导电的化合物为非电解质;(5)溶液和胶体的区别方法用丁达尔现象鉴别;(6)钠是活泼金属和空气中的氧气、水蒸气等方式反应;(7)②和⑨反应是稀硝酸和BaCO3反应生成硝酸钡、水和二氧化碳.
21.【答案】(1)2H++MgO=Mg2++H2O
(2)HCO3﹣+H+=H2O+CO2↑
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl
(4)FeCl3+3H2O Fe(OH)3(胶体)+3HCl
【解析】【解答】解:(1)稀硫酸跟氧化镁反应生成硫酸镁和水,离子方程式:2H++MgO=Mg2++H2O;故答案为:2H++MgO=Mg2++H2O;(2)盐酸跟碳酸氢钠溶液反应生成氯化钠和二氧化碳、水,离子方程式:HCO3﹣+H+=H2O+CO2↑;故答案为:HCO3﹣+H+=H2O+CO2↑;(3)Cu2++2OH﹣=Cu(OH)2↓可以表示可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐,可以表示氯化铜与氢氧化钠反应,方程式:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;4)氯化铁水解生成氢氧化铁胶体和氯化氢,离子方程式:FeCl3+3H2O Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O Fe(OH)3(胶体)+3HCl.
【分析】(1)稀硫酸跟氧化镁反应生成硫酸镁和水;(2)盐酸跟碳酸氢钠溶液反应生成氯化钠和二氧化碳、水;(3)Cu2++2OH﹣=Cu(OH)2↓可以表示可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐;(4)氯化铁水解生成氢氧化铁胶体和氯化氢
一、单选题
1.下列物质不属于电解质的是( )
A.Na B.H2SO4 C.NaOH D.Na2SO4
2.下列物质属于电解质的是( )
A.铝制导线 B.氨水
C.稀硫酸 D.硝酸钠
3.下列属于电解质并能导电的物质是()
A.熔融的NaCl B.KNO3溶液
C.Na D.NH3的水溶液
4.下列物质属于电解质的是( )
A.CO2 B.H2SO4溶液
C.Na2SO4固体 D.C2H5OH(乙醇)
5.室温下,下列各组离子在指定溶液中能大量共存的是
A.溶液:、、
B.溶液:、、
C.加入甲基橙后变红的溶液:、、
D.溶液:、、
6.下列反应的离子方程式书写错误的是( )
A.向氯化铝溶液中加入过量的氨水:Al3++3NH3·H2O= Al(OH)3↓+3NH4+
B.用氨水吸收过量的二氧化硫:NH3·H2O+SO2 = NH4+ +HSO3-
C.向偏铝酸钠溶液中加入过量的稀盐酸:AlO2-+H++H2O= Al(OH)3↓
D.向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO +CO32-
7.下列物质属于电解质的是( )
A.食盐水 B.铜 C.二氧化硫 D.氢氧化钠
8.粗盐含有K+、Ca2+、Mg2+、Fe3+、SO 等杂质离子,实验室提纯NaCl的流程如图:
下列说法错误的是( )
A.试剂a的滴加顺序依次为NaOH、Na2CO3、BaCl2
B.过滤所用到的玻璃仪器主要有烧杯、玻璃棒、漏斗
C.加入盐酸调pH的目的是将过量的NaOH和Na2CO3转化为NaCl
D.除去NaCl晶体中混有的少量KCl可用重结晶的方法
9.下列化学反应的离子方程式书写正确的是( )
A.把金属铁放入稀硫酸中:Fe+2H+═Fe3++H2↑
B.往碳酸镁中滴加稀盐酸:CO32﹣+2H+═CO2↑+H2O
C.氢氧化铜加到盐酸中:Cu(OH)2+2H+═Cu2++2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣+H++OH﹣═Ba SO4↓+H2O
10.在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是( )
A.K+、Ba2+、Cl–、NO3– B.Na+、Ca2+、I–、NO3–
C.NH4+、Al3+、Br–、SO42– D.K+、Na+、HCO3–、SO42–
11.某溶液中由水电离产生的C(H+)=1.0×10-10mol/L,则下列各组离子在该溶液中肯定能大量共存的是:( )
A.K+、Na+、HCO3-、Cl- B.Na+、K+、NO3-、Cl-
C.K+、Na+、S2-、NO3- D.Mg2+、Na+、SO32-、CO32-
12.下列各组离子在选项条件下一定能大量共存的是( )
A.无色溶液:Na+、Cu2+、Cl-、 、
B.酸性溶液: 、Fe3+、S2 、
C.遇酚酞变红的溶液:Na+、K+、 、
D.碱性溶液:K+、Al3+、 、
13.下列关于铝及其化合物反应的离子方程式书写正确的是
A.铝与NaOH溶液反应:
B.与NaOH溶液反应:
C.明矾净水原理:
D.与过量氨水反应:
14.常温下,下列各组离子在指定条件下能大量共存的是( )
A.弱碱性溶液中:Na+、K+、Cl﹣、HCO3﹣
B.无色透明的酸性溶液中:Al3+、NH4+、Cl 、HCO3
C.pH=1的溶液中:ClO﹣、SO42﹣、Fe2+、K+
D.由水电离的c(OH﹣)=10﹣14mol L﹣1的溶液中:CH3 COO﹣、SO42﹣、Na+、NH4+
15.下列电离方程式错误的是( )
A.NaHCO3=Na++H++CO32﹣ B.NaHSO4=Na++H++SO42﹣
C.H2SO4=2H++SO42﹣ D.CH3COOH CH3COO﹣+H+
16.下列各组中的离子,能在溶液中大量共存的是( )
A.Cl-、Na+、 、Ca2+ B.H+、 、Cl-、K+
C.K+、Ba2+、Cl-、 D.Fe2+、 、 、H+
二、综合题
17.按要求写出下列方程式
(1)Fe2(SO4)3(写出电离方程式)
(2)Ba(OH)2和H2SO4溶液:(写出化学方程式) .
18.以下12种为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4④SO3⑤H2SO4⑥C2H5OH ⑦CaCO3⑧BaSO4⑨Cu(OH)2⑩Fe(OH)3 NaOH NH3 H2O
请按下列分类标准回答问题.(用序号填空)
(1)属于非电解质的是 .
(2)能电离出H+的是 ,属于酸的是 .
(3)属于碱的是 ,其中属于难溶性碱的是 .
(4)属于难溶的盐是 .
19.氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。
提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②用离子方程式表示加盐酸的作用是 ; ;
(2)实验所得纯NaCl的质量大于粗盐中NaCl的质量,原因是 。
20.今有10种物质:①Na ②稀硝酸 ③纯醋酸 ④NH3 ⑤空气 ⑥CO2⑦Fe(OH)3胶体 ⑧NaCl晶体 ⑨BaCO3 ⑩碘酒,(1)至(4)小题按信息用番号填空.
(1)能导电的物质 ;
(2)电解质,但熔融状态下并不导电 .
(3)强电解质 ;
(4)非电解质 ;
(5)区分Fe(OH)3胶体和FeCl3溶液实验方法 ;
(6)实验室中①通常保存在 中;
(7)写出②和⑨反应的离子方程式 .
21.按要求填空
(1)稀硫酸跟氧化镁反应(写出离子方程式)
(2)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(3)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式)
(4)氢氧化铁胶体制备(写出化学方程式) .
答案解析部分
1.【答案】A
【解析】【解答】A. Na是单质,电解质和非电解质都是化合物,所以钠既不属于电解质,也不属于非电解质,故A符合题意;
B. 在水溶液中,H2SO4电离出自由移动的离子导电,H2SO4是电解质,故B不符合题意;
C. NaOH是化合物,在水溶液或熔融状态下能够导电,属于电解质,故C不符合题意;
D. Na2SO4是化合物,在水溶液在熔融状态下能够导电,属于电解质,故D不符合题意;
故答案为:A。
【分析】易错点:电解质及非电解质都是化合物,所以单质和混合物既不是电解质也不是非电解质
2.【答案】D
【解析】【解答】A.铝是单质不是化合物,不是电解质,也不是非电解质,故A不符合题意;
B.氨水是氨气溶于水形成的一水合氨溶液,属于混合物,不是电解质,也不是非电解质,故B不符合题意;
C.稀硫酸是混合物,不是化合物,既不是电解质,也不是非电解质,故C不符合题意;
D.硝酸钠的水溶液或熔融状态都能导电,所以硝酸钠是电解质,故D符合题意;
故答案为:D。
【分析】电解质是在水溶液里或熔融状态下能导电的化合物;在水溶液里或熔融状态下都不能导电的化合物是非电解质
3.【答案】A
【解析】【解答】A.NaCl为电解质,在熔融状态下能导电,A符合题意;
B.KNO3溶液能导电,但属于混合物,不是电解质,B不符合题意;
C.Na为单质,不是电解质,也不是非电解质,C不符合题意;
D.NH3的水溶液能导电,氨气是非电解质,D不符合题意。
故答案为:A
【分析】电解质:在水溶液或熔融状态能够导电的化合物;
非电解质:在水溶液和熔融状态均不能导电的化合物;
所以混合物和单质既不是电解质,也不是非电解质。
4.【答案】C
【解析】【解答】
A. CO2的水溶液虽然可以导电,但是溶液中的离子是由碳酸电离产生的,并非CO2自身电离产生的,因此CO2属于非电解质,故A不符合题意;
B. H2SO4溶液是混合物,既不是电解质也不是非电解质,故B不符合题意;
C. Na2SO4固体溶于水和熔融态均可以导电,故其是电解质,故C符合题意;
D. C2H5OH(乙醇)在水溶液里和熔融状态下均不能导电,是非电解质,故D不符合题意;
故答案为:C。
【分析】电解质是在水溶液里或熔融状态下能导电的化合物,非电解质是在水溶液里和熔融状态下均不能导电的化合物。
5.【答案】D
【解析】【解答】A.偏铝酸根离子与氢离子会生成氢氧化铝沉淀或铝离子,两者不能大量共存,A不符合题意;
B.铁离子与碳酸根离子会发生双水解生成氢氧化铁沉淀和二氧化碳,不能大量共存,B不符合题意;
C.加入甲基橙后变红的溶液存在氢离子,氢离子与氟离子会反应生成弱电解质HF,氢离子和碳酸根离子反应生成二氧化碳,C不符合题意;
D.限定溶液中,离子均不反应,能大量共存,D符合题意;
故答案为:D
【分析】能发生反应的离子不能大量共存。复分解型离子反应中,生成难溶物、易挥发的物质、弱电解质均不能共存。
6.【答案】C
【解析】【解答】A.氯化铝溶液中加入过量的氨水,反应的离子方程式为:Al3++3NH3·H2O= Al(OH)3↓+3NH4+,所以A选项是不符合题意的;
B.用氨水吸收过量的二氧化硫,反应生成亚硫酸氢铵,反应的离子方程式为:NH3·H2O+SO2 = NH4+ +HSO3-,所以B选项是不符合题意的;
C.向偏铝酸钠溶液中加入过量稀盐酸,反应生成氯化铝和水,符合题意的离子方程式为:AlO2-+4H+= Al3++2H2O,故C符合题意;
D.次氯酸钠溶液中通入少量的二氧化碳,反应生成碳酸钠和次氯酸,反应的离子方程式为:2ClO-+CO2+H2O=2HClO +CO32-,所以D选项是不符合题意的。
故答案为:C。
【分析】离子方程式,即用实际参加反应的离子符号表示离子反应的式子。是指可溶性物质可拆的反应。多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三特殊,四反应。
7.【答案】D
【解析】【解答】电解质是指在水溶液或熔融状态下能导电的化合物,A项食盐水是混合物,不是电解质;B项铜是单质,不是电解质;C项二氧化硫本身不能导电,不是电解质,D项氢氧化钠是电解质,
故答案为:D。
【分析】电解质是指在水溶液或熔融状态下能导电的化合物,二氧化硫本身不能电离出离子,不是电解质。
8.【答案】A
【解析】【解答】A.氢氧化钠除去Mg2+、Fe3+,氯化钡除去硫酸根离子,碳酸钠除去钙离子和过量的钡离子,则试剂a的滴加顺序依次为NaOH、BaCl2、Na2CO3,A符合题意;
B.过滤所用到的玻璃仪器主要有烧杯、玻璃棒、漏斗,B不符符合题意;
C.根据流程图可知氢氧化钠和碳酸钠过量,则加入盐酸调pH的目的是将过量的NaOH和Na2CO3转化为NaCl,C不符符合题意;
D.氯化钠和氯化钾的溶解度受温度影响不同,则除去NaCl晶体中混有的少量KCl可用重结晶的方法,D不符符合题意;
故答案为:A。
【分析】此实验是氯化钠的提纯,加入的试剂时氢氧化钠、碳酸钠、氯化钡溶液,一定要注意碳酸钠需要在氯化钡溶液之后加入,碳酸钠的作用不仅要除去钙离子还要除去钡离子,过滤是需要的玻璃仪器是烧杯、漏斗、玻璃棒,加入稀盐酸的目的是除去多余的碳酸钠和氢氧化钠,氯化钾和氯化钠均在溶液中,应该采取结晶的方式进行除杂
9.【答案】C
【解析】【解答】解:A.把金属铁放入稀硫酸中,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.往碳酸镁中滴加稀盐酸,离子方程式:MgCO3+2H+═CO2↑+H2O+Mg2+,故B错误;
C.氢氧化铜加到盐酸中发生酸碱中和反应离子方程式为:Cu(OH)2+2H+═Cu2++2H2O,故C正确;
D.氢氧化钡溶液与稀硫酸反应,离子方程式:Ba2++SO42﹣+2H++2OH﹣═Ba SO4↓+2H2O,故D错误;
故选:C.
【分析】A.不符合反应客观事实,二者反应生成硫酸亚铁和氢气;
B.碳酸镁为沉淀,保留化学式;
C.二者反应生成氯化铜和水;
D.离子个数配比不符合物质结构.
10.【答案】A
【解析】【解答】由水电离产生的c(H+)=1×10–14mol/L,此溶液为酸或碱,A、在酸或碱中能大量共存,故A正确;
B、NO3-在酸性溶液具有强氧化性,能把Fe2+氧化成Fe3+,在酸中不能大量共存,在碱中Ca2+和Fe2+与OH-不能大量共存,故B错误;
C、NH4+和Al3+在碱中不能大量共存,生成NH3·H2O和Al(OH)3,因此不能大量共存,故C错误;
D、HCO3-既不能存在酸中,也不能存在于碱中,因此不能大量共存,故D错误。
【分析】产生水:OH-和H+、HCO3-、HS-、HCO3-不能共存;
产生气体:NH4+和OH-不能共存、H+和CO32-、HCO3-、S2-、HS-、SO32-、HSO3-不能共存;
产生固体:OH-只能和K+、Na+、Ba2+大量共存;
CO32-只能和K+、Na+共存;
SO42-只和Ba2+、Ca2+、Ag+不能共存;
Cl-只和Ag+不能共存
11.【答案】B
【解析】【解答】A、溶液可能是酸性或碱性,碳酸氢根离子在酸性或碱性条件下不存在,不选A;
B、四种离子在酸性或碱性溶液中存在,选B;
C、硫离子在酸性条件下反应而不共存,不选C;
D、镁离子在碱性条件下反应不存在,亚硫酸根离子和碳酸根离子在酸性条件下反应不存在,不选D。
故答案为:B。
【分析】水电离产生的c(H+)=1.0×10-10mol/L的溶液可能是酸溶液,也可能是碱溶液。
12.【答案】C
【解析】【解答】A.Cu2+的水溶液显蓝色,在无色溶液中不能大量存在,A不符合题意;
B.酸性溶液中含有大量H+,H+与S2 会发生反应产生硫化氢,Fe3+具有氧化性,S2 具有还原性,Fe3+、S2-会发生氧化还原反应,不能大量共存,B不符合题意;
C.遇酚酞变红的溶液显碱性,含大量OH-,OH-与选项离子之间不能发生任何反应,可以大量共存,C符合题意;
D.碱性溶液含大量OH-,OH-与Al3+会发生离子反应生成氢氧化铝或偏铝酸根及H2O,不能大量共存,D不符合题意;
故答案为:C。
【分析】A.铜离子为有色离子;
B.铁离子、氢离子与硫离子反应;
C.该溶液呈碱性,四种离子之间不反应,都不与氢氧根离子反应;
D.铝离子与氢氧根离子反应。
13.【答案】C
【解析】【解答】A.铝与NaOH溶液反应的氧化剂是水,故其离子反应方程式为:,A不符合题意;
B.与NaOH溶液反应的离子方程式未配平,配平后的离子方程式为:,B不符合题意;
C.明矾溶于水后电离产生的铝离子发生水解产生的氢氧化铝胶体,吸附悬浮物,起到净水作用,C符合题意;
D.一水合氨为弱碱,故氢氧化铝无法与一水合氨发生反应,与过量氨水反应为:,D不符合题意;
故答案为:C。
【分析】A.电荷不守恒;
B.原子不守恒;
C.依据盐类水解规律分析;
D.一水合氨为弱碱,氢氧化铝无法与一水合氨反应。
14.【答案】A
【解析】【解答】解:A.HCO3﹣在溶液中发生水解,溶液呈弱碱性,四种离子之间不发生反应,能够大量共存,故A正确;
B.酸性溶液中存在大量氢离子,HCO3 与氢离子反应,Al3+、HCO3 之间发生双水解反应,在溶液中一定不能大量共存,故B错误;
C.pH=1的溶液中存在大量氢离子,ClO﹣、Fe2+之间发生氧化还原反应,ClO﹣与氢离子反应,在溶液中一定不能大量共存,故C错误;
D.由水电离的c(OH﹣)=10﹣14mol L﹣1的溶液中存在大量氢离子或氢氧根离子,CH3COO﹣、与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
【分析】A.碳酸氢根离子水解,溶液呈弱碱性;
B.铝离子与碳酸氢根离子发生双水解反应,碳酸氢根离子与酸性溶液中的氢离子反应;
C.pH=1的溶液中存在大量氢离子,次氯酸根离子与氢离子反应,次氯酸根离子能够氧化亚铁离子;
D.由水电离的c(OH﹣)=10﹣14mol L﹣1的溶液中存在大量氢离子或氢氧根离子,醋酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
15.【答案】A
【解析】【解答】解:A.碳酸氢根离子为弱酸的酸式根离子不能拆,碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3﹣,故A错误;
B.NaHSO4在溶液中电离生成Na+和H+、SO42﹣,电离方程式为:NaHSO4=Na++H++SO42﹣,故B正确;
C.硫酸为强电解质,完全电离出氢离子与硫酸根离子,电离方程式:H2SO4=2H++SO42﹣,故C正确;
D.乙酸为弱电解质,部分电离,电离方程式:CH3COOH CH3COO﹣+H+,故D正确;
故选A.
【分析】A.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆;
B.硫酸氢钠是强电解质,能完全电离出Na+和H+、SO42﹣,溶液有强的酸性;
C.硫酸为强电解质,一步完全电离出氢离子与硫酸根离子;
D.CH3COOH为弱电解质,部分电离,用可逆符号.
16.【答案】A
【解析】【解答】A. Cl-、Na+、NO3-、Ca2+之间不反应,能在溶液中大量共存,A符合题意;
B. H+、HCO3-反应生成二氧化碳和水,不能大量共存,B不符合题意;
C. Ba2+、SO42-反应生成硫酸钡沉淀,不能大量共存,C不符合题意;
D. Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,D不符合题意,
故答案为:A
【分析】溶液中离子能大量共存,则相互间不发生反应,即不形成弱电解质、易挥发性物质、不形成难溶(或微溶)性物质;据此结合选项所给离子进行分析。
17.【答案】(1)Fe2(SO4)3═2Fe3++3SO42﹣
(2)Ba(OH)2+H2SO4═2H2O+BaSO4↑
【解析】【解答】解:(1)硫酸铁为强电解质,完全电离出三价铁离子与硫酸根离子,电离方程式:Fe2(SO4)3═2Fe3++3SO42﹣;
故答案为:Fe2(SO4)3═2Fe3++3SO42﹣;(2)Ba(OH)2和H2SO4溶液,二者反应生成硫酸钡沉淀和氢氧化铜沉淀,化学方程式:Ba(OH)2+H2SO4═2H2O+BaSO4↓;
故答案为:Ba(OH)2+H2SO4═2H2O+BaSO4↓.
【分析】(1)硫酸铁为强电解质,完全电离出三价铁离子与硫酸根离子;(2)二者反应生成硫酸钡沉淀和氢氧化铜沉淀.
18.【答案】(1)④⑥
(2)③⑤;⑤
(3)⑨⑩ ;⑨⑩
(4)⑦⑧
【解析】【解答】解:(1)④SO3、⑥C2H5OH在溶液中或液态时本身不能电离出离子,二者属于非电解质,
故答案为:④⑥;(2)③NaHSO4⑤H2SO4 能电离出氢离子;电离出的阳离子全部是氢离子的化合物为酸,故⑤为酸,
故答案为:③⑤;⑤;(3)⑨Cu(OH)2⑩Fe(OH)3 NaOH NH3 H2O电离出的阴离子全是氢氧根离子属于碱,其中⑨Cu(OH)2⑩Fe(OH)3
难溶于水,属于难溶性碱,
故答案为:⑨⑩ ;⑨⑩;(4)碳酸钙、硫酸钡不溶于水,都属于难溶性盐,
故答案为:⑦⑧.
【分析】(1)非电解质是在水溶液中和熔融状态下都不能导电的化合物,根据电解质的定义分析;(2)酸或酸式盐能电离出氢离子;(3)电离出阴离子全是氢氧根离子的化合物为碱;根据物质的溶解性分析;(4)根据常见物质的溶解性大小分析.
19.【答案】(1)BaCl2;Na2CO3;H++OH-=H2O;2H++CO32-=H2O+CO2↑
(2)除去杂质的同时试剂之间反应,会发生反应生成NaCl
【解析】【解答】(1)①依次滴加过量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液时,可以依次除去氯化镁、硫酸钠、氯化钙和过量的氯化钡;
②加入盐酸是为了中和氢氧化钠、与碳酸钠反应,从而把过量的氢氧化钠、碳酸钠除去,故填:H++OH-=H2O;2H++CO32-=H2O+CO2↑;
(2)除去杂质的同时试剂之间反应,会生成NaCl,,所以,纯NaCl的质量大于粗盐中NaCl的质量。
故填:除去杂质的同时试剂之间反应,会生成NaCl。
【分析】(1)粗盐提纯时,先BaCl2,再加Na2CO3,两者顺序不能颠倒;盐酸的作用是除去过量的氢氧化钠和碳酸钠;
(2)除杂试剂中含有钠离子,均生成了氯化钠。
20.【答案】(1)①②⑦
(2)③
(3)⑧⑨
(4)④⑥
(5)用一束可见光线通过Fe(OH)3胶体和FeCl3溶液,在氢氧化铁胶体中会出现光亮的通路
(6)煤油
(7)BaCO3+2H+=Ba2++CO2↑+H2O
【解析】【解答】解:(1)能导电的物质有①Na,②稀硝酸、⑦Fe(OH)3胶体,故答案为:①②⑦;(2)属于电解质,但熔融状态下并不导电的化合物为:③纯醋酸,故答案为:③;(3)强电解质是⑧NaCl晶体,⑨BaCO3,故答案为:⑧⑨;(4)非电解质是④NH3,⑥CO2 ,故答案为:④⑥;(5)区分Fe(OH)3胶体和FeCl3溶液实验方法是用一束可见光线通过Fe(OH)3胶体和FeCl3溶液,在氢氧化铁胶体中会出现光亮的通路,氯化铁溶液无此现象,
故答案为:用一束可见光线通过Fe(OH)3胶体和FeCl3溶液,在氢氧化铁胶体中会出现光亮的通路;(6)钠是活泼金属和空气中的氧气、水蒸气等方式反应,实验室中保存在煤油中,故答案为:煤油;(7)②和⑨反应是稀硝酸和BaCO3反应生成硝酸钡、水和二氧化碳,反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
【分析】(1)当物质中有自由移动的离子或自由移动的电子时,则物质能导电,据此分析;(2)熔融状态下不导电的电解质说明化合物为共价化合物;(3)在水溶液中或熔融状态下能完全电离的化合物为强电解质;(4)在水溶液中和熔融状态下都不能导电的化合物为非电解质;(5)溶液和胶体的区别方法用丁达尔现象鉴别;(6)钠是活泼金属和空气中的氧气、水蒸气等方式反应;(7)②和⑨反应是稀硝酸和BaCO3反应生成硝酸钡、水和二氧化碳.
21.【答案】(1)2H++MgO=Mg2++H2O
(2)HCO3﹣+H+=H2O+CO2↑
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl
(4)FeCl3+3H2O Fe(OH)3(胶体)+3HCl
【解析】【解答】解:(1)稀硫酸跟氧化镁反应生成硫酸镁和水,离子方程式:2H++MgO=Mg2++H2O;故答案为:2H++MgO=Mg2++H2O;(2)盐酸跟碳酸氢钠溶液反应生成氯化钠和二氧化碳、水,离子方程式:HCO3﹣+H+=H2O+CO2↑;故答案为:HCO3﹣+H+=H2O+CO2↑;(3)Cu2++2OH﹣=Cu(OH)2↓可以表示可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐,可以表示氯化铜与氢氧化钠反应,方程式:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;4)氯化铁水解生成氢氧化铁胶体和氯化氢,离子方程式:FeCl3+3H2O Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O Fe(OH)3(胶体)+3HCl.
【分析】(1)稀硫酸跟氧化镁反应生成硫酸镁和水;(2)盐酸跟碳酸氢钠溶液反应生成氯化钠和二氧化碳、水;(3)Cu2++2OH﹣=Cu(OH)2↓可以表示可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐;(4)氯化铁水解生成氢氧化铁胶体和氯化氢
