2.1.1 共价键课件(22张)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.1 共价键课件(22张)2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 16:02:39 | ||
图片预览





文档简介
(共22张PPT)
第一节 共价键
第二章
第1课时 共价键
教学目标
1. 认识原子间通过原子轨道重叠形成共价键。
2. 根据原子轨道的重叠方式,了解共价键可分为σ键和π键等类型。
3. 结合原子轨道的伸展方向,了解共价键具有饱和性和方向性。
π键是什么样的化学键,它又是怎么形成的呢?
防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为它所含的有效成分的分子中含有π键,阻挡部分紫外线对皮肤的伤害。
防晒霜为何能防晒呢?
01
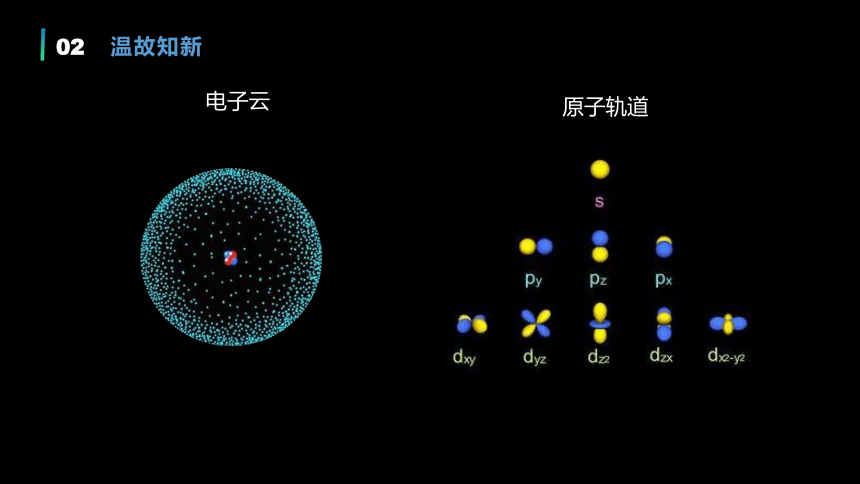
电子云
原子轨道
温故知新
02
1.什么是共价键?
原子之间通过共用电子对所形成的相互作用
2.用电子式表示H2分子的形成过程
H + H → H∶H
02
温故知新
原子间形成
共用电子对
从电子云
角度理解
原子轨道的重叠
原子轨道的重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
共价键的实质
03
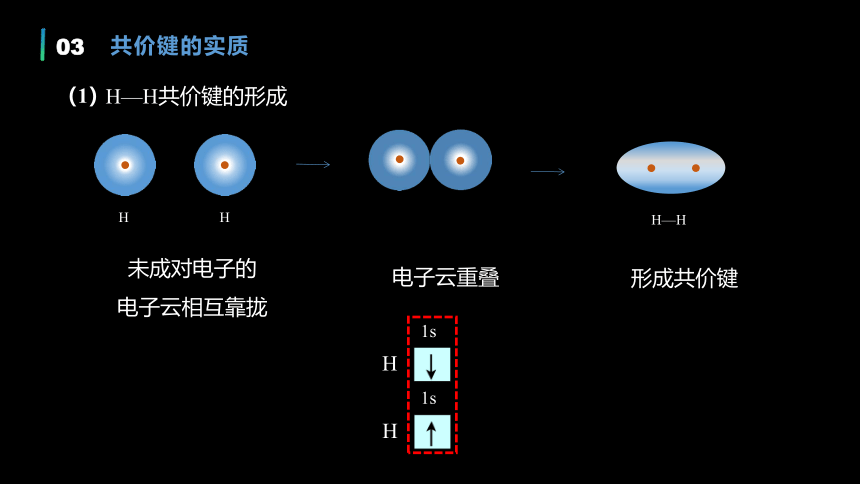
H
未成对电子的
电子云相互靠拢
H
1s
1s
H
H
电子云重叠
形成共价键
H—H
H—H共价键的形成
(1)
共价键的实质
03
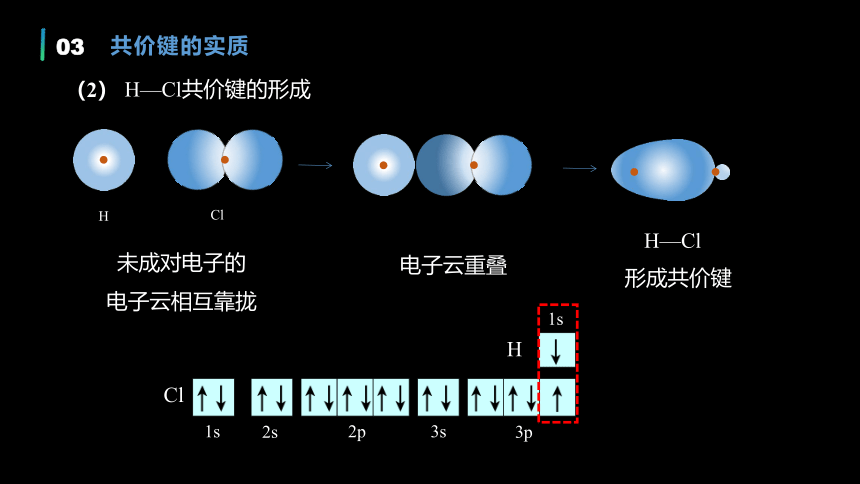
未成对电子的
电子云相互靠拢
电子云重叠
1s
2s
2p
3s
3p
Cl
1s
H
H
Cl
形成共价键
H—Cl
H—Cl共价键的形成
(2)
共价键的实质
03
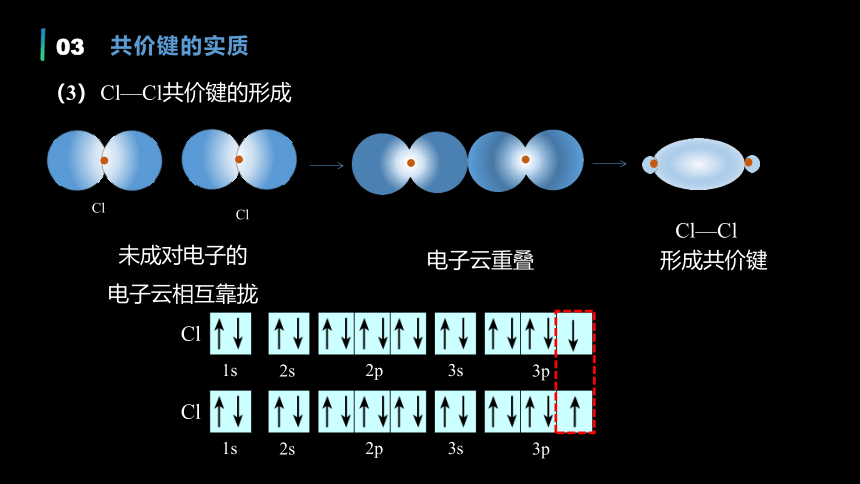
未成对电子的
电子云相互靠拢
电子云重叠
形成共价键
1s
2s
2p
3s
3p
Cl
1s
2s
2p
3s
3p
Cl
Cl
Cl
Cl—Cl
Cl—Cl共价键的形成
(3)
共价键的实质
03
s-s重叠,无方向:
σ 键成键方式 “头碰头”
x
x
轴对称
s-p重叠,沿p轨道的键轴方向重叠:
p-p重叠,沿p轨道的键轴方向重叠:
x
小结升华 1
H-H s-s σ键的形成
H-Cl s-p σ键的形成
Cl-Cl p-p σ键的形成
有没有可能存在 H3 、Cl3 、H2Cl 分子?为什么?
共价键特征 1 饱和性
●
●
●
●
●
●
●
●
●
一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”
共价键特征 1 饱和性
未成对电子的
电子云相互靠拢
“肩并肩”重叠
形成 π 键
两个原子的 p 轨道“肩并肩”重叠形成共价键的过程
p-p π 键的形成
04
π 键特点: 两个原子轨道以 “肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为镜面对称
π键成键方式 “肩并肩”
镜面对称
小结升华 2
键类型 σ键 π键
重叠方式
重叠部位
重叠程度
键的强度
沿键轴方向“头碰头”重叠
沿键轴方向“肩并肩”重叠
两原子核之间,在键轴处
键轴上方和下方,键轴处为零
小
大
较大,不易断裂
较小,易断裂
H-H
σ键和π键的比较
特征
存在
实例
绕轴转动不破坏键
轨道侧面不能动
可单独,也可与键共存
存在双键或三键中
O2、N2、C2H4、C2H2等分子
H2、Cl2、CH4、卤化氢等分子
小结升华 2
HCl
Cl2
x
y
x
y
重叠越多,形成键越牢固
成键原子的“轨道”必须在各自密度最大的方向上重叠
共价键特征 2 方向性
√
√
1. σ键和π键的判断
5个σ键和1个π键
7个σ键
3个σ键和2个π键
04
探究
H
H
04
科学探究
2. 乙炔分子中的 键形成
两个碳各用两个p轨道形成两个 键
3. 钠和氯通过得失电子同样也是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?讨论后请填写下表:
原子 Na Cl H Cl C O
电负性
电负性之差
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。
0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
1.7
04
科学探究
本节知识总结
1.共价键的形成
以“头碰头”成键,呈轴对称,类型:
以“肩并肩”成键,呈镜像对称
2.共价键的特征
3.判断共价键类型规律
(1)σ键:
(2)π键:
(1)饱和性
(2)方向性
——决定分子的组成
——决定分子的立体构型
s-s σ
s-p σ
p-p σ
1.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的稳定结构。则一个三硫化四磷分子中含有的共价键个数是( )
A.7个 B.9个 C.19个 D.不能确定
B
当堂训练
2.P元素的价电子排布为3s23p3,P与Cl形成的化合物有PCl3、PCl5,对此判断正确的是( )
A.磷原子最外层有三个未成对电子,故只能结合三个氯原子形成PCl3
B.PCl3分子中的P—Cl键含有π键
C.PCl5分子中的P—Cl键都是π键
D.磷原子最外层有三个未成对电子,但是能形成PCl5,说明传统的价键理论存在缺陷
D
当堂训练
第一节 共价键
第二章
第1课时 共价键
教学目标
1. 认识原子间通过原子轨道重叠形成共价键。
2. 根据原子轨道的重叠方式,了解共价键可分为σ键和π键等类型。
3. 结合原子轨道的伸展方向,了解共价键具有饱和性和方向性。
π键是什么样的化学键,它又是怎么形成的呢?
防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为它所含的有效成分的分子中含有π键,阻挡部分紫外线对皮肤的伤害。
防晒霜为何能防晒呢?
01
电子云
原子轨道
温故知新
02
1.什么是共价键?
原子之间通过共用电子对所形成的相互作用
2.用电子式表示H2分子的形成过程
H + H → H∶H
02
温故知新
原子间形成
共用电子对
从电子云
角度理解
原子轨道的重叠
原子轨道的重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
共价键的实质
03
H
未成对电子的
电子云相互靠拢
H
1s
1s
H
H
电子云重叠
形成共价键
H—H
H—H共价键的形成
(1)
共价键的实质
03
未成对电子的
电子云相互靠拢
电子云重叠
1s
2s
2p
3s
3p
Cl
1s
H
H
Cl
形成共价键
H—Cl
H—Cl共价键的形成
(2)
共价键的实质
03
未成对电子的
电子云相互靠拢
电子云重叠
形成共价键
1s
2s
2p
3s
3p
Cl
1s
2s
2p
3s
3p
Cl
Cl
Cl
Cl—Cl
Cl—Cl共价键的形成
(3)
共价键的实质
03
s-s重叠,无方向:
σ 键成键方式 “头碰头”
x
x
轴对称
s-p重叠,沿p轨道的键轴方向重叠:
p-p重叠,沿p轨道的键轴方向重叠:
x
小结升华 1
H-H s-s σ键的形成
H-Cl s-p σ键的形成
Cl-Cl p-p σ键的形成
有没有可能存在 H3 、Cl3 、H2Cl 分子?为什么?
共价键特征 1 饱和性
●
●
●
●
●
●
●
●
●
一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”
共价键特征 1 饱和性
未成对电子的
电子云相互靠拢
“肩并肩”重叠
形成 π 键
两个原子的 p 轨道“肩并肩”重叠形成共价键的过程
p-p π 键的形成
04
π 键特点: 两个原子轨道以 “肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为镜面对称
π键成键方式 “肩并肩”
镜面对称
小结升华 2
键类型 σ键 π键
重叠方式
重叠部位
重叠程度
键的强度
沿键轴方向“头碰头”重叠
沿键轴方向“肩并肩”重叠
两原子核之间,在键轴处
键轴上方和下方,键轴处为零
小
大
较大,不易断裂
较小,易断裂
H-H
σ键和π键的比较
特征
存在
实例
绕轴转动不破坏键
轨道侧面不能动
可单独,也可与键共存
存在双键或三键中
O2、N2、C2H4、C2H2等分子
H2、Cl2、CH4、卤化氢等分子
小结升华 2
HCl
Cl2
x
y
x
y
重叠越多,形成键越牢固
成键原子的“轨道”必须在各自密度最大的方向上重叠
共价键特征 2 方向性
√
√
1. σ键和π键的判断
5个σ键和1个π键
7个σ键
3个σ键和2个π键
04
探究
H
H
04
科学探究
2. 乙炔分子中的 键形成
两个碳各用两个p轨道形成两个 键
3. 钠和氯通过得失电子同样也是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?讨论后请填写下表:
原子 Na Cl H Cl C O
电负性
电负性之差
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。
0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
1.7
04
科学探究
本节知识总结
1.共价键的形成
以“头碰头”成键,呈轴对称,类型:
以“肩并肩”成键,呈镜像对称
2.共价键的特征
3.判断共价键类型规律
(1)σ键:
(2)π键:
(1)饱和性
(2)方向性
——决定分子的组成
——决定分子的立体构型
s-s σ
s-p σ
p-p σ
1.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的稳定结构。则一个三硫化四磷分子中含有的共价键个数是( )
A.7个 B.9个 C.19个 D.不能确定
B
当堂训练
2.P元素的价电子排布为3s23p3,P与Cl形成的化合物有PCl3、PCl5,对此判断正确的是( )
A.磷原子最外层有三个未成对电子,故只能结合三个氯原子形成PCl3
B.PCl3分子中的P—Cl键含有π键
C.PCl5分子中的P—Cl键都是π键
D.磷原子最外层有三个未成对电子,但是能形成PCl5,说明传统的价键理论存在缺陷
D
当堂训练
