2.1.2 键参数——键能、键长与键角课件(共23张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.2 键参数——键能、键长与键角课件(共23张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 15:59:32 | ||
图片预览





文档简介
(共23张PPT)
第2课时 键参数——键能、键长与键角
第一节 共价键
第二章
教学目标
1. 认识共价键的键能、键长和键角。
2. 掌握用共价键的强弱解释物质稳定性的方法。
3. 理解分子的性质与键参数的关系,培养证据推理与模型认知的核心素养。
分子结构在很大程度上影响了化学物质的反应性、极性、相态、颜色、磁性和生物活性等
分子结构重要吗?
01
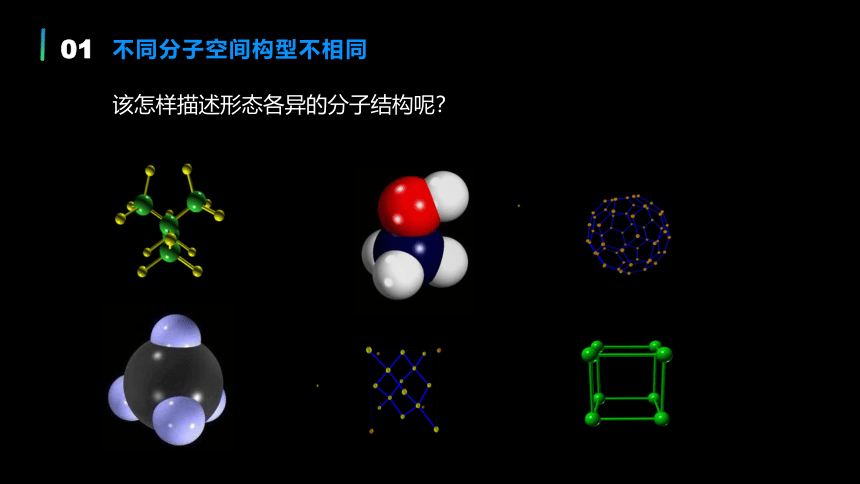
该怎样描述形态各异的分子结构呢?
不同分子空间构型不相同
01
02
键能——衡量共价键的强弱
定义:气态分子中 1 mol 化学键解离成气态原子所吸收的能量
对多原子分子,键能为1 mol气态分子完全离解成气态原子各个共价键所吸收能量的平均值。
例如:
NH3(g)=== NH2(g)+ H(g),D1 = 435 kJ·mol-1
NH2(g)===NH(g)+ H(g) ,D2= 397 kJ·mol-1
NH(g)===N(g)+ H(g) , D3= 339 kJ·mol-1
NH3分子中虽然有三个等价的N—H键,但先后拆开它们所需的能量是不同的。
N—H= ==391 kJ·mol-1
键能通常是298.15 K、101 kPa条件下的标准值,单位是kJ/mol
键能通常通过热化学方法或光谱化学实验测定离解能得到
1
2
3
02
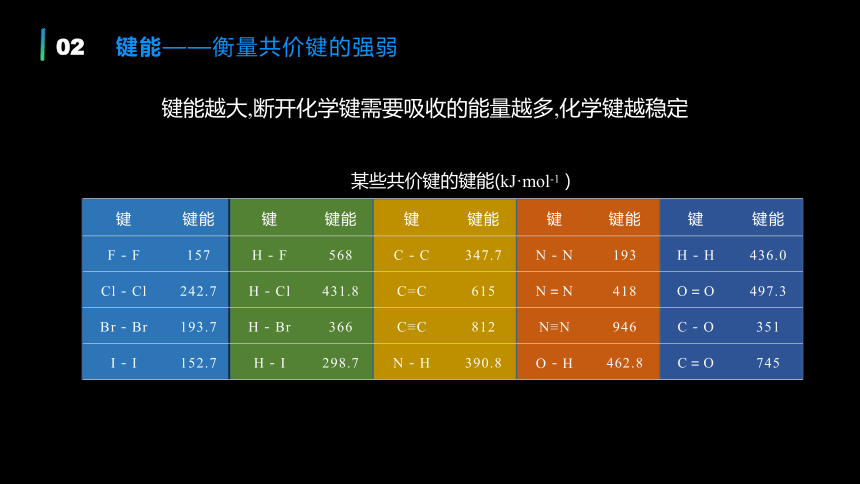
某些共价键的键能(kJ·mol-1 )
键能越大,断开化学键需要吸收的能量越多,化学键越稳定
键 键能 键 键能 键 键能 键 键能 键 键能
F-F 157 H-F 568 C-C 347.7 N-N 193 H-H 436.0
Cl-Cl 242.7 H-Cl 431.8 C=C 615 N=N 418 O=O 497.3
Br-Br 193.7 H-Br 366 C≡C 812 N≡N 946 C-O 351
I-I 152.7 H-I 298.7 N-H 390.8 O-H 462.8 C=O 745
键能——衡量共价键的强弱
键能的应用
03
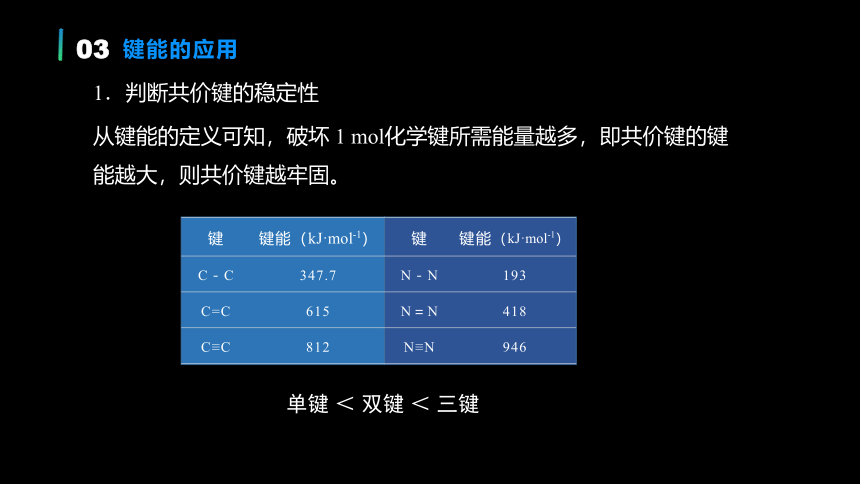
从键能的定义可知,破坏 1 mol化学键所需能量越多,即共价键的键能越大,则共价键越牢固。
1.判断共价键的稳定性
单键 < 双键 < 三键
键 键能(kJ·mol-1) 键 键能(kJ·mol-1)
C-C 347.7 N-N 193
C=C 615 N=N 418
C≡C 812 N≡N 946
已知键能C-C 347.7 kJ·mol-1、C=C 615 kJ·mol-1、C≡C812 kJ·mol-1、N-N193 kJ·mol-1、N=N 418 kJ·mol-1、N≡N 946 kJ·mol-1,如何利用这些数据说明氮气不易加成,乙炔容易加成?
科学探究
C≡C与C=C键能差值197kJ·mol-1,小于N≡N与N=N键能差值528kJ·mol-1。说明C≡C中的σ键比N≡N中的σ键键能小,更易断裂,乙炔等含C≡C的物质更易发生加成反应。
键能的应用
03
一般来说,结构相似的分子中,共价键的键能越大,分子越稳定。
2. 判断分子的稳定性
如,由于键能 H-F>H-Cl>H-Br>H-I
所以,分子的稳定性:HF>HCl>HBr>HI
键 键能(kJ·mol-1)
H-F 568
H-Cl 431.8
H-Br 366
H-I 298.7
N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一事实?
解释
N—H、O—H、H—F的键能依次为390.8 kJ mol-1、462.8 kJ mol-1、568 kJ mol-1,键能依次增加,分子的稳定性增强,故N2、O2、F2与氢气的反应能力依次增强。
1
N≡N、O=O、F—F的键能依次为946 kJ mol-1、497.3 kJ mol-1、157 kJ mol-1,键能依次减小、共价键越来越容易断裂,分子的稳定性减弱,故N2、O2、F2与氢气的反应能力依次增强。
2
科学探究
键能的应用
03
ΔH = 反应物中化学键键能之和﹣生成物中化学键键能之和
3.估算化学反应的反应热
同一化学键解离成气态原子所吸收的能量与气态原子结合形成化学键所释放的能量在数值上是相等的
根据表中键能的数据,计算 1 mol H2分别跟 1 mol Cl2、1 mol Br2(蒸气)反应,分别生成 2 mol HCl和 2 mol HBr分子,哪个反应放出的能量多?如何用计算的结构说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
科学探究
某些共价键的键能(kJ·mol-1 )
键 键能 键 键能 键 键能 键 键能 键 键能
F-F 157 H-F 568 C-C 347.7 N-N 193 H-H 436.0
Cl-Cl 242.7 H-Cl 431.8 C=C 615 N=N 418 O=O 497.3
Br-Br 193.7 H-Br 366 C≡C 812 N≡N 946 C-O 351
I-I 152.7 H-I 298.7 N-H 390.8 O-H 462.8 C=O 745
H2 + Cl2 = 2HCl
ΔH=436.0 kJ·mol-1 + 242.7 kJ·mol-1 -2×431.8 kJ·mol-1 = -184.9 kJ/mol
H2 + Br2 = 2HBr
ΔH=436.0 kJ·mol - 1 + 193.7 kJ·mol - 1 -2×366 kJ·mol - 1 = -102.3 kJ/mol
根据上表中键能的数据,计算 1 mol H2分别跟 1 mol Cl2、1 mol Br2(蒸气)反应,分别生成 2 mol HCl和 2 mol HBr分子,哪个反应放出的能量多?如何用计算的结构说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
形成HCl放出的能量多,HCl分子更稳定,HBr分子更容易发生热分解生成相应的单质
科学探究
键长是构成化学键的两个原子的核间距。不过分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
键长——衡量共价键强弱的另一重要参数
04
键 键能 (kJ·mol-1 ) 键长 键 键能(kJ·mol-1 ) 键长
H-H 436 74 C≡C 812 120
F-F 157 141 C-H 413.4 109
Cl-Cl 242.7 198 N-H 390.8 101
Br-Br 193.7 228 O-H 462.8 96
I-I 152.7 267 N≡N 946 110
C-C 347.7 154 Si-Si 235
C=C 615 133 Si-O 162
键长越短,一般键能越大,化学键越牢固,由该键形成的分子越稳定。
比如键长:F-F<Cl-Cl<Br-Br,则分子的稳定性F2>Cl2>Br2
键长——衡量共价键强弱的另一重要参数
04
对于相同的两原子形成的共价键而言,当两个原子间形成双键、三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。如键长:C-C > C=C > C≡C
小结升华
键长判断方法
根据原子半径判断
其他条件相同时,成键原子的半径越小,键长越短。
如 键长:H-I > H-Cl > H-F;Br-Br > Cl-Cl > F-F;Si-Si > Si-C > C-C。
根据共用电子对数目判断
键 键能(kJ·mol-1 ) 键长 键 键能(kJ·mol-1 ) 键长
H-H 436 74 H-Cl 428.0 128
Cl-Cl 242.7 198 H-Br 362.0 141
H-F 565.0 92 H-I 295.0 161
由下表的数据判断,下列分子的稳定性:
A. H2、Cl2 B. HCl、HBr、HI
【答案】A. H2 > Cl2
B. HCl > HBr > HI
科学探究
在多原子分子中,两个相邻共价键之间的夹角称为键角
105°
180°
107.5°
109°28
H2O
C2H2
NH3
CH4
多原子分子的键角一定,表明共价键具有方向性。键角是描述分子空间结构的重要参数,分子的许多性质都与键角有关。
05
键角——决定分子的空间构型
键长和键角的数值可通过晶体的X射线衍射实验获得。
05
键角——决定分子的空间构型
本节知识总结
键能
键长
键角
分子的稳定性
分子的立体结构
分子的性质
决定
决定
决定
1. 关于键长、键能和键角,下列说法不正确的是 ( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越大,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
C
当堂训练
2. 已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,计算N≡N键的键能是 kJ·mol-1。
945.6
当堂训练
回答下列问题:
(1)通常条件下,比较CH4和SiH4的稳定性强弱:_______________。
(2)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_____________________________________________________________________________________________________________________________________。
(3)SiH4的稳定性小于CH4,更易生成氧化物,原因是
_______________________________________________________________________________________________________________________________。
CH4比SiH4稳定
C—C键和C—H键键能较强,所形成的烷烃稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
3. 碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实
共价键 C—C C—H C—O Si—Si Si—H Si—O
键能 348 413 351 226 318 452
当堂训练
第2课时 键参数——键能、键长与键角
第一节 共价键
第二章
教学目标
1. 认识共价键的键能、键长和键角。
2. 掌握用共价键的强弱解释物质稳定性的方法。
3. 理解分子的性质与键参数的关系,培养证据推理与模型认知的核心素养。
分子结构在很大程度上影响了化学物质的反应性、极性、相态、颜色、磁性和生物活性等
分子结构重要吗?
01
该怎样描述形态各异的分子结构呢?
不同分子空间构型不相同
01
02
键能——衡量共价键的强弱
定义:气态分子中 1 mol 化学键解离成气态原子所吸收的能量
对多原子分子,键能为1 mol气态分子完全离解成气态原子各个共价键所吸收能量的平均值。
例如:
NH3(g)=== NH2(g)+ H(g),D1 = 435 kJ·mol-1
NH2(g)===NH(g)+ H(g) ,D2= 397 kJ·mol-1
NH(g)===N(g)+ H(g) , D3= 339 kJ·mol-1
NH3分子中虽然有三个等价的N—H键,但先后拆开它们所需的能量是不同的。
N—H= ==391 kJ·mol-1
键能通常是298.15 K、101 kPa条件下的标准值,单位是kJ/mol
键能通常通过热化学方法或光谱化学实验测定离解能得到
1
2
3
02
某些共价键的键能(kJ·mol-1 )
键能越大,断开化学键需要吸收的能量越多,化学键越稳定
键 键能 键 键能 键 键能 键 键能 键 键能
F-F 157 H-F 568 C-C 347.7 N-N 193 H-H 436.0
Cl-Cl 242.7 H-Cl 431.8 C=C 615 N=N 418 O=O 497.3
Br-Br 193.7 H-Br 366 C≡C 812 N≡N 946 C-O 351
I-I 152.7 H-I 298.7 N-H 390.8 O-H 462.8 C=O 745
键能——衡量共价键的强弱
键能的应用
03
从键能的定义可知,破坏 1 mol化学键所需能量越多,即共价键的键能越大,则共价键越牢固。
1.判断共价键的稳定性
单键 < 双键 < 三键
键 键能(kJ·mol-1) 键 键能(kJ·mol-1)
C-C 347.7 N-N 193
C=C 615 N=N 418
C≡C 812 N≡N 946
已知键能C-C 347.7 kJ·mol-1、C=C 615 kJ·mol-1、C≡C812 kJ·mol-1、N-N193 kJ·mol-1、N=N 418 kJ·mol-1、N≡N 946 kJ·mol-1,如何利用这些数据说明氮气不易加成,乙炔容易加成?
科学探究
C≡C与C=C键能差值197kJ·mol-1,小于N≡N与N=N键能差值528kJ·mol-1。说明C≡C中的σ键比N≡N中的σ键键能小,更易断裂,乙炔等含C≡C的物质更易发生加成反应。
键能的应用
03
一般来说,结构相似的分子中,共价键的键能越大,分子越稳定。
2. 判断分子的稳定性
如,由于键能 H-F>H-Cl>H-Br>H-I
所以,分子的稳定性:HF>HCl>HBr>HI
键 键能(kJ·mol-1)
H-F 568
H-Cl 431.8
H-Br 366
H-I 298.7
N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一事实?
解释
N—H、O—H、H—F的键能依次为390.8 kJ mol-1、462.8 kJ mol-1、568 kJ mol-1,键能依次增加,分子的稳定性增强,故N2、O2、F2与氢气的反应能力依次增强。
1
N≡N、O=O、F—F的键能依次为946 kJ mol-1、497.3 kJ mol-1、157 kJ mol-1,键能依次减小、共价键越来越容易断裂,分子的稳定性减弱,故N2、O2、F2与氢气的反应能力依次增强。
2
科学探究
键能的应用
03
ΔH = 反应物中化学键键能之和﹣生成物中化学键键能之和
3.估算化学反应的反应热
同一化学键解离成气态原子所吸收的能量与气态原子结合形成化学键所释放的能量在数值上是相等的
根据表中键能的数据,计算 1 mol H2分别跟 1 mol Cl2、1 mol Br2(蒸气)反应,分别生成 2 mol HCl和 2 mol HBr分子,哪个反应放出的能量多?如何用计算的结构说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
科学探究
某些共价键的键能(kJ·mol-1 )
键 键能 键 键能 键 键能 键 键能 键 键能
F-F 157 H-F 568 C-C 347.7 N-N 193 H-H 436.0
Cl-Cl 242.7 H-Cl 431.8 C=C 615 N=N 418 O=O 497.3
Br-Br 193.7 H-Br 366 C≡C 812 N≡N 946 C-O 351
I-I 152.7 H-I 298.7 N-H 390.8 O-H 462.8 C=O 745
H2 + Cl2 = 2HCl
ΔH=436.0 kJ·mol-1 + 242.7 kJ·mol-1 -2×431.8 kJ·mol-1 = -184.9 kJ/mol
H2 + Br2 = 2HBr
ΔH=436.0 kJ·mol - 1 + 193.7 kJ·mol - 1 -2×366 kJ·mol - 1 = -102.3 kJ/mol
根据上表中键能的数据,计算 1 mol H2分别跟 1 mol Cl2、1 mol Br2(蒸气)反应,分别生成 2 mol HCl和 2 mol HBr分子,哪个反应放出的能量多?如何用计算的结构说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
形成HCl放出的能量多,HCl分子更稳定,HBr分子更容易发生热分解生成相应的单质
科学探究
键长是构成化学键的两个原子的核间距。不过分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
键长——衡量共价键强弱的另一重要参数
04
键 键能 (kJ·mol-1 ) 键长 键 键能(kJ·mol-1 ) 键长
H-H 436 74 C≡C 812 120
F-F 157 141 C-H 413.4 109
Cl-Cl 242.7 198 N-H 390.8 101
Br-Br 193.7 228 O-H 462.8 96
I-I 152.7 267 N≡N 946 110
C-C 347.7 154 Si-Si 235
C=C 615 133 Si-O 162
键长越短,一般键能越大,化学键越牢固,由该键形成的分子越稳定。
比如键长:F-F<Cl-Cl<Br-Br,则分子的稳定性F2>Cl2>Br2
键长——衡量共价键强弱的另一重要参数
04
对于相同的两原子形成的共价键而言,当两个原子间形成双键、三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。如键长:C-C > C=C > C≡C
小结升华
键长判断方法
根据原子半径判断
其他条件相同时,成键原子的半径越小,键长越短。
如 键长:H-I > H-Cl > H-F;Br-Br > Cl-Cl > F-F;Si-Si > Si-C > C-C。
根据共用电子对数目判断
键 键能(kJ·mol-1 ) 键长 键 键能(kJ·mol-1 ) 键长
H-H 436 74 H-Cl 428.0 128
Cl-Cl 242.7 198 H-Br 362.0 141
H-F 565.0 92 H-I 295.0 161
由下表的数据判断,下列分子的稳定性:
A. H2、Cl2 B. HCl、HBr、HI
【答案】A. H2 > Cl2
B. HCl > HBr > HI
科学探究
在多原子分子中,两个相邻共价键之间的夹角称为键角
105°
180°
107.5°
109°28
H2O
C2H2
NH3
CH4
多原子分子的键角一定,表明共价键具有方向性。键角是描述分子空间结构的重要参数,分子的许多性质都与键角有关。
05
键角——决定分子的空间构型
键长和键角的数值可通过晶体的X射线衍射实验获得。
05
键角——决定分子的空间构型
本节知识总结
键能
键长
键角
分子的稳定性
分子的立体结构
分子的性质
决定
决定
决定
1. 关于键长、键能和键角,下列说法不正确的是 ( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越大,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
C
当堂训练
2. 已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,计算N≡N键的键能是 kJ·mol-1。
945.6
当堂训练
回答下列问题:
(1)通常条件下,比较CH4和SiH4的稳定性强弱:_______________。
(2)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_____________________________________________________________________________________________________________________________________。
(3)SiH4的稳定性小于CH4,更易生成氧化物,原因是
_______________________________________________________________________________________________________________________________。
CH4比SiH4稳定
C—C键和C—H键键能较强,所形成的烷烃稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
3. 碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实
共价键 C—C C—H C—O Si—Si Si—H Si—O
键能 348 413 351 226 318 452
当堂训练
