2.2.2 杂化轨道理论课件(共19张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.2 杂化轨道理论课件(共19张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 15:59:59 | ||
图片预览



文档简介
(共19张PPT)
第2课时 杂化轨道理论
第二节 分子的空间结构
第二章
教学目标
1. 理解杂化轨道理论的内涵。
2. 掌握常见杂化形式。
3. 理解VSEPR模型与中心原子的杂化轨道类型的关系。
杂化轨道理论
01
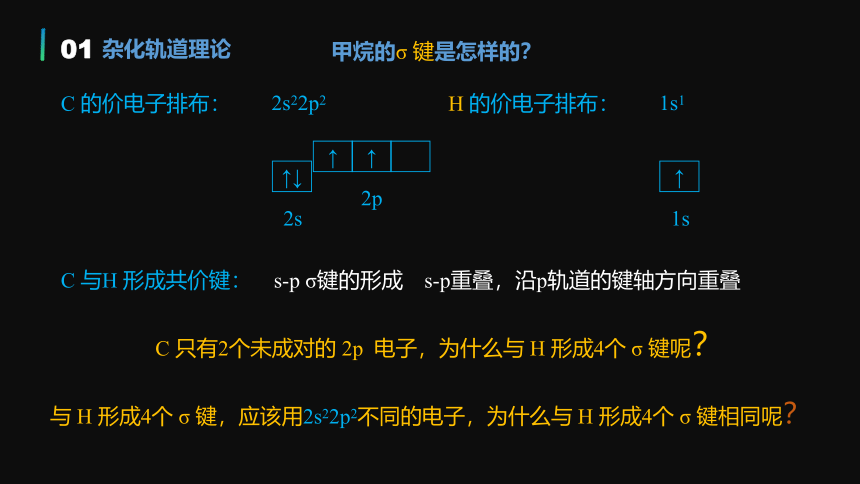
C 的价电子排布:
2s22p2
↑↓
2s
↑
2p
↑
C 与H 形成共价键:
H 的价电子排布:
1s1
↑
1s
s-p重叠,沿p轨道的键轴方向重叠
s-p σ键的形成
C 只有2个未成对的 2p 电子,为什么与 H 形成4个 σ 键呢?
与 H 形成4个 σ 键,应该用2s22p2不同的电子,为什么与 H 形成4个 σ 键相同呢?
甲烷的σ 键是怎样的?
01
1922年 鲍林毕业照
杂化轨道理论
要点:
在形成分子时,原子中能量相近的轨道会发生混杂,形成新的原子轨道,这个过程称“杂化”, 新的原子轨道称“杂化轨道”。
杂化前后原子轨道总数不变,但能量趋于平均化,“杂化轨道”电子云分布更集中,利于成键。
原子中的“杂化轨道”可与其它原子的轨道重叠形成共价键。
Pauling(鲍林)提出了“杂化”假设,补充了价键理论的不足
02
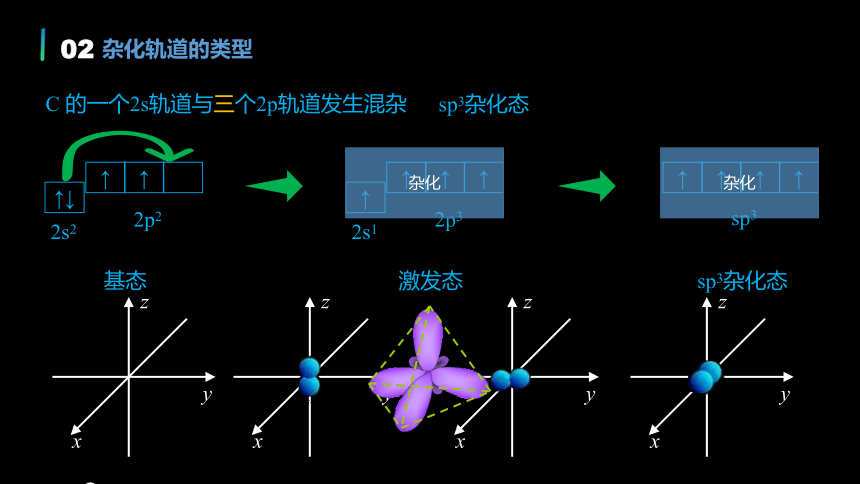
杂化轨道的类型
C 的一个2s轨道与三个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp3
↑
↑
2p3
↑
↑
2s1
基态
激发态
sp3杂化态
z
x
y
z
x
y
z
x
y
z
x
y
sp3杂化态
杂化
杂化
02
杂化轨道的类型
C 的一个2s轨道与三个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp3
↑
↑
2p3
↑
↑
2s1
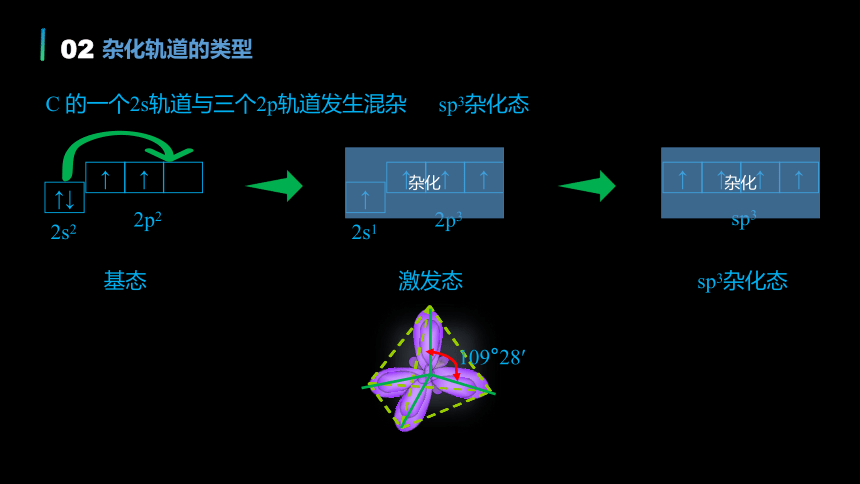
激发态
sp3杂化态
sp3杂化态
基态
109°28′
杂化
杂化
02
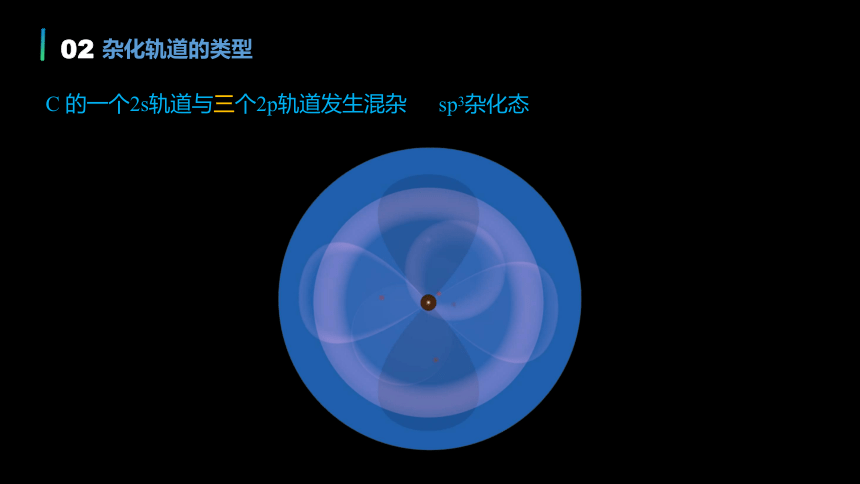
杂化轨道的类型
C 的一个2s轨道与三个2p轨道发生混杂
sp3杂化态
02
杂化轨道的类型
C 的一个2s轨道与二个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp2
↑
↑
2p3
↑
↑
2s1
基态
激发态
sp2杂化态
z
x
y
z
x
y
z
x
y
z
x
y
sp2杂化态
杂化
杂化
02
杂化轨道的类型
C 的一个2s轨道与二个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp2
↑
↑
2p3
↑
↑
2s1
激发态
sp2杂化态
sp2杂化态
基态
120°
杂化
杂化
z
x
y
02
杂化轨道的类型
C 的一个2s轨道与二个2p轨道发生混杂
sp2杂化态
02
杂化轨道的类型
C 的一个2s轨道与一个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp
↑
↑
2p3
↑
↑
2s1
基态
激发态
sp杂化态
z
x
y
z
x
y
z
x
y
sp杂化态
杂化
杂化
z
x
y
180°
02
杂化轨道的类型
C 的一个2s轨道与一个2p轨道发生混杂
sp杂化态
03
VSEPR模型与中心原子的杂化轨道类型的关系
BF3与H3O+中心原子的杂化类型?
H3O+
BF3
价层电子对数 =
σ 键数 +
2
—
1
(a-xb)
=σ 键数 +
2
—
1
(a-xb)
=3 +
2
—
1
(3-3)
=3
=σ 键数 +
2
—
1
(a-xb)
=3 +
=4
2
—
1
(6-1-1×3)
VSEPR模型
sp2杂化
sp3杂化
杂化类型
杂化轨道数 =中心原子价层电子对数= σ 键数+中心原子孤对电子对数
03
VSEPR模型与中心原子的杂化轨道类型的关系
0+2=2
sp
直线形
0+3=3
sp2
平面三角形
1+2=3
sp2
V形
0+4=4
sp3
正四面体形
1+3=4
sp3
三角锥形
2+2=4
sp3
V形
价层电子对数
杂化轨道类型
分子结构
CO2
SO3
CH4
NH3
H2O
SO2
VSEPR模型
本节知识总结
1.杂化轨道理论
2.常见杂化形式
3.判断共价键类型规律
在形成分子时,原子中能量相近的轨道会发生混杂,形成新的原子轨道,这个过程称“杂化”, 新的原子轨道称“杂化轨道”
2个sp杂化轨道
3个sp2杂化轨道
4个sp3杂化轨道
杂化轨道数 =中心原子价层电子对数= σ 键数+中心原子孤对电子对数
当堂训练
1.下列有关杂化轨道理论的说法不正确的是( )
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形的结构可以用sp3杂化轨道解释
D.杂化轨道全部参与形成化学键
杂化轨道可以部分参与形成化学键,如NH3中N原子采取sp3杂化,形成了4个sp3杂化轨道,但是只有3个杂化轨道参与形成化学键,
D
当堂训练
2.下列有关sp2杂化轨道的说法错误的是( )
A.由同一能层上的s轨道与p轨道杂化而成
C.sp2杂化轨道最多可形成2个 σ 键
D.每个杂化轨道中s能级成分占三分之一
B.所形成的3个sp2杂化轨道的能量相同
sp2杂化轨道最多可形成3个σ 键
C
当堂训练
3.下列关于
、NH3、
A.三种微粒所含有的电子数相等
B.三种微粒的空间构型相同
C.三种微粒中氮原子的杂化方式相同
D.键角大小关系:
三种微粒的说法不正确的是( )
、NH3、
价层电子对数 =
σ 键数 +
2
—
1
(a-xb)
(5 1 4×1)=4
4 +
2
—
1
(5 3×1)=4
3 +
2
—
1
(5+1 2×1)=4
2 +
2
—
1
正四面体结构
三角锥形
V形
孤电子对数
0
1
2
空间构型
B
价层电子对数
本节内容结束
第2课时 杂化轨道理论
第二节 分子的空间结构
第二章
教学目标
1. 理解杂化轨道理论的内涵。
2. 掌握常见杂化形式。
3. 理解VSEPR模型与中心原子的杂化轨道类型的关系。
杂化轨道理论
01
C 的价电子排布:
2s22p2
↑↓
2s
↑
2p
↑
C 与H 形成共价键:
H 的价电子排布:
1s1
↑
1s
s-p重叠,沿p轨道的键轴方向重叠
s-p σ键的形成
C 只有2个未成对的 2p 电子,为什么与 H 形成4个 σ 键呢?
与 H 形成4个 σ 键,应该用2s22p2不同的电子,为什么与 H 形成4个 σ 键相同呢?
甲烷的σ 键是怎样的?
01
1922年 鲍林毕业照
杂化轨道理论
要点:
在形成分子时,原子中能量相近的轨道会发生混杂,形成新的原子轨道,这个过程称“杂化”, 新的原子轨道称“杂化轨道”。
杂化前后原子轨道总数不变,但能量趋于平均化,“杂化轨道”电子云分布更集中,利于成键。
原子中的“杂化轨道”可与其它原子的轨道重叠形成共价键。
Pauling(鲍林)提出了“杂化”假设,补充了价键理论的不足
02
杂化轨道的类型
C 的一个2s轨道与三个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp3
↑
↑
2p3
↑
↑
2s1
基态
激发态
sp3杂化态
z
x
y
z
x
y
z
x
y
z
x
y
sp3杂化态
杂化
杂化
02
杂化轨道的类型
C 的一个2s轨道与三个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp3
↑
↑
2p3
↑
↑
2s1
激发态
sp3杂化态
sp3杂化态
基态
109°28′
杂化
杂化
02
杂化轨道的类型
C 的一个2s轨道与三个2p轨道发生混杂
sp3杂化态
02
杂化轨道的类型
C 的一个2s轨道与二个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp2
↑
↑
2p3
↑
↑
2s1
基态
激发态
sp2杂化态
z
x
y
z
x
y
z
x
y
z
x
y
sp2杂化态
杂化
杂化
02
杂化轨道的类型
C 的一个2s轨道与二个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp2
↑
↑
2p3
↑
↑
2s1
激发态
sp2杂化态
sp2杂化态
基态
120°
杂化
杂化
z
x
y
02
杂化轨道的类型
C 的一个2s轨道与二个2p轨道发生混杂
sp2杂化态
02
杂化轨道的类型
C 的一个2s轨道与一个2p轨道发生混杂
↑↓
↑
2p2
↑
↑
↑
↑
↑
2s2
sp
↑
↑
2p3
↑
↑
2s1
基态
激发态
sp杂化态
z
x
y
z
x
y
z
x
y
sp杂化态
杂化
杂化
z
x
y
180°
02
杂化轨道的类型
C 的一个2s轨道与一个2p轨道发生混杂
sp杂化态
03
VSEPR模型与中心原子的杂化轨道类型的关系
BF3与H3O+中心原子的杂化类型?
H3O+
BF3
价层电子对数 =
σ 键数 +
2
—
1
(a-xb)
=σ 键数 +
2
—
1
(a-xb)
=3 +
2
—
1
(3-3)
=3
=σ 键数 +
2
—
1
(a-xb)
=3 +
=4
2
—
1
(6-1-1×3)
VSEPR模型
sp2杂化
sp3杂化
杂化类型
杂化轨道数 =中心原子价层电子对数= σ 键数+中心原子孤对电子对数
03
VSEPR模型与中心原子的杂化轨道类型的关系
0+2=2
sp
直线形
0+3=3
sp2
平面三角形
1+2=3
sp2
V形
0+4=4
sp3
正四面体形
1+3=4
sp3
三角锥形
2+2=4
sp3
V形
价层电子对数
杂化轨道类型
分子结构
CO2
SO3
CH4
NH3
H2O
SO2
VSEPR模型
本节知识总结
1.杂化轨道理论
2.常见杂化形式
3.判断共价键类型规律
在形成分子时,原子中能量相近的轨道会发生混杂,形成新的原子轨道,这个过程称“杂化”, 新的原子轨道称“杂化轨道”
2个sp杂化轨道
3个sp2杂化轨道
4个sp3杂化轨道
杂化轨道数 =中心原子价层电子对数= σ 键数+中心原子孤对电子对数
当堂训练
1.下列有关杂化轨道理论的说法不正确的是( )
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形的结构可以用sp3杂化轨道解释
D.杂化轨道全部参与形成化学键
杂化轨道可以部分参与形成化学键,如NH3中N原子采取sp3杂化,形成了4个sp3杂化轨道,但是只有3个杂化轨道参与形成化学键,
D
当堂训练
2.下列有关sp2杂化轨道的说法错误的是( )
A.由同一能层上的s轨道与p轨道杂化而成
C.sp2杂化轨道最多可形成2个 σ 键
D.每个杂化轨道中s能级成分占三分之一
B.所形成的3个sp2杂化轨道的能量相同
sp2杂化轨道最多可形成3个σ 键
C
当堂训练
3.下列关于
、NH3、
A.三种微粒所含有的电子数相等
B.三种微粒的空间构型相同
C.三种微粒中氮原子的杂化方式相同
D.键角大小关系:
三种微粒的说法不正确的是( )
、NH3、
价层电子对数 =
σ 键数 +
2
—
1
(a-xb)
(5 1 4×1)=4
4 +
2
—
1
(5 3×1)=4
3 +
2
—
1
(5+1 2×1)=4
2 +
2
—
1
正四面体结构
三角锥形
V形
孤电子对数
0
1
2
空间构型
B
价层电子对数
本节内容结束
