2.3.1 共价键的极性课件(共35张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.1 共价键的极性课件(共35张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 16:00:31 | ||
图片预览







文档简介
(共35张PPT)
第1课时 共价键的极性
第三节 分子结构与物质的性质
第二章
教学目标
1. 认识共价键的极性并能判断分子中化学键的极性。
2. 了解分子的极性并能对分子的极性进行判断。
3. 了解键的极性对化学性质的影响,形成“结构决定性质”的化学观念。
情境引入
共价键的极性
H
Cl
δ+
δ-
1.0
3.0
极性共价键
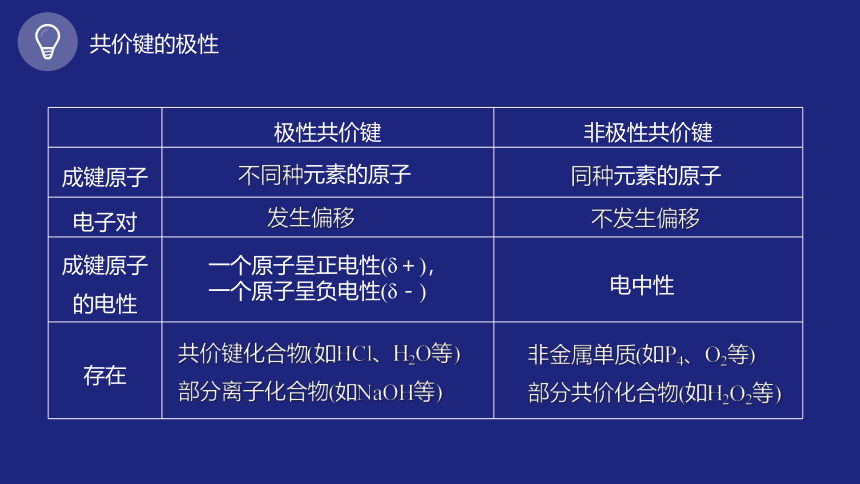
共价键的极性
极性共价键 非极性共价键
成键原子
电子对
成键原子的电性
存在
不同种元素的原子
同种元素的原子
发生偏移
不发生偏移
共价键化合物(如HCl、H2O等)
部分离子化合物(如NaOH等)
非金属单质(如P4、O2等)
部分共价化合物(如H2O2等)
一个原子呈正电性(δ+),一个原子呈负电性(δ-)
电中性
分子的极性
极性分子:正电中心和负电中心不重合,使分子的某一个部分
呈正电性 (δ+),另一部分呈负电性(δ-)
分子的极性
非极性分子:正电中心和负电中心相重合的分子
Cl
Cl
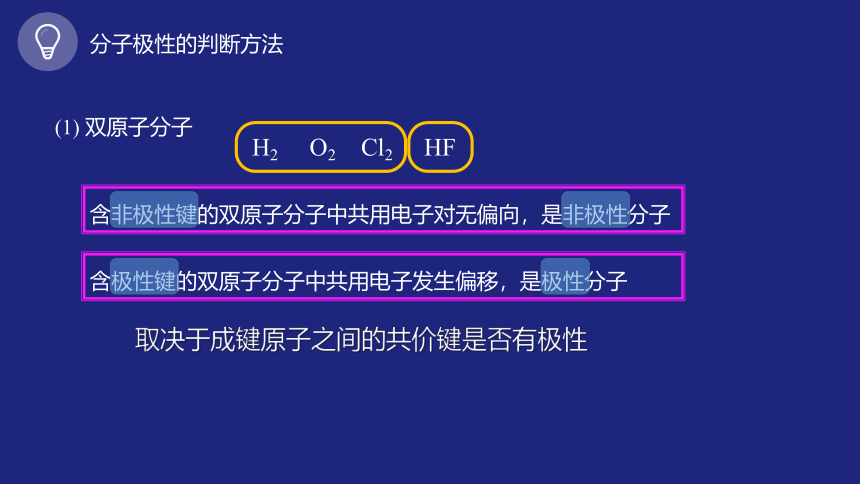
分子极性的判断方法
(1) 双原子分子
H2 O2 Cl2 HF
含非极性键的双原子分子中共用电子对无偏向,是非极性分子
含极性键的双原子分子中共用电子发生偏移,是极性分子
取决于成键原子之间的共价键是否有极性
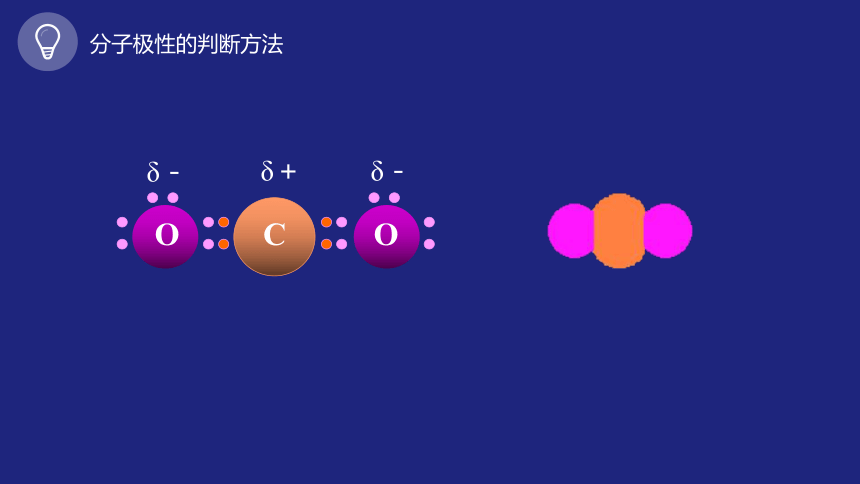
分子极性的判断方法
(2) 多原子分子
C60
P4
完全由非极性键组成的多原子分子是非极性分子
O
O
C
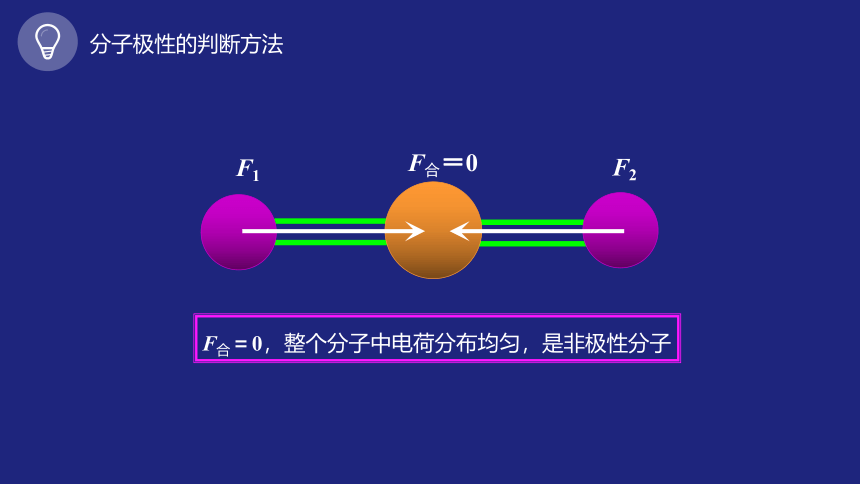
分子极性的判断方法
δ+
δ-
δ-
F1
F2
F合=0
分子极性的判断方法
F合=0,整个分子中电荷分布均匀,是非极性分子
C
H
H
H
H
正四面体形,C—H键的极性互相抵消( F合=0) ,是 非极性分子
分子极性的判断方法
H
O
H
F1
F2
F合≠ 0
O—H键是极性键,共用电子对偏O,分子结构为V形,两个O—H键的极性不能抵消( F合≠0),整个分子电荷分布不均匀,是极性分子
分子极性的判断方法
H
H
H
N
三角锥形,不对称,键的极性不能抵消,是极性分子
分子极性的判断方法
在ABn分子中,A—B键看作A、B原子间的相互作用力,根据中心原子A所受合力是否为零来判断:
F合=0,为非极性分子
F合 ≠ 0,为极性分子
方法归纳
F合=0
F合 ≠ 0
臭氧是极性分子
δ+
δ-
δ-
O
O
O
臭氧是极性分子
臭氧分子的空间结构与水分子相似,分子中的共价键是极性键。臭氧分子有极性,但很微弱,仅是水分子极性的28%,其中心氧原子是呈正电性的,端位的两个氧原子是呈电负性的
由于臭氧极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度
比较臭氧在水中的溶解度和其CCl4中的溶解度?
思考提升
科学探究
已知H2O2分子的空间结构可在二面角中表示,如图所示:
(1) 分析H2O2分子中共价键的种类有哪些
H2O2分子中H—O键为极性共价键,O—O键为非极性共价键。
H2O2属于极性分子
(2) H2O2分子中正电中心和负电中心是否重合 H2O2属于极性分子还是非极性分子
不重合
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
为什么酸性:三氟乙酸>三氯乙酸?
键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
电负性:F>Cl
F—C—C—O—H
F
F
O
Cl—C—C—O—H
Cl
Cl
O
>
δ-
δ-
δ-
δ-
δ-
δ-
键的极性对化学性质的影响
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
酸性:
三氟乙酸
三氯乙酸
>
键的极性对化学性质的影响
Cl—C—C—O—H
Cl
Cl
O
Cl—C—C—O—H
H
Cl
O
>
δ-
δ-
δ-
δ-
δ-
H—C—C—O—H
H
Cl
O
>
δ-
键的极性对化学性质的影响
烃基是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性减小,羧基的酸性越弱
H—C—O—H
O
CH3—C—O—H
O
CH3—CH2—C—O—H
O
>
>
本节知识总结
共价键的极性
极性共价键
非极性共价键
分子的极性
极性分子
非极性分子
键的极性对化学性质的影响
当堂训练
1.下列每组物质中化学键类型和分子的极性都相同的是( )
A. CO2和CS2
B. NaCl和HCl
C. H2O和CH4
D. O2和HBr
A
当堂训练
【解析】CO2和CS2中均含极性共价键,且均为直线形对称分子,均属于非极性分子,A正确;NaCl含离子键,HCl含极性共价键,B错误;H2O和CH4中均含极性共价键,H2O为V形,属于极性分子,CH4为正四面体形,属于非极性分子,C错误;O2和HBr中分别含非极性键、极性键,分别属于非极性分子和极性分子,D错误。
当堂训练
2.实验测得BeCl2为共价化合物,两个Be—Cl键之间的夹角为180°并有对称性,由此可判断BeCl2属于( )
A. 由极性键形成的极性分子
B. 由极性键形成的非极性分子
C. 由非极性键形成的极性分子
D. 由非极性键形成的非极性分子
B
当堂训练
【解析】BeCl2由Be,Cl两种元素构成, Be—Cl键为极性键,Be—Cl键之间的夹角为180°并有对称性,分子中电荷分布均匀,为非极性分子,B正确。
3. S2Cl2是橙黄色液体。少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法错误的是( )
A. 为非极性分子
B. 分子中既含有极性键又含有非极性键
C. 与S2Br2结构相似,熔、沸点:S2Br2>S2Cl2
D. 与水反应的化学方程式可能为:2S2Cl2+2H2O===SO2↑+3S↓+4HCl
当堂训练
A
当堂训练
【解析】根据S2Cl2的分子结构形状可知,它属于极性分子,A错误;由于与S2Br2结构相似,而相对分子质量S2Br2大,则熔、沸点:S2Br2>S2Cl2,C正确;由于S2Cl2少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液,则与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl,D正确。
4.科学家目前成功合成的具有独特化学特性的氢
铝化合物(AlH3)n,其结构类似由硼和氢组成的硼
烷,有关研究报告发表在最新出版的美国《科学》
杂志上。最简单的氢铝化合物为Al2H6它的熔点为
150℃,燃烧热极高,Al2H6模型如图。下列有关说法不正确的是( )
A.Al2H6中H为+1价,Al为-3价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6分子是非极性分子
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
当堂训练
A
当堂训练
5. A,B,C,D,E是相邻三个周期中的五种元素,它们的原子序数依次增大,B,C,D属同一周期,A,E在周期表中处于同一纵行。已知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B,B与C都能生成气态非极性分子的化合物;
③D与E生成离子化合物,其离子的电子层结构相同。
(1)A为_____元素,B为_____元素,C为_____元素,D为_____元素。
(2)C元素在周期表中属第________周期________族元素,其原子核外电子排布式为________。
(3)B与C形成的非极性分子是________。其中共价键类型及数目是________________(填σ或π键)
2个σ键2个π键
1s22s22p4
氢 碳 氧 氟
二 ⅥA
CO2
本节内容结束
第1课时 共价键的极性
第三节 分子结构与物质的性质
第二章
教学目标
1. 认识共价键的极性并能判断分子中化学键的极性。
2. 了解分子的极性并能对分子的极性进行判断。
3. 了解键的极性对化学性质的影响,形成“结构决定性质”的化学观念。
情境引入
共价键的极性
H
Cl
δ+
δ-
1.0
3.0
极性共价键
共价键的极性
极性共价键 非极性共价键
成键原子
电子对
成键原子的电性
存在
不同种元素的原子
同种元素的原子
发生偏移
不发生偏移
共价键化合物(如HCl、H2O等)
部分离子化合物(如NaOH等)
非金属单质(如P4、O2等)
部分共价化合物(如H2O2等)
一个原子呈正电性(δ+),一个原子呈负电性(δ-)
电中性
分子的极性
极性分子:正电中心和负电中心不重合,使分子的某一个部分
呈正电性 (δ+),另一部分呈负电性(δ-)
分子的极性
非极性分子:正电中心和负电中心相重合的分子
Cl
Cl
分子极性的判断方法
(1) 双原子分子
H2 O2 Cl2 HF
含非极性键的双原子分子中共用电子对无偏向,是非极性分子
含极性键的双原子分子中共用电子发生偏移,是极性分子
取决于成键原子之间的共价键是否有极性
分子极性的判断方法
(2) 多原子分子
C60
P4
完全由非极性键组成的多原子分子是非极性分子
O
O
C
分子极性的判断方法
δ+
δ-
δ-
F1
F2
F合=0
分子极性的判断方法
F合=0,整个分子中电荷分布均匀,是非极性分子
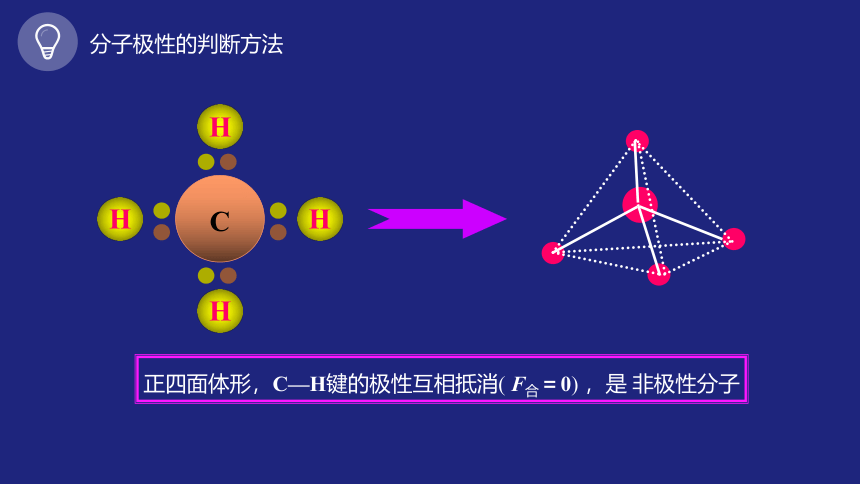
C
H
H
H
H
正四面体形,C—H键的极性互相抵消( F合=0) ,是 非极性分子
分子极性的判断方法
H
O
H
F1
F2
F合≠ 0
O—H键是极性键,共用电子对偏O,分子结构为V形,两个O—H键的极性不能抵消( F合≠0),整个分子电荷分布不均匀,是极性分子
分子极性的判断方法
H
H
H
N
三角锥形,不对称,键的极性不能抵消,是极性分子
分子极性的判断方法
在ABn分子中,A—B键看作A、B原子间的相互作用力,根据中心原子A所受合力是否为零来判断:
F合=0,为非极性分子
F合 ≠ 0,为极性分子
方法归纳
F合=0
F合 ≠ 0
臭氧是极性分子
δ+
δ-
δ-
O
O
O
臭氧是极性分子
臭氧分子的空间结构与水分子相似,分子中的共价键是极性键。臭氧分子有极性,但很微弱,仅是水分子极性的28%,其中心氧原子是呈正电性的,端位的两个氧原子是呈电负性的
由于臭氧极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度
比较臭氧在水中的溶解度和其CCl4中的溶解度?
思考提升
科学探究
已知H2O2分子的空间结构可在二面角中表示,如图所示:
(1) 分析H2O2分子中共价键的种类有哪些
H2O2分子中H—O键为极性共价键,O—O键为非极性共价键。
H2O2属于极性分子
(2) H2O2分子中正电中心和负电中心是否重合 H2O2属于极性分子还是非极性分子
不重合
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
为什么酸性:三氟乙酸>三氯乙酸?
键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
电负性:F>Cl
F—C—C—O—H
F
F
O
Cl—C—C—O—H
Cl
Cl
O
>
δ-
δ-
δ-
δ-
δ-
δ-
键的极性对化学性质的影响
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
酸性:
三氟乙酸
三氯乙酸
>
键的极性对化学性质的影响
Cl—C—C—O—H
Cl
Cl
O
Cl—C—C—O—H
H
Cl
O
>
δ-
δ-
δ-
δ-
δ-
H—C—C—O—H
H
Cl
O
>
δ-
键的极性对化学性质的影响
烃基是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性减小,羧基的酸性越弱
H—C—O—H
O
CH3—C—O—H
O
CH3—CH2—C—O—H
O
>
>
本节知识总结
共价键的极性
极性共价键
非极性共价键
分子的极性
极性分子
非极性分子
键的极性对化学性质的影响
当堂训练
1.下列每组物质中化学键类型和分子的极性都相同的是( )
A. CO2和CS2
B. NaCl和HCl
C. H2O和CH4
D. O2和HBr
A
当堂训练
【解析】CO2和CS2中均含极性共价键,且均为直线形对称分子,均属于非极性分子,A正确;NaCl含离子键,HCl含极性共价键,B错误;H2O和CH4中均含极性共价键,H2O为V形,属于极性分子,CH4为正四面体形,属于非极性分子,C错误;O2和HBr中分别含非极性键、极性键,分别属于非极性分子和极性分子,D错误。
当堂训练
2.实验测得BeCl2为共价化合物,两个Be—Cl键之间的夹角为180°并有对称性,由此可判断BeCl2属于( )
A. 由极性键形成的极性分子
B. 由极性键形成的非极性分子
C. 由非极性键形成的极性分子
D. 由非极性键形成的非极性分子
B
当堂训练
【解析】BeCl2由Be,Cl两种元素构成, Be—Cl键为极性键,Be—Cl键之间的夹角为180°并有对称性,分子中电荷分布均匀,为非极性分子,B正确。
3. S2Cl2是橙黄色液体。少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法错误的是( )
A. 为非极性分子
B. 分子中既含有极性键又含有非极性键
C. 与S2Br2结构相似,熔、沸点:S2Br2>S2Cl2
D. 与水反应的化学方程式可能为:2S2Cl2+2H2O===SO2↑+3S↓+4HCl
当堂训练
A
当堂训练
【解析】根据S2Cl2的分子结构形状可知,它属于极性分子,A错误;由于与S2Br2结构相似,而相对分子质量S2Br2大,则熔、沸点:S2Br2>S2Cl2,C正确;由于S2Cl2少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液,则与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl,D正确。
4.科学家目前成功合成的具有独特化学特性的氢
铝化合物(AlH3)n,其结构类似由硼和氢组成的硼
烷,有关研究报告发表在最新出版的美国《科学》
杂志上。最简单的氢铝化合物为Al2H6它的熔点为
150℃,燃烧热极高,Al2H6模型如图。下列有关说法不正确的是( )
A.Al2H6中H为+1价,Al为-3价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6分子是非极性分子
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
当堂训练
A
当堂训练
5. A,B,C,D,E是相邻三个周期中的五种元素,它们的原子序数依次增大,B,C,D属同一周期,A,E在周期表中处于同一纵行。已知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B,B与C都能生成气态非极性分子的化合物;
③D与E生成离子化合物,其离子的电子层结构相同。
(1)A为_____元素,B为_____元素,C为_____元素,D为_____元素。
(2)C元素在周期表中属第________周期________族元素,其原子核外电子排布式为________。
(3)B与C形成的非极性分子是________。其中共价键类型及数目是________________(填σ或π键)
2个σ键2个π键
1s22s22p4
氢 碳 氧 氟
二 ⅥA
CO2
本节内容结束
