2.3.2 分子间作用力 分子的手性课件(共55张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.2 分子间作用力 分子的手性课件(共55张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 16:01:04 | ||
图片预览






文档简介
(共55张PPT)
第2课时 分子间作用力 分子的手性
第三节 分子结构与物质的性质
第二章
教学目标
1. 了解分子间作用力、氢键的形成及对物质性质的影响,了解影响物质溶解性的因素,形成“结构决定性质”的观念。
2. 了解手性分子及在生命科学等方面的应用。
情境引入
蜘蛛脚上的大量细毛与天花板之间的 “黏力”使蜘蛛不致坠落
分子间作用力
概念:把分子聚集在一起的作用力
本质:分子之间的静电作用
存在:非金属单质(除C、Si)分子、稀有气体分子、共价化合物
(除SiO2)分子之间;石墨片层之间
常见的有范德华力和氢键两类
范德华力
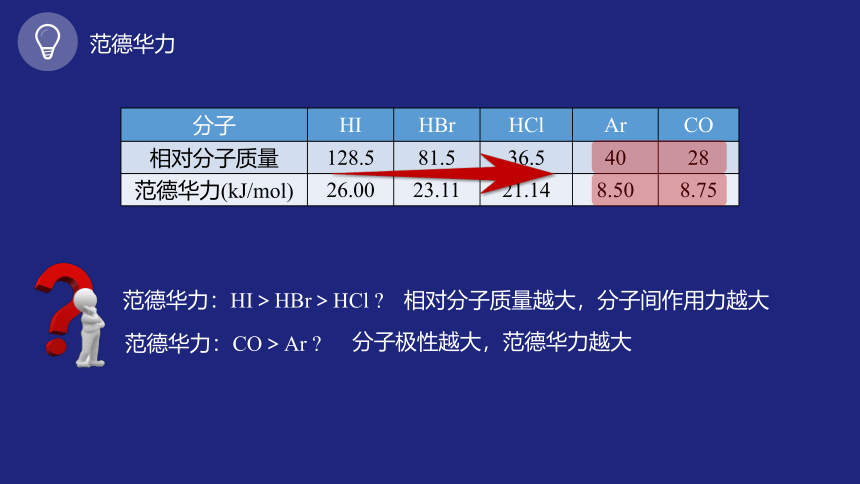
分子 HI HBr HCl Ar CO
相对分子质量 128.5 81.5 36.5 40 28
范德华力(kJ/mol) 26.00 23.11 21.14 8.50 8.75
范德华力:HI>HBr>HCl
相对分子质量越大,分子间作用力越大
范德华力:CO>Ar
分子极性越大,范德华力越大
范德华力
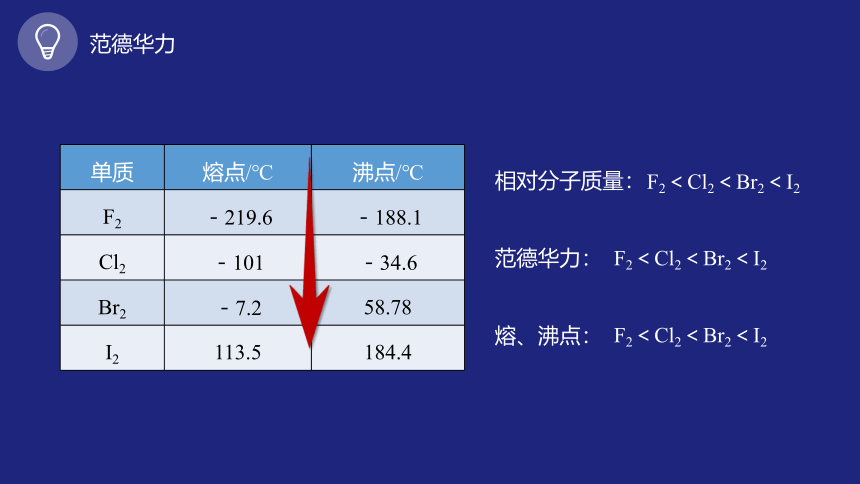
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
相对分子质量:
范德华力:
熔、沸点:
F2<Cl2<Br2<I2
F2<Cl2<Br2<I2
F2<Cl2<Br2<I2
范德华力
特点
(1) 分子之间广泛存在
(2) 作用力能量很弱,约比化学键的键能小1~2个数量级
(3) 主要影响物理性质——熔沸点
键能影响分子的热稳定性, 范德华力影响物质的熔、沸点
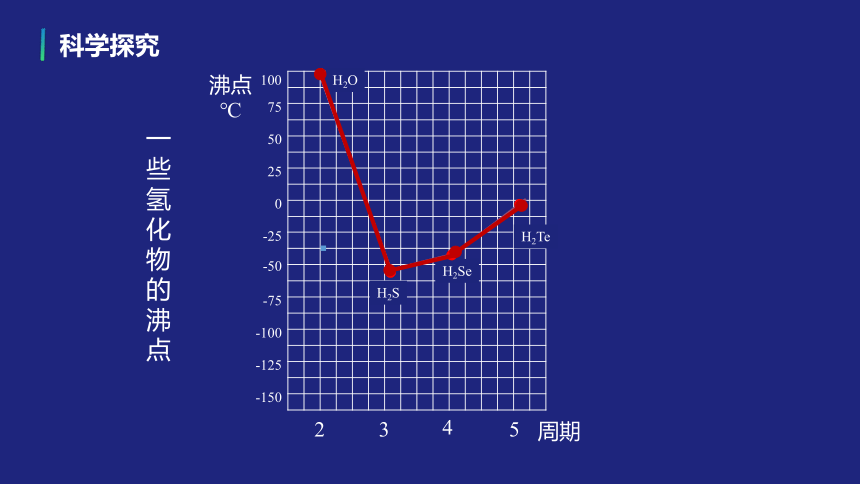
预测:H2O、 H2S、 H2Se、 H2Te沸点的变化规律
科学探究
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
H2O
H2S
H2Se
H2Te
沸点
℃
周期
一些氢化物的沸点
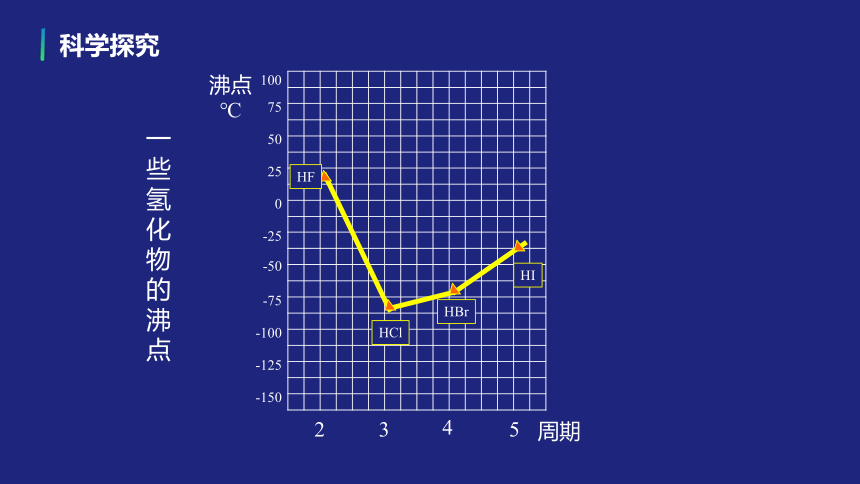
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
沸点
℃
周期
一些氢化物的沸点
HF
HCl
HI
HBr
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
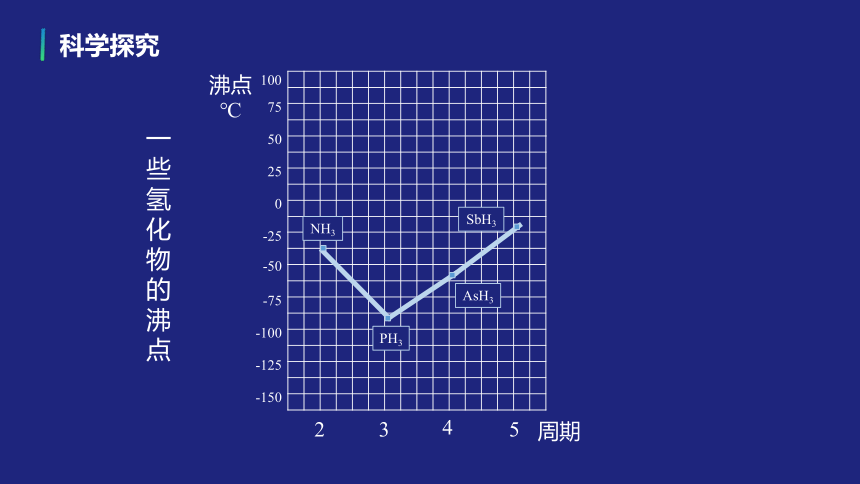
NH3
PH3
AsH3
SbH3
沸点
℃
周期
一些氢化物的沸点
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
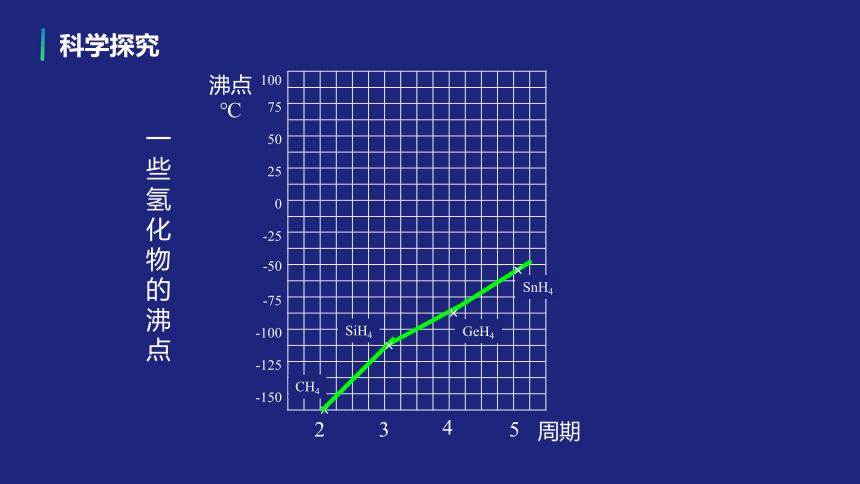
CH4
×
×
×
SiH4
GeH4
SnH4
沸点
℃
周期
一些氢化物的沸点
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
沸点
℃
周期
一些氢化物的沸点
×
×
×
特殊的作用力
氢键
氢 键
在水分子的O-H中,共用电子对强烈的偏向 O,使 H 几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键
…
O
H
H
δ+
δ+
δ-
O
H
H
δ+
δ+
δ-
本质:静电作用,属于分子间作用力
形成条件:①部分裸露的氢原子核
②电负性很大的原子提供孤电子对
氢 键
定义:是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很
大的原子之间的作用力
氢键的表达方式:A—H···B
A和 B 代表 F、O、N 等电负性大而半径较小的非金属原子
O
H
H
O
H
H
…
氢 键
氢键的特征
饱和性 每个裸露的氢原子核只能形成一个氢键
氢 键
方向性 水中,氧原子的孤电子对伸展方向与O—H键键轴的方向一致
大多情况下,O—H···O键角为180°
每个孤电子对只能形成一个氢键
共价键键能 范德华力 氢键
强度 467 11 18.8
冰晶体中
氢 键
类型 化学键 范德华力 氢键
强度 一般在 100~600 kJ mol-1 一般在 2~20 kJ mol-1 一般不超过40 kJ mol-1,
比范德华力大些
氢键不是化学键!
H—O—H···O—H
H
O—H···O
N—H···N—H
H
H
H
H
N—H···N
氨水中的氢键
(1)
(2)
H—O—H···N—H
H
H
O—H···N
(3)
1.乙醇和甲醚互为同分异构体,相对分子质量相同,为什么沸点相差这么多?
物质 沸点/℃
乙醇(CH3CH2OH) 78.3
甲醚(CH3OCH3) -24.9
CH3CH2—O
CH2CH3
H
···H—O
科学探究
O
C
H
O
H
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
科学探究
O
H
C
H
O
科学探究
O
H
C
H
O
δ+
δ-
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
科学探究
O
H
C
H
O
O
H
C
H
O
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
对羟基苯甲醛可以形成分子间氢键,沸腾时需破坏氢键;邻羟基苯甲醛形成分子内氢键,不能形成分子间氢键,沸腾时只需破坏范德华力
科学探究
分子间氢键使物质熔沸点升高
分子内氢键使物质熔沸点降低
影响物质的熔沸点
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
如何解释四种有机物在水中的溶解性的差异?
物质 溶解性
乙烷(CH3CH3) 难溶
乙醇(CH3CH2OH) 互溶
乙醛(CH3CHO) 互溶
乙酸(CH3COOH) 互溶
科学探究
CH3CH2—O
H
H
··· H—O
C=O
H
··· H—O
H3C
H
C=O
H
···H—O
H3C
H—O···H—O
H
科学探究
如何解释四种有机物在水中的溶解性的差异?
蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原来的氢键部位可能发生移动,由此引起羊毛织品变形。
羊毛织品水洗后为什么会变形
化学与生活
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
DNA双螺旋结构中的氢键
化学与生活
溶解性
“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
蔗糖和氨易溶于水,难溶于CCl4,因为蔗糖、氨、水都是极性分子;
萘和碘易溶于CCl4,难溶于水,因为萘、碘和CCl4都是非极性分子。
离子化合物是强极性物质,很多易溶于水。
溶解性
氢键:若溶剂与溶质分子之间可以形成氢键,则溶解性好;若溶质分子不能与水分子形成氢键,在水中溶解度就相对较小。
如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,是因为这些物质的分子与水分子之间能够形成氢键。
溶解性
分子结构的相似性: “相似相溶”还适用于分子结构的相似性。
如乙醇分子中的—OH与水分子中的—OH相近,因而乙醇能与水互溶。当然乙醇分子由于—OH的极性较强,能与H2O形成氢键也是其互溶的原因。
而戊醇(CH3CH2CH2CH2CH2OH)分子中的烃基较大,烃基是非极性基团,是疏水亲油基团,导致戊醇在水中的溶解度比乙醇小。烃基越大的醇在水中的溶解度就越小。
思考与讨论
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
思考与讨论
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL
蒸馏水,观察碘在水中的溶解性。在碘水溶液中加
入约1 mL四氯化碳,振荡试管,形成紫红色的碘的
四氯化碳溶液。再向试管里加入1 mL浓碘化钾水溶
液,振荡试管,溶液紫色变浅,这是由于在水溶液
里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
情境引入
情境引入
情境引入
分子的手性
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,但在三维空间里不能重叠,互称手性异构体
手性异构体
手性分子
有手性异构体的分子叫做手性分子
特征:①分子中原子或原子团互相连接的次序相同
②在空间的排列方向不同
分子的手性
碳原子结合的四个原子或原子团各不相同
记作﹡C
﹡
手性碳原子
分子的手性
C
C
COOH
COOH
H
H
OH
HO
CH3
CH3
﹡
﹡
分子的手性
﹡
H
H
H
Cl
H
Cl
﹡
手性分子
H
H
H
H
Cl
Cl
﹡
﹡
非手性分子
分子的手性
分子的手性
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家,用他们的方法可以只得到或者主要得到一种手性分子,这种独特的方法称为手性合成。
分子的手性
手性催化剂只催化或者主要催化一种手性分子的合成,可以比喻成握手,手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握。
催化剂
催化剂
不与催化剂手性匹配的手性异构体体
合成的手性异构体
自然界中的手性物质
常见的贝壳为右螺旋
罕见、珍贵的法螺左旋贝,百万分之一
手性与生命科学
法国科学家巴斯德
巴斯德与手性
手性酒石酸盐晶体
本节知识总结
分子间作用力
范德华力
氢 键
分子的手性
氢键的形成
物质的溶解性
氢键对物质性质的影响
当堂训练
1.下列化合物的沸点,前者低于后者的是( )
A.乙醇与氯乙烷
B.C3F8(全氟丙烷)与C3H8
C.对羟基苯甲醛与邻羟基苯甲醛
D.邻羟基苯甲酸与对羟基苯甲酸
D
当堂训练
解析:
乙醇存在氢键,沸点较高,前者高于后者,A不符合题意;
C3F8与C3H8都是分子晶体,结构相似,相对分子质量越大,沸点越高,前者高于后者,B不符合题意;
对羟基苯甲醛含有分子间氢键,邻羟基苯甲醛含有分子内氢键,分子间作用力较强,沸点较高,前者高于后者,C不符合题意;
邻羟基苯甲酸存在分子内氢键,对羟基苯甲酸存在分子间氢键,分子间作用力较强,沸点较高,前者低于后者,D符合题意。
当堂训练
2.下列说法错误的是( )
A.卤化氢中,以HF沸点最高,是由于HF分子间可以形成氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水分子间形成的氢键键能大
D.氨气极易溶于水与氨气分子和水分子之间可以形成氢键有关
C
当堂训练
解析:
HF分子间可以形成氢键,故沸点:HF>HI>HBr>HCl,A正确;
邻羟基苯甲醛可以形成分子内氢键,而对羟基苯甲醛的氢键只存在于分子间,所以对羟基苯甲醛的熔、沸点高,B正确;
根据F原子半径小于O原子半径,可知(HF)n中氢键键长比水中氢键键长小、键能大,但由于一个HF分子只能与两个相邻的HF分子形成氢键,而一个H2O分子可与四个相邻的H2O分子形成氢键,故H2O的沸点比HF的沸点高,C错误;
氨气在水中的溶解性与NH3分子和H2O分子之间形成氢键有关,D正确。
当堂训练
3.下列化合物分子中含有手性碳原子的是( )
A . CCl2F2 B . CH3CH2OH
D
D .
C .
当堂训练
解析:
分子中②号C连有—CH3、—H、—COOH、
—OH 4种不同的原子或原子团,D正确。
当堂训练
4.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )
A. B. C. D.
B
当堂训练
解析:根据氢键的形成条件可知电负性大的元素的原子(一般是N、O、F)与氢原子之间易形成氢键,观察题目给出的结构式可知从氢键的成键原理上讲,A、B都成立;但从空间构型上讲,由于氨气分子是三角锥形,易于提供孤电子对,所以B项中的方式结合空间阻碍最小,结构最稳定。
本节内容结束
第2课时 分子间作用力 分子的手性
第三节 分子结构与物质的性质
第二章
教学目标
1. 了解分子间作用力、氢键的形成及对物质性质的影响,了解影响物质溶解性的因素,形成“结构决定性质”的观念。
2. 了解手性分子及在生命科学等方面的应用。
情境引入
蜘蛛脚上的大量细毛与天花板之间的 “黏力”使蜘蛛不致坠落
分子间作用力
概念:把分子聚集在一起的作用力
本质:分子之间的静电作用
存在:非金属单质(除C、Si)分子、稀有气体分子、共价化合物
(除SiO2)分子之间;石墨片层之间
常见的有范德华力和氢键两类
范德华力
分子 HI HBr HCl Ar CO
相对分子质量 128.5 81.5 36.5 40 28
范德华力(kJ/mol) 26.00 23.11 21.14 8.50 8.75
范德华力:HI>HBr>HCl
相对分子质量越大,分子间作用力越大
范德华力:CO>Ar
分子极性越大,范德华力越大
范德华力
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
相对分子质量:
范德华力:
熔、沸点:
F2<Cl2<Br2<I2
F2<Cl2<Br2<I2
F2<Cl2<Br2<I2
范德华力
特点
(1) 分子之间广泛存在
(2) 作用力能量很弱,约比化学键的键能小1~2个数量级
(3) 主要影响物理性质——熔沸点
键能影响分子的热稳定性, 范德华力影响物质的熔、沸点
预测:H2O、 H2S、 H2Se、 H2Te沸点的变化规律
科学探究
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
H2O
H2S
H2Se
H2Te
沸点
℃
周期
一些氢化物的沸点
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
沸点
℃
周期
一些氢化物的沸点
HF
HCl
HI
HBr
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
NH3
PH3
AsH3
SbH3
沸点
℃
周期
一些氢化物的沸点
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
CH4
×
×
×
SiH4
GeH4
SnH4
沸点
℃
周期
一些氢化物的沸点
科学探究
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
沸点
℃
周期
一些氢化物的沸点
×
×
×
特殊的作用力
氢键
氢 键
在水分子的O-H中,共用电子对强烈的偏向 O,使 H 几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键
…
O
H
H
δ+
δ+
δ-
O
H
H
δ+
δ+
δ-
本质:静电作用,属于分子间作用力
形成条件:①部分裸露的氢原子核
②电负性很大的原子提供孤电子对
氢 键
定义:是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很
大的原子之间的作用力
氢键的表达方式:A—H···B
A和 B 代表 F、O、N 等电负性大而半径较小的非金属原子
O
H
H
O
H
H
…
氢 键
氢键的特征
饱和性 每个裸露的氢原子核只能形成一个氢键
氢 键
方向性 水中,氧原子的孤电子对伸展方向与O—H键键轴的方向一致
大多情况下,O—H···O键角为180°
每个孤电子对只能形成一个氢键
共价键键能 范德华力 氢键
强度 467 11 18.8
冰晶体中
氢 键
类型 化学键 范德华力 氢键
强度 一般在 100~600 kJ mol-1 一般在 2~20 kJ mol-1 一般不超过40 kJ mol-1,
比范德华力大些
氢键不是化学键!
H—O—H···O—H
H
O—H···O
N—H···N—H
H
H
H
H
N—H···N
氨水中的氢键
(1)
(2)
H—O—H···N—H
H
H
O—H···N
(3)
1.乙醇和甲醚互为同分异构体,相对分子质量相同,为什么沸点相差这么多?
物质 沸点/℃
乙醇(CH3CH2OH) 78.3
甲醚(CH3OCH3) -24.9
CH3CH2—O
CH2CH3
H
···H—O
科学探究
O
C
H
O
H
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
科学探究
O
H
C
H
O
科学探究
O
H
C
H
O
δ+
δ-
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
科学探究
O
H
C
H
O
O
H
C
H
O
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
对羟基苯甲醛可以形成分子间氢键,沸腾时需破坏氢键;邻羟基苯甲醛形成分子内氢键,不能形成分子间氢键,沸腾时只需破坏范德华力
科学探究
分子间氢键使物质熔沸点升高
分子内氢键使物质熔沸点降低
影响物质的熔沸点
2.为什么邻羟基苯甲醛的沸点低于对羟基苯甲醛?
如何解释四种有机物在水中的溶解性的差异?
物质 溶解性
乙烷(CH3CH3) 难溶
乙醇(CH3CH2OH) 互溶
乙醛(CH3CHO) 互溶
乙酸(CH3COOH) 互溶
科学探究
CH3CH2—O
H
H
··· H—O
C=O
H
··· H—O
H3C
H
C=O
H
···H—O
H3C
H—O···H—O
H
科学探究
如何解释四种有机物在水中的溶解性的差异?
蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原来的氢键部位可能发生移动,由此引起羊毛织品变形。
羊毛织品水洗后为什么会变形
化学与生活
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
DNA双螺旋结构中的氢键
化学与生活
溶解性
“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
蔗糖和氨易溶于水,难溶于CCl4,因为蔗糖、氨、水都是极性分子;
萘和碘易溶于CCl4,难溶于水,因为萘、碘和CCl4都是非极性分子。
离子化合物是强极性物质,很多易溶于水。
溶解性
氢键:若溶剂与溶质分子之间可以形成氢键,则溶解性好;若溶质分子不能与水分子形成氢键,在水中溶解度就相对较小。
如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,是因为这些物质的分子与水分子之间能够形成氢键。
溶解性
分子结构的相似性: “相似相溶”还适用于分子结构的相似性。
如乙醇分子中的—OH与水分子中的—OH相近,因而乙醇能与水互溶。当然乙醇分子由于—OH的极性较强,能与H2O形成氢键也是其互溶的原因。
而戊醇(CH3CH2CH2CH2CH2OH)分子中的烃基较大,烃基是非极性基团,是疏水亲油基团,导致戊醇在水中的溶解度比乙醇小。烃基越大的醇在水中的溶解度就越小。
思考与讨论
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
思考与讨论
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL
蒸馏水,观察碘在水中的溶解性。在碘水溶液中加
入约1 mL四氯化碳,振荡试管,形成紫红色的碘的
四氯化碳溶液。再向试管里加入1 mL浓碘化钾水溶
液,振荡试管,溶液紫色变浅,这是由于在水溶液
里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
情境引入
情境引入
情境引入
分子的手性
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,但在三维空间里不能重叠,互称手性异构体
手性异构体
手性分子
有手性异构体的分子叫做手性分子
特征:①分子中原子或原子团互相连接的次序相同
②在空间的排列方向不同
分子的手性
碳原子结合的四个原子或原子团各不相同
记作﹡C
﹡
手性碳原子
分子的手性
C
C
COOH
COOH
H
H
OH
HO
CH3
CH3
﹡
﹡
分子的手性
﹡
H
H
H
Cl
H
Cl
﹡
手性分子
H
H
H
H
Cl
Cl
﹡
﹡
非手性分子
分子的手性
分子的手性
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家,用他们的方法可以只得到或者主要得到一种手性分子,这种独特的方法称为手性合成。
分子的手性
手性催化剂只催化或者主要催化一种手性分子的合成,可以比喻成握手,手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握。
催化剂
催化剂
不与催化剂手性匹配的手性异构体体
合成的手性异构体
自然界中的手性物质
常见的贝壳为右螺旋
罕见、珍贵的法螺左旋贝,百万分之一
手性与生命科学
法国科学家巴斯德
巴斯德与手性
手性酒石酸盐晶体
本节知识总结
分子间作用力
范德华力
氢 键
分子的手性
氢键的形成
物质的溶解性
氢键对物质性质的影响
当堂训练
1.下列化合物的沸点,前者低于后者的是( )
A.乙醇与氯乙烷
B.C3F8(全氟丙烷)与C3H8
C.对羟基苯甲醛与邻羟基苯甲醛
D.邻羟基苯甲酸与对羟基苯甲酸
D
当堂训练
解析:
乙醇存在氢键,沸点较高,前者高于后者,A不符合题意;
C3F8与C3H8都是分子晶体,结构相似,相对分子质量越大,沸点越高,前者高于后者,B不符合题意;
对羟基苯甲醛含有分子间氢键,邻羟基苯甲醛含有分子内氢键,分子间作用力较强,沸点较高,前者高于后者,C不符合题意;
邻羟基苯甲酸存在分子内氢键,对羟基苯甲酸存在分子间氢键,分子间作用力较强,沸点较高,前者低于后者,D符合题意。
当堂训练
2.下列说法错误的是( )
A.卤化氢中,以HF沸点最高,是由于HF分子间可以形成氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水分子间形成的氢键键能大
D.氨气极易溶于水与氨气分子和水分子之间可以形成氢键有关
C
当堂训练
解析:
HF分子间可以形成氢键,故沸点:HF>HI>HBr>HCl,A正确;
邻羟基苯甲醛可以形成分子内氢键,而对羟基苯甲醛的氢键只存在于分子间,所以对羟基苯甲醛的熔、沸点高,B正确;
根据F原子半径小于O原子半径,可知(HF)n中氢键键长比水中氢键键长小、键能大,但由于一个HF分子只能与两个相邻的HF分子形成氢键,而一个H2O分子可与四个相邻的H2O分子形成氢键,故H2O的沸点比HF的沸点高,C错误;
氨气在水中的溶解性与NH3分子和H2O分子之间形成氢键有关,D正确。
当堂训练
3.下列化合物分子中含有手性碳原子的是( )
A . CCl2F2 B . CH3CH2OH
D
D .
C .
当堂训练
解析:
分子中②号C连有—CH3、—H、—COOH、
—OH 4种不同的原子或原子团,D正确。
当堂训练
4.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )
A. B. C. D.
B
当堂训练
解析:根据氢键的形成条件可知电负性大的元素的原子(一般是N、O、F)与氢原子之间易形成氢键,观察题目给出的结构式可知从氢键的成键原理上讲,A、B都成立;但从空间构型上讲,由于氨气分子是三角锥形,易于提供孤电子对,所以B项中的方式结合空间阻碍最小,结构最稳定。
本节内容结束
