第十单元 化学实验(4)实验方案的设计与评价 精讲课件(共38张PPT)——2024届高考解锁大单元一轮复习
文档属性
| 名称 | 第十单元 化学实验(4)实验方案的设计与评价 精讲课件(共38张PPT)——2024届高考解锁大单元一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-01 19:04:02 | ||
图片预览








文档简介
(共38张PPT)
第十单元 化学实验
第四节 实验方案的设计与评价
核心素养
科学探究与创新意识:根据化学实验的目的和要求,设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。各部分知识与技能的综合应用。
化学实验方案的设计
01
1.化学实验方案的设计
(1)主要类型
(2)化学实验方案设计的五项基本原则
(3)化学实验方案设计的步骤
(3)化学实验方案设计示例
设计实验证明氯酸钾中含有氯元素。
(1)实验原理
2KClO3 2KCl+3O2↑,Ag++Cl- AgCl↓。
(2)实验试剂:氯酸钾固体、 、 溶液、稀
硝酸。
(3)操作步骤
a.将氯酸钾和MnO2混合共热。
b.冷却至室温,加水充分溶解后, 。
c.取少量滤液于洁净试管中,加入几滴硝酸酸化的 溶液,观
察到有白色沉淀生成,证明氯酸钾中含有氯元素。
二氧化锰
硝酸银
过滤
AgNO3
1.过氧化钙是一种白色固体,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如图装置(部分固定装置略)用钙和氧气制备过氧
化钙。
基础测评
①请选择必要的装置(装置可重复使用),按气流方向连接顺序为
。(填仪器接口的字母编号)
②连接好装置进行实验,步骤如下:
Ⅰ.检查装置气密性后,装入药品;
Ⅱ. ;
Ⅲ.点燃B处酒精灯加热药品;反应结束后,
;
Ⅳ.拆除装置,取出产物
(2)已知化学反应Ca2++H2O2+2NH3+8H2O CaO2·8H2O↓+2N 。在
碱性环境中制取CaO2·8H2O的装置如图所示:
aedbce
或aedcbe
打开分液漏斗旋塞,通一段时间氧气
先熄灭酒精灯,待产品冷却后再停
止通入氧气
①装置B中仪器X的作用是 ;
反应在冰水浴中进行的目的是____________________________________。
②反应结束后,经 、 、低温烘干获得CaO2·8H2O。
导气,防止倒吸
防止温度过高H2O2分解;利于晶体析出
过滤
洗涤
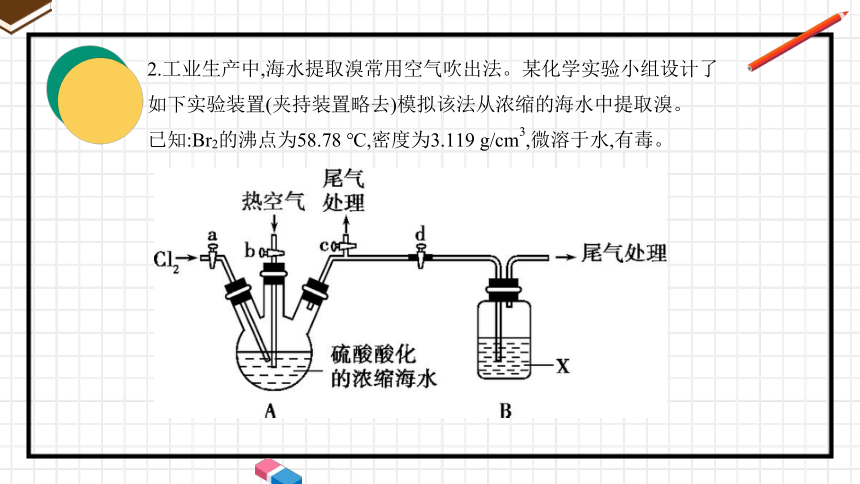
2.工业生产中,海水提取溴常用空气吹出法。某化学实验小组设计了如下实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。
已知:Br2的沸点为58.78 ℃,密度为3.119 g/cm3,微溶于水,有毒。
回答下列问题:
(1)实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭活塞 ,打开活塞 ,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量Cl2;
④取B中所得溶液进行蒸馏,收集液溴。
(2)步骤①A中主要反应的离子方程式为 。
a、c
b、d
Cl2+2Br- Br2+2Cl-
(3)X试剂可以是 (填序号),步骤②B中X试剂与Br2发生反应的离
子方程式为__________________________________。
A.H2O B.饱和食盐水 C.饱和Na2SO3溶液
(4)该实验中尾气处理所用的试剂可为 。
(5)蒸馏时,除酒精灯、石棉网、铁架台外,还应该选择仪器
(填序号)。蒸馏操作中应控制温度为_________________________。
C
Br2+SO32- +H2O SO42- +2Br-+2H+
NaOH溶液
①③⑤⑥⑦
59 ℃(58.78 ℃~60 ℃之间均可)
3.某校研究性学习小组选用如图装置组装制备纯净干燥的NH3并探究NH3与CuO发生的反应,同时检验和收集非固态产物。请回答下列问题:
(1)完成实验所需装置按气流方向从左到右的连接顺序为 。
(2)连接好装置后应首先 ,然后添加药品进行实验。
(3)装置A中发生反应的化学方程式为______________________________________。
(4)装置D中盛放碱石灰的仪器名称是 ,装置E的作用是
。
ADCEGBF
检查装置的气密性
2NH4Cl+Ca(OH)2 CaCl2+2H2O
+2NH3↑
球形干燥管
检验NH3与CuO反应的产物中是否有水
(5)通过进一步检测发现装置F中收集到的气体是一种常见的单质气体,
装置C硬质玻璃管中得到一种固体单质。试描述该小组同学还能观察
到的其他现象
;装置C中发生反应的化学方程式为___________________________________________。
装置C中黑色固体逐渐变红,管壁上有液珠产生;装置E中
白色固体逐渐变蓝
2NH3+3CuO
3Cu+3H2O+N2
4.资料显示:O2的氧化性随溶液pH的增大逐渐减弱。室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下。
回答下列问题:
(1)实验③的目的是________________________________________。
(2)实验②中发生反应的离子方程式是 。
(3)实验②比实验④溶液颜色深的原因是______________________________________________________________________________________________。
为进一步探究KI与O2的反应,用上述装置继续进行实验:
验证Cl-是否影响KI与O2的反应
4I-+O2+4H+ 2I2+2H2O
HCl是强电解质,其溶液中c(H+)
比相同浓度的醋酸溶液中的大,O2的氧化性较强
对于实验⑥的现象,甲同学猜想“pH=10时O2不能氧化I-”,他设计了下
列装置进行实验以验证猜想。
(4)烧杯a中的溶液为 。
(5)实验结果表明此猜想不成立。支持该结论的实验现象是:通入O2后,
pH=10的KOH溶液
。
(6)乙同学向pH=10的“KOH-淀粉溶液”中滴加碘水,溶液先变蓝后迅
速褪色,经检测,褪色后的溶液中含有I ,用离子方程式表示褪色的原
因: 。
(7)该小组同学对实验过程进行了反思,推测实验①和实验⑥的现象产
生的原因分别可能是_________________________________________________________________________________________________________________________________________________________。
电流表指针偏转,烧杯b中的溶液逐渐变成蓝色
3I2+6OH- IO3- +5I-+3H2O
中性条件下,O2的氧化性比较弱,短时间内难以生成
“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被O2氧化生成I2,I2迅速发生歧化反应变为IO3- 和I-
化学实验方案的评价
02
2.化学实验方案的评价
(1)绿色化学方面
(2)安全性方面
(3)规范性方面
基础测评
1. 下列图示实验正确的是 ( )
B
2. 下列装置进行的相关实验,能达到实验目的的是 ( )
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可演示NO的喷泉实验
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.用图4装置验证苯中是否有独立的碳碳双键
D
3. 某小组设计如图实验装置探究:(Ⅰ)苯与液溴发生取代反应;(Ⅱ)苯与液溴在催化剂作用下的反应机理。
已知:MnO2+2NaBr+2H2SO4(浓) Br2↑+MnSO4+Na2SO4+2H2O
(1)B装置的作用是 ;D装置用于吸收溴蒸气,盛装试
剂是 (填标号)。
提供干燥的溴蒸气
bd
a.氢氧化钠溶液 b.四氯化碳 c.KI溶液 d.苯
(2)能判断C装置中发生取代反应的实验现象是________________________。
(3)启动A装置中反应一段时间后,发现C装置中液体处于沸腾状态,其原因是 。写出C中发生反应的化学方程式:_______________________________________ 。
(4)实验完毕后,分离提纯C装置中产品的步骤有:①用少量蒸馏水洗涤;
②用大量蒸馏水洗涤粗产品;③用10%氢氧化钠溶液洗涤;④蒸馏;⑤加
入硫酸镁,过滤;⑥分液。
E装置中产生浅黄色沉淀
溴与苯在溴化铁作用下发生放热反应
+Br2
其正确的操作顺序为 。
(5)查阅资料:苯与液溴在溴化铁催化下的反应机理分三步。
第一步:Br2+FeBr3 Br++FeB
第二步:
①第三步反应是_____________________________________________________。
②该小组将B装置中浓硫酸用稀硫酸替代,实验失败,试从反应机理推测
可能的原因是 。
②③①⑥⑤④
+FeB +HBr+FeBr3
溴化铁水解,催化剂失效,不能产生溴正离子
4.某化学课外活动小组通过实验制备并研究NO2的性质。已知:2
NO2+2NaOH NaNO3+NaNO2+H2O
利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置已略去)。
(1)E装置中制取NO2的化学方程式是
。
Cu+4HNO3(浓) Cu(NO3)2
+2NO2↑+2H2O
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原
理的角度分析了原因,认为可能是:
①NH3的还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③_________________________________________。
(4)此实验装置存在的一个明显缺陷是 。
混合气体的颜
色变浅(合理均可)
在此条件下,该反应的化学反应速率极慢
缺少尾气处理装置
真题演练
1.(2022·浙江·高考真题)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是
C
2.(2021·江苏·高考真题)下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是
A.用装置甲除去废铜屑表面的油污 B.用装置乙在加热的条件下溶解废铜屑
C.用装置丙过滤得到CuSO4溶液 D.用装置丁蒸干溶液获得CuSO4·5H2O
D
3.(2020·天津·高考真题)为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:
实验步骤:
(1)判断 沉淀完全的操作为___________________________________________________________________________。
(2)步骤②判断沉淀是否洗净所选用的试剂为__________。
(3)步骤③灼烧时盛装样品的仪器名称为____。
向上层清液中继续滴加BaCl2溶液,无白
色沉淀生成,则沉淀完全
AgNO3溶液
坩埚
(4)固体质量为wg,则c(CuSO4)=________mol L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_____(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:
实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
偏低
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为______________。
(7)步骤⑥需保证体系恢复到室温的原因是__(填序号)。
a.反应热受温度影响
b.气体密度受温度影响
c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下 ,
则c(CuSO4)____________mol L-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)_____(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:___(填“是”或“否”)。
检查装置气密性
b
偏高
否
THANKS
谢谢观看
第十单元 化学实验
第四节 实验方案的设计与评价
核心素养
科学探究与创新意识:根据化学实验的目的和要求,设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。各部分知识与技能的综合应用。
化学实验方案的设计
01
1.化学实验方案的设计
(1)主要类型
(2)化学实验方案设计的五项基本原则
(3)化学实验方案设计的步骤
(3)化学实验方案设计示例
设计实验证明氯酸钾中含有氯元素。
(1)实验原理
2KClO3 2KCl+3O2↑,Ag++Cl- AgCl↓。
(2)实验试剂:氯酸钾固体、 、 溶液、稀
硝酸。
(3)操作步骤
a.将氯酸钾和MnO2混合共热。
b.冷却至室温,加水充分溶解后, 。
c.取少量滤液于洁净试管中,加入几滴硝酸酸化的 溶液,观
察到有白色沉淀生成,证明氯酸钾中含有氯元素。
二氧化锰
硝酸银
过滤
AgNO3
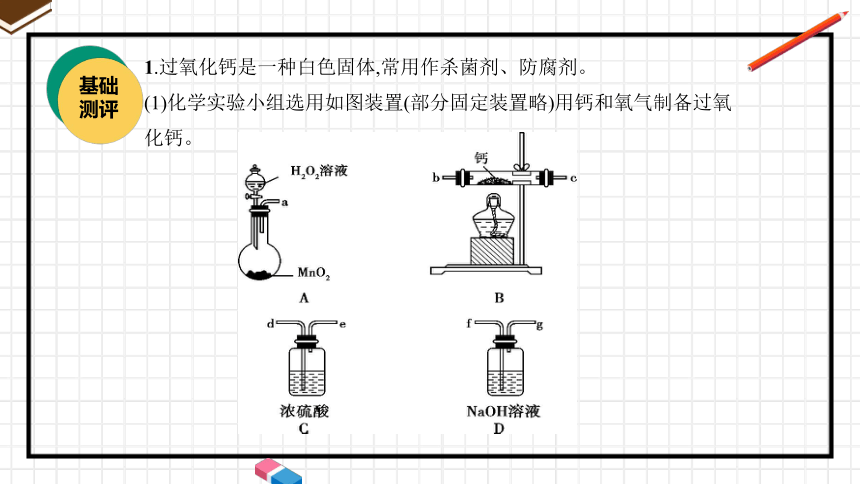
1.过氧化钙是一种白色固体,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如图装置(部分固定装置略)用钙和氧气制备过氧
化钙。
基础测评
①请选择必要的装置(装置可重复使用),按气流方向连接顺序为
。(填仪器接口的字母编号)
②连接好装置进行实验,步骤如下:
Ⅰ.检查装置气密性后,装入药品;
Ⅱ. ;
Ⅲ.点燃B处酒精灯加热药品;反应结束后,
;
Ⅳ.拆除装置,取出产物
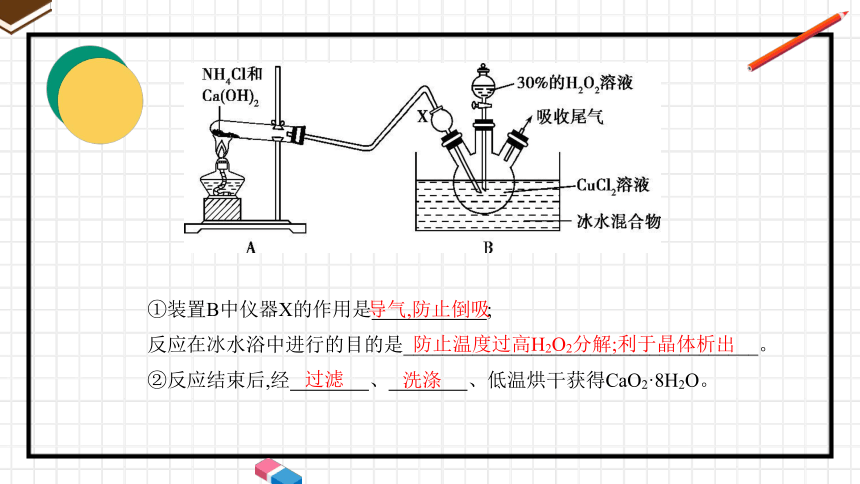
(2)已知化学反应Ca2++H2O2+2NH3+8H2O CaO2·8H2O↓+2N 。在
碱性环境中制取CaO2·8H2O的装置如图所示:
aedbce
或aedcbe
打开分液漏斗旋塞,通一段时间氧气
先熄灭酒精灯,待产品冷却后再停
止通入氧气
①装置B中仪器X的作用是 ;
反应在冰水浴中进行的目的是____________________________________。
②反应结束后,经 、 、低温烘干获得CaO2·8H2O。
导气,防止倒吸
防止温度过高H2O2分解;利于晶体析出
过滤
洗涤
2.工业生产中,海水提取溴常用空气吹出法。某化学实验小组设计了如下实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。
已知:Br2的沸点为58.78 ℃,密度为3.119 g/cm3,微溶于水,有毒。
回答下列问题:
(1)实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭活塞 ,打开活塞 ,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量Cl2;
④取B中所得溶液进行蒸馏,收集液溴。
(2)步骤①A中主要反应的离子方程式为 。
a、c
b、d
Cl2+2Br- Br2+2Cl-
(3)X试剂可以是 (填序号),步骤②B中X试剂与Br2发生反应的离
子方程式为__________________________________。
A.H2O B.饱和食盐水 C.饱和Na2SO3溶液
(4)该实验中尾气处理所用的试剂可为 。
(5)蒸馏时,除酒精灯、石棉网、铁架台外,还应该选择仪器
(填序号)。蒸馏操作中应控制温度为_________________________。
C
Br2+SO32- +H2O SO42- +2Br-+2H+
NaOH溶液
①③⑤⑥⑦
59 ℃(58.78 ℃~60 ℃之间均可)
3.某校研究性学习小组选用如图装置组装制备纯净干燥的NH3并探究NH3与CuO发生的反应,同时检验和收集非固态产物。请回答下列问题:
(1)完成实验所需装置按气流方向从左到右的连接顺序为 。
(2)连接好装置后应首先 ,然后添加药品进行实验。
(3)装置A中发生反应的化学方程式为______________________________________。
(4)装置D中盛放碱石灰的仪器名称是 ,装置E的作用是
。
ADCEGBF
检查装置的气密性
2NH4Cl+Ca(OH)2 CaCl2+2H2O
+2NH3↑
球形干燥管
检验NH3与CuO反应的产物中是否有水
(5)通过进一步检测发现装置F中收集到的气体是一种常见的单质气体,
装置C硬质玻璃管中得到一种固体单质。试描述该小组同学还能观察
到的其他现象
;装置C中发生反应的化学方程式为___________________________________________。
装置C中黑色固体逐渐变红,管壁上有液珠产生;装置E中
白色固体逐渐变蓝
2NH3+3CuO
3Cu+3H2O+N2
4.资料显示:O2的氧化性随溶液pH的增大逐渐减弱。室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下。
回答下列问题:
(1)实验③的目的是________________________________________。
(2)实验②中发生反应的离子方程式是 。
(3)实验②比实验④溶液颜色深的原因是______________________________________________________________________________________________。
为进一步探究KI与O2的反应,用上述装置继续进行实验:
验证Cl-是否影响KI与O2的反应
4I-+O2+4H+ 2I2+2H2O
HCl是强电解质,其溶液中c(H+)
比相同浓度的醋酸溶液中的大,O2的氧化性较强
对于实验⑥的现象,甲同学猜想“pH=10时O2不能氧化I-”,他设计了下
列装置进行实验以验证猜想。
(4)烧杯a中的溶液为 。
(5)实验结果表明此猜想不成立。支持该结论的实验现象是:通入O2后,
pH=10的KOH溶液
。
(6)乙同学向pH=10的“KOH-淀粉溶液”中滴加碘水,溶液先变蓝后迅
速褪色,经检测,褪色后的溶液中含有I ,用离子方程式表示褪色的原
因: 。
(7)该小组同学对实验过程进行了反思,推测实验①和实验⑥的现象产
生的原因分别可能是_________________________________________________________________________________________________________________________________________________________。
电流表指针偏转,烧杯b中的溶液逐渐变成蓝色
3I2+6OH- IO3- +5I-+3H2O
中性条件下,O2的氧化性比较弱,短时间内难以生成
“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被O2氧化生成I2,I2迅速发生歧化反应变为IO3- 和I-
化学实验方案的评价
02
2.化学实验方案的评价
(1)绿色化学方面
(2)安全性方面
(3)规范性方面
基础测评
1. 下列图示实验正确的是 ( )
B
2. 下列装置进行的相关实验,能达到实验目的的是 ( )
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可演示NO的喷泉实验
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.用图4装置验证苯中是否有独立的碳碳双键
D
3. 某小组设计如图实验装置探究:(Ⅰ)苯与液溴发生取代反应;(Ⅱ)苯与液溴在催化剂作用下的反应机理。
已知:MnO2+2NaBr+2H2SO4(浓) Br2↑+MnSO4+Na2SO4+2H2O
(1)B装置的作用是 ;D装置用于吸收溴蒸气,盛装试
剂是 (填标号)。
提供干燥的溴蒸气
bd
a.氢氧化钠溶液 b.四氯化碳 c.KI溶液 d.苯
(2)能判断C装置中发生取代反应的实验现象是________________________。
(3)启动A装置中反应一段时间后,发现C装置中液体处于沸腾状态,其原因是 。写出C中发生反应的化学方程式:_______________________________________ 。
(4)实验完毕后,分离提纯C装置中产品的步骤有:①用少量蒸馏水洗涤;
②用大量蒸馏水洗涤粗产品;③用10%氢氧化钠溶液洗涤;④蒸馏;⑤加
入硫酸镁,过滤;⑥分液。
E装置中产生浅黄色沉淀
溴与苯在溴化铁作用下发生放热反应
+Br2
其正确的操作顺序为 。
(5)查阅资料:苯与液溴在溴化铁催化下的反应机理分三步。
第一步:Br2+FeBr3 Br++FeB
第二步:
①第三步反应是_____________________________________________________。
②该小组将B装置中浓硫酸用稀硫酸替代,实验失败,试从反应机理推测
可能的原因是 。
②③①⑥⑤④
+FeB +HBr+FeBr3
溴化铁水解,催化剂失效,不能产生溴正离子
4.某化学课外活动小组通过实验制备并研究NO2的性质。已知:2
NO2+2NaOH NaNO3+NaNO2+H2O
利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置已略去)。
(1)E装置中制取NO2的化学方程式是
。
Cu+4HNO3(浓) Cu(NO3)2
+2NO2↑+2H2O
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原
理的角度分析了原因,认为可能是:
①NH3的还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③_________________________________________。
(4)此实验装置存在的一个明显缺陷是 。
混合气体的颜
色变浅(合理均可)
在此条件下,该反应的化学反应速率极慢
缺少尾气处理装置
真题演练
1.(2022·浙江·高考真题)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是
C
2.(2021·江苏·高考真题)下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是
A.用装置甲除去废铜屑表面的油污 B.用装置乙在加热的条件下溶解废铜屑
C.用装置丙过滤得到CuSO4溶液 D.用装置丁蒸干溶液获得CuSO4·5H2O
D
3.(2020·天津·高考真题)为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:
实验步骤:
(1)判断 沉淀完全的操作为___________________________________________________________________________。
(2)步骤②判断沉淀是否洗净所选用的试剂为__________。
(3)步骤③灼烧时盛装样品的仪器名称为____。
向上层清液中继续滴加BaCl2溶液,无白
色沉淀生成,则沉淀完全
AgNO3溶液
坩埚
(4)固体质量为wg,则c(CuSO4)=________mol L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_____(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:
实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
偏低
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为______________。
(7)步骤⑥需保证体系恢复到室温的原因是__(填序号)。
a.反应热受温度影响
b.气体密度受温度影响
c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下 ,
则c(CuSO4)____________mol L-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)_____(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:___(填“是”或“否”)。
检查装置气密性
b
偏高
否
THANKS
谢谢观看
同课章节目录
