3.2水的电离和溶液的PH 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 653.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 08:41:48 | ||
图片预览


文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
1.下列实验操作不会引起误差的是
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
2.时,的酸()加蒸馏水稀释,随溶液的体积变化关系如图所示,下列说法错误的是
A.为一元弱酸
B.的中约有的发生了电离
C.升高温度,溶液的pH增大
D.该酸的电离平衡常数约为
3.下列仪器使用前不需检验是否漏水的有
A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶
4.25℃时,0.01mol/L醋酸的pH大约是( )
A.2 B.4 C.7 D.10
5.现有室温下四种溶液,下列有关叙述不正确的是
序号 ① ② ③ ④
pH 12 12 2 2
溶液 氨水 氢氧化钾溶液 醋酸 盐酸
A.④中加入适量的醋酸钠晶体后,溶液的pH增大
B.②和③两溶液等体积混合,所得溶液中
C.分别加水稀释100倍,四种溶液的pH:①>②>④>③
D.④与①溶液混合后,若混合后溶液pH=7,则
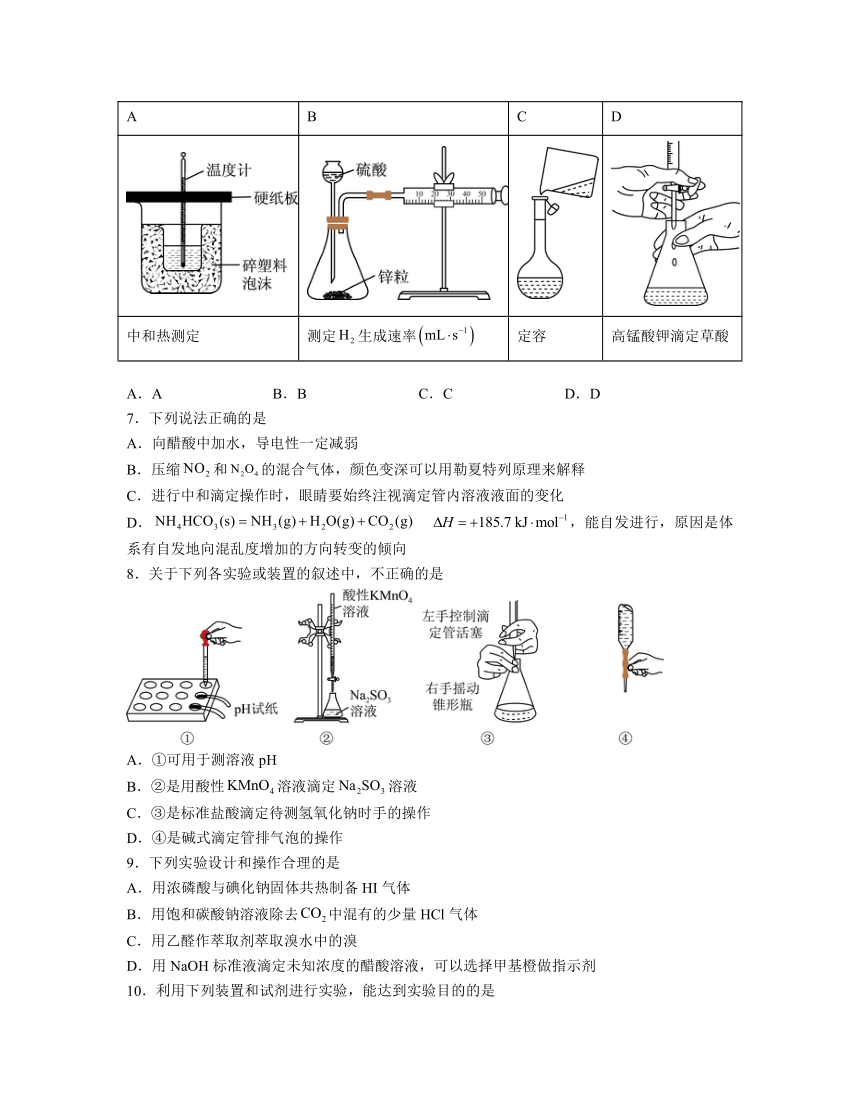
6.下列装置或操作能达到实验目的是
A B C D
中和热测定 测定生成速率 定容 高锰酸钾滴定草酸
A.A B.B C.C D.D
7.下列说法正确的是
A.向醋酸中加水,导电性一定减弱
B.压缩和的混合气体,颜色变深可以用勒夏特列原理来解释
C.进行中和滴定操作时,眼睛要始终注视滴定管内溶液液面的变化
D. ,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
8.关于下列各实验或装置的叙述中,不正确的是
A.①可用于测溶液pH
B.②是用酸性溶液滴定溶液
C.③是标准盐酸滴定待测氢氧化钠时手的操作
D.④是碱式滴定管排气泡的操作
9.下列实验设计和操作合理的是
A.用浓磷酸与碘化钠固体共热制备HI气体
B.用饱和碳酸钠溶液除去中混有的少量HCl气体
C.用乙醛作萃取剂萃取溴水中的溴
D.用NaOH标准液滴定未知浓度的醋酸溶液,可以选择甲基橙做指示剂
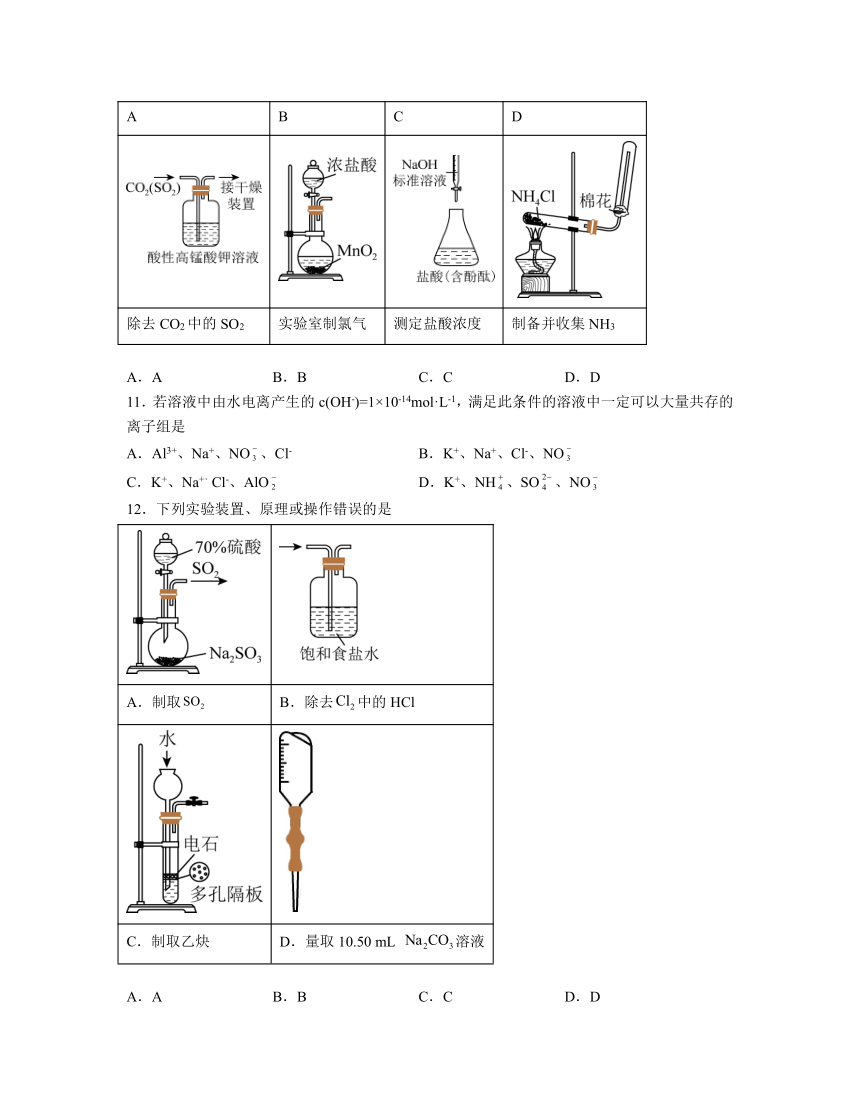
10.利用下列装置和试剂进行实验,能达到实验目的的是
A B C D
除去CO2中的SO2 实验室制氯气 测定盐酸浓度 制备并收集NH3
A.A B.B C.C D.D
11.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、NO、Cl- B.K+、Na+、Cl-、NO
C.K+、Na+、Cl-、AlO D.K+、NH、SO、NO
12.下列实验装置、原理或操作错误的是
A.制取 B.除去中的HCl
C.制取乙炔 D.量取10.50 mL 溶液
A.A B.B C.C D.D
13.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.高锰酸钾溶液中:、、、葡萄糖分子
B.使甲基橙试液显红色的溶液中:、、、
C.与反应能放出的溶液中:、、、
D.水电离的的溶液中:、、、
14.下列实验设计及其对应的离子方程式均正确的是
A.将氯气溶于水制备次氯酸:
B.硫酸型酸雨久置,pH减小:
C.用浓盐酸酸化的溶液与反应,证明具有还原性:
D.向溶液中滴加NaOH溶液至水的电离程度最大:
15.某药物中间体结构如图所示,其中W、R、X、Y、Z为1~20号元素且原子序数依次增大,其中X与Y同主族,Z和W的最外层电子数目相同,下列叙述错误的是
A.简单离子半径:X<Z<Y
B.W与Y形成的二元化合物能促进水的电离
C.该物质中R、X、Y、Z均满足最外层8电子构型
D.X分别与W、R、Y、Z元素均可以形成2种或以上的化合物
二、填空题
16.某温度下重水的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
(1)写出重水的电离方程式___________。
(2)该温度下,重水中的c(D+)=___________,pD=___________(已知lg2=0.3)。
(3)0.01mol·L-1的NaOD溶液pD=___________。
17.已知某温度下,水的离子积常数,请回答下列问题:
(1)此温度_______________(填“>”“<”或“=”),原因是_________________。
(2)对水进行下列操作,能抑制水的电离的是_______________(填标号,双选)。
A.通入适量气体 B.加入适量溶液
C.升温至 D.加入一小块Na
(3)此温度下纯水中的______________________。
18.请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1,N2(g)+O2(g)=2NO(g) H=+180.0kJ·mol-1,则相同条件下破坏1molNO的化学键需要吸收的能量为___________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的c(H+)=___________mol/L;往溶液中加入少量NaOH固体(不考虑温度变化),则溶液中___________(填“增大”、“减小”或“不变”)。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是___________。
A.c(H+) B. C.c(H+)·c(OH-) D.
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=___________。
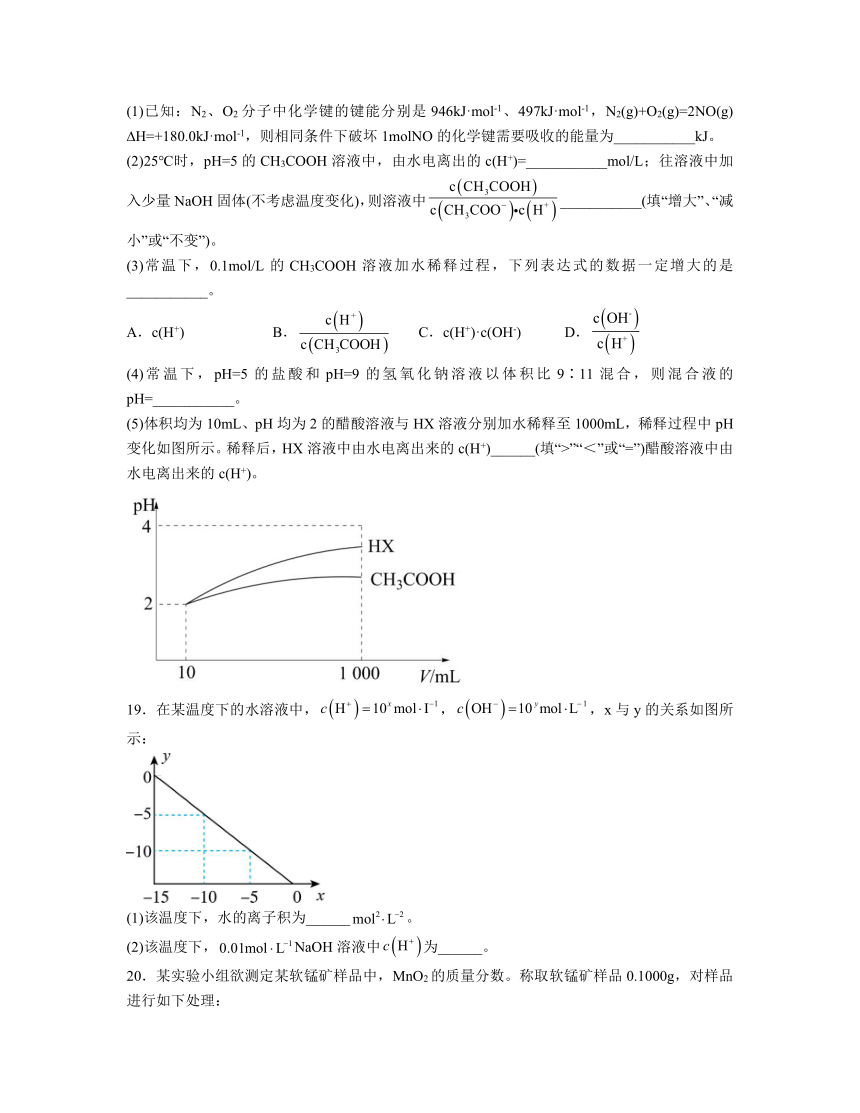
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。稀释后,HX溶液中由水电离出来的c(H+)______(填“>”“<”或“=”)醋酸溶液中由水电离出来的c(H+)。
19.在某温度下的水溶液中,,,x与y的关系如图所示:
(1)该温度下,水的离子积为______。
(2)该温度下,NaOH溶液中为______。
20.某实验小组欲测定某软锰矿样品中,MnO2的质量分数。称取软锰矿样品0.1000g,对样品进行如下处理:
①用过氧化钠处理,得到MnO溶液;
②煮沸溶液,除去剩余的过氧化物;
③酸化溶液,MnO歧化为MnO和MnO2;
④滤去MnO2;
⑤用0.100mol L-1Fe2+标准溶液滴定滤液中MnO,共用去20.80mL。
计算:
(1)滤液中MnO的物质的量___mol。
(2)样品中MnO2的质量分数___(用百分数表示,保留1位小数)。
21.现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
I.实验步骤
(1)用_______(填仪器名称,下同)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL_______中定容,摇匀即得待测白醋溶液。
(2)若在室温下,用溶液滴定该醋酸溶液,本实验可选的指示剂可以是_______(填序号)。
A.甲基橙 B.酚酞 C.石蕊 D.百里酚酞(pH变色范围9.4-10.6)
(3)读取盛装溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为_______mL。
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察_______。
(5)当_______时,停止滴定,并记录NaOH溶液的最终读数。重复滴定3次。
II.实验记录
滴定次数 1 2 3 4
V(样品)/mL 20.00 20.00 20.00 20.00
V消耗(NaOH)/mL 15.95 15.00 15.05 14.95
III.数据处理与讨论
(6)甲同学在处理数据时计算得:平均消耗的溶液的体积:
①指出他的计算的不合理之处:_______。
②按正确数据处理,市售白醋总酸量为_______g/100mL (已知醋酸相对分子量为60)。
(7)在本实验的滴定过程中,下列操作会使实验结果偏低的是_______(填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体测出
E.滴定终点读数时采用俯视方法
【参考答案】
一、选择题
1.C
【分析】用公式c(待测)=分析误差,主要是对标准液所用体积的影响进行分析。
解析:A.锥形瓶用蒸馏水洗后,不能用待测润洗,否则待测液的物质的量增加,滴定时标准液所用体积增加,导致测定结果偏大,A项错误;
B.酸碱中和滴定时,滴定管水洗后,直接盛装标准液,标准液的浓度会稀释而降低,为达到终点将待测液反应完毕,滴定时标准液所用体积增加,导致测定结果偏大,故需要先用标准液润洗滴定管,然后再盛装标准溶液,B项错误;
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,由于反应产物为NaCl,滴定终点时溶液呈中性,因此指示剂即可选酚酞,也可以选甲基橙,C项正确;
D.滴定终点时酸式滴定管尖嘴部分有气泡,开始实验时无气泡,可以理解成滴定终点时气泡将使滴定管里的液面上升,标准液的体积减小,导致测定浓度偏低,D项错误;
答案选C。
【点睛】本题考查酸碱中和滴定误差的判断,根据公式c(待测)=进行中和滴定的误差分析是最基本的方法,使用中应注意由于操作的失误导致公式中的某些数据发生变化,从而导致最终结果出现误差。
2.C
解析:A.25℃,起点时,pH=3,,小于0.1mol/L,故HA不完全电离,是一元弱酸,A正确;
B.,其中,说明只存在的HA发生电离,,有的发生了电离,B正确;
C.电离是吸热反应,升高温度,促进电离正向移动,c(H+)增大,pH减小,C错误;
D.,,D正确;
故选:C。
3.A
解析:在高中阶段常见仪器需要检漏的有:分液漏斗、容量瓶、酸式滴定管和碱式滴定管,综上所述,A符合题意。
故选A。
4.B
解析:0.01mol/L醋酸溶液呈酸性,pH小于7;若醋酸为强酸,0.01mol/L醋酸溶液中c(H+)=0.01mol/L,pH=-lg c(H+)=2;事实上醋酸为弱酸,不能完全电离,但选酸性,故c(H+)<0.01mol/L,7>pH>2,故选B。
5.D
解析:A.④中加入适量的醋酸钠晶体后,醋酸根离子与氢离子结合产生醋酸分子,氢离子浓度减小,溶液的pH增大,选项A正确;
B.假设是强酸和强碱,且物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,,选项B正确;
C.分别加水稀释100倍,假设平衡不移动,那么①、②溶液的pH均为10,但稀释氨水使电离平衡右移,使①pH>10,同理醋酸稀释后pH<4,选项C正确;
D.假设是强酸和强碱,混合后溶液呈中性,,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要氨水的体积少,即,选项D错误;
答案选D。
6.D
解析:A.中和热的测定实验中缺少环形玻璃搅拌棒,故A错误;
B.使用长颈漏斗会使生成的氢气从长颈漏斗中逸出,应该使用分液漏斗,故B错误;
C.应该使用玻璃棒引流,故C错误;
D.高锰酸钾溶液具有氧化性,故使用酸式滴定管,故D正确;
故选D。
7.D
解析:A.向冰醋酸中加水,促进醋酸电离,开始时,醋酸电离程度大于溶液体积增大程度,溶液中c(CH3COO-)和c(H+)增大,溶液导电性增强,A错误;
B.压缩和的混合气体,颜色变深是因为体积缩小,NO2的浓度增大,不是因为平衡移动导致的,即不能用勒夏特列原理来解释,B错误;
C.进行中和滴定操作时,眼睛要始终注视锥形瓶内溶液颜色的变化,C错误;
D.该反应中,生成物有气体,体系混乱度增大,则,反应能自发进行,D正确;
故选D。
8.D
解析:A.用pH试纸测溶液的pH,可将pH试纸放于井穴板上,滴一滴待测试液于试纸上,将试纸显色的颜色和标准比色卡对照,即可测定溶液的pH,故A正确;
B.酸性高锰酸钾溶液放于酸式滴定管中,滴入锥形瓶中,和亚硫酸钠反应,故B正确;
C.标准盐酸滴定待测氢氧化钠时,将盐酸放在酸式滴定管中,NaOH溶液放在锥形瓶中,左手控制酸式滴定管的活塞,右手摇动锥形瓶,将盐酸滴入锥形瓶中,故C正确;
D.排碱式滴定管中的气泡时,把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,使溶液从尖嘴快速喷出,故D错误;
故选D。
9.A
解析:A.用浓磷酸与碘化钠固体共热时发生反应:3NaI+H3PO4=Na3PO4+3HI(气体),可以制备HI气体,故A正确;
B.也能和饱和碳酸钠溶液反应,不能用饱和碳酸钠溶液除去中混有的少量HCl气体,故B错误;
C.乙醛溶于水,且会和溴水反应,不能作萃取剂萃取溴水中的溴,故C错误;
D.醋酸为弱酸,滴定终点呈碱性,应用酚酞作指示剂,故D错误;
故选A。
10.A
解析:A.SO2具有还原性,能与酸性高锰酸钾反应,CO2不与酸性高锰酸钾反应,因此通过酸性高锰酸钾溶液洗气可除去CO2中的SO2,故A正确;
B.浓盐酸和二氧化锰反应制取氯气需要加热,故B错误;
C.NaOH与酸式滴定管的玻璃活塞反应生成硅酸钠,应用碱式滴定管盛装NaOH溶液,故C错误;
D.加热氯化铵分解生成氨气和氯化氢,生成的氨气和氯化氢在试管口又化合生成氯化铵,得不到氨气,故D错误;
答案选A。
11.B
【分析】若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,说明水的电离受到抑制,可能是酸性溶液也可能是碱性溶液;
解析:A.若为碱性溶液,含大量OH-,则与Al3+反应得到沉淀,A项不符合题意;
B.K+、Na+、Cl-、NO离子间不反应,且在酸性或者酸性条件下都能共存,B项符合题意;
C.若溶液为酸性,含大量H+,H+与AlO反应得到氢氧化铝沉淀,不共存,C项不符合题意;
D.若为碱性溶液,含大量OH-,则与NH反应得到一水合氨,不能共存,D项不符合题意;
故答案选B。
12.C
解析:A.可用70%的硫酸与亚硫酸钠发生复分解反应制取二氧化硫时,反应无需加热,A正确;
B.氯气难溶于饱和食盐水,氯化氢可溶解在饱和食盐水中,所以除去氯气中的氯化氢,可以用饱和食盐水,B正确;
C.电石与水直接反应时反应速率过快,不便于乙炔气体的收集,通常采用加饱和食盐水的方法来减缓反应速率,C错误;
D.碳酸钠溶液显碱性,所以量取10.50mL碳酸钠溶液应采用碱式滴定管,或移液管,D正确;
故选C。
13.B
解析:A.与氢离子会生成弱酸草酸分子,且草酸根离子和葡萄糖分子都有还原性,均可被酸性高锰酸钾溶液氧化,不能大量共存,A不符合题意;
B.使甲基橙试液显红色的溶液中存在大量氢离子,、、、不和H+反应,、、、相互间也不反应,能大量共存,B符合题意;
C.与Al反应能放出 H2的溶液中可存在大量氢离子,也可存在大量氢氧根离子,若存在氢离子,硝酸根离子在酸性条件下具有强氧化性,能氧化Fe2+,若存在氢氧根离子,则亚铁离子会与氢氧根离子反应生成沉淀而不能共存,C不符合题意;
D.水电离的 的溶液中可存在大量氢离子,也可存在大量氢氧根离子,若存在氢离子,、均会反应不能大量共存,D不符合题意;
故选B。
14.D
解析:A.次氯酸为弱酸,不能写成离子,氯气溶于水制备次氯酸的离子方程式为,故A错误;
B.由于亚硫酸被空气中氧气氧化成硫酸,导致酸雨久置pH变小,亚硫酸为弱酸,所以离子方程式为,故B错误;
C.浓盐酸中氯离子也能被酸性高锰酸钾溶液氧化,不能证明具有还原性,故C错误;
D.铵根离子的水解促进水的电离,硫酸氢根离子电离出的氢离子抑制水的电离,所以水的电离程度最大时溶液中的溶质为,离子方程式为,故D正确;
故选D。
15.B
【分析】W、R、X、Y、Z为1~20号元素且原子序数依次增大,X与Y最外层电子数目相同,Z和W的最外层电子数目相同,由化合物中阴阳离子的结构可知,W、R、X、Y、Z分别为H元素、C元素、O元素、S元素、K元素。
解析:A.电子层数越小,离子的离子半径越小,则氧离子的离子半径最小,电子层数相同的离子,核电荷数越大,离子半径越小,则硫离子的离子半径大于钾离子,所以三种离子的离子半径大小顺序为O2-<K+<S2-,选项A正确;
B.W与Y形成的二元化合物硫化氢,硫化氢是二元弱酸,在溶液中分步电离出的氢离子抑制水的电离,故B错误;
C.由化合物中阴阳离子的结构可知,C、O、S、K四种元素均满足最外层8电子构型,故C正确;
D.氧元素与氢元素可以形成水、过氧化氢,与碳元素可以形成一氧化碳、二氧化碳,与硫元素可以形成二氧化硫、三氧化硫,与钾元素可以形成氧化钾、过氧化钾、超氧化钾,形成的化合物均为2种或以上,故D正确;
故选B。
二、填空题
16.(1)D2OD++OD-
(2) 4×10-8mol·L-1 7.4
(3)12.8
解析:(1)根据水的电离方程式可知,重水电离方程式为D2OD++OD-;
(2)该温度下,c(D+)=mol·L-1=4×10-8mol·L-1,pD=-lg(4×10-8)=8-2lg2=7.4;
(3)由公式c(D+)·c(OD-)=KW,c(D+)=mol·L-1=1.6×10-13mol·L-1,pD=14-lg16=14-4lg2=12.8。
17. > 水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大 AB
解析:(1)由于若电解质的电离是个吸热的过程,因为此温度下的大于时的,说明此温度高于,故答案为:>;水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大;
(2)A.通入适量气体,与反应生成,抑制水的电离,A符合题意;
B.加入适量溶液,其电离出的抑制水的电离,符合题意;
C.升温促进水的电离,不合题意;
D.加入Na,Na与电离出的反应,促进了水的电离,不合题意;
故答案为:AB;
(3)纯水中,又有此温度下,所以,故答案为:。
18.(1)631.5
(2) 10-9 不变
(3)BD
(4)8
(5)>
解析:(1)设NO的化学键的键能为x,由焓变数值可知,946kJ·mol-1+497kJ·mol-1-2x=180.0kJ·mol-1,x=631.5.0kJ·mol-1。
(2)25℃时,pH=5的CH3COOH溶液中,水的电离受到抑制,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,故由水电离出的c(H+)=mol/L;往溶液中加入少量NaOH固体(不考虑温度变化),则溶液中 ,醋酸的电离常数只受温度影响,故不变。
(3)A. 加水稀释,溶液总体积变大则c(H+)变小,A错误;
B. ,加水稀释,醋酸根离子浓度减小,比值变大,B正确;
C. c(H+)·c(OH-)=Kw,温度不变,值不变,C错误;
D. ,加水稀释,氢离子浓度减小,比值变大,D正确。
故选BD。
(4)常温下,pH=9的氢氧化钠溶液浓度为10-5mol/L;pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,氢氧化钠溶液过量,设两者体积分别9v、11v,则混合液的氢氧根离子浓度为;则氢离子浓度,则pH=8。
(5)由图可知,分别加水稀释至1000mL,HX的pH值变化比醋酸的变化大,醋酸溶液酸性更强,对水的抑制更大,故稀释后,HX溶液中由水电离出来的c(H+)大于醋酸溶液中由水电离出来的c(H+)。
19.
解析:(1)由图可知,当时,,故。
(2)NaOH溶液中,故。
20.16×10-4 54.3%
【分析】根据滴定过程中Fe2+与MnO发生的反应,结合MnO2转化为MnO,MnO转化为MnO的反应,确定关系式,再结合反应消耗的Fe2+进行计算。
解析:(1)滴定过程中,Fe2+与MnO反应的离子方程式为MnO+5Fe2++8H+=Mn2++5Fe3++4H2O,有MnO~5Fe2+,滤液中MnO的物质的量为=4.16×10 4mol,故答案为:4.16×10 4;
(2)用过氧化钠处理MnO2得到MnO,溶液酸性条件下,MnO转化为MnO和MnO2的离子方程式为3MnO+4H+=2MnO+MnO2↓+2H2O;滴定过程中,Fe2+与MnO反应的离子方程式为MnO+5Fe2++8H+=Mn2++5Fe3++4H2O,可得关系式:3MnO2~3MnO~2MnO~10Fe2+,因此样品中所含MnO2的物质的量为=6.24×10 4mol,因此软锰矿样品中所含MnO2的质量分数为×100%=54.3%,故答案为:54.3%。
21.(1) 酸式滴定管 容量瓶
(2)B
(3)0.60
(4)锥形瓶中溶液颜色的变化
(5)最后一滴标准液加入后溶液由无色恰好变为浅红色,且在半分钟内不褪色,
(6) 第一组数据误差较大,舍弃 4.5
(7)DE
解析:滴定实验的步骤是:滴定前的准备:滴定管:查漏→洗涤→润洗→装液→调液面→记录,锥形瓶:注液体→记体积→加指示剂;滴定:眼睛注视锥形瓶溶液颜色变化;终点判断:记录数据;数据处理:通过数据进行计算;误差分析的原理:依据c(标准)·V(标准)=c(待测)·V(待测),所以c(待测)=,因为c(标准)与V(待测)已确定,所以只要分析出不正确操作引起V(标准)的变化,即可分析出结果。
(1)白醋的成分是CH3COOH,应该用酸式滴定管量取;容量瓶可以配制一定浓度的溶液,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用溶液滴定该醋酸溶液,滴定终点得到醋酸钠,醋酸钠为强碱弱酸盐,水溶液显碱性,酚酞的变色范围为8-10,故本实验可选的指示剂可以是酚酞,故选B;
(3)读数时,视线要与凹液面最低处保持水平,由滴定管数据可知,液体的体积为0.60mL;
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶中溶液颜色的变化,及时判断滴定终点;
(5)当达到滴定终点时,最后一滴标准液加入后溶液由无色恰好变为浅红色,且在半分钟内不褪色,停止滴定,并记录NaOH溶液的最终读数。
(6)①由表格中数据可知第一组数据误差较大,舍弃,消耗NaOH溶液的平均体积V=mL=15.00mL;
②设10mL白醋样品中含有CH3COOH质量为a,由CH3COOH~NaOH可知a==0.45g,因此100mL该样品中含有醋酸的质量为0.45g×=4.5g,即市售白醋总酸量=4.5g/100mL;
(7)A.碱式滴定管在滴定时用标准NaOH溶液润洗,未用NaOH标准溶液润洗,导致标准液用量增加,滴定结果偏大,A项错误;
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,使V(标准)偏大,导致溶液浓度偏高,B项错误;
C.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,溶液浓度不变,C项错误;
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量偏小,导致V(标准)偏小,溶液浓度偏低,D项正确;
E.滴定终点读数时采用俯视方法,使得导致V(标准)读数偏小,溶液浓度偏低,E项正确;
故选DE
一、选择题
1.下列实验操作不会引起误差的是
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
2.时,的酸()加蒸馏水稀释,随溶液的体积变化关系如图所示,下列说法错误的是
A.为一元弱酸
B.的中约有的发生了电离
C.升高温度,溶液的pH增大
D.该酸的电离平衡常数约为
3.下列仪器使用前不需检验是否漏水的有
A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶
4.25℃时,0.01mol/L醋酸的pH大约是( )
A.2 B.4 C.7 D.10
5.现有室温下四种溶液,下列有关叙述不正确的是
序号 ① ② ③ ④
pH 12 12 2 2
溶液 氨水 氢氧化钾溶液 醋酸 盐酸
A.④中加入适量的醋酸钠晶体后,溶液的pH增大
B.②和③两溶液等体积混合,所得溶液中
C.分别加水稀释100倍,四种溶液的pH:①>②>④>③
D.④与①溶液混合后,若混合后溶液pH=7,则
6.下列装置或操作能达到实验目的是
A B C D
中和热测定 测定生成速率 定容 高锰酸钾滴定草酸
A.A B.B C.C D.D
7.下列说法正确的是
A.向醋酸中加水,导电性一定减弱
B.压缩和的混合气体,颜色变深可以用勒夏特列原理来解释
C.进行中和滴定操作时,眼睛要始终注视滴定管内溶液液面的变化
D. ,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
8.关于下列各实验或装置的叙述中,不正确的是
A.①可用于测溶液pH
B.②是用酸性溶液滴定溶液
C.③是标准盐酸滴定待测氢氧化钠时手的操作
D.④是碱式滴定管排气泡的操作
9.下列实验设计和操作合理的是
A.用浓磷酸与碘化钠固体共热制备HI气体
B.用饱和碳酸钠溶液除去中混有的少量HCl气体
C.用乙醛作萃取剂萃取溴水中的溴
D.用NaOH标准液滴定未知浓度的醋酸溶液,可以选择甲基橙做指示剂
10.利用下列装置和试剂进行实验,能达到实验目的的是
A B C D
除去CO2中的SO2 实验室制氯气 测定盐酸浓度 制备并收集NH3
A.A B.B C.C D.D
11.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、NO、Cl- B.K+、Na+、Cl-、NO
C.K+、Na+、Cl-、AlO D.K+、NH、SO、NO
12.下列实验装置、原理或操作错误的是
A.制取 B.除去中的HCl
C.制取乙炔 D.量取10.50 mL 溶液
A.A B.B C.C D.D
13.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.高锰酸钾溶液中:、、、葡萄糖分子
B.使甲基橙试液显红色的溶液中:、、、
C.与反应能放出的溶液中:、、、
D.水电离的的溶液中:、、、
14.下列实验设计及其对应的离子方程式均正确的是
A.将氯气溶于水制备次氯酸:
B.硫酸型酸雨久置,pH减小:
C.用浓盐酸酸化的溶液与反应,证明具有还原性:
D.向溶液中滴加NaOH溶液至水的电离程度最大:
15.某药物中间体结构如图所示,其中W、R、X、Y、Z为1~20号元素且原子序数依次增大,其中X与Y同主族,Z和W的最外层电子数目相同,下列叙述错误的是
A.简单离子半径:X<Z<Y
B.W与Y形成的二元化合物能促进水的电离
C.该物质中R、X、Y、Z均满足最外层8电子构型
D.X分别与W、R、Y、Z元素均可以形成2种或以上的化合物
二、填空题
16.某温度下重水的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
(1)写出重水的电离方程式___________。
(2)该温度下,重水中的c(D+)=___________,pD=___________(已知lg2=0.3)。
(3)0.01mol·L-1的NaOD溶液pD=___________。
17.已知某温度下,水的离子积常数,请回答下列问题:
(1)此温度_______________(填“>”“<”或“=”),原因是_________________。
(2)对水进行下列操作,能抑制水的电离的是_______________(填标号,双选)。
A.通入适量气体 B.加入适量溶液
C.升温至 D.加入一小块Na
(3)此温度下纯水中的______________________。
18.请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1,N2(g)+O2(g)=2NO(g) H=+180.0kJ·mol-1,则相同条件下破坏1molNO的化学键需要吸收的能量为___________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的c(H+)=___________mol/L;往溶液中加入少量NaOH固体(不考虑温度变化),则溶液中___________(填“增大”、“减小”或“不变”)。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是___________。
A.c(H+) B. C.c(H+)·c(OH-) D.
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=___________。
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。稀释后,HX溶液中由水电离出来的c(H+)______(填“>”“<”或“=”)醋酸溶液中由水电离出来的c(H+)。
19.在某温度下的水溶液中,,,x与y的关系如图所示:
(1)该温度下,水的离子积为______。
(2)该温度下,NaOH溶液中为______。
20.某实验小组欲测定某软锰矿样品中,MnO2的质量分数。称取软锰矿样品0.1000g,对样品进行如下处理:
①用过氧化钠处理,得到MnO溶液;
②煮沸溶液,除去剩余的过氧化物;
③酸化溶液,MnO歧化为MnO和MnO2;
④滤去MnO2;
⑤用0.100mol L-1Fe2+标准溶液滴定滤液中MnO,共用去20.80mL。
计算:
(1)滤液中MnO的物质的量___mol。
(2)样品中MnO2的质量分数___(用百分数表示,保留1位小数)。
21.现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
I.实验步骤
(1)用_______(填仪器名称,下同)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL_______中定容,摇匀即得待测白醋溶液。
(2)若在室温下,用溶液滴定该醋酸溶液,本实验可选的指示剂可以是_______(填序号)。
A.甲基橙 B.酚酞 C.石蕊 D.百里酚酞(pH变色范围9.4-10.6)
(3)读取盛装溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为_______mL。
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察_______。
(5)当_______时,停止滴定,并记录NaOH溶液的最终读数。重复滴定3次。
II.实验记录
滴定次数 1 2 3 4
V(样品)/mL 20.00 20.00 20.00 20.00
V消耗(NaOH)/mL 15.95 15.00 15.05 14.95
III.数据处理与讨论
(6)甲同学在处理数据时计算得:平均消耗的溶液的体积:
①指出他的计算的不合理之处:_______。
②按正确数据处理,市售白醋总酸量为_______g/100mL (已知醋酸相对分子量为60)。
(7)在本实验的滴定过程中,下列操作会使实验结果偏低的是_______(填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体测出
E.滴定终点读数时采用俯视方法
【参考答案】
一、选择题
1.C
【分析】用公式c(待测)=分析误差,主要是对标准液所用体积的影响进行分析。
解析:A.锥形瓶用蒸馏水洗后,不能用待测润洗,否则待测液的物质的量增加,滴定时标准液所用体积增加,导致测定结果偏大,A项错误;
B.酸碱中和滴定时,滴定管水洗后,直接盛装标准液,标准液的浓度会稀释而降低,为达到终点将待测液反应完毕,滴定时标准液所用体积增加,导致测定结果偏大,故需要先用标准液润洗滴定管,然后再盛装标准溶液,B项错误;
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,由于反应产物为NaCl,滴定终点时溶液呈中性,因此指示剂即可选酚酞,也可以选甲基橙,C项正确;
D.滴定终点时酸式滴定管尖嘴部分有气泡,开始实验时无气泡,可以理解成滴定终点时气泡将使滴定管里的液面上升,标准液的体积减小,导致测定浓度偏低,D项错误;
答案选C。
【点睛】本题考查酸碱中和滴定误差的判断,根据公式c(待测)=进行中和滴定的误差分析是最基本的方法,使用中应注意由于操作的失误导致公式中的某些数据发生变化,从而导致最终结果出现误差。
2.C
解析:A.25℃,起点时,pH=3,,小于0.1mol/L,故HA不完全电离,是一元弱酸,A正确;
B.,其中,说明只存在的HA发生电离,,有的发生了电离,B正确;
C.电离是吸热反应,升高温度,促进电离正向移动,c(H+)增大,pH减小,C错误;
D.,,D正确;
故选:C。
3.A
解析:在高中阶段常见仪器需要检漏的有:分液漏斗、容量瓶、酸式滴定管和碱式滴定管,综上所述,A符合题意。
故选A。
4.B
解析:0.01mol/L醋酸溶液呈酸性,pH小于7;若醋酸为强酸,0.01mol/L醋酸溶液中c(H+)=0.01mol/L,pH=-lg c(H+)=2;事实上醋酸为弱酸,不能完全电离,但选酸性,故c(H+)<0.01mol/L,7>pH>2,故选B。
5.D
解析:A.④中加入适量的醋酸钠晶体后,醋酸根离子与氢离子结合产生醋酸分子,氢离子浓度减小,溶液的pH增大,选项A正确;
B.假设是强酸和强碱,且物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,,选项B正确;
C.分别加水稀释100倍,假设平衡不移动,那么①、②溶液的pH均为10,但稀释氨水使电离平衡右移,使①pH>10,同理醋酸稀释后pH<4,选项C正确;
D.假设是强酸和强碱,混合后溶液呈中性,,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要氨水的体积少,即,选项D错误;
答案选D。
6.D
解析:A.中和热的测定实验中缺少环形玻璃搅拌棒,故A错误;
B.使用长颈漏斗会使生成的氢气从长颈漏斗中逸出,应该使用分液漏斗,故B错误;
C.应该使用玻璃棒引流,故C错误;
D.高锰酸钾溶液具有氧化性,故使用酸式滴定管,故D正确;
故选D。
7.D
解析:A.向冰醋酸中加水,促进醋酸电离,开始时,醋酸电离程度大于溶液体积增大程度,溶液中c(CH3COO-)和c(H+)增大,溶液导电性增强,A错误;
B.压缩和的混合气体,颜色变深是因为体积缩小,NO2的浓度增大,不是因为平衡移动导致的,即不能用勒夏特列原理来解释,B错误;
C.进行中和滴定操作时,眼睛要始终注视锥形瓶内溶液颜色的变化,C错误;
D.该反应中,生成物有气体,体系混乱度增大,则,反应能自发进行,D正确;
故选D。
8.D
解析:A.用pH试纸测溶液的pH,可将pH试纸放于井穴板上,滴一滴待测试液于试纸上,将试纸显色的颜色和标准比色卡对照,即可测定溶液的pH,故A正确;
B.酸性高锰酸钾溶液放于酸式滴定管中,滴入锥形瓶中,和亚硫酸钠反应,故B正确;
C.标准盐酸滴定待测氢氧化钠时,将盐酸放在酸式滴定管中,NaOH溶液放在锥形瓶中,左手控制酸式滴定管的活塞,右手摇动锥形瓶,将盐酸滴入锥形瓶中,故C正确;
D.排碱式滴定管中的气泡时,把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,使溶液从尖嘴快速喷出,故D错误;
故选D。
9.A
解析:A.用浓磷酸与碘化钠固体共热时发生反应:3NaI+H3PO4=Na3PO4+3HI(气体),可以制备HI气体,故A正确;
B.也能和饱和碳酸钠溶液反应,不能用饱和碳酸钠溶液除去中混有的少量HCl气体,故B错误;
C.乙醛溶于水,且会和溴水反应,不能作萃取剂萃取溴水中的溴,故C错误;
D.醋酸为弱酸,滴定终点呈碱性,应用酚酞作指示剂,故D错误;
故选A。
10.A
解析:A.SO2具有还原性,能与酸性高锰酸钾反应,CO2不与酸性高锰酸钾反应,因此通过酸性高锰酸钾溶液洗气可除去CO2中的SO2,故A正确;
B.浓盐酸和二氧化锰反应制取氯气需要加热,故B错误;
C.NaOH与酸式滴定管的玻璃活塞反应生成硅酸钠,应用碱式滴定管盛装NaOH溶液,故C错误;
D.加热氯化铵分解生成氨气和氯化氢,生成的氨气和氯化氢在试管口又化合生成氯化铵,得不到氨气,故D错误;
答案选A。
11.B
【分析】若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,说明水的电离受到抑制,可能是酸性溶液也可能是碱性溶液;
解析:A.若为碱性溶液,含大量OH-,则与Al3+反应得到沉淀,A项不符合题意;
B.K+、Na+、Cl-、NO离子间不反应,且在酸性或者酸性条件下都能共存,B项符合题意;
C.若溶液为酸性,含大量H+,H+与AlO反应得到氢氧化铝沉淀,不共存,C项不符合题意;
D.若为碱性溶液,含大量OH-,则与NH反应得到一水合氨,不能共存,D项不符合题意;
故答案选B。
12.C
解析:A.可用70%的硫酸与亚硫酸钠发生复分解反应制取二氧化硫时,反应无需加热,A正确;
B.氯气难溶于饱和食盐水,氯化氢可溶解在饱和食盐水中,所以除去氯气中的氯化氢,可以用饱和食盐水,B正确;
C.电石与水直接反应时反应速率过快,不便于乙炔气体的收集,通常采用加饱和食盐水的方法来减缓反应速率,C错误;
D.碳酸钠溶液显碱性,所以量取10.50mL碳酸钠溶液应采用碱式滴定管,或移液管,D正确;
故选C。
13.B
解析:A.与氢离子会生成弱酸草酸分子,且草酸根离子和葡萄糖分子都有还原性,均可被酸性高锰酸钾溶液氧化,不能大量共存,A不符合题意;
B.使甲基橙试液显红色的溶液中存在大量氢离子,、、、不和H+反应,、、、相互间也不反应,能大量共存,B符合题意;
C.与Al反应能放出 H2的溶液中可存在大量氢离子,也可存在大量氢氧根离子,若存在氢离子,硝酸根离子在酸性条件下具有强氧化性,能氧化Fe2+,若存在氢氧根离子,则亚铁离子会与氢氧根离子反应生成沉淀而不能共存,C不符合题意;
D.水电离的 的溶液中可存在大量氢离子,也可存在大量氢氧根离子,若存在氢离子,、均会反应不能大量共存,D不符合题意;
故选B。
14.D
解析:A.次氯酸为弱酸,不能写成离子,氯气溶于水制备次氯酸的离子方程式为,故A错误;
B.由于亚硫酸被空气中氧气氧化成硫酸,导致酸雨久置pH变小,亚硫酸为弱酸,所以离子方程式为,故B错误;
C.浓盐酸中氯离子也能被酸性高锰酸钾溶液氧化,不能证明具有还原性,故C错误;
D.铵根离子的水解促进水的电离,硫酸氢根离子电离出的氢离子抑制水的电离,所以水的电离程度最大时溶液中的溶质为,离子方程式为,故D正确;
故选D。
15.B
【分析】W、R、X、Y、Z为1~20号元素且原子序数依次增大,X与Y最外层电子数目相同,Z和W的最外层电子数目相同,由化合物中阴阳离子的结构可知,W、R、X、Y、Z分别为H元素、C元素、O元素、S元素、K元素。
解析:A.电子层数越小,离子的离子半径越小,则氧离子的离子半径最小,电子层数相同的离子,核电荷数越大,离子半径越小,则硫离子的离子半径大于钾离子,所以三种离子的离子半径大小顺序为O2-<K+<S2-,选项A正确;
B.W与Y形成的二元化合物硫化氢,硫化氢是二元弱酸,在溶液中分步电离出的氢离子抑制水的电离,故B错误;
C.由化合物中阴阳离子的结构可知,C、O、S、K四种元素均满足最外层8电子构型,故C正确;
D.氧元素与氢元素可以形成水、过氧化氢,与碳元素可以形成一氧化碳、二氧化碳,与硫元素可以形成二氧化硫、三氧化硫,与钾元素可以形成氧化钾、过氧化钾、超氧化钾,形成的化合物均为2种或以上,故D正确;
故选B。
二、填空题
16.(1)D2OD++OD-
(2) 4×10-8mol·L-1 7.4
(3)12.8
解析:(1)根据水的电离方程式可知,重水电离方程式为D2OD++OD-;
(2)该温度下,c(D+)=mol·L-1=4×10-8mol·L-1,pD=-lg(4×10-8)=8-2lg2=7.4;
(3)由公式c(D+)·c(OD-)=KW,c(D+)=mol·L-1=1.6×10-13mol·L-1,pD=14-lg16=14-4lg2=12.8。
17. > 水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大 AB
解析:(1)由于若电解质的电离是个吸热的过程,因为此温度下的大于时的,说明此温度高于,故答案为:>;水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大;
(2)A.通入适量气体,与反应生成,抑制水的电离,A符合题意;
B.加入适量溶液,其电离出的抑制水的电离,符合题意;
C.升温促进水的电离,不合题意;
D.加入Na,Na与电离出的反应,促进了水的电离,不合题意;
故答案为:AB;
(3)纯水中,又有此温度下,所以,故答案为:。
18.(1)631.5
(2) 10-9 不变
(3)BD
(4)8
(5)>
解析:(1)设NO的化学键的键能为x,由焓变数值可知,946kJ·mol-1+497kJ·mol-1-2x=180.0kJ·mol-1,x=631.5.0kJ·mol-1。
(2)25℃时,pH=5的CH3COOH溶液中,水的电离受到抑制,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,故由水电离出的c(H+)=mol/L;往溶液中加入少量NaOH固体(不考虑温度变化),则溶液中 ,醋酸的电离常数只受温度影响,故不变。
(3)A. 加水稀释,溶液总体积变大则c(H+)变小,A错误;
B. ,加水稀释,醋酸根离子浓度减小,比值变大,B正确;
C. c(H+)·c(OH-)=Kw,温度不变,值不变,C错误;
D. ,加水稀释,氢离子浓度减小,比值变大,D正确。
故选BD。
(4)常温下,pH=9的氢氧化钠溶液浓度为10-5mol/L;pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,氢氧化钠溶液过量,设两者体积分别9v、11v,则混合液的氢氧根离子浓度为;则氢离子浓度,则pH=8。
(5)由图可知,分别加水稀释至1000mL,HX的pH值变化比醋酸的变化大,醋酸溶液酸性更强,对水的抑制更大,故稀释后,HX溶液中由水电离出来的c(H+)大于醋酸溶液中由水电离出来的c(H+)。
19.
解析:(1)由图可知,当时,,故。
(2)NaOH溶液中,故。
20.16×10-4 54.3%
【分析】根据滴定过程中Fe2+与MnO发生的反应,结合MnO2转化为MnO,MnO转化为MnO的反应,确定关系式,再结合反应消耗的Fe2+进行计算。
解析:(1)滴定过程中,Fe2+与MnO反应的离子方程式为MnO+5Fe2++8H+=Mn2++5Fe3++4H2O,有MnO~5Fe2+,滤液中MnO的物质的量为=4.16×10 4mol,故答案为:4.16×10 4;
(2)用过氧化钠处理MnO2得到MnO,溶液酸性条件下,MnO转化为MnO和MnO2的离子方程式为3MnO+4H+=2MnO+MnO2↓+2H2O;滴定过程中,Fe2+与MnO反应的离子方程式为MnO+5Fe2++8H+=Mn2++5Fe3++4H2O,可得关系式:3MnO2~3MnO~2MnO~10Fe2+,因此样品中所含MnO2的物质的量为=6.24×10 4mol,因此软锰矿样品中所含MnO2的质量分数为×100%=54.3%,故答案为:54.3%。
21.(1) 酸式滴定管 容量瓶
(2)B
(3)0.60
(4)锥形瓶中溶液颜色的变化
(5)最后一滴标准液加入后溶液由无色恰好变为浅红色,且在半分钟内不褪色,
(6) 第一组数据误差较大,舍弃 4.5
(7)DE
解析:滴定实验的步骤是:滴定前的准备:滴定管:查漏→洗涤→润洗→装液→调液面→记录,锥形瓶:注液体→记体积→加指示剂;滴定:眼睛注视锥形瓶溶液颜色变化;终点判断:记录数据;数据处理:通过数据进行计算;误差分析的原理:依据c(标准)·V(标准)=c(待测)·V(待测),所以c(待测)=,因为c(标准)与V(待测)已确定,所以只要分析出不正确操作引起V(标准)的变化,即可分析出结果。
(1)白醋的成分是CH3COOH,应该用酸式滴定管量取;容量瓶可以配制一定浓度的溶液,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用溶液滴定该醋酸溶液,滴定终点得到醋酸钠,醋酸钠为强碱弱酸盐,水溶液显碱性,酚酞的变色范围为8-10,故本实验可选的指示剂可以是酚酞,故选B;
(3)读数时,视线要与凹液面最低处保持水平,由滴定管数据可知,液体的体积为0.60mL;
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶中溶液颜色的变化,及时判断滴定终点;
(5)当达到滴定终点时,最后一滴标准液加入后溶液由无色恰好变为浅红色,且在半分钟内不褪色,停止滴定,并记录NaOH溶液的最终读数。
(6)①由表格中数据可知第一组数据误差较大,舍弃,消耗NaOH溶液的平均体积V=mL=15.00mL;
②设10mL白醋样品中含有CH3COOH质量为a,由CH3COOH~NaOH可知a==0.45g,因此100mL该样品中含有醋酸的质量为0.45g×=4.5g,即市售白醋总酸量=4.5g/100mL;
(7)A.碱式滴定管在滴定时用标准NaOH溶液润洗,未用NaOH标准溶液润洗,导致标准液用量增加,滴定结果偏大,A项错误;
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,使V(标准)偏大,导致溶液浓度偏高,B项错误;
C.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,溶液浓度不变,C项错误;
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量偏小,导致V(标准)偏小,溶液浓度偏低,D项正确;
E.滴定终点读数时采用俯视方法,使得导致V(标准)读数偏小,溶液浓度偏低,E项正确;
故选DE
