第四章 物质结构元素周期律 测试题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律 测试题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 438.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 08:42:13 | ||
图片预览



文档简介
第四章 物质结构元素周期律 测试题
一、选择题
1.下列说法不正确的是
A.侯德榜发明联合制碱法,为我国化学工业发展作出重要贡献
B.我国化学家徐光宪院士在稀土元素的分离及应用中作出了重要贡献
C.英国科学家道尔顿提出分子是构成物质的基本粒子,是不可再分的实心球,为近代化学的发展奠定了坚实的基础
D.俄国化学家门捷列夫发现了元素周期律,使化学的研究变得有规律可循
2.下列对离子化合物的叙述不正确的是
①离子化合物一定是含有离子键的化合物 ②离子化合物一定是由金属元素和非金属元素构成 ③共价化合物可能含有离子键 ④离子化合物中可能含有共价键,也可能不含共价键
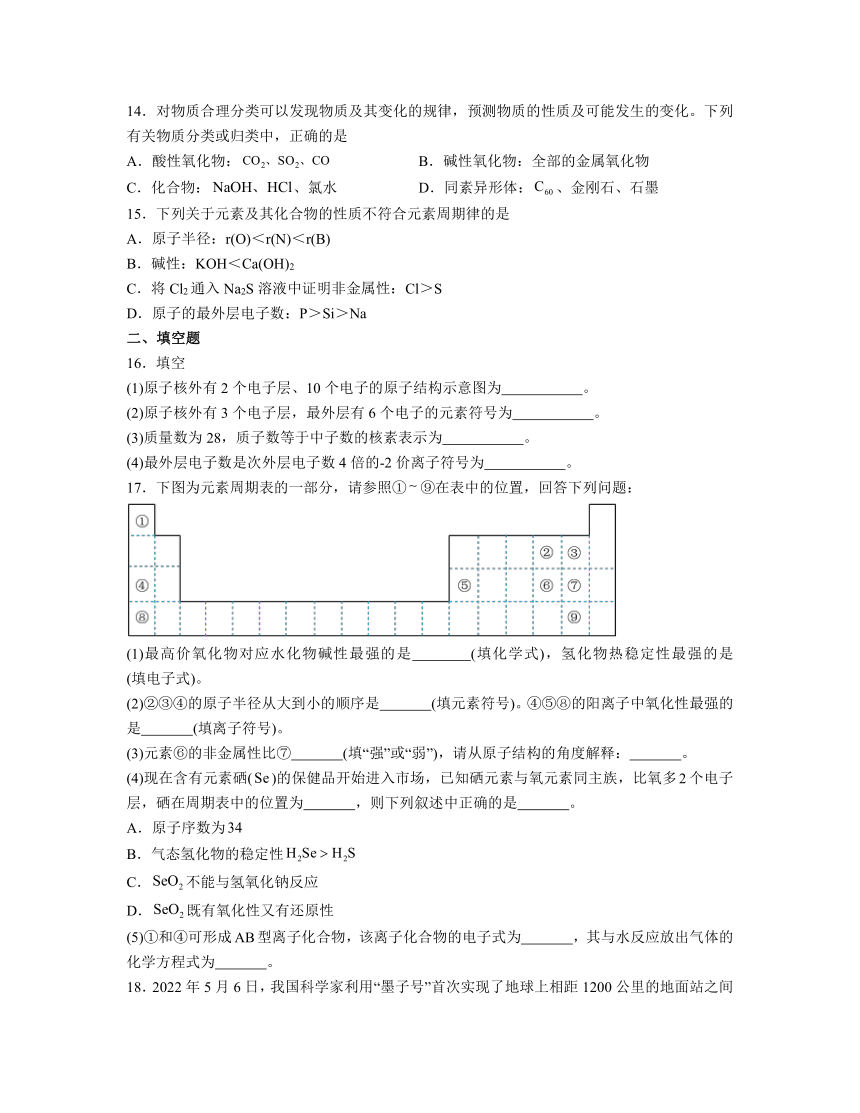
A.①② B.②③ C.①③ D.②④
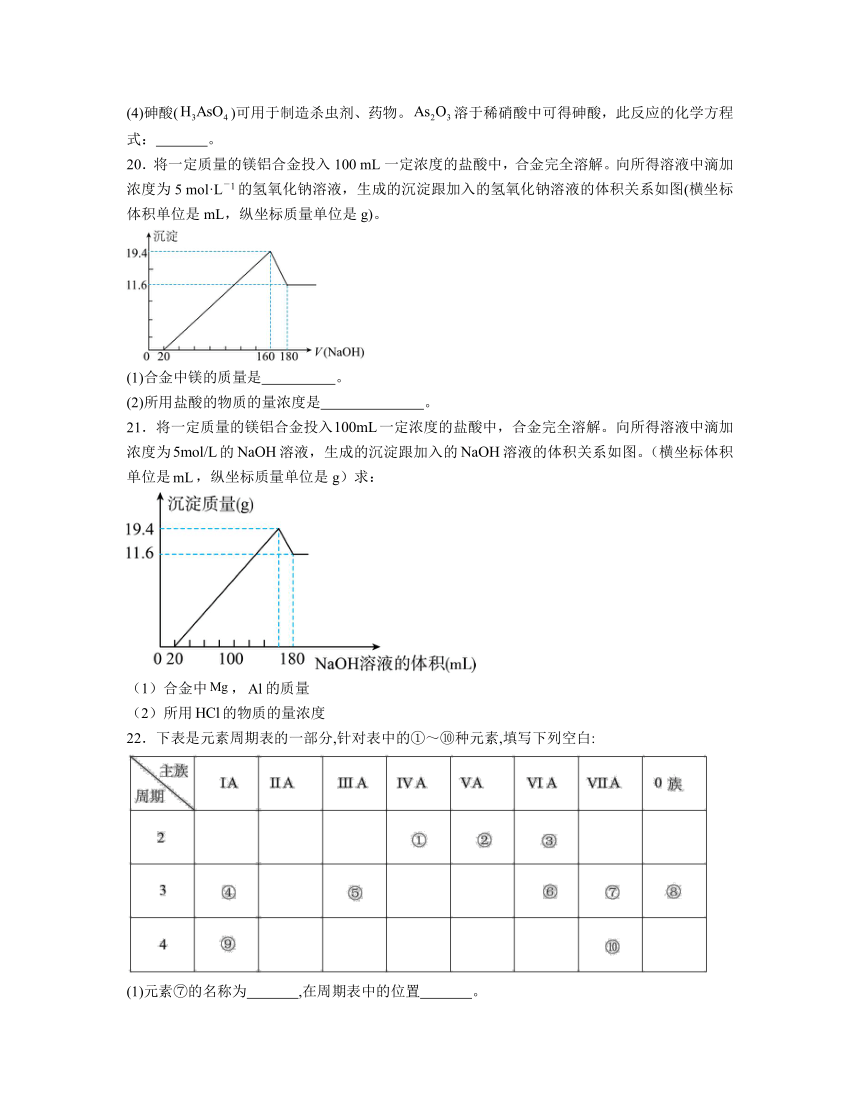
3.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 + 2KNO3= K2O+5Na2O + 16N2↑。下列相关说法正确的是
A.氧离子结构示意图:
B.中子数为20的钾原子:
C.N2分子的结构式:N=N
D.NaN3仅含离子键
4.据报道,我国科学家找到了水稻突变体“耐砷()富硒()”开关,这对提高水稻营养价值降低砷的毒性意义重大。下列说法正确的是
A.砷与硫属于同族元素 B.砷的简单氢化物为
C.简单氢化物的稳定性:As5.同种元素的不同微粒,一定具有相同的
A.质量数 B.质子数 C.中子数 D.电子数
6.下列离子方程式正确的是
A.FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O
C.Al(OH)3与NaOH溶液反应:OH-+Al(OH)3=2H2O+AlO
D.氯气溶于水:Cl2+H2OCl-+ClO-+2H+
7.下列各项说法正确且能证明F比O的非金属性强的是
A.H2O的稳定性比HF强 B.共用电子对偏向:H-FC.H2O的沸点比HF的高 D.OF2中O是+2价,F是-1价
8.同温同压下,关于D37Cl和T35Cl两种气体,下列说法正确的是
A.物理性质相同 B.化学性质不同
C.气体密度相同 D.摩尔体积相同
9.为阿伏加德罗常数的值,下列说法正确的是
A.100gCaS与的混合物中含有32g硫元素,则氧元素的质量为28g
B.标准状况下,11.2LHF中含有H—F键的数目为
C.晶体中含有的共价键数目为
D.与浓盐酸充分反应,转移的电子数目为
10.下列物质中不存在非极性共价键的是
A.氮气 B.双氧水 C.Na2S2O3 D. (甲酸)
11.下列物质属于离子化合物且含有共价键的是
A. B. C. D.
12.由下列事实进行归纳推测,推测不合理的是
选项 事实 推测
A Mg与水反应缓慢,Ca与水反应较快 Ba与水反应会更快
B Si和Ge都是半导体材料 第IVA族元素的单质都可作半导体
C Al与Cl形成共价键,Mg与Cl形成离子键 Na和Cl形成离子键
D HCl在1500℃时分解,HI在300℃时分解HBr的分解 温度介于二者之间
A.A B.B C.C D.D
13.稀有金属铟由于其良好的性能常用于生产液晶显示器和平板屏幕,如图是铟元素的相关信息,下列说法中不正确的是
A.铟元素的原子序数是49 B.铟元素的相对原子质量是114.8
C.、互为同素异形体 D.原子最外层有3个电子
14.对物质合理分类可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。下列有关物质分类或归类中,正确的是
A.酸性氧化物: B.碱性氧化物:全部的金属氧化物
C.化合物:、氯水 D.同素异形体:、金刚石、石墨
15.下列关于元素及其化合物的性质不符合元素周期律的是
A.原子半径:r(O)<r(N)<r(B)
B.碱性:KOH<Ca(OH)2
C.将Cl2通入Na2S溶液中证明非金属性:Cl>S
D.原子的最外层电子数:P>Si>Na
二、填空题
16.填空
(1)原子核外有2个电子层、10个电子的原子结构示意图为 。
(2)原子核外有3个电子层,最外层有6个电子的元素符号为 。
(3)质量数为28,质子数等于中子数的核素表示为 。
(4)最外层电子数是次外层电子数4倍的-2价离子符号为 。
17.下图为元素周期表的一部分,请参照①⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是 (填化学式),氢化物热稳定性最强的是 (填电子式)。
(2)②③④的原子半径从大到小的顺序是 (填元素符号)。④⑤⑧的阳离子中氧化性最强的是 (填离子符号)。
(3)元素⑥的非金属性比⑦ (填“强”或“弱”),请从原子结构的角度解释: 。
(4)现在含有元素硒()的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多个电子层,硒在周期表中的位置为 ,则下列叙述中正确的是 。
A.原子序数为
B.气态氢化物的稳定性
C.不能与氢氧化钠反应
D.既有氧化性又有还原性
(5)①和④可形成型离子化合物,该离子化合物的电子式为 ,其与水反应放出气体的化学方程式为 。
18.2022年5月6日,我国科学家利用“墨子号”首次实现了地球上相距1200公里的地面站之间的量子态远程传输。化学助力我国科技发展,借助元素周期表可以认识各种材料的结构与性质,元素a~h是元素周期表中短周期元素,其相对位置如下表所示:
请回答下列问题:
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为 (填化学式)。
(2)元素b的一种单质是“墨子号”的储能器件,b在元素周期表中的位置是 。
(3)“墨子号”的制作使用了2000多吨的e合金,e的简单离子结构示意图为 ,请写出e的氧化物与d的最高价氧化物对应水化物反应的离子方程式: 。
(4)c与f的化合物是“墨子号”实现远程传输的核心材料,该化合物属于 (填“离子”或“共价”)化合物。
(5)利用元素d与g所研发的电池具有充放电效率高、循环寿命长等优点,现已广泛应用于各科技领域,请写出d与g所形成的简单化合物的电子式: 。元素g与元素h所形成的简单氢化物的稳定性大小:g (填“>”“<”或“=”)h。
19.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图,汞在第 周期。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是 。
a.硒元素的最低负化合价为-2
b.二氧化硒()具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是,它的中子数为 。
②已知与的性质相似,则对性质的推测不正确的是 (填序号)。
a.含有离子键和共价键
b.能与溶液反应
c.与加热充分分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法不正确的是 (填字母)。
a.热稳定性: b.酸性:
c.的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
(4)砷酸()可用于制造杀虫剂、药物。溶于稀硝酸中可得砷酸,此反应的化学方程式: 。
20.将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
(1)合金中镁的质量是 。
(2)所用盐酸的物质的量浓度是 。
21.将一定质量的镁铝合金投入一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为的溶液,生成的沉淀跟加入的溶液的体积关系如图。(横坐标体积单位是,纵坐标质量单位是g)求:
(1)合金中,的质量
(2)所用的物质的量浓度
22.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑦的名称为 ,在周期表中的位置 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合 物的电子式是 。
(3)用电子式表示元素④和⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(4)写出一种由元素③和④组成的既有离子键又有共价键的物质的电子式 。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是 (用离子符号表 示)
23.利用如图装置可验证同主族元素非金属性的变化规律。
(1)仪器A的名称为 ,干燥管 D 的作用为 。
(2)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B 中装有固体,则 A中试剂为 ,观察到 C 中溶液 (填现象),即 可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶 液吸收尾气。
(3)若要证明非金属性:C>Si,则在 A中加盐酸、B 中加、C 中加溶液。观察到 C 中溶液 (填现象),即可证明。但有的同学认 为盐酸具有挥发性,HCl可进入 C 中干扰实验,应在两装置间添加装有 溶液的洗气瓶除去。
【参考答案】
一、选择题
1.C
解析:A.我国化学家侯德榜改进了制碱工艺,发明了联合制碱法,为化学工业做出了重大贡献,故A正确;
B.我国化学家徐光宪院士在稀土元素的分离及应用中作出了重要贡献,促进了我国稀土工业的发展,故B正确;
C.19世纪初,英国化学家道尔顿提出近代原子学说,认为原子是不可再分的实心球体,故C错误;
D.俄国化学家门捷列夫发现了元素周期律,使化学的研究变得有规律可循,故D正确;
故选C。
2.B
解析:①含有离子键的化合物属于离子化合物,则离子化合物一定是含有离子键的化合物,①正确;
②离子化合物中不一定含有金属元素,也可能含有,②不正确;
③共价化合物只含有共价键,一定不含有离子键,③不正确;
④离子化合物中一定含有离子键,可能含有共价键,也可能不含共价键,如NaCl中只含离子键,NaOH中既含离子键、又含共价键,④正确;
通过以上分析可知,②③不正确,故选B。
3.B
解析:A.氧离子的核电荷数为8,其结构示意图为 ,A项错误;
B.中子数为20的K原子的质量数为39,B项正确;
C.N2分子的结构式为N≡N,C项错误;
D.NaN3由Na+和构成,所以NaN3中既有离子键又有共价键,D项错误;
故选B。
4.C
解析:A.由题干信息可知,砷是33号元素,其核外最外层上有5个电子,即其位于第VA族,而S位于第ⅥA族,故砷与硫不属于同族元素,A错误;
B.由题干信息可知,砷是33号元素,其核外最外层上有5个电子,则砷的最高正价为+5价,则其最低负价为-3价,即砷的简单氢化物为AsH3,B错误;
C.已知As与Se位于同一周期且位于Se的左侧,故非金属性As<Se,故简单氢化物的稳定性:AsD.已知As与Se位于同一周期且位于Se的左侧,故非金属性As<Se,故其元素最高价氧化物水化物的酸性:As故答案为:C。
5.B
解析:A.同种元素的不同微粒,质量数可能不同,如质量数不同,故不选A;
B.元素是具有相同质子数的一类原子的总称,同种元素的不同微粒,质子数一定相等,故选B;
C.不同同位素原子的中子数不同,如的中子数不相等,故不选C;
D.同种元素的不同微粒,电子数可能不同,Na的电子数为11、Na+的电子数为10,故不选D;
故选B。
6.C
解析:A.溶液中通入足量,也会被氧化,正确的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故A错误;
B.将氧气通入酸性碘化钾溶液中,得失电子不守恒,正确的离子方程式为:,故B错误;
C.与NaOH溶液反应:,故C正确;
D.HClO是弱酸,则氯气溶于水:,故D错误;
综上所述,答案为C。
7.D
解析:A.非金属性越强简单氢化物越稳定,非金属性F>O,则H2O的稳定性应比HF弱,A不符合题意;
B.F的非金属性大于O,则F吸引电子能力更强,所以共用电子对偏向:H-F>H-O,B不符合题意;
C.虽然H2O的沸点比HF的高,但熔沸点与非金属性强弱无关,C不符合题意;
D.OF2中O是+2价,F是-1价,说明F吸引电子能力强于O,即F比O的非金属性强,D符合题意;
综上所述答案为D。
8.D
解析:A.D37Cl和T35Cl的相对分子质量不同,物理性质不同,A错误;
B.D37Cl和T35Cl都是氯化氢,其化学性质相同,B错误;
C.D37Cl和T35Cl的相对分子质量不同,同温同压下相同体积的两种气体质量不同,气体密度不同,C错误;
D.同温同压下,这两种气体的摩尔体积相同,D正确;
故答案选D。
9.A
解析:A.CaS与的混合物中,Ca与S的个数比为1∶1,100g混合物中含有32g硫元素,则必含40g钙元素,则氧元素的质量,A正确;
B.标准状况下,HF呈液态,故不能用气体摩尔体积去计算,B错误;
C.NH4F晶体中N和H之间以N—H共价键相连,故晶体中含有的共价键数目为,C错误;
D.制取氯气的反应中,随着反应的进行,浓盐酸的浓度逐渐降低,变成了稀盐酸,稀盐酸与不反应,反应结束后,也有剩余,故与浓盐酸充分反应,转移的电子数目小于,D错误。
故选A。
10.D
解析:A.氮气分子中含有键,存在非极性共价键,A不符合题意;
B.H2O2结构式为H-O-O-H,存在O-O非极性共价键,B不符合题意;
C.Na2S2O3结构式为,存在S=S非极性共价键,C不符合题意;
D.HCOOH结构式为,不存在非极性共价键,D符合题意;
故选D。
11.C
解析:A.属于离子化合物,Na+和O2-间只含有离子键,A项不符合题意;
B.只含有共价键,属于共价化合物,B项不符合题意;
C.属于离子化合物,间形成离子键、中含有共价键,C项符合题意;
D.只含有共价键,属于共价化合物,D项不符合题意;
故选:C。
12.B
解析:A.Mg、Ca、Ba为同主族元素,同主族元素从上到下金属性逐渐增强,Ba的金属性强于Ca,Ba与水反应会更快,A正确;
B.并不是第ⅣA族元素的单质都可用作半导体,比如C单质就不能用作半导体,B错误;
C.Al、Mg、Na金属性逐渐增强,越容易与非金属元素结合形成离子键,则Na与Cl形成离子键,C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br>I,则HBr分解的温度介于300-1500℃之间,D正确;
故答案选B。
13.C
解析:A.根据元素周期表元素信息可知,铟元素的原子序数是49,A正确;
B.根据元素周期表元素信息可知,铟元素的相对原子质量是114.8,B正确;
C.、的质子数相同,中子数不同,两者互为同位素,C错误;
D.铟元素的原子序数是49,则核外电子排布为,原子最外层有3个电子,D正确;
故选C。
14.D
解析:A.CO为不成盐氧化物,不属于酸性氧化物,A错误;
B.并不是所有的金属氧化物都是碱性氧化物,如氧化铝为两性氧化物,Mn2O7属于酸性氧化物,B错误;
C.氯水为氯气的水溶液,属于混合物,C错误;
D.、金刚石、石墨属于碳元素的不同单质,互为同素异形体,D正确;
故选D。
15.B
解析:A.同一周期主族元素,从左到右,原子半径逐渐减小,所以原子半径:r(O)<r(N)<r(B),故A正确;
B.同周期自左向右金属性逐渐减弱,最高价氧化物对应水化物碱性逐渐减弱,则碱性:KOH>Ca(OH)2,故B错误;
C.同一周期主族元素,从左到右,非金属性增强,原子得电子能力增强,氯气能置换出硫化钠中的硫,说明非金属性:Cl>S,故C正确;
D.同一周期主族元素,原子的最外层电子数逐渐增多,原子的最外层电子数:P>Si>Na,故D正确。
答案选B。
二、填空题
16.(1) (2)S (3) (4)O2-
解析:(1)原子核外有2个电子层、10个电子的原子为Ne,其原子结构示意图为:;
(2)原子核外有3个电子层,最外层有6个电子的元素为S,元素符号为S;
(3)质子数+中子数=质量数,质量数为28且质子数等于中子数,则其质子数为14,元素符号为Si,其核素表示为;
(4)最外层电子数是次外层电子数4倍的-2价离子,说明该原子含有两层,且最外层电子数为6,即该元素为O,-2价离子符号为:O2-。
17.(1) KOH
(2)
(3)弱 和位于同一周期,从左到右原子半径减小,得电子能力逐渐增强,所以的非金属性比弱
(4) VIA AD
(5)
解析:(1)同一周期从左至右,元素的金属性逐渐减弱,非金属性逐渐增强,同一主族从上至下,元素的金属性逐渐增强,非金属性逐渐减弱,元素的金属性越强,其最高价氧化物对应水化物碱性越强,因此上述序号元素中金属性最强的是⑧,即K元素,对应的碱为KOH;元素的非金属性越强,其简单氢化物的稳定性越强,因此上述序号元素中非金属性最强的是③,即F元素,对应的氢化物为HF,其电子式为。
(2)原子核外电子层数越多,原子半径越大,电子层数相同时,质子数越大,原子半径越小,因此原子半径:;金属单质的活动性越强,其对应离子的氧化性越弱,因此氧化性:。
(3)和位于同一周期,从左到右原子半径减小,得电子能力逐渐增强,所以的非金属性比弱。
(4)O原子核外有2个电子层,O元素位于VIA 族,Se原子核外比O原子多2个电子层,因此Se元素位于元素周期表中第四周期VIA族;
A.Se原子核外电子层填充数目依次为2、8、18、6,因此Se原子序数为2+8+18+6=34,故A正确;
B.S与Se位于同一主族,原子序数Se>S,因此非金属性S>Se,气态氢化物的稳定性:H2S>H2Se,故B错误;
C.Se元素位于金属元素与非金属元素的分界线附近,因此SeO2具有两性,即SeO2能与酸和碱发生反应,故C错误;
D.Se元素的最高化合价为+6,SeO2中Se元素化合价为+4,即SeO2中Se元素化合价处于中间价态,因此SeO2既有氧化性又有还原性,故D正确;
综上所述,答案为:VIA;AD。
(5)①为H,④为Na,二者形成的NaH为离子化合物,其电子式为;NaH中H元素为-1价,能与水发生归中反应生成H2,反应化学方程式为。
18.(1)H2O
(2)第二周期ⅣA族
(3)
(4)共价
(5) <
【分析】根据元素在周期表中的位置,a是H元素、b是C元素、c是O元素、d是Na元素、e是Al元素、f是Si元素、g是S元素、h是Cl元素。
解析:(1)氢气的单质常用作火箭推进剂,氢气燃烧生成水,对应的产物为H2O。
(2)b是C元素,在元素周期表中的位置是第二周期ⅣA族。
(3)Al3+核外有10个电子,结构示意图为,Al2O3与NaOH反应生成偏铝酸钠和水,反应的离子方程式为 。
(4)O与Si形成的化合物SiO2属于共价化合物。
(5)Na与S所形成的简单化合物是Na2S,电子式为。同周期元素从左到右非金属性增强,元素S与元素Cl所形成的简单氢化物的稳定性大小H2S19.(1)六
(2)c
(3) 42 c c
(4)
解析:(1)原子的电子层数=周期序数,Hg原子有6个电子层,故位于元素周期表第六周期。
(2)a. 硒(Se)与硫位于同一主族,最外层均有6个电子,且均为非金属元素,最低价均为-2价,a正确;
b. 硒(Se)的最高价为+6价,最低价为-2价,SeO2中Se的化合价为+4价,处于中间价态,既有氧化性又有还原性,b正确;
c. 硒的氧化物对应的水化物有H2SeO3和H2SeO4,属于酸,Se的非金属性弱于硫,因此酸性大小关系为:H2SO3>H2SeO3,H2SO4>H2SeO4,即H2SeO3和H2SeO4均为弱酸,c错误;
故选c;
(3)①砷为第33号元素,质子数为33,中子数为75-33=42。
②a.NH4I是离子化合物,PH4I与之性质相似,因此也属于离子化合物,与之间存在离子键,内P与H之间存在共价键,a正确;
b.NH4I能与NaOH反应生成NH3,因此PH4I也能与NaOH反应,b正确;
c.PH4I加热分解生成PH3和HI,HI不稳定,加热时也分解,生成H2和I2,因此与NH4Cl加热分解产物种类不一样,c错误;
故选c。
③a.非金属性越强,氢化物稳定性越强,N的非金属性比P强,因此稳定性大小关系为NH3>PH3,a正确;
b.非金属性越强,最高价氧化物水化物酸性越强,N的非金属性比As强,因此酸性强弱关系为HNO3>H 3AsO4,b正确;
c.As为非金属元素,其氧化物的水化物属于酸,c错误;
d.第VA族元素随原子序数增大,其简单离子电子层数依次增多,离子半径依次增大,d正确;
故选c。
(4)As2O3中As化合价为+3价,H2AsO4中As化合价为+5价,因此As2O3与稀HNO3发生氧化还原反应,反应的化学方程式为:。
20.8 g 8 mol·L-1
【分析】在合金中,Mg与HCl反应生成MgCl2,MgCl2与NaOH反应转化为Mg(OH)2,由图象中11.6g为Mg(OH)2的质量,可求出合金中镁的质量。在图象的0点,溶液的成分为MgCl2、AlCl3、HCl,在沉淀的最高点,溶液中只有NaCl,由NaOH的体积,结合其物质的量浓度,可求出HCl的物质的量,从而求出其物质的量浓度。
解析:(1)由图象可知,氢氧化镁的质量为11.6 g,根据镁元素守恒:
合金中镁的质量=11.6 g÷58 g·mol-1×24 g·mol-1=4.8 g。答案为:4.8 g;
(2)当沉淀的量最大时,溶液中溶质为氯化钠,
盐酸的物质的量浓度=0.16 L×5 mol·L-1÷0.1 L=8 mol·L-1。答案为:8 mol·L-1。
21.8g ;
【分析】由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、AI后,盐酸有剩余,此时发生的反应为: HCl+ NaOH= NaCl+ H2O ;继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为: Al (OH)3+ NaOH=NaAlO2+2H2O ,据此分析作答;
解析:(1 )由上述分析可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160 mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,该阶段消耗氢氧化钠140 mL ,由氢氧根守恒可知: 3n[Al (OH)3]+2n[Mg (OH) 2]=n ( NaOH)= ( 0.16L-0.02L ) 5 mol/L=0.7 mol ;从加入氢氧化钠溶液160mL ~ 180mL溶解氢氧化铝,该阶段发生反应: Al (OH)3+ NaOH=NaAlO2+2H2O,所以n[Al (OH)3]= ( 0.18L-0.16L ) 5mol/L=0.1 mol,由元素守恒规律可知n (Al) =n[Al (OH)3]= 0.1 mol,故Al的质量为:0.1mol 27g/mol= 2.7g;同理可求出n[Mg (OH) 2]=0.2mol ,由元素守恒可知n (Mg) =n[Mg (OH) 2]=0.2mol ,所以Mg的质量为: 0.2mol 24g/mol= 4.8g,故答案为4.8g、2.7g;
(2)沉淀量最大,溶液为氯化钠溶液,根据钠元素守恒可知,此时溶液中n ( NaCl) =n ( NaOH) =0.16L5mol/L=0.8mol ,根据氯离子守恒:n( HCl) =n( NaCl ) =0.mol ,故盐酸的物质的量浓度为: =8mol/L,故答案为。
22.氯 第三周期第ⅦA族 HClO4 离子 S2->Cl->K+
【分析】由元素在周期表中的位置可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,以此答题。
解析:(1)由题可知元素⑦处于周期表中第三周期第ⅦA族,是氯元素,故答案为:氯、第三周期第ⅦA族。
(2)由分析可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,即最高价氧化物的水化物中,酸性最强的化合物是HClO4,其中元素K的金属性最强,KOH的碱性最强,其电子式为,故答案为: HClO4;。
(3)元素④为Na,⑥为S,即元素④和⑥形成的化合物为Na2S,属于离子化合物,用电子式表示其形成过程为:,故答案为:;离子。
(4)由分析可知,③为O、④为Na,即由元素③和④组成的既有离子键又有共价键的物质是Na2O2,故电子式为:;
(5) ⑥、⑦、⑨三种元素分别S、C1、K,即形成的离子分别为:S2-、Cl-、K+,三者电子层结构相同,核电荷数越大离子半径越小,故离子半径由大到小的顺序:S2->Cl->K+。
23. 分液漏斗 防止倒吸 浓盐酸 变蓝 NaOH溶液 产生白色沉淀
解析:(1)仪器A的名称为:分液漏斗,D的作用是防止倒吸,故答案为:分液漏斗;防止倒吸;
(2)A中浓盐酸和B中KMnO4反应产生Cl2,Cl2和C中的KI反应置换出I2,I2遇淀粉变蓝,即C中变蓝,本实验说明Cl2的氧化性强于I2,那么Cl的非金属性强于I。本实验涉及的Cl2有毒,反应不完全排放到空气中会污染空气,因此缺少一个尾气处理装置,可用NaOH溶液吸收尾气,故答案为:浓盐酸;变蓝;NaOH溶液;
(3)A中的盐酸和B中的CaCO3反应产生CO2,CO2与C中Na2SiO3溶液反应产生白色沉淀H2SiO3,说明H2CO3的酸性强于H2SiO3,那么C的非金属性强于Si。但是本实验存在一个缺陷:浓HCl易挥发,HCl可进入C中和Na2SiO3反应产生白色沉淀H2SiO3干扰实验,故应在两装置之间添加一个除HCl的装置,可用饱和NaHCO3溶液,故答案为:产生白色沉淀;NaHCO3
一、选择题
1.下列说法不正确的是
A.侯德榜发明联合制碱法,为我国化学工业发展作出重要贡献
B.我国化学家徐光宪院士在稀土元素的分离及应用中作出了重要贡献
C.英国科学家道尔顿提出分子是构成物质的基本粒子,是不可再分的实心球,为近代化学的发展奠定了坚实的基础
D.俄国化学家门捷列夫发现了元素周期律,使化学的研究变得有规律可循
2.下列对离子化合物的叙述不正确的是
①离子化合物一定是含有离子键的化合物 ②离子化合物一定是由金属元素和非金属元素构成 ③共价化合物可能含有离子键 ④离子化合物中可能含有共价键,也可能不含共价键
A.①② B.②③ C.①③ D.②④
3.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 + 2KNO3= K2O+5Na2O + 16N2↑。下列相关说法正确的是
A.氧离子结构示意图:
B.中子数为20的钾原子:
C.N2分子的结构式:N=N
D.NaN3仅含离子键
4.据报道,我国科学家找到了水稻突变体“耐砷()富硒()”开关,这对提高水稻营养价值降低砷的毒性意义重大。下列说法正确的是
A.砷与硫属于同族元素 B.砷的简单氢化物为
C.简单氢化物的稳定性:As
A.质量数 B.质子数 C.中子数 D.电子数
6.下列离子方程式正确的是
A.FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O
C.Al(OH)3与NaOH溶液反应:OH-+Al(OH)3=2H2O+AlO
D.氯气溶于水:Cl2+H2OCl-+ClO-+2H+
7.下列各项说法正确且能证明F比O的非金属性强的是
A.H2O的稳定性比HF强 B.共用电子对偏向:H-F
8.同温同压下,关于D37Cl和T35Cl两种气体,下列说法正确的是
A.物理性质相同 B.化学性质不同
C.气体密度相同 D.摩尔体积相同
9.为阿伏加德罗常数的值,下列说法正确的是
A.100gCaS与的混合物中含有32g硫元素,则氧元素的质量为28g
B.标准状况下,11.2LHF中含有H—F键的数目为
C.晶体中含有的共价键数目为
D.与浓盐酸充分反应,转移的电子数目为
10.下列物质中不存在非极性共价键的是
A.氮气 B.双氧水 C.Na2S2O3 D. (甲酸)
11.下列物质属于离子化合物且含有共价键的是
A. B. C. D.
12.由下列事实进行归纳推测,推测不合理的是
选项 事实 推测
A Mg与水反应缓慢,Ca与水反应较快 Ba与水反应会更快
B Si和Ge都是半导体材料 第IVA族元素的单质都可作半导体
C Al与Cl形成共价键,Mg与Cl形成离子键 Na和Cl形成离子键
D HCl在1500℃时分解,HI在300℃时分解HBr的分解 温度介于二者之间
A.A B.B C.C D.D
13.稀有金属铟由于其良好的性能常用于生产液晶显示器和平板屏幕,如图是铟元素的相关信息,下列说法中不正确的是
A.铟元素的原子序数是49 B.铟元素的相对原子质量是114.8
C.、互为同素异形体 D.原子最外层有3个电子
14.对物质合理分类可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。下列有关物质分类或归类中,正确的是
A.酸性氧化物: B.碱性氧化物:全部的金属氧化物
C.化合物:、氯水 D.同素异形体:、金刚石、石墨
15.下列关于元素及其化合物的性质不符合元素周期律的是
A.原子半径:r(O)<r(N)<r(B)
B.碱性:KOH<Ca(OH)2
C.将Cl2通入Na2S溶液中证明非金属性:Cl>S
D.原子的最外层电子数:P>Si>Na
二、填空题
16.填空
(1)原子核外有2个电子层、10个电子的原子结构示意图为 。
(2)原子核外有3个电子层,最外层有6个电子的元素符号为 。
(3)质量数为28,质子数等于中子数的核素表示为 。
(4)最外层电子数是次外层电子数4倍的-2价离子符号为 。
17.下图为元素周期表的一部分,请参照①⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是 (填化学式),氢化物热稳定性最强的是 (填电子式)。
(2)②③④的原子半径从大到小的顺序是 (填元素符号)。④⑤⑧的阳离子中氧化性最强的是 (填离子符号)。
(3)元素⑥的非金属性比⑦ (填“强”或“弱”),请从原子结构的角度解释: 。
(4)现在含有元素硒()的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多个电子层,硒在周期表中的位置为 ,则下列叙述中正确的是 。
A.原子序数为
B.气态氢化物的稳定性
C.不能与氢氧化钠反应
D.既有氧化性又有还原性
(5)①和④可形成型离子化合物,该离子化合物的电子式为 ,其与水反应放出气体的化学方程式为 。
18.2022年5月6日,我国科学家利用“墨子号”首次实现了地球上相距1200公里的地面站之间的量子态远程传输。化学助力我国科技发展,借助元素周期表可以认识各种材料的结构与性质,元素a~h是元素周期表中短周期元素,其相对位置如下表所示:
请回答下列问题:
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为 (填化学式)。
(2)元素b的一种单质是“墨子号”的储能器件,b在元素周期表中的位置是 。
(3)“墨子号”的制作使用了2000多吨的e合金,e的简单离子结构示意图为 ,请写出e的氧化物与d的最高价氧化物对应水化物反应的离子方程式: 。
(4)c与f的化合物是“墨子号”实现远程传输的核心材料,该化合物属于 (填“离子”或“共价”)化合物。
(5)利用元素d与g所研发的电池具有充放电效率高、循环寿命长等优点,现已广泛应用于各科技领域,请写出d与g所形成的简单化合物的电子式: 。元素g与元素h所形成的简单氢化物的稳定性大小:g (填“>”“<”或“=”)h。
19.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图,汞在第 周期。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是 。
a.硒元素的最低负化合价为-2
b.二氧化硒()具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是,它的中子数为 。
②已知与的性质相似,则对性质的推测不正确的是 (填序号)。
a.含有离子键和共价键
b.能与溶液反应
c.与加热充分分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法不正确的是 (填字母)。
a.热稳定性: b.酸性:
c.的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
(4)砷酸()可用于制造杀虫剂、药物。溶于稀硝酸中可得砷酸,此反应的化学方程式: 。
20.将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
(1)合金中镁的质量是 。
(2)所用盐酸的物质的量浓度是 。
21.将一定质量的镁铝合金投入一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为的溶液,生成的沉淀跟加入的溶液的体积关系如图。(横坐标体积单位是,纵坐标质量单位是g)求:
(1)合金中,的质量
(2)所用的物质的量浓度
22.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑦的名称为 ,在周期表中的位置 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合 物的电子式是 。
(3)用电子式表示元素④和⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(4)写出一种由元素③和④组成的既有离子键又有共价键的物质的电子式 。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是 (用离子符号表 示)
23.利用如图装置可验证同主族元素非金属性的变化规律。
(1)仪器A的名称为 ,干燥管 D 的作用为 。
(2)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B 中装有固体,则 A中试剂为 ,观察到 C 中溶液 (填现象),即 可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶 液吸收尾气。
(3)若要证明非金属性:C>Si,则在 A中加盐酸、B 中加、C 中加溶液。观察到 C 中溶液 (填现象),即可证明。但有的同学认 为盐酸具有挥发性,HCl可进入 C 中干扰实验,应在两装置间添加装有 溶液的洗气瓶除去。
【参考答案】
一、选择题
1.C
解析:A.我国化学家侯德榜改进了制碱工艺,发明了联合制碱法,为化学工业做出了重大贡献,故A正确;
B.我国化学家徐光宪院士在稀土元素的分离及应用中作出了重要贡献,促进了我国稀土工业的发展,故B正确;
C.19世纪初,英国化学家道尔顿提出近代原子学说,认为原子是不可再分的实心球体,故C错误;
D.俄国化学家门捷列夫发现了元素周期律,使化学的研究变得有规律可循,故D正确;
故选C。
2.B
解析:①含有离子键的化合物属于离子化合物,则离子化合物一定是含有离子键的化合物,①正确;
②离子化合物中不一定含有金属元素,也可能含有,②不正确;
③共价化合物只含有共价键,一定不含有离子键,③不正确;
④离子化合物中一定含有离子键,可能含有共价键,也可能不含共价键,如NaCl中只含离子键,NaOH中既含离子键、又含共价键,④正确;
通过以上分析可知,②③不正确,故选B。
3.B
解析:A.氧离子的核电荷数为8,其结构示意图为 ,A项错误;
B.中子数为20的K原子的质量数为39,B项正确;
C.N2分子的结构式为N≡N,C项错误;
D.NaN3由Na+和构成,所以NaN3中既有离子键又有共价键,D项错误;
故选B。
4.C
解析:A.由题干信息可知,砷是33号元素,其核外最外层上有5个电子,即其位于第VA族,而S位于第ⅥA族,故砷与硫不属于同族元素,A错误;
B.由题干信息可知,砷是33号元素,其核外最外层上有5个电子,则砷的最高正价为+5价,则其最低负价为-3价,即砷的简单氢化物为AsH3,B错误;
C.已知As与Se位于同一周期且位于Se的左侧,故非金属性As<Se,故简单氢化物的稳定性:As
5.B
解析:A.同种元素的不同微粒,质量数可能不同,如质量数不同,故不选A;
B.元素是具有相同质子数的一类原子的总称,同种元素的不同微粒,质子数一定相等,故选B;
C.不同同位素原子的中子数不同,如的中子数不相等,故不选C;
D.同种元素的不同微粒,电子数可能不同,Na的电子数为11、Na+的电子数为10,故不选D;
故选B。
6.C
解析:A.溶液中通入足量,也会被氧化,正确的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故A错误;
B.将氧气通入酸性碘化钾溶液中,得失电子不守恒,正确的离子方程式为:,故B错误;
C.与NaOH溶液反应:,故C正确;
D.HClO是弱酸,则氯气溶于水:,故D错误;
综上所述,答案为C。
7.D
解析:A.非金属性越强简单氢化物越稳定,非金属性F>O,则H2O的稳定性应比HF弱,A不符合题意;
B.F的非金属性大于O,则F吸引电子能力更强,所以共用电子对偏向:H-F>H-O,B不符合题意;
C.虽然H2O的沸点比HF的高,但熔沸点与非金属性强弱无关,C不符合题意;
D.OF2中O是+2价,F是-1价,说明F吸引电子能力强于O,即F比O的非金属性强,D符合题意;
综上所述答案为D。
8.D
解析:A.D37Cl和T35Cl的相对分子质量不同,物理性质不同,A错误;
B.D37Cl和T35Cl都是氯化氢,其化学性质相同,B错误;
C.D37Cl和T35Cl的相对分子质量不同,同温同压下相同体积的两种气体质量不同,气体密度不同,C错误;
D.同温同压下,这两种气体的摩尔体积相同,D正确;
故答案选D。
9.A
解析:A.CaS与的混合物中,Ca与S的个数比为1∶1,100g混合物中含有32g硫元素,则必含40g钙元素,则氧元素的质量,A正确;
B.标准状况下,HF呈液态,故不能用气体摩尔体积去计算,B错误;
C.NH4F晶体中N和H之间以N—H共价键相连,故晶体中含有的共价键数目为,C错误;
D.制取氯气的反应中,随着反应的进行,浓盐酸的浓度逐渐降低,变成了稀盐酸,稀盐酸与不反应,反应结束后,也有剩余,故与浓盐酸充分反应,转移的电子数目小于,D错误。
故选A。
10.D
解析:A.氮气分子中含有键,存在非极性共价键,A不符合题意;
B.H2O2结构式为H-O-O-H,存在O-O非极性共价键,B不符合题意;
C.Na2S2O3结构式为,存在S=S非极性共价键,C不符合题意;
D.HCOOH结构式为,不存在非极性共价键,D符合题意;
故选D。
11.C
解析:A.属于离子化合物,Na+和O2-间只含有离子键,A项不符合题意;
B.只含有共价键,属于共价化合物,B项不符合题意;
C.属于离子化合物,间形成离子键、中含有共价键,C项符合题意;
D.只含有共价键,属于共价化合物,D项不符合题意;
故选:C。
12.B
解析:A.Mg、Ca、Ba为同主族元素,同主族元素从上到下金属性逐渐增强,Ba的金属性强于Ca,Ba与水反应会更快,A正确;
B.并不是第ⅣA族元素的单质都可用作半导体,比如C单质就不能用作半导体,B错误;
C.Al、Mg、Na金属性逐渐增强,越容易与非金属元素结合形成离子键,则Na与Cl形成离子键,C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br>I,则HBr分解的温度介于300-1500℃之间,D正确;
故答案选B。
13.C
解析:A.根据元素周期表元素信息可知,铟元素的原子序数是49,A正确;
B.根据元素周期表元素信息可知,铟元素的相对原子质量是114.8,B正确;
C.、的质子数相同,中子数不同,两者互为同位素,C错误;
D.铟元素的原子序数是49,则核外电子排布为,原子最外层有3个电子,D正确;
故选C。
14.D
解析:A.CO为不成盐氧化物,不属于酸性氧化物,A错误;
B.并不是所有的金属氧化物都是碱性氧化物,如氧化铝为两性氧化物,Mn2O7属于酸性氧化物,B错误;
C.氯水为氯气的水溶液,属于混合物,C错误;
D.、金刚石、石墨属于碳元素的不同单质,互为同素异形体,D正确;
故选D。
15.B
解析:A.同一周期主族元素,从左到右,原子半径逐渐减小,所以原子半径:r(O)<r(N)<r(B),故A正确;
B.同周期自左向右金属性逐渐减弱,最高价氧化物对应水化物碱性逐渐减弱,则碱性:KOH>Ca(OH)2,故B错误;
C.同一周期主族元素,从左到右,非金属性增强,原子得电子能力增强,氯气能置换出硫化钠中的硫,说明非金属性:Cl>S,故C正确;
D.同一周期主族元素,原子的最外层电子数逐渐增多,原子的最外层电子数:P>Si>Na,故D正确。
答案选B。
二、填空题
16.(1) (2)S (3) (4)O2-
解析:(1)原子核外有2个电子层、10个电子的原子为Ne,其原子结构示意图为:;
(2)原子核外有3个电子层,最外层有6个电子的元素为S,元素符号为S;
(3)质子数+中子数=质量数,质量数为28且质子数等于中子数,则其质子数为14,元素符号为Si,其核素表示为;
(4)最外层电子数是次外层电子数4倍的-2价离子,说明该原子含有两层,且最外层电子数为6,即该元素为O,-2价离子符号为:O2-。
17.(1) KOH
(2)
(3)弱 和位于同一周期,从左到右原子半径减小,得电子能力逐渐增强,所以的非金属性比弱
(4) VIA AD
(5)
解析:(1)同一周期从左至右,元素的金属性逐渐减弱,非金属性逐渐增强,同一主族从上至下,元素的金属性逐渐增强,非金属性逐渐减弱,元素的金属性越强,其最高价氧化物对应水化物碱性越强,因此上述序号元素中金属性最强的是⑧,即K元素,对应的碱为KOH;元素的非金属性越强,其简单氢化物的稳定性越强,因此上述序号元素中非金属性最强的是③,即F元素,对应的氢化物为HF,其电子式为。
(2)原子核外电子层数越多,原子半径越大,电子层数相同时,质子数越大,原子半径越小,因此原子半径:;金属单质的活动性越强,其对应离子的氧化性越弱,因此氧化性:。
(3)和位于同一周期,从左到右原子半径减小,得电子能力逐渐增强,所以的非金属性比弱。
(4)O原子核外有2个电子层,O元素位于VIA 族,Se原子核外比O原子多2个电子层,因此Se元素位于元素周期表中第四周期VIA族;
A.Se原子核外电子层填充数目依次为2、8、18、6,因此Se原子序数为2+8+18+6=34,故A正确;
B.S与Se位于同一主族,原子序数Se>S,因此非金属性S>Se,气态氢化物的稳定性:H2S>H2Se,故B错误;
C.Se元素位于金属元素与非金属元素的分界线附近,因此SeO2具有两性,即SeO2能与酸和碱发生反应,故C错误;
D.Se元素的最高化合价为+6,SeO2中Se元素化合价为+4,即SeO2中Se元素化合价处于中间价态,因此SeO2既有氧化性又有还原性,故D正确;
综上所述,答案为:VIA;AD。
(5)①为H,④为Na,二者形成的NaH为离子化合物,其电子式为;NaH中H元素为-1价,能与水发生归中反应生成H2,反应化学方程式为。
18.(1)H2O
(2)第二周期ⅣA族
(3)
(4)共价
(5) <
【分析】根据元素在周期表中的位置,a是H元素、b是C元素、c是O元素、d是Na元素、e是Al元素、f是Si元素、g是S元素、h是Cl元素。
解析:(1)氢气的单质常用作火箭推进剂,氢气燃烧生成水,对应的产物为H2O。
(2)b是C元素,在元素周期表中的位置是第二周期ⅣA族。
(3)Al3+核外有10个电子,结构示意图为,Al2O3与NaOH反应生成偏铝酸钠和水,反应的离子方程式为 。
(4)O与Si形成的化合物SiO2属于共价化合物。
(5)Na与S所形成的简单化合物是Na2S,电子式为。同周期元素从左到右非金属性增强,元素S与元素Cl所形成的简单氢化物的稳定性大小H2S
(2)c
(3) 42 c c
(4)
解析:(1)原子的电子层数=周期序数,Hg原子有6个电子层,故位于元素周期表第六周期。
(2)a. 硒(Se)与硫位于同一主族,最外层均有6个电子,且均为非金属元素,最低价均为-2价,a正确;
b. 硒(Se)的最高价为+6价,最低价为-2价,SeO2中Se的化合价为+4价,处于中间价态,既有氧化性又有还原性,b正确;
c. 硒的氧化物对应的水化物有H2SeO3和H2SeO4,属于酸,Se的非金属性弱于硫,因此酸性大小关系为:H2SO3>H2SeO3,H2SO4>H2SeO4,即H2SeO3和H2SeO4均为弱酸,c错误;
故选c;
(3)①砷为第33号元素,质子数为33,中子数为75-33=42。
②a.NH4I是离子化合物,PH4I与之性质相似,因此也属于离子化合物,与之间存在离子键,内P与H之间存在共价键,a正确;
b.NH4I能与NaOH反应生成NH3,因此PH4I也能与NaOH反应,b正确;
c.PH4I加热分解生成PH3和HI,HI不稳定,加热时也分解,生成H2和I2,因此与NH4Cl加热分解产物种类不一样,c错误;
故选c。
③a.非金属性越强,氢化物稳定性越强,N的非金属性比P强,因此稳定性大小关系为NH3>PH3,a正确;
b.非金属性越强,最高价氧化物水化物酸性越强,N的非金属性比As强,因此酸性强弱关系为HNO3>H 3AsO4,b正确;
c.As为非金属元素,其氧化物的水化物属于酸,c错误;
d.第VA族元素随原子序数增大,其简单离子电子层数依次增多,离子半径依次增大,d正确;
故选c。
(4)As2O3中As化合价为+3价,H2AsO4中As化合价为+5价,因此As2O3与稀HNO3发生氧化还原反应,反应的化学方程式为:。
20.8 g 8 mol·L-1
【分析】在合金中,Mg与HCl反应生成MgCl2,MgCl2与NaOH反应转化为Mg(OH)2,由图象中11.6g为Mg(OH)2的质量,可求出合金中镁的质量。在图象的0点,溶液的成分为MgCl2、AlCl3、HCl,在沉淀的最高点,溶液中只有NaCl,由NaOH的体积,结合其物质的量浓度,可求出HCl的物质的量,从而求出其物质的量浓度。
解析:(1)由图象可知,氢氧化镁的质量为11.6 g,根据镁元素守恒:
合金中镁的质量=11.6 g÷58 g·mol-1×24 g·mol-1=4.8 g。答案为:4.8 g;
(2)当沉淀的量最大时,溶液中溶质为氯化钠,
盐酸的物质的量浓度=0.16 L×5 mol·L-1÷0.1 L=8 mol·L-1。答案为:8 mol·L-1。
21.8g ;
【分析】由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、AI后,盐酸有剩余,此时发生的反应为: HCl+ NaOH= NaCl+ H2O ;继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为: Al (OH)3+ NaOH=NaAlO2+2H2O ,据此分析作答;
解析:(1 )由上述分析可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160 mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,该阶段消耗氢氧化钠140 mL ,由氢氧根守恒可知: 3n[Al (OH)3]+2n[Mg (OH) 2]=n ( NaOH)= ( 0.16L-0.02L ) 5 mol/L=0.7 mol ;从加入氢氧化钠溶液160mL ~ 180mL溶解氢氧化铝,该阶段发生反应: Al (OH)3+ NaOH=NaAlO2+2H2O,所以n[Al (OH)3]= ( 0.18L-0.16L ) 5mol/L=0.1 mol,由元素守恒规律可知n (Al) =n[Al (OH)3]= 0.1 mol,故Al的质量为:0.1mol 27g/mol= 2.7g;同理可求出n[Mg (OH) 2]=0.2mol ,由元素守恒可知n (Mg) =n[Mg (OH) 2]=0.2mol ,所以Mg的质量为: 0.2mol 24g/mol= 4.8g,故答案为4.8g、2.7g;
(2)沉淀量最大,溶液为氯化钠溶液,根据钠元素守恒可知,此时溶液中n ( NaCl) =n ( NaOH) =0.16L5mol/L=0.8mol ,根据氯离子守恒:n( HCl) =n( NaCl ) =0.mol ,故盐酸的物质的量浓度为: =8mol/L,故答案为。
22.氯 第三周期第ⅦA族 HClO4 离子 S2->Cl->K+
【分析】由元素在周期表中的位置可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,以此答题。
解析:(1)由题可知元素⑦处于周期表中第三周期第ⅦA族,是氯元素,故答案为:氯、第三周期第ⅦA族。
(2)由分析可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,即最高价氧化物的水化物中,酸性最强的化合物是HClO4,其中元素K的金属性最强,KOH的碱性最强,其电子式为,故答案为: HClO4;。
(3)元素④为Na,⑥为S,即元素④和⑥形成的化合物为Na2S,属于离子化合物,用电子式表示其形成过程为:,故答案为:;离子。
(4)由分析可知,③为O、④为Na,即由元素③和④组成的既有离子键又有共价键的物质是Na2O2,故电子式为:;
(5) ⑥、⑦、⑨三种元素分别S、C1、K,即形成的离子分别为:S2-、Cl-、K+,三者电子层结构相同,核电荷数越大离子半径越小,故离子半径由大到小的顺序:S2->Cl->K+。
23. 分液漏斗 防止倒吸 浓盐酸 变蓝 NaOH溶液 产生白色沉淀
解析:(1)仪器A的名称为:分液漏斗,D的作用是防止倒吸,故答案为:分液漏斗;防止倒吸;
(2)A中浓盐酸和B中KMnO4反应产生Cl2,Cl2和C中的KI反应置换出I2,I2遇淀粉变蓝,即C中变蓝,本实验说明Cl2的氧化性强于I2,那么Cl的非金属性强于I。本实验涉及的Cl2有毒,反应不完全排放到空气中会污染空气,因此缺少一个尾气处理装置,可用NaOH溶液吸收尾气,故答案为:浓盐酸;变蓝;NaOH溶液;
(3)A中的盐酸和B中的CaCO3反应产生CO2,CO2与C中Na2SiO3溶液反应产生白色沉淀H2SiO3,说明H2CO3的酸性强于H2SiO3,那么C的非金属性强于Si。但是本实验存在一个缺陷:浓HCl易挥发,HCl可进入C中和Na2SiO3反应产生白色沉淀H2SiO3干扰实验,故应在两装置之间添加一个除HCl的装置,可用饱和NaHCO3溶液,故答案为:产生白色沉淀;NaHCO3
