8.1.2海水资源的开发和利用课件(共18页)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 8.1.2海水资源的开发和利用课件(共18页)2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 08:48:24 | ||
图片预览

文档简介
(共18张PPT)
8.1.2
海水资源的开发利用
学习目标:
1.了解海水资源的开发利用。
2.认识海水提溴、碘、镁等的工艺流程。
培养“科学探究与社会责任”的核心素养。
广阔性
海水中水的储量约为1.3×109 亿吨,占地球总水量 97%
元素种类很多,总计含有80多种元素
多样性
分散性
许多元素的富集程度很低
课前导入
海水的特点
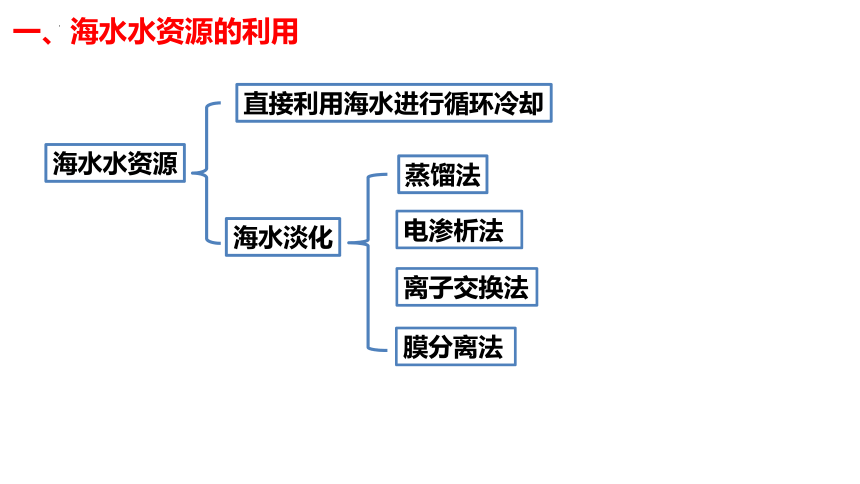
直接利用海水进行循环冷却
海水淡化
海水水资源
电渗析法
膜分离法
蒸馏法
离子交换法
一、海水水资源的利用
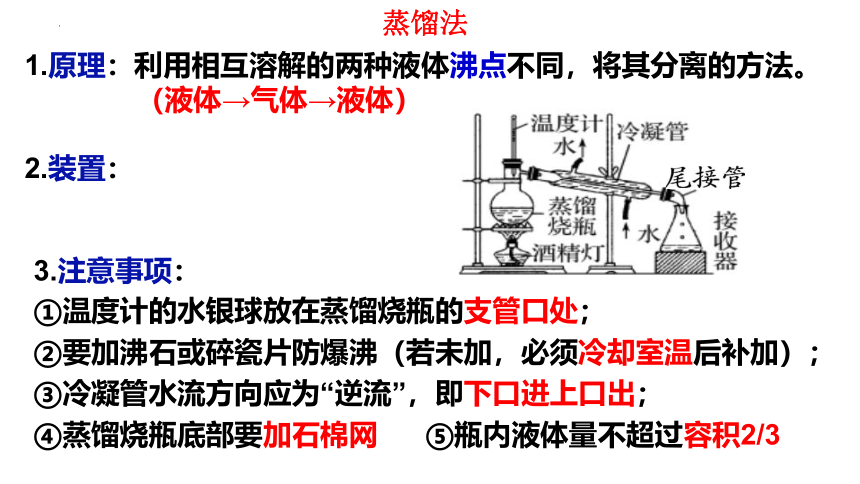
蒸馏法
1.原理:利用相互溶解的两种液体沸点不同,将其分离的方法。
(液体→气体→液体)
2.装置:
3.注意事项:
①温度计的水银球放在蒸馏烧瓶的支管口处;
②要加沸石或碎瓷片防爆沸(若未加,必须冷却室温后补加);
③冷凝管水流方向应为“逆流”,即下口进上口出;
④蒸馏烧瓶底部要加石棉网 ⑤瓶内液体量不超过容积2/3
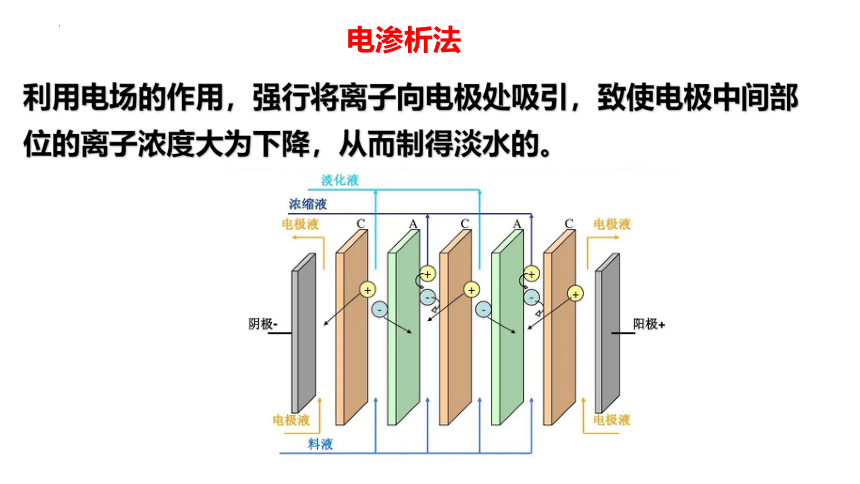
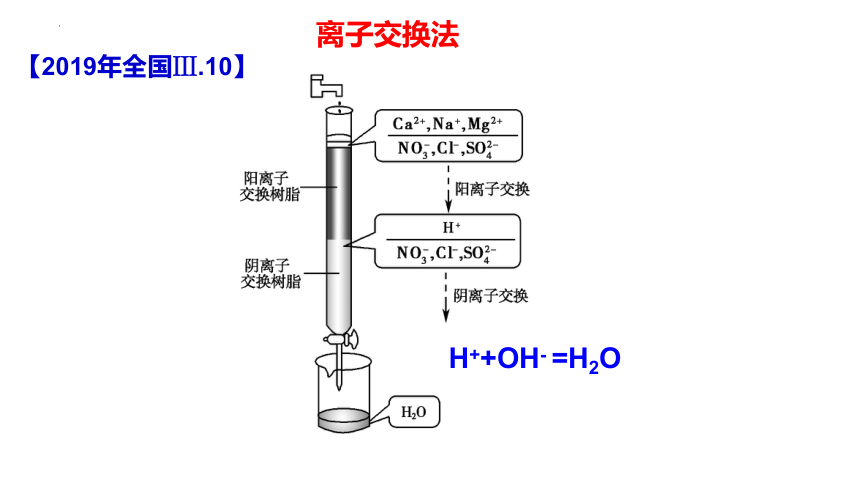
利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的。
电渗析法
H++OH- =H2O
离子交换法
【2019年全国Ⅲ.10】
【2019年全国Ⅲ.10】离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO3-、SO42-、Cl-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH- =H2O
A
二、海水中化学资源的利用
1.海水制盐
盐田
海水
饱和食盐水
引入
日晒风吹
析出粗盐
食用盐
氯碱工业
精制
蒸发结晶
(1)氯碱工业
(2)制钠和氯气
(3)制盐酸
(4)制漂白粉
(5)制纯碱
(侯氏制碱法)
2NaCl+2H2O ══ 2NaOH + H2↑ +Cl2↑
电解
Cl2+H2 ══ 2HCl
点燃
2Cl2+2Ca(OH)2 ══ CaCl2 + Ca(ClO)2 +2H2O
2NaHCO3 ═ Na2CO3+H2O↑+CO2↑
△
NaCl+H2O+NH3+CO2 ═ NaHCO3↓+NH4Cl
方法 适用对象 实例
蒸发结晶 溶解度随温度变化不大的溶质
冷却结晶 溶解度随温度下降明显降低的溶质
(1)定义:在一定条件下,溶液中的溶质以晶体的形式从溶液中析出的过程
不饱和溶液→饱和溶液→过饱和溶液→晶体析出
蒸发结晶(蒸发溶剂)
冷却结晶(冷却热饱和溶液)
(2)方法
结晶的原理及方法
NaCl
KNO3
2.海水提溴
海水
提取粗盐
苦卤
硫酸酸化
Cl2
含Br2的海水
空气吹出
含Br2的空气
SO2和水
HBr溶液
Cl2
富集
溴水混合物
冷凝
蒸馏
溴蒸气
液溴
(含有高浓度的K+、Mg2+、Br-和SO42-)
利用溴的挥发性
①
②
③
④
⑤
⑥
⑦
②Cl2 + 2Br- = Br2 + 2Cl-
④Br2 + SO2 + 2H2O = 2HBr + H2SO4
⑤作用:
富集溴元素
目标产品
物质转化、分离提纯
工业原料
富集
3.海水提镁
②CaO + H2O = Ca(OH)2
①CaCO3 = CaO + CO2↑
高温
③MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2
①
②
③
④
从海水中提取镁的工艺流程可表示如下,下列说法不正确的是( )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2溶液得到金属Mg
C.制备过程中产生的氯气可以用来制备盐酸,循环使用
D.上述工艺流程中涉及化合、分解和复分解反应
B
镁及其合金是一种用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2.试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂①的量应_______
(2)加入试剂①后,能够分离得到Mg(OH)2,沉淀的方法是 。
(3)试剂②可以选用___________
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_________
Ca(OH)2
过量
过滤
盐酸
4.海水提碘
海带灰
海带
海带灰悬浊液
①灼烧
②浸泡
含I-溶液
③
④H2O2、稀硫酸或Cl2
含I2溶液
⑤萃取、分液
I2的CCl4溶液
⑥
单质I2
①坩埚
④ H2O2 + 2I- +2H+ = I2 + 2H2O
2I- + Cl2 = I2 + 2Cl-
从海带中提取碘的实验过程中涉及下列操作,其中正确的是( )。
D
1.萃取:溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。
(用有机溶剂在碘水中提碘/溴水中提溴)
萃取、分液
①萃取剂与原溶剂不混溶、不反应;
②溶质在萃取剂中有较大的溶解度;
③溶质不与萃取剂发生任何反应
2.萃取剂的选择原则:
3.分液:将分层后两种互不相溶的液体分开的操作
3、萃取分液步骤:(萃取碘水中的碘)
(1)查漏:检验分液漏斗是否漏液
(2)加萃取剂
(3)振荡萃取
(4)静置分层
(5)分液
取10ml碘的饱和水溶液,倒入分液漏斗,然后再注入4ml四氯化碳,盖好玻璃塞,溶液分层,四氯化碳在下层
用右手压住分液漏斗玻璃塞,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触,振荡过程中要打开活塞两到三次,使漏斗内气体放出
静置分层,上层为水层,无色;下层为四氯化碳层,显紫色
使下层液体慢慢沿烧杯壁流下,上层液体从分液漏斗上口倒出
1、混合物分离方法
①不溶性的固体和液体分离——除去食盐水中的泥沙( )
②可溶性的固体和液体分离——NaCl溶液中除去水( )
③互溶的两种沸点不同的液体混合物分离——海水淡化( )
④在两种互不相溶的溶剂中溶解度相差很大——碘水中提取碘( )
⑤互不相溶的两种液态混合物——四氯化碳和水的混合物( )
过滤
蒸发
蒸馏
萃取
分液
8.1.2
海水资源的开发利用
学习目标:
1.了解海水资源的开发利用。
2.认识海水提溴、碘、镁等的工艺流程。
培养“科学探究与社会责任”的核心素养。
广阔性
海水中水的储量约为1.3×109 亿吨,占地球总水量 97%
元素种类很多,总计含有80多种元素
多样性
分散性
许多元素的富集程度很低
课前导入
海水的特点
直接利用海水进行循环冷却
海水淡化
海水水资源
电渗析法
膜分离法
蒸馏法
离子交换法
一、海水水资源的利用
蒸馏法
1.原理:利用相互溶解的两种液体沸点不同,将其分离的方法。
(液体→气体→液体)
2.装置:
3.注意事项:
①温度计的水银球放在蒸馏烧瓶的支管口处;
②要加沸石或碎瓷片防爆沸(若未加,必须冷却室温后补加);
③冷凝管水流方向应为“逆流”,即下口进上口出;
④蒸馏烧瓶底部要加石棉网 ⑤瓶内液体量不超过容积2/3
利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的。
电渗析法
H++OH- =H2O
离子交换法
【2019年全国Ⅲ.10】
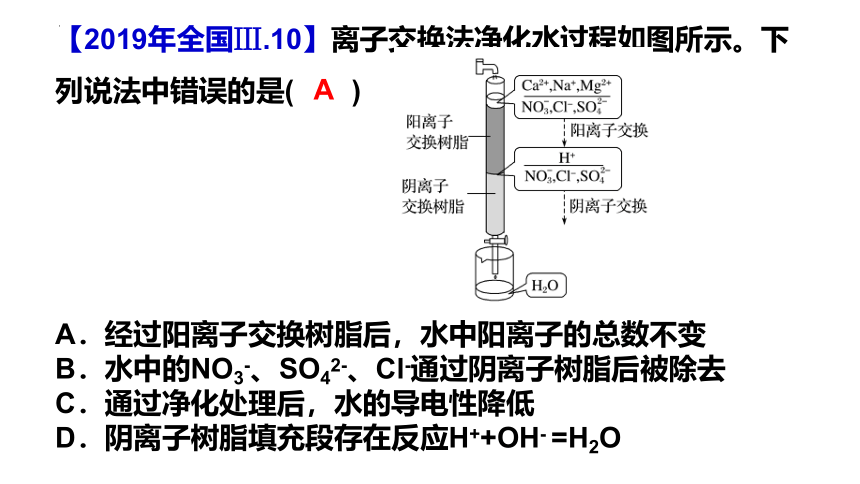
【2019年全国Ⅲ.10】离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO3-、SO42-、Cl-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH- =H2O
A
二、海水中化学资源的利用
1.海水制盐
盐田
海水
饱和食盐水
引入
日晒风吹
析出粗盐
食用盐
氯碱工业
精制
蒸发结晶
(1)氯碱工业
(2)制钠和氯气
(3)制盐酸
(4)制漂白粉
(5)制纯碱
(侯氏制碱法)
2NaCl+2H2O ══ 2NaOH + H2↑ +Cl2↑
电解
Cl2+H2 ══ 2HCl
点燃
2Cl2+2Ca(OH)2 ══ CaCl2 + Ca(ClO)2 +2H2O
2NaHCO3 ═ Na2CO3+H2O↑+CO2↑
△
NaCl+H2O+NH3+CO2 ═ NaHCO3↓+NH4Cl
方法 适用对象 实例
蒸发结晶 溶解度随温度变化不大的溶质
冷却结晶 溶解度随温度下降明显降低的溶质
(1)定义:在一定条件下,溶液中的溶质以晶体的形式从溶液中析出的过程
不饱和溶液→饱和溶液→过饱和溶液→晶体析出
蒸发结晶(蒸发溶剂)
冷却结晶(冷却热饱和溶液)
(2)方法
结晶的原理及方法
NaCl
KNO3
2.海水提溴
海水
提取粗盐
苦卤
硫酸酸化
Cl2
含Br2的海水
空气吹出
含Br2的空气
SO2和水
HBr溶液
Cl2
富集
溴水混合物
冷凝
蒸馏
溴蒸气
液溴
(含有高浓度的K+、Mg2+、Br-和SO42-)
利用溴的挥发性
①
②
③
④
⑤
⑥
⑦
②Cl2 + 2Br- = Br2 + 2Cl-
④Br2 + SO2 + 2H2O = 2HBr + H2SO4
⑤作用:
富集溴元素
目标产品
物质转化、分离提纯
工业原料
富集
3.海水提镁
②CaO + H2O = Ca(OH)2
①CaCO3 = CaO + CO2↑
高温
③MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2
①
②
③
④
从海水中提取镁的工艺流程可表示如下,下列说法不正确的是( )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2溶液得到金属Mg
C.制备过程中产生的氯气可以用来制备盐酸,循环使用
D.上述工艺流程中涉及化合、分解和复分解反应
B
镁及其合金是一种用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2.试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂①的量应_______
(2)加入试剂①后,能够分离得到Mg(OH)2,沉淀的方法是 。
(3)试剂②可以选用___________
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_________
Ca(OH)2
过量
过滤
盐酸
4.海水提碘
海带灰
海带
海带灰悬浊液
①灼烧
②浸泡
含I-溶液
③
④H2O2、稀硫酸或Cl2
含I2溶液
⑤萃取、分液
I2的CCl4溶液
⑥
单质I2
①坩埚
④ H2O2 + 2I- +2H+ = I2 + 2H2O
2I- + Cl2 = I2 + 2Cl-
从海带中提取碘的实验过程中涉及下列操作,其中正确的是( )。
D
1.萃取:溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。
(用有机溶剂在碘水中提碘/溴水中提溴)
萃取、分液
①萃取剂与原溶剂不混溶、不反应;
②溶质在萃取剂中有较大的溶解度;
③溶质不与萃取剂发生任何反应
2.萃取剂的选择原则:
3.分液:将分层后两种互不相溶的液体分开的操作
3、萃取分液步骤:(萃取碘水中的碘)
(1)查漏:检验分液漏斗是否漏液
(2)加萃取剂
(3)振荡萃取
(4)静置分层
(5)分液
取10ml碘的饱和水溶液,倒入分液漏斗,然后再注入4ml四氯化碳,盖好玻璃塞,溶液分层,四氯化碳在下层
用右手压住分液漏斗玻璃塞,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触,振荡过程中要打开活塞两到三次,使漏斗内气体放出
静置分层,上层为水层,无色;下层为四氯化碳层,显紫色
使下层液体慢慢沿烧杯壁流下,上层液体从分液漏斗上口倒出
1、混合物分离方法
①不溶性的固体和液体分离——除去食盐水中的泥沙( )
②可溶性的固体和液体分离——NaCl溶液中除去水( )
③互溶的两种沸点不同的液体混合物分离——海水淡化( )
④在两种互不相溶的溶剂中溶解度相差很大——碘水中提取碘( )
⑤互不相溶的两种液态混合物——四氯化碳和水的混合物( )
过滤
蒸发
蒸馏
萃取
分液
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
