3.2.2溶液的酸碱性与pH课件(共26张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.2溶液的酸碱性与pH课件(共26张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 08:48:53 | ||
图片预览








文档简介
(共26张PPT)
1. 温度升高,促进水的电离,Kw增大;
2. 酸、碱抑制水的电离,Kw不变;
3. 外加能与H+、OH- 反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。
上节课小结:水的电离的影响因素
25℃时,Kw=c(H+)·c(OH-) =1×10-14
100℃时,Kw=c(H+)·c(OH-) =1×10-12
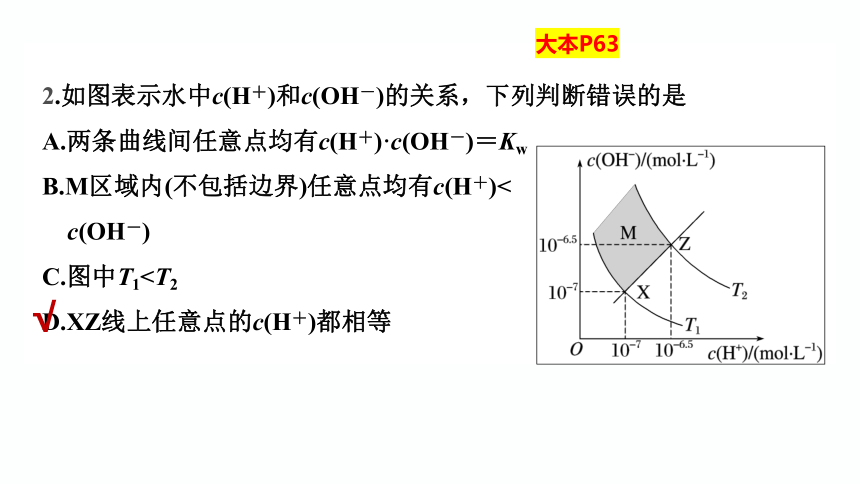
2.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内(不包括边界)任意点均有c(H+)<
c(OH-)
C.图中T1D.XZ线上任意点的c(H+)都相等
√
大本P63
12.水的电离常数如图所示,曲线上的点都符合c(H+)·c(OH-)=常数,下列说法错误的是
A.图中温度:T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将0.005 mol·L-1的硫酸溶
液与由水电离的c(H+)=1.0×10-12 mol·L-1的KOH溶液等体积混合后,溶液显碱性
√
小本P184
Kw应用2:水的电离平衡曲线的理解与识别
13.(1)某温度时,水的Kw=1×10-12,则该温度 (填“>”“<”或“=”)25 ℃,其理由是___________________________。
>
升温促进水的电离,Kw增大
(2)该温度下,c(H+)=1×10-7 mol·L-1的溶液呈 (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)= mol·L-1。
碱性
1×10-7
小本185页
(4)25 ℃时,下列0.1 mol·L-1的6种溶液,水电离出的c(H+)由大到小的________________________ (填序号)。
①盐酸 ②H2SO4 ③CH3COOH(Ka=1.8×10-5) ④NH3·H2O(氨水)(Kb=1.8×10-5) ⑤NaOH ⑥Ba(OH)2
③=④>①=⑤>②=⑥
酸、碱抑制水的电离,Kw不变;
7.一定温度下,用水稀释0.1 mol·L-1的一元弱酸HA溶液,随着稀释的进行,下列一定增大的是
√
3.22溶液的酸碱性与pH
学习目标
1、理解溶液的pH及pH跟溶液中c(H+) 之间的关系
2、学会有关pH的简单计算
3、了解pH的简单测定方法
4、了解溶液pH的调控在工农业生产和科学研究中的应用
核心素养
证据推理与模型认知:通过分析、推理等方法知道溶液pH的概念、溶液酸碱性与pH的关系,建立溶液酸碱性判断的思维模型。
课本P64【思考与讨论】
体系 纯水 向纯水中加入 少量盐酸 向纯水中加入少量 NaOH溶液
c(H+)
c(OH-)
c(H+)和c(OH-)的大小比较
溶液的酸碱性
10-7 mol/L
中性
10-7 mol/L
c(H+) = c(OH-)
减小
增大
增大
减小
碱性
酸性
c(H+) > c(OH-)
c(H+) < c(OH-)
二、溶液的酸碱性与c(H+) 、c(OH-)的关系
酸性溶液中存在OH-,碱性溶液中存在H+。因为在水溶液中存在
H2O H+ +OH-
(2)
(1)
1、溶液的酸碱性与c(H+)、c(OH-)的关系
溶液酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
c(H+) > c(OH-)
c(H+) < c(OH-)
中性
酸性
碱性
c(H+) = c(OH-)
任意条件,溶液酸碱性的判断依据:
只有常温时:KW= 1×10-14
中性:c(H+) =1×10-7
酸性:c(H+) >1×10-7
碱性:c(H+) <1×10-7
【练习1】c(H+)>1.0×10-7mol/L的溶液一定呈酸性吗?
如何判断溶液的酸碱性?
判断溶液酸、碱性,只能通过比较c(H+)和c(OH-)的相对大小。
(2)表达式 : pH= 。
(1)溶液pH的定义:H+的物质的量浓度的负对数
﹣lgc(H+)
c(H+) = 10-pH mol/L
25℃下,1.0×10-2mol/L 的HCl溶液的c(H+) =_____mol/L,pH= ___
2
25℃下,1.0×10-2mol/L 的NaOH溶液的c(H+) =_____mol/L,pH= ___
12
10-12
10-2
(3)意义:pH越大,溶液碱性越 ,c(H+)越 。
pH越小,溶液酸性越 ,c(H+)越 。
强
强
小
大
2、pH表示溶液酸碱性:
【练习】计算下列溶液的PH值:
中性
酸性
碱性
[H+]
mol/L
pH
100
10-1
10-2
10-3
10-14
10-4
10-13
10-11
10-12
10-10
10-9
10-8
10-5
10-6
10-7
0
1
2
3
4
5
7
8
9
10
11
12
13
14
6
室温下水溶液中pH、 c(H+)与酸碱性的关系图:
室温(25℃)下
pH=7, c(H+) = c(OH-),溶液显中性;
pH<7, c(H+) > c(OH-),溶液显酸性;
pH>7, c(H+) < c(OH-),溶液显碱性。
(4)溶液适用范围:
1×10-14 mol·L-1 ≤ c(H+) ≤ 1 mol·L-1
(5)PH范围:0~14
PH=0? PH=1?
2、pH表示溶液酸碱性:
【思考交流】pH=7的溶液一定呈中性吗
不一定。
在25 ℃时,pH=7的溶液呈中性。
温度高于25 ℃时,水的电离程度增大,KW >1.0×10-14,此时pH=7呈碱性。
判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH大小,只有满足c(H+)=c(OH-)的溶液才一定呈中性。
25℃时,Kw=c(H+)·c(OH-) =1×10-14
100℃时,Kw=c(H+)·c(OH-) =1×10-12
1.下列关于溶液的酸碱性,说法正确的是
A.pH=7的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1
C.c(OH-)=c(H+)的溶液呈中性
D.在100 ℃时,纯水的pH<7,因此显酸性
√
大本65页
(1)定性测量:酸碱指示剂
只能粗略测定溶液的pH范围,不能准确测定出pH的具体值
指示剂 变色范围(pH) 遇酸的颜色 遇碱的颜色
甲基橙
石蕊
酚酞
3.1
4.4
橙色
红色
(pH<3.1)
黄色
(pH>4.4)
5.0
8.0
紫色
红色
(pH<5.0)
蓝色
(pH>8.0)
8.2
10.0
粉红色
无色
(pH<8.2)
红色
(pH>10.0)
3、溶液pH的测量:
(2)定量测量——pH试纸法
②种类
①pH试纸是将试纸用多种酸碱指示剂的混合溶液浸透,经晾干制成的。它对不同pH的溶液能显示不同的颜色,可用于讯速测定溶液的pH。
广泛pH试纸:其pH范围是 (最常用),可以识别的pH差约为 。
精密pH试纸:可判别0.2或0.3的pH差值。
专用pH试纸:用于酸性、中性或碱性溶液。
1~14
1
3、溶液pH的测量:
课本65页
2.用广泛pH试纸测得的pH是整数,不会有小数
③使用方法:使用pH试纸的正确操作:取一小块pH试纸于干燥洁净的_____________
_____,用干燥洁净的玻璃棒蘸取待测液点在试纸上,当试纸颜色变化稳定后迅速与 对照,读出pH。
比色卡
1.测定溶液的pH时,不能将试纸用水润湿。 (将溶液稀释,导致所测定的pH不准确)
3、溶液pH的测量:
玻璃片或表面
皿上
标准比色卡
通过电子仪器,把仪器的探棒放入溶液即可在显示屏上读出数据,该法精确度高。
3、溶液pH的测量:
课本65页
(2)定量测量——pH计法(可精确到0.1)
4.用pH试纸测定溶液pH的正确操作是
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸中央,
再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测
液点在试纸中央,再与标准比色卡对照
C.将一小块试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色
卡对照
D.将一小块试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准
比色卡对照
√
小本185页
(1)任何温度下,如果c(H+)不等于c(OH-),则溶液一定呈现酸碱性( )
(2)某溶液的pH=7,该溶液一定显中性( )
(3)升高温度水的电离程度增大,酸性增强( )
(4)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低( )
(5)用广泛pH试纸测得某溶液的pH为3.4( )
(6)用pH计测得某溶液的pH为7.45( )
√
×
×
×
×
正误判断
√
25℃时,Kw=c(H+)·c(OH-) =1×10-14
100℃时,Kw=c(H+)·c(OH-) =1×10-12
5.下列溶液一定呈中性的是
A.由非电解质溶于水得到的溶液
B.c(OH-)、c(H+)均为5.0×10-7 mol·L-1的溶液
C.等物质的量的强酸与强碱反应得到的溶液
D.将c(OH-)=10-5 mol·L-1的烧碱溶液稀释到原来的100倍所得到的溶液
√
小本185页
10.25 ℃时,在等体积的①0.5 mol·L-1的H2SO4溶液;②0.05 mol·L-1的Ba(OH)2溶液;③1 mol·L-1的NaCl溶液;④纯水中由水电离出的H+的物质的量之比是
A.1∶10∶107∶107 B.107∶107∶1∶1
C.107∶106∶2∶2 D.107∶106∶(2×107)∶2
√
小本P184
A.25 ℃时,0.5 mol·L-1的H2SO4溶液中c(H+)=1 mol·L-1,由水电离出的c水(H+)=10-14 mol·L-1;
B.0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.1 mol·L-1,由水电离出的c水(H+)=10-13 mol·L-1;
10-14∶10-13∶10-7∶10-7=1∶10∶107∶107。
13.已知水在25 ℃和95 ℃时,水电离平衡曲线如图所示:
(1)95 ℃时,水的电离平衡曲线应为B,请说明理由:______________________________
____________________________。
水的电离是吸热过程,温度高时,
电离程度大,c(H+)、c(OH-)大
4、下表是不同温度下水的离子积数据:试回答下列问题:
(1)若25”“<”或“=”)1×10-14,做出此判断的理由是
_____________________________________________________________。
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为
_________________。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_______________mol·L-1。
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
>
5.76×10-9
2.4×10-7mol·L-1
14.某学生为探究Kw的影响因素,做了以下实验。
(1)查阅资料,不同温度下水的离子积常数如表所示。
t/ ℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
由此推出:随着温度的升高,Kw (填“增大”或“减小”,下同),水的电离程度 ;水的电离平衡向 (填“左”或“右”)移动,水的电离过程是 (填“吸热”或“放热”)过程。
增大
增大
右
吸热
作业:大本64-65页
1. 温度升高,促进水的电离,Kw增大;
2. 酸、碱抑制水的电离,Kw不变;
3. 外加能与H+、OH- 反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。
上节课小结:水的电离的影响因素
25℃时,Kw=c(H+)·c(OH-) =1×10-14
100℃时,Kw=c(H+)·c(OH-) =1×10-12
2.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内(不包括边界)任意点均有c(H+)<
c(OH-)
C.图中T1
√
大本P63
12.水的电离常数如图所示,曲线上的点都符合c(H+)·c(OH-)=常数,下列说法错误的是
A.图中温度:T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将0.005 mol·L-1的硫酸溶
液与由水电离的c(H+)=1.0×10-12 mol·L-1的KOH溶液等体积混合后,溶液显碱性
√
小本P184
Kw应用2:水的电离平衡曲线的理解与识别
13.(1)某温度时,水的Kw=1×10-12,则该温度 (填“>”“<”或“=”)25 ℃,其理由是___________________________。
>
升温促进水的电离,Kw增大
(2)该温度下,c(H+)=1×10-7 mol·L-1的溶液呈 (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)= mol·L-1。
碱性
1×10-7
小本185页
(4)25 ℃时,下列0.1 mol·L-1的6种溶液,水电离出的c(H+)由大到小的________________________ (填序号)。
①盐酸 ②H2SO4 ③CH3COOH(Ka=1.8×10-5) ④NH3·H2O(氨水)(Kb=1.8×10-5) ⑤NaOH ⑥Ba(OH)2
③=④>①=⑤>②=⑥
酸、碱抑制水的电离,Kw不变;
7.一定温度下,用水稀释0.1 mol·L-1的一元弱酸HA溶液,随着稀释的进行,下列一定增大的是
√
3.22溶液的酸碱性与pH
学习目标
1、理解溶液的pH及pH跟溶液中c(H+) 之间的关系
2、学会有关pH的简单计算
3、了解pH的简单测定方法
4、了解溶液pH的调控在工农业生产和科学研究中的应用
核心素养
证据推理与模型认知:通过分析、推理等方法知道溶液pH的概念、溶液酸碱性与pH的关系,建立溶液酸碱性判断的思维模型。
课本P64【思考与讨论】
体系 纯水 向纯水中加入 少量盐酸 向纯水中加入少量 NaOH溶液
c(H+)
c(OH-)
c(H+)和c(OH-)的大小比较
溶液的酸碱性
10-7 mol/L
中性
10-7 mol/L
c(H+) = c(OH-)
减小
增大
增大
减小
碱性
酸性
c(H+) > c(OH-)
c(H+) < c(OH-)
二、溶液的酸碱性与c(H+) 、c(OH-)的关系
酸性溶液中存在OH-,碱性溶液中存在H+。因为在水溶液中存在
H2O H+ +OH-
(2)
(1)
1、溶液的酸碱性与c(H+)、c(OH-)的关系
溶液酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
c(H+) > c(OH-)
c(H+) < c(OH-)
中性
酸性
碱性
c(H+) = c(OH-)
任意条件,溶液酸碱性的判断依据:
只有常温时:KW= 1×10-14
中性:c(H+) =1×10-7
酸性:c(H+) >1×10-7
碱性:c(H+) <1×10-7
【练习1】c(H+)>1.0×10-7mol/L的溶液一定呈酸性吗?
如何判断溶液的酸碱性?
判断溶液酸、碱性,只能通过比较c(H+)和c(OH-)的相对大小。
(2)表达式 : pH= 。
(1)溶液pH的定义:H+的物质的量浓度的负对数
﹣lgc(H+)
c(H+) = 10-pH mol/L
25℃下,1.0×10-2mol/L 的HCl溶液的c(H+) =_____mol/L,pH= ___
2
25℃下,1.0×10-2mol/L 的NaOH溶液的c(H+) =_____mol/L,pH= ___
12
10-12
10-2
(3)意义:pH越大,溶液碱性越 ,c(H+)越 。
pH越小,溶液酸性越 ,c(H+)越 。
强
强
小
大
2、pH表示溶液酸碱性:
【练习】计算下列溶液的PH值:
中性
酸性
碱性
[H+]
mol/L
pH
100
10-1
10-2
10-3
10-14
10-4
10-13
10-11
10-12
10-10
10-9
10-8
10-5
10-6
10-7
0
1
2
3
4
5
7
8
9
10
11
12
13
14
6
室温下水溶液中pH、 c(H+)与酸碱性的关系图:
室温(25℃)下
pH=7, c(H+) = c(OH-),溶液显中性;
pH<7, c(H+) > c(OH-),溶液显酸性;
pH>7, c(H+) < c(OH-),溶液显碱性。
(4)溶液适用范围:
1×10-14 mol·L-1 ≤ c(H+) ≤ 1 mol·L-1
(5)PH范围:0~14
PH=0? PH=1?
2、pH表示溶液酸碱性:
【思考交流】pH=7的溶液一定呈中性吗
不一定。
在25 ℃时,pH=7的溶液呈中性。
温度高于25 ℃时,水的电离程度增大,KW >1.0×10-14,此时pH=7呈碱性。
判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH大小,只有满足c(H+)=c(OH-)的溶液才一定呈中性。
25℃时,Kw=c(H+)·c(OH-) =1×10-14
100℃时,Kw=c(H+)·c(OH-) =1×10-12
1.下列关于溶液的酸碱性,说法正确的是
A.pH=7的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1
C.c(OH-)=c(H+)的溶液呈中性
D.在100 ℃时,纯水的pH<7,因此显酸性
√
大本65页
(1)定性测量:酸碱指示剂
只能粗略测定溶液的pH范围,不能准确测定出pH的具体值
指示剂 变色范围(pH) 遇酸的颜色 遇碱的颜色
甲基橙
石蕊
酚酞
3.1
4.4
橙色
红色
(pH<3.1)
黄色
(pH>4.4)
5.0
8.0
紫色
红色
(pH<5.0)
蓝色
(pH>8.0)
8.2
10.0
粉红色
无色
(pH<8.2)
红色
(pH>10.0)
3、溶液pH的测量:
(2)定量测量——pH试纸法
②种类
①pH试纸是将试纸用多种酸碱指示剂的混合溶液浸透,经晾干制成的。它对不同pH的溶液能显示不同的颜色,可用于讯速测定溶液的pH。
广泛pH试纸:其pH范围是 (最常用),可以识别的pH差约为 。
精密pH试纸:可判别0.2或0.3的pH差值。
专用pH试纸:用于酸性、中性或碱性溶液。
1~14
1
3、溶液pH的测量:
课本65页
2.用广泛pH试纸测得的pH是整数,不会有小数
③使用方法:使用pH试纸的正确操作:取一小块pH试纸于干燥洁净的_____________
_____,用干燥洁净的玻璃棒蘸取待测液点在试纸上,当试纸颜色变化稳定后迅速与 对照,读出pH。
比色卡
1.测定溶液的pH时,不能将试纸用水润湿。 (将溶液稀释,导致所测定的pH不准确)
3、溶液pH的测量:
玻璃片或表面
皿上
标准比色卡
通过电子仪器,把仪器的探棒放入溶液即可在显示屏上读出数据,该法精确度高。
3、溶液pH的测量:
课本65页
(2)定量测量——pH计法(可精确到0.1)
4.用pH试纸测定溶液pH的正确操作是
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸中央,
再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测
液点在试纸中央,再与标准比色卡对照
C.将一小块试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色
卡对照
D.将一小块试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准
比色卡对照
√
小本185页
(1)任何温度下,如果c(H+)不等于c(OH-),则溶液一定呈现酸碱性( )
(2)某溶液的pH=7,该溶液一定显中性( )
(3)升高温度水的电离程度增大,酸性增强( )
(4)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低( )
(5)用广泛pH试纸测得某溶液的pH为3.4( )
(6)用pH计测得某溶液的pH为7.45( )
√
×
×
×
×
正误判断
√
25℃时,Kw=c(H+)·c(OH-) =1×10-14
100℃时,Kw=c(H+)·c(OH-) =1×10-12
5.下列溶液一定呈中性的是
A.由非电解质溶于水得到的溶液
B.c(OH-)、c(H+)均为5.0×10-7 mol·L-1的溶液
C.等物质的量的强酸与强碱反应得到的溶液
D.将c(OH-)=10-5 mol·L-1的烧碱溶液稀释到原来的100倍所得到的溶液
√
小本185页
10.25 ℃时,在等体积的①0.5 mol·L-1的H2SO4溶液;②0.05 mol·L-1的Ba(OH)2溶液;③1 mol·L-1的NaCl溶液;④纯水中由水电离出的H+的物质的量之比是
A.1∶10∶107∶107 B.107∶107∶1∶1
C.107∶106∶2∶2 D.107∶106∶(2×107)∶2
√
小本P184
A.25 ℃时,0.5 mol·L-1的H2SO4溶液中c(H+)=1 mol·L-1,由水电离出的c水(H+)=10-14 mol·L-1;
B.0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.1 mol·L-1,由水电离出的c水(H+)=10-13 mol·L-1;
10-14∶10-13∶10-7∶10-7=1∶10∶107∶107。
13.已知水在25 ℃和95 ℃时,水电离平衡曲线如图所示:
(1)95 ℃时,水的电离平衡曲线应为B,请说明理由:______________________________
____________________________。
水的电离是吸热过程,温度高时,
电离程度大,c(H+)、c(OH-)大
4、下表是不同温度下水的离子积数据:试回答下列问题:
(1)若25
_____________________________________________________________。
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为
_________________。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_______________mol·L-1。
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
>
5.76×10-9
2.4×10-7mol·L-1
14.某学生为探究Kw的影响因素,做了以下实验。
(1)查阅资料,不同温度下水的离子积常数如表所示。
t/ ℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
由此推出:随着温度的升高,Kw (填“增大”或“减小”,下同),水的电离程度 ;水的电离平衡向 (填“左”或“右”)移动,水的电离过程是 (填“吸热”或“放热”)过程。
增大
增大
右
吸热
作业:大本64-65页
