3.3.1 金属晶体 离子晶体课件(共47张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3.1 金属晶体 离子晶体课件(共47张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 13:46:41 | ||
图片预览








文档简介
(共47张PPT)
金属晶体 离子晶体
JINGSHUJINGTI LIZIJINGTI
晶体结构与性质
目录
金属键与金属晶体
金属晶体的结构和性质
离子键与离子晶体
离子晶体的结构和性质
当堂小结
CONTENTS
新知导入
金属有哪些物理通性呢 金属为什么具有这些物理通性呢
金属键与金属晶体
电子气
金属原子脱落下来的价电子形成遍布整块晶体的 “电子气”,被所有原子所共有,从而把所有的金属原子维系在一起。
金属键与金属晶体
金属键
概念:金属离子和自由电子之间的强烈的相互作用
成键微粒:金属阳离子、自由电子
成键本质:金属阳离子与自由电子之间的强烈的静电作用
特征:无方向性和饱和性,成键电子可以在金属中自由流动
电子气理论:金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共有,从而把所有金属原子维系在一起,这一理论称为“电子气理论”
金属键与金属晶体
定义:金属原子之间通过金属键相互结合形成的晶体
构成粒子:金属阳离子和自由电子
微粒间的作用力:金属键
在金属晶体中只有阳离子,没有阴离子
晶体中有阳离子不一定有阴离子,若有阴离子,则一定有阳离子
(2) 在金属晶体中,不存在单个分子或原子
金属晶体是一种“巨分子”
金属键与金属晶体
金属晶体
金属晶体的结构和性质
金属晶体的结构和性质
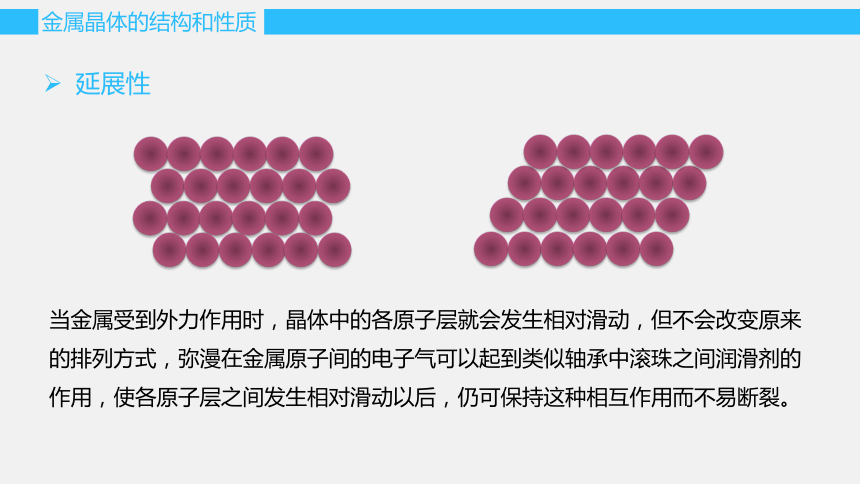
延展性
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,使各原子层之间发生相对滑动以后,仍可保持这种相互作用而不易断裂。
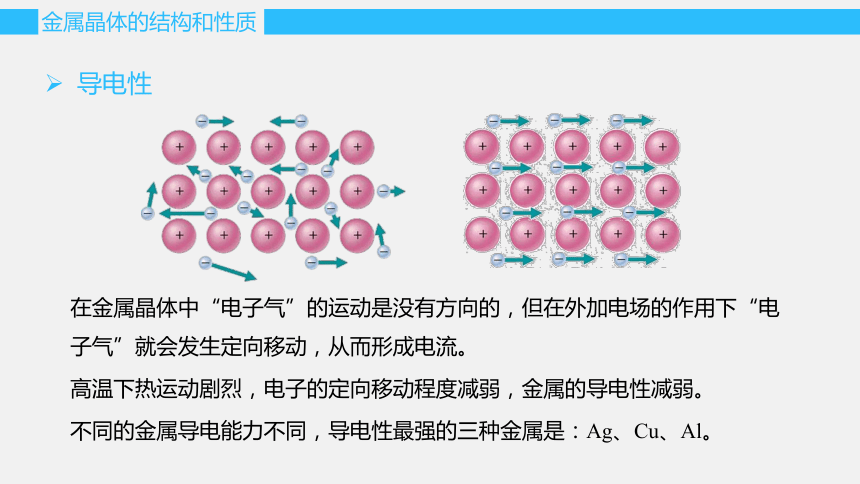
导电性
在金属晶体中“电子气”的运动是没有方向的,但在外加电场的作用下“电子气”就会发生定向移动,从而形成电流。
高温下热运动剧烈,电子的定向移动程度减弱,金属的导电性减弱。
不同的金属导电能力不同,导电性最强的三种金属是:Ag、Cu、Al。
金属晶体的结构和性质
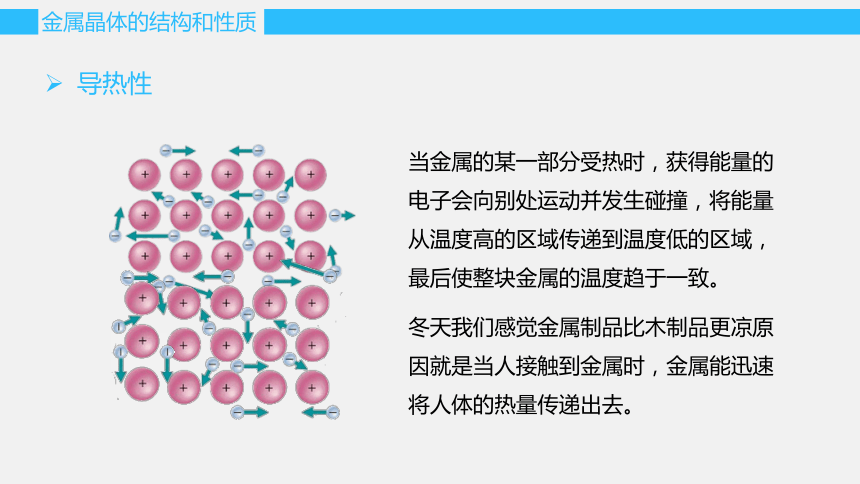
当金属的某一部分受热时,获得能量的电子会向别处运动并发生碰撞,将能量从温度高的区域传递到温度低的区域,最后使整块金属的温度趋于一致。
导热性
冬天我们感觉金属制品比木制品更凉原因就是当人接触到金属时,金属能迅速将人体的热量传递出去。
金属晶体的结构和性质
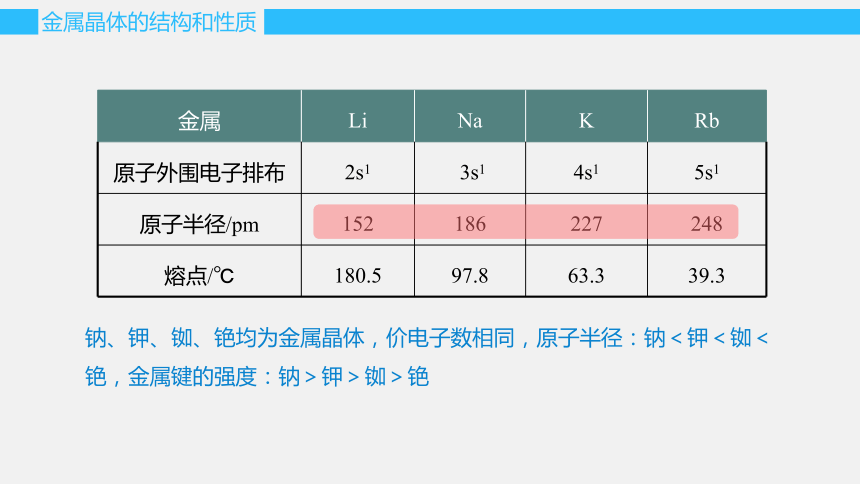
金属 Li Na K Rb
原子外围电子排布 2s1 3s1 4s1 5s1
原子半径/pm 152 186 227 248
熔点/℃ 180.5 97.8 63.3 39.3
钠、钾、铷、铯均为金属晶体,价电子数相同,原子半径:钠<钾<铷<铯,金属键的强度:钠>钾>铷>铯
金属晶体的结构和性质
金属 Na Mg Al Cr
原子外围电子排布 3s1 3s2 3s23p1 3d54s1
原子半径/pm 186 160 143.1 124.9
熔点/℃ 97.8 650 660 1900
三者均为金属晶体,单位体积内自由电子数目:Na<Mg<Al;原子半径:Na>Mg>Al,金属键强度:钠<镁<铝
金属晶体的结构和性质
金属 Na Mg Al Cr
原子外围电子排布 3s1 3s2 3s23p1 3d54s1
原子半径/pm 186 160 143.1 124.9
熔点/℃ 97.8 650 660 1900
金属晶体的熔点差别很大
金属晶体的结构和性质
同一主族金属原子半径越来越大,单位体积内自由电子数减少,故熔点越来越低,硬度越来越小
影响金属键强弱的因素:
(1) 金属元素的原子半径
(2) 单位体积内自由电子的数目
同一周期金属原子半径越来越小,单位体积内自由电子数增加,故熔点越来越高,硬度越来越大
金属键的原子半径越小,单位体积内自由电子的数目越多,金属键越强
金属晶体的结构和性质
合 金
白铜
青铜
黄铜
金属晶体中还有大量的合金。大多数合金是以一种金属为主要组成,如以铁为主要成分的碳钢、锰钢、不锈钢等,以铜为主要成分的黄铜、青铜、白铜等。
金属晶体的结构和性质
白铜
青铜
黄铜
金属在形成合金时是向金属晶体中掺入不同的金属或非金属,就像滚珠之间掺入了细小而坚硬的砂土或碎石一样,会使金属的延展性、硬度等性能发生改变。
金属晶体的结构和性质
合 金
对点练习
1.下列关于金属键的叙述中,正确的是( )
A. 金属键是金属阳离子和自由电子间的强烈相互作用,不是一种电性作用
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所 以与共价键类似,也有方向性和饱和性
C. 金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键 有饱和性和方向性
D. 构成金属键的自由电子在整个金属内部的三维空间中做自由运动
D
对点练习
【解析】从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用,特征都是无方向性和饱和性,自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键与共价键有类似之处,但两者又有明显的不同,如金属键无方向性和饱和性。
对点练习
2.(双选)铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
δ-Fe
γ-Fe
α-Fe
1349℃
912℃
2.(双选)铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
对点练习
A. δ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有8个
B. γ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有12个
C. α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3∶a3
D. 将铁加热到1500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
CD
对点练习
【解析】δ-Fe中心Fe与8个顶点上的Fe相接触,晶胞含铁原子1+8×=2;γ-Fe中与相邻铁原子距离相等且最近的铁原子有12个,晶胞含铁原子8×+6×=4,则α-Fe和γ-Fe两种晶体的密度比为=b3∶4a3;由转化温度可以看出急速冷却和缓慢冷却分别到两种不同类型的晶体,C、D错误,A、B正确。
对点练习
3.如图为二维平面晶体示意图,所表示物质的化学式为AX3的是 。
b
【解析】由图甲中直接相邻的原子数可以求得a、b中两类原子数之比分别为1∶2、1∶3,求出化学式分别为AX2、AX3,答案为b。
对点练习
4.图为一个金属铜的晶胞,该晶胞“实际”拥有铜原子数是 个。
8× +6× =4
4
新课导入
+11
+17
+11
Cl-
Na+
+17
+11
离子键与离子晶体
离子键与离子晶体
阴阳离子间通过静电作用所形成的强烈的相互作用
阴阳离子
静电作用(静电引力和斥力)
阴、阳离子接近到某一定距离时,吸引和排斥达到平衡即形成离子键
定义
成键微粒
键的本质
成键过程
Cl-
Na+
离子键
离子键
通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,则一个离子可以同时吸引多个带相反电荷的离子,因此离子键没有方向性和饱和性。
Cl-
Na+
Cl-
Cl-
Cl-
Cl-
Na+
Na+
Na+
Na+
离子键与离子晶体
离子晶体
包括:强碱、活泼金属氧化物、大部分盐类
定义:离子间通过离子键结合而成的晶体
性质:熔、沸点较高,硬度较大,难挥发、难压缩,
水溶液或者熔融状态下导电
一般阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔沸点越高。
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
离子键与离子晶体
离子晶体
包括:强碱、活泼金属氧化物、大部分盐类
定义:离子间通过离子键结合而成的晶体
性质:熔、沸点较高,硬度较大,难挥发、难压缩,
水溶液或者熔融状态下导电
阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
离子键与离子晶体
离子晶体的结构和性质
离子晶体的结构和性质
1
5
4
2
3
6
Cl-
Na+
1
5
4
2
3
6
氯化钠晶体结构
(1) 钠离子、氯离子的位置
Na+ :面心和顶点
Cl- :体心和棱中点
Cl-位于Na+组成的正八面体空隙中
每个Na+周围与之等距且最近的Cl-有6个,Na+有12个;每个Cl-周围与之等距且最近的Na+有6个,Cl-有12个
离子晶体的结构和性质
氯化钠晶体结构
(2) 晶胞含钠离子、氯离子的个数
Cl-:12×+1=4
Na+:8×+6×=4
离子晶体的结构和性质
氯化铯晶体结构
离子晶体的结构和性质
(1) 每个Cs+同时吸引8个Cl-,每个Cl-同时吸引8个Cs+
(3) 每个晶胞中含有的粒子个数
(2) 每个Cs+周围与它最近的且距离相等的Cs+有6个
氯化铯晶体结构
Cs+:
8
Cl-:
8×+6×+12×=8
离子晶体的结构和性质
方 法 技 巧
(1)利用物质的分类
金属离子和酸根离子、OH-形成的大多数盐、强碱、活泼金属的氧化物和过氧化物(如Na2O和Na2O2)、活泼金属的氢化物(如NaH)、活泼金属的硫化物
离子晶体的判断
(2)利用元素的性质和种类
成键元素的电负性差值大于1.7的物质,金属元素(特别是活泼的金属元素如ⅠA、ⅡA族元素)与非金属元素(特别是活泼的非金属元素,ⅥA、ⅦA族元素)组成的化合物
离子晶体的结构和性质
方 法 技 巧
离子晶体的判断
(3)利用物质的性质
离子晶体一般具有较高的熔、沸点,难挥发,硬而脆;固体不导电,但熔融或溶于水时能导电,大多数离子晶体易溶于极性溶剂而难溶于非极性溶剂。
离子晶体的结构和性质
科学·技术·社会
化合物 熔点/℃
CaO 2613
NH4NO3 170
Ca(H2PO4)2 109
C2H5NH3NO3 12
随着离子晶体中阴、阳离子体积的增大,物质的熔点越来越低。有的离子晶体的熔点稍高于室温或低于室温,称为离子液体。
科学·技术·社会
大多数离子液体含有体积很大的阴、阳离子。常见的阴离子如四氯铝酸根()、六氟磷酸根()、四氟硼酸根()等,常见的阳离子如季铵离子(R4N+,即的—H被烃基—R取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺阳离子等。
传统的有机溶剂大多易挥发,它们的蒸气大多有毒,而离子液体却有难挥发的优点,这是由于离子液体的粒子全都是带电荷的离子。
1-丁基-3-甲基咪唑六氟磷酸盐
科学·技术·社会
离子液体可用作溶剂。如有一种叫天丝的织物纤维,是将树木的纤维素分子溶于一种离子液体,滤去不溶的木质素后,加水析出纤维素分子组装成的再生植物纤维。离子液体有良好的导电性,用作电化学研究的电解质,并被开发为原电池的电解质。许多离子液体被用于有机合成的溶剂和催化剂,如合成药物。离子液体在生物化学等科研领域也有广泛应用。
当堂小结
离子晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
典 型 晶 体
金属晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
1.高温下,超氧化钾晶体呈立方体结构,晶胞结构如图,晶体中氧的化合价部分为0,部分为-2。下列说法正确的是( )
对点练习
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧元素与-2价氧元素的原子个数之比为1∶3
A
对点练习
【解析】在一个超氧化钾晶胞中,含K+数为8×+6×=4, 数为12×+1=4,故化学式为KO2,且每个晶胞中含有4个K+和4个 ,A正确;晶体中每个K+周围有6个,每个周围有6个K+,B错误;晶体中与每个K+最近距离的K+有12个,C错误;设0价氧原子个数为x,-2价氧原子个数为y,根据KO2为电中性物质,得:2y==3∶1,D错误。
对点练习
2.某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A. B2A B. BA2
C. B7A4 D. B4A7
B
对点练习
【解析】A位于晶胞的体内,共8个,B位于晶胞的顶点和面心,晶胞中B的个数为8×+6×=4,则B与A的离子个数为4∶8=1∶2,则化学式为BA2,B正确。
本节内容结束
金属晶体 离子晶体
JINGSHUJINGTI LIZIJINGTI
晶体结构与性质
目录
金属键与金属晶体
金属晶体的结构和性质
离子键与离子晶体
离子晶体的结构和性质
当堂小结
CONTENTS
新知导入
金属有哪些物理通性呢 金属为什么具有这些物理通性呢
金属键与金属晶体
电子气
金属原子脱落下来的价电子形成遍布整块晶体的 “电子气”,被所有原子所共有,从而把所有的金属原子维系在一起。
金属键与金属晶体
金属键
概念:金属离子和自由电子之间的强烈的相互作用
成键微粒:金属阳离子、自由电子
成键本质:金属阳离子与自由电子之间的强烈的静电作用
特征:无方向性和饱和性,成键电子可以在金属中自由流动
电子气理论:金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共有,从而把所有金属原子维系在一起,这一理论称为“电子气理论”
金属键与金属晶体
定义:金属原子之间通过金属键相互结合形成的晶体
构成粒子:金属阳离子和自由电子
微粒间的作用力:金属键
在金属晶体中只有阳离子,没有阴离子
晶体中有阳离子不一定有阴离子,若有阴离子,则一定有阳离子
(2) 在金属晶体中,不存在单个分子或原子
金属晶体是一种“巨分子”
金属键与金属晶体
金属晶体
金属晶体的结构和性质
金属晶体的结构和性质
延展性
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,使各原子层之间发生相对滑动以后,仍可保持这种相互作用而不易断裂。
导电性
在金属晶体中“电子气”的运动是没有方向的,但在外加电场的作用下“电子气”就会发生定向移动,从而形成电流。
高温下热运动剧烈,电子的定向移动程度减弱,金属的导电性减弱。
不同的金属导电能力不同,导电性最强的三种金属是:Ag、Cu、Al。
金属晶体的结构和性质
当金属的某一部分受热时,获得能量的电子会向别处运动并发生碰撞,将能量从温度高的区域传递到温度低的区域,最后使整块金属的温度趋于一致。
导热性
冬天我们感觉金属制品比木制品更凉原因就是当人接触到金属时,金属能迅速将人体的热量传递出去。
金属晶体的结构和性质
金属 Li Na K Rb
原子外围电子排布 2s1 3s1 4s1 5s1
原子半径/pm 152 186 227 248
熔点/℃ 180.5 97.8 63.3 39.3
钠、钾、铷、铯均为金属晶体,价电子数相同,原子半径:钠<钾<铷<铯,金属键的强度:钠>钾>铷>铯
金属晶体的结构和性质
金属 Na Mg Al Cr
原子外围电子排布 3s1 3s2 3s23p1 3d54s1
原子半径/pm 186 160 143.1 124.9
熔点/℃ 97.8 650 660 1900
三者均为金属晶体,单位体积内自由电子数目:Na<Mg<Al;原子半径:Na>Mg>Al,金属键强度:钠<镁<铝
金属晶体的结构和性质
金属 Na Mg Al Cr
原子外围电子排布 3s1 3s2 3s23p1 3d54s1
原子半径/pm 186 160 143.1 124.9
熔点/℃ 97.8 650 660 1900
金属晶体的熔点差别很大
金属晶体的结构和性质
同一主族金属原子半径越来越大,单位体积内自由电子数减少,故熔点越来越低,硬度越来越小
影响金属键强弱的因素:
(1) 金属元素的原子半径
(2) 单位体积内自由电子的数目
同一周期金属原子半径越来越小,单位体积内自由电子数增加,故熔点越来越高,硬度越来越大
金属键的原子半径越小,单位体积内自由电子的数目越多,金属键越强
金属晶体的结构和性质
合 金
白铜
青铜
黄铜
金属晶体中还有大量的合金。大多数合金是以一种金属为主要组成,如以铁为主要成分的碳钢、锰钢、不锈钢等,以铜为主要成分的黄铜、青铜、白铜等。
金属晶体的结构和性质
白铜
青铜
黄铜
金属在形成合金时是向金属晶体中掺入不同的金属或非金属,就像滚珠之间掺入了细小而坚硬的砂土或碎石一样,会使金属的延展性、硬度等性能发生改变。
金属晶体的结构和性质
合 金
对点练习
1.下列关于金属键的叙述中,正确的是( )
A. 金属键是金属阳离子和自由电子间的强烈相互作用,不是一种电性作用
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所 以与共价键类似,也有方向性和饱和性
C. 金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键 有饱和性和方向性
D. 构成金属键的自由电子在整个金属内部的三维空间中做自由运动
D
对点练习
【解析】从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用,特征都是无方向性和饱和性,自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键与共价键有类似之处,但两者又有明显的不同,如金属键无方向性和饱和性。
对点练习
2.(双选)铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
δ-Fe
γ-Fe
α-Fe
1349℃
912℃
2.(双选)铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
对点练习
A. δ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有8个
B. γ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有12个
C. α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3∶a3
D. 将铁加热到1500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
CD
对点练习
【解析】δ-Fe中心Fe与8个顶点上的Fe相接触,晶胞含铁原子1+8×=2;γ-Fe中与相邻铁原子距离相等且最近的铁原子有12个,晶胞含铁原子8×+6×=4,则α-Fe和γ-Fe两种晶体的密度比为=b3∶4a3;由转化温度可以看出急速冷却和缓慢冷却分别到两种不同类型的晶体,C、D错误,A、B正确。
对点练习
3.如图为二维平面晶体示意图,所表示物质的化学式为AX3的是 。
b
【解析】由图甲中直接相邻的原子数可以求得a、b中两类原子数之比分别为1∶2、1∶3,求出化学式分别为AX2、AX3,答案为b。
对点练习
4.图为一个金属铜的晶胞,该晶胞“实际”拥有铜原子数是 个。
8× +6× =4
4
新课导入
+11
+17
+11
Cl-
Na+
+17
+11
离子键与离子晶体
离子键与离子晶体
阴阳离子间通过静电作用所形成的强烈的相互作用
阴阳离子
静电作用(静电引力和斥力)
阴、阳离子接近到某一定距离时,吸引和排斥达到平衡即形成离子键
定义
成键微粒
键的本质
成键过程
Cl-
Na+
离子键
离子键
通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,则一个离子可以同时吸引多个带相反电荷的离子,因此离子键没有方向性和饱和性。
Cl-
Na+
Cl-
Cl-
Cl-
Cl-
Na+
Na+
Na+
Na+
离子键与离子晶体
离子晶体
包括:强碱、活泼金属氧化物、大部分盐类
定义:离子间通过离子键结合而成的晶体
性质:熔、沸点较高,硬度较大,难挥发、难压缩,
水溶液或者熔融状态下导电
一般阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔沸点越高。
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
离子键与离子晶体
离子晶体
包括:强碱、活泼金属氧化物、大部分盐类
定义:离子间通过离子键结合而成的晶体
性质:熔、沸点较高,硬度较大,难挥发、难压缩,
水溶液或者熔融状态下导电
阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
离子键与离子晶体
离子晶体的结构和性质
离子晶体的结构和性质
1
5
4
2
3
6
Cl-
Na+
1
5
4
2
3
6
氯化钠晶体结构
(1) 钠离子、氯离子的位置
Na+ :面心和顶点
Cl- :体心和棱中点
Cl-位于Na+组成的正八面体空隙中
每个Na+周围与之等距且最近的Cl-有6个,Na+有12个;每个Cl-周围与之等距且最近的Na+有6个,Cl-有12个
离子晶体的结构和性质
氯化钠晶体结构
(2) 晶胞含钠离子、氯离子的个数
Cl-:12×+1=4
Na+:8×+6×=4
离子晶体的结构和性质
氯化铯晶体结构
离子晶体的结构和性质
(1) 每个Cs+同时吸引8个Cl-,每个Cl-同时吸引8个Cs+
(3) 每个晶胞中含有的粒子个数
(2) 每个Cs+周围与它最近的且距离相等的Cs+有6个
氯化铯晶体结构
Cs+:
8
Cl-:
8×+6×+12×=8
离子晶体的结构和性质
方 法 技 巧
(1)利用物质的分类
金属离子和酸根离子、OH-形成的大多数盐、强碱、活泼金属的氧化物和过氧化物(如Na2O和Na2O2)、活泼金属的氢化物(如NaH)、活泼金属的硫化物
离子晶体的判断
(2)利用元素的性质和种类
成键元素的电负性差值大于1.7的物质,金属元素(特别是活泼的金属元素如ⅠA、ⅡA族元素)与非金属元素(特别是活泼的非金属元素,ⅥA、ⅦA族元素)组成的化合物
离子晶体的结构和性质
方 法 技 巧
离子晶体的判断
(3)利用物质的性质
离子晶体一般具有较高的熔、沸点,难挥发,硬而脆;固体不导电,但熔融或溶于水时能导电,大多数离子晶体易溶于极性溶剂而难溶于非极性溶剂。
离子晶体的结构和性质
科学·技术·社会
化合物 熔点/℃
CaO 2613
NH4NO3 170
Ca(H2PO4)2 109
C2H5NH3NO3 12
随着离子晶体中阴、阳离子体积的增大,物质的熔点越来越低。有的离子晶体的熔点稍高于室温或低于室温,称为离子液体。
科学·技术·社会
大多数离子液体含有体积很大的阴、阳离子。常见的阴离子如四氯铝酸根()、六氟磷酸根()、四氟硼酸根()等,常见的阳离子如季铵离子(R4N+,即的—H被烃基—R取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺阳离子等。
传统的有机溶剂大多易挥发,它们的蒸气大多有毒,而离子液体却有难挥发的优点,这是由于离子液体的粒子全都是带电荷的离子。
1-丁基-3-甲基咪唑六氟磷酸盐
科学·技术·社会
离子液体可用作溶剂。如有一种叫天丝的织物纤维,是将树木的纤维素分子溶于一种离子液体,滤去不溶的木质素后,加水析出纤维素分子组装成的再生植物纤维。离子液体有良好的导电性,用作电化学研究的电解质,并被开发为原电池的电解质。许多离子液体被用于有机合成的溶剂和催化剂,如合成药物。离子液体在生物化学等科研领域也有广泛应用。
当堂小结
离子晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
典 型 晶 体
金属晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
1.高温下,超氧化钾晶体呈立方体结构,晶胞结构如图,晶体中氧的化合价部分为0,部分为-2。下列说法正确的是( )
对点练习
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧元素与-2价氧元素的原子个数之比为1∶3
A
对点练习
【解析】在一个超氧化钾晶胞中,含K+数为8×+6×=4, 数为12×+1=4,故化学式为KO2,且每个晶胞中含有4个K+和4个 ,A正确;晶体中每个K+周围有6个,每个周围有6个K+,B错误;晶体中与每个K+最近距离的K+有12个,C错误;设0价氧原子个数为x,-2价氧原子个数为y,根据KO2为电中性物质,得:2y==3∶1,D错误。
对点练习
2.某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A. B2A B. BA2
C. B7A4 D. B4A7
B
对点练习
【解析】A位于晶胞的体内,共8个,B位于晶胞的顶点和面心,晶胞中B的个数为8×+6×=4,则B与A的离子个数为4∶8=1∶2,则化学式为BA2,B正确。
本节内容结束
