3.2.1 分子晶体课件(共38张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.1 分子晶体课件(共38张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 13:48:37 | ||
图片预览









文档简介
(共38张PPT)
分子晶体
FENZIJINGTI
晶体结构与性质
目录
分子晶体的定义
常见的分子晶体
分子晶体的物理特性
分子晶体的结构
当堂小结
CONTENTS
新知导入
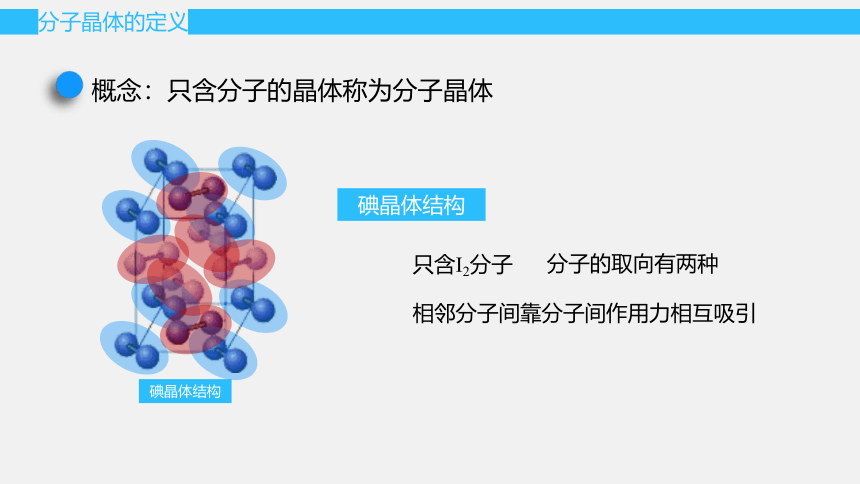
碘晶体结构
构成它们的基本粒子是什么?粒子之间通过什么作用力结合
分析碘晶胞示意图,计算一个晶胞中平均含有几个碘原子
分子晶体的定义
分子晶体的定义
碘晶体结构
只含I2分子
碘晶体结构
相邻分子间靠分子间作用力相互吸引
分子的取向有两种
概念:只含分子的晶体称为分子晶体
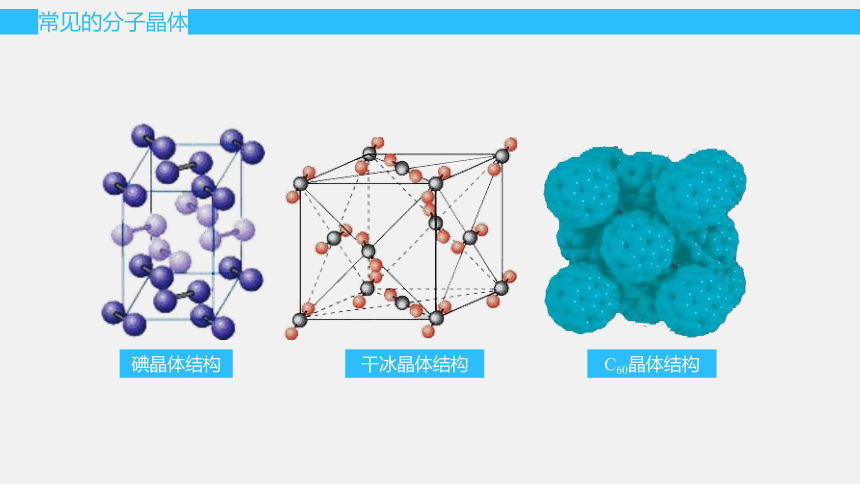
常见的分子晶体
常见的分子晶体
碘晶体结构
C60晶体结构
干冰晶体结构
绝大多数有机物: 乙醇,冰醋酸,蔗糖
所有非金属氢化物:H2O,H2S,NH3,CH4,HX
部分非金属单质: X2 , O2 , S8 , P4 , C60 、稀有气体等
部分非金属氧化物: CO2 , SO2 , NO2 , P4O6 , P4O10
几乎所有的酸:H2SO4 , HNO3 , H3PO4
典型的分子晶体
常见的分子晶体
X2 , O2 , S8 , P4 , C60
均属于非金属单质
所有的非金属单质均属于分子晶体吗?
乙醇,冰醋酸,蔗糖
H2O,H2S,NH3,CH4,HX
CO2 , SO2 , NO2 , P4O6 , P4O10
H2SO4 , HNO3 , H3PO4
均属于共价化合物
所有的共价化合物均属于分子晶体吗?
SiO2
金刚石等
常见的分子晶体
方 法 技 巧
(1)依据物质的类别判断:部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体都是分子晶体。
(2)依据组成晶体的粒子及粒子间作用判断:组成晶体的粒子是分子、粒子间作用是分子间作用力的是分子晶体。
(3)依据物质的性质判断:硬度小,熔、沸点低,在熔融状态或固体时均不导电的是分子晶体。
分子晶体的判断方法
常见的分子晶体
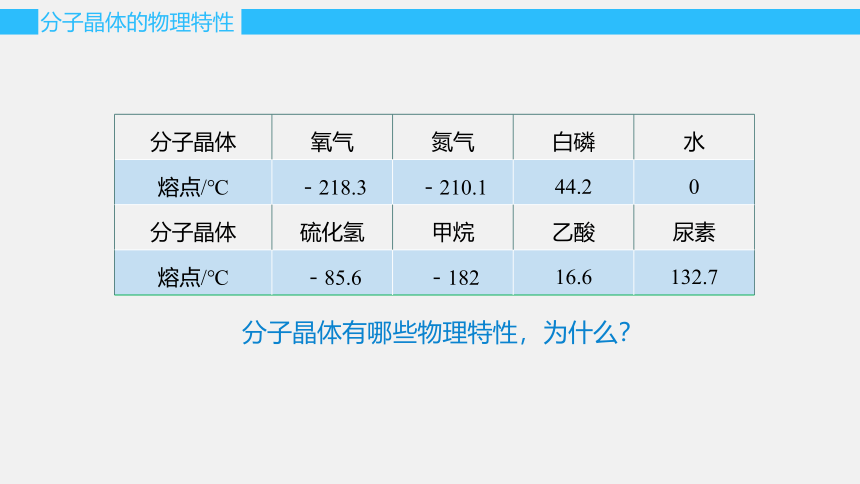
分子晶体的物理特性
分子晶体的物理特性
分子晶体有哪些物理特性,为什么?
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
较低的熔、沸点
较小的硬度
一般都是绝缘体,熔融状态也不导电
分子晶体在固态和熔融状态下不存在自由移动的离子或电子,因而在固态和熔融状态下都不能导电。
分子晶体熔化时破坏的是分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,且硬度较小。
分子晶体的物理特性
分子晶体的物理特性
方 法 技 巧
分子晶体熔沸点高低的判断
(2) 非金属氢化物分子间若含有氢键,熔、沸点比同族元素的氢化物反常得高,如H2O>H2Te>H2Se> H2S。
(5) 同分异构体的支链越多,熔、沸点越低。
(1) 组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
(3) 相对分子质量接近的物质,分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
(4) 烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子的增加,熔、沸点升高。
分子晶体的物理特性
分子晶体的结构
分子晶体的结构
二氧化碳分子
与CO2分子距离最近的CO2分子共有12个
与每个二氧化碳分子等距离且最近的二氧化碳分子的个数
8×1/8+6×1/2=4
12个
每个晶胞含二氧化碳分子的个数
二氧化碳分子的位置:在晶体中截取一个最小的正方体,CO2分子的中心位于正方体的八个顶点及每个面的面心上
分子的密堆积
分子晶体的结构
O2的晶体结构
C60的晶体结构
分子的密堆积
分子晶体的结构
分子晶体的结构
H
H
O
H
H
S
分子间作用力包括:
氢键的形成条件:部分裸露的氢原子核;孤电子对
(1) 范德华力
(2) 氢键
无方向性和饱和性
有方向性和饱和性
存在氢键的物质:含有N-H、O-H、F-H的物质中均存在氢键,NH3、N2H4、H2O、H2O2、醇、酚、羧酸、氨基酸等
分子晶体的结构
1个水分子周围有4个水分子
氢键具有方向性和饱和性
分子的非密堆积
分子晶体的结构
为什么冰的密度比水的密度小?对自然界生物有何影响?
分子晶体的结构
冰中1个水分子周围4个水分子
冰融化,氢键减少
空隙减小 密度增大
大量氢键 非密堆积
空隙大 密度小
分子晶体的结构
分子晶体的结构
水结冰时体积增大,密度减小,从而浮在水面上。
冰浮在水面,成为一隔热层,使下面的水温保持在 4 ℃ 左右。结冰时散热,冰融时吸热,这一过程有缓冲水温变化的作用,利于生物的生存。
分子晶体的结构
镁能持续燃烧,镁可以跟二氧化碳反应,干冰有易升华的特性
实验结论:
分子晶体的结构
干冰
冰
外观 硬度
相似或接近
晶体中分子堆积形式
分子间作用力
1个分子周围紧邻分子个数
晶体
干冰和冰的外观相似、硬度接近,Mr(CO2) > Mr(H2O),但为什么干冰的熔点比冰低,但密度比冰的高?
范德华力
密堆积
12 个
4 个
非密堆积
氢键
性质特点
易升华
用途
制冷剂
维持自然界生态平衡
分子晶体的结构
无分子间氢键
分子晶体的结构特征
有分子间氢键
分子密堆积
如:C60、干冰 、I2、O2
如:HF、冰、NH3
分子非密堆积
分子晶体的结构
天然气水合物
20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体,这种晶体的主要成分是甲烷,又称甲烷水合物,它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,又称“可燃冰”。
科学·技术·社会
估计全球的海底和冰川底部藏在天然气水合物中的天然气,总量超过煤、石油、天然气等化石燃料的总和的2倍,是巨大的潜在能源。
气体分子
水分子
科学·技术·社会
当堂小结
结构
性质
应用
分子晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
典 型 晶 体
结 构 特 征
对点练习
1.氯化硼的熔点为 -107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,能水解,有关叙述正确的是( )
A. 氯化硼液态时能导电而固态时不导电
B. 氯化硼加到水中使溶液的pH升高
C. 氯化硼分子呈正三角形,属极性分子
D. 氯化硼遇水蒸气会产生白雾
D
【解析】氯化硼熔、沸点都较低说明其是分子化合物,液态时不导电,A错误;氯化硼水解产生HCl,使溶液pH降低,B错误;其分子构型对称,正负电荷重心重合,属于非极性分子,C错误;氯化硼水解生成的HCl在空气中会形成白雾,D正确。
2.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173 ℃(在100 ℃以上能升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁中, 与Fe2+之间形成的化学键类型是离子键
C. 已知环戊二烯的结构式为 ,则其中仅有1个碳原子采取sp3杂化
D. 中一定含有π键
对点练习
B
对点练习
【解析】
根据二茂铁的物理性质如熔点低、易升华、易溶于有机溶剂等,可知二茂铁为分子晶体,A正确;
碳原子含有孤电子对,铁离子含有空轨道,二者可形成配位键,B错误;
1号碳原子含有4个σ键,无孤电子对,杂化类型为sp3,2、3、4、5号碳原子有3个σ键,无孤电子对,杂化类型为sp2,因此仅有1个碳原子采取sp3杂化,C正确;
中碳原子没有达到饱和,故存在碳碳双键,而碳碳双键中只有一个σ键,另一个必然为π键,D正确。
对点练习
3.有A,B,C,D,E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是:
__________________________________。
(3)A,B,C 3种元素的第一电离能由大到小的顺序为______________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
F>N>O
Ca
2
H2O分子间存在氢键
3d104s1
(5)A的最简单氢化物分子的空间构型为____________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知
晶体的密度为 ρ g·cm-3,阿伏加德罗常数为NA,求
晶胞边长a=____________cm(用ρ、NA的计算式表示)
对点练习
三角锥形
sp3
对点练习
【解析】根据题意可知元素A,B,C,D,E分别是N、O、F、Ca、Cu。
(1)A单质是N2,其结构式是 N≡N,含有两个π键。
(2)由于H2O的分子间有氢键,使得其沸点是同族元素氢化物中最高的。
(3)N的2p能级是半充满状态,比较稳定,其第一电离能比O要大,但比同周期的F要小。
(5)NH3的空间构型是三角锥形,其中N是sp3杂化。
(6)根据晶胞的结构,应用“均摊法”计算可得,1个晶胞中含有4个Ca2+,8个F-,故其密度为ρ=(312/NA)÷a3,可解得 a 。
本节内容结束
分子晶体
FENZIJINGTI
晶体结构与性质
目录
分子晶体的定义
常见的分子晶体
分子晶体的物理特性
分子晶体的结构
当堂小结
CONTENTS
新知导入
碘晶体结构
构成它们的基本粒子是什么?粒子之间通过什么作用力结合
分析碘晶胞示意图,计算一个晶胞中平均含有几个碘原子
分子晶体的定义
分子晶体的定义
碘晶体结构
只含I2分子
碘晶体结构
相邻分子间靠分子间作用力相互吸引
分子的取向有两种
概念:只含分子的晶体称为分子晶体
常见的分子晶体
常见的分子晶体
碘晶体结构
C60晶体结构
干冰晶体结构
绝大多数有机物: 乙醇,冰醋酸,蔗糖
所有非金属氢化物:H2O,H2S,NH3,CH4,HX
部分非金属单质: X2 , O2 , S8 , P4 , C60 、稀有气体等
部分非金属氧化物: CO2 , SO2 , NO2 , P4O6 , P4O10
几乎所有的酸:H2SO4 , HNO3 , H3PO4
典型的分子晶体
常见的分子晶体
X2 , O2 , S8 , P4 , C60
均属于非金属单质
所有的非金属单质均属于分子晶体吗?
乙醇,冰醋酸,蔗糖
H2O,H2S,NH3,CH4,HX
CO2 , SO2 , NO2 , P4O6 , P4O10
H2SO4 , HNO3 , H3PO4
均属于共价化合物
所有的共价化合物均属于分子晶体吗?
SiO2
金刚石等
常见的分子晶体
方 法 技 巧
(1)依据物质的类别判断:部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体都是分子晶体。
(2)依据组成晶体的粒子及粒子间作用判断:组成晶体的粒子是分子、粒子间作用是分子间作用力的是分子晶体。
(3)依据物质的性质判断:硬度小,熔、沸点低,在熔融状态或固体时均不导电的是分子晶体。
分子晶体的判断方法
常见的分子晶体
分子晶体的物理特性
分子晶体的物理特性
分子晶体有哪些物理特性,为什么?
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
较低的熔、沸点
较小的硬度
一般都是绝缘体,熔融状态也不导电
分子晶体在固态和熔融状态下不存在自由移动的离子或电子,因而在固态和熔融状态下都不能导电。
分子晶体熔化时破坏的是分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,且硬度较小。
分子晶体的物理特性
分子晶体的物理特性
方 法 技 巧
分子晶体熔沸点高低的判断
(2) 非金属氢化物分子间若含有氢键,熔、沸点比同族元素的氢化物反常得高,如H2O>H2Te>H2Se> H2S。
(5) 同分异构体的支链越多,熔、沸点越低。
(1) 组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
(3) 相对分子质量接近的物质,分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
(4) 烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子的增加,熔、沸点升高。
分子晶体的物理特性
分子晶体的结构
分子晶体的结构
二氧化碳分子
与CO2分子距离最近的CO2分子共有12个
与每个二氧化碳分子等距离且最近的二氧化碳分子的个数
8×1/8+6×1/2=4
12个
每个晶胞含二氧化碳分子的个数
二氧化碳分子的位置:在晶体中截取一个最小的正方体,CO2分子的中心位于正方体的八个顶点及每个面的面心上
分子的密堆积
分子晶体的结构
O2的晶体结构
C60的晶体结构
分子的密堆积
分子晶体的结构
分子晶体的结构
H
H
O
H
H
S
分子间作用力包括:
氢键的形成条件:部分裸露的氢原子核;孤电子对
(1) 范德华力
(2) 氢键
无方向性和饱和性
有方向性和饱和性
存在氢键的物质:含有N-H、O-H、F-H的物质中均存在氢键,NH3、N2H4、H2O、H2O2、醇、酚、羧酸、氨基酸等
分子晶体的结构
1个水分子周围有4个水分子
氢键具有方向性和饱和性
分子的非密堆积
分子晶体的结构
为什么冰的密度比水的密度小?对自然界生物有何影响?
分子晶体的结构
冰中1个水分子周围4个水分子
冰融化,氢键减少
空隙减小 密度增大
大量氢键 非密堆积
空隙大 密度小
分子晶体的结构
分子晶体的结构
水结冰时体积增大,密度减小,从而浮在水面上。
冰浮在水面,成为一隔热层,使下面的水温保持在 4 ℃ 左右。结冰时散热,冰融时吸热,这一过程有缓冲水温变化的作用,利于生物的生存。
分子晶体的结构
镁能持续燃烧,镁可以跟二氧化碳反应,干冰有易升华的特性
实验结论:
分子晶体的结构
干冰
冰
外观 硬度
相似或接近
晶体中分子堆积形式
分子间作用力
1个分子周围紧邻分子个数
晶体
干冰和冰的外观相似、硬度接近,Mr(CO2) > Mr(H2O),但为什么干冰的熔点比冰低,但密度比冰的高?
范德华力
密堆积
12 个
4 个
非密堆积
氢键
性质特点
易升华
用途
制冷剂
维持自然界生态平衡
分子晶体的结构
无分子间氢键
分子晶体的结构特征
有分子间氢键
分子密堆积
如:C60、干冰 、I2、O2
如:HF、冰、NH3
分子非密堆积
分子晶体的结构
天然气水合物
20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体,这种晶体的主要成分是甲烷,又称甲烷水合物,它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,又称“可燃冰”。
科学·技术·社会
估计全球的海底和冰川底部藏在天然气水合物中的天然气,总量超过煤、石油、天然气等化石燃料的总和的2倍,是巨大的潜在能源。
气体分子
水分子
科学·技术·社会
当堂小结
结构
性质
应用
分子晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
典 型 晶 体
结 构 特 征
对点练习
1.氯化硼的熔点为 -107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,能水解,有关叙述正确的是( )
A. 氯化硼液态时能导电而固态时不导电
B. 氯化硼加到水中使溶液的pH升高
C. 氯化硼分子呈正三角形,属极性分子
D. 氯化硼遇水蒸气会产生白雾
D
【解析】氯化硼熔、沸点都较低说明其是分子化合物,液态时不导电,A错误;氯化硼水解产生HCl,使溶液pH降低,B错误;其分子构型对称,正负电荷重心重合,属于非极性分子,C错误;氯化硼水解生成的HCl在空气中会形成白雾,D正确。
2.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173 ℃(在100 ℃以上能升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁中, 与Fe2+之间形成的化学键类型是离子键
C. 已知环戊二烯的结构式为 ,则其中仅有1个碳原子采取sp3杂化
D. 中一定含有π键
对点练习
B
对点练习
【解析】
根据二茂铁的物理性质如熔点低、易升华、易溶于有机溶剂等,可知二茂铁为分子晶体,A正确;
碳原子含有孤电子对,铁离子含有空轨道,二者可形成配位键,B错误;
1号碳原子含有4个σ键,无孤电子对,杂化类型为sp3,2、3、4、5号碳原子有3个σ键,无孤电子对,杂化类型为sp2,因此仅有1个碳原子采取sp3杂化,C正确;
中碳原子没有达到饱和,故存在碳碳双键,而碳碳双键中只有一个σ键,另一个必然为π键,D正确。
对点练习
3.有A,B,C,D,E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是:
__________________________________。
(3)A,B,C 3种元素的第一电离能由大到小的顺序为______________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
F>N>O
Ca
2
H2O分子间存在氢键
3d104s1
(5)A的最简单氢化物分子的空间构型为____________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知
晶体的密度为 ρ g·cm-3,阿伏加德罗常数为NA,求
晶胞边长a=____________cm(用ρ、NA的计算式表示)
对点练习
三角锥形
sp3
对点练习
【解析】根据题意可知元素A,B,C,D,E分别是N、O、F、Ca、Cu。
(1)A单质是N2,其结构式是 N≡N,含有两个π键。
(2)由于H2O的分子间有氢键,使得其沸点是同族元素氢化物中最高的。
(3)N的2p能级是半充满状态,比较稳定,其第一电离能比O要大,但比同周期的F要小。
(5)NH3的空间构型是三角锥形,其中N是sp3杂化。
(6)根据晶胞的结构,应用“均摊法”计算可得,1个晶胞中含有4个Ca2+,8个F-,故其密度为ρ=(312/NA)÷a3,可解得 a 。
本节内容结束
