3.4 配合物与超分子课件(共50张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.4 配合物与超分子课件(共50张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 182.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 13:53:46 | ||
图片预览










文档简介
配合物与超分子
PEIHEWUYUCHAOFENZI
晶体结构与性质
目录
配合物
超分子
当堂小结
对点练习
CONTENTS
新知导入
CuSO4
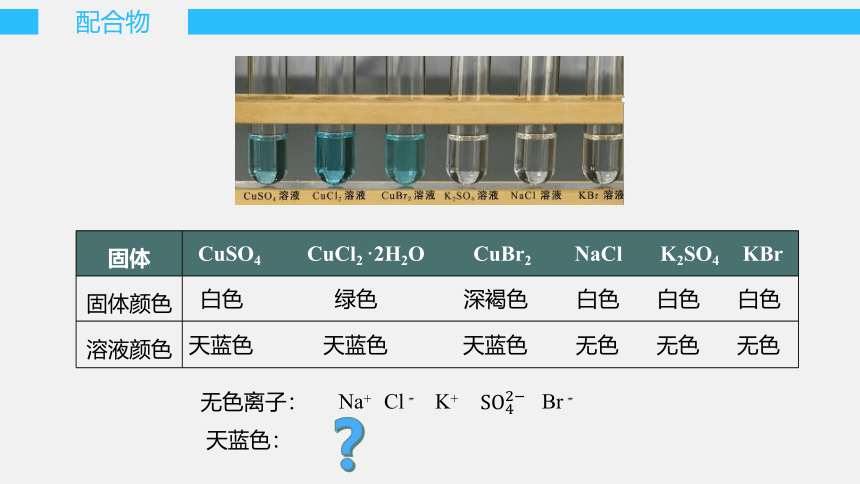
CuSO4 是白色的,CuSO4·5H2O 晶体却是蓝色的,这是为什么呢?
CuSO4·5H2O
配 合 物
配合物
配合物
{7DF18680-E054-41AD-8BC1-D1AEF772440D}固体
CuSO4 CuCl2 ·2H2O CuBr2 NaCl K2SO4 KBr
固体颜色
白色 绿色 深褐色 白色 白色 白色
溶液颜色
天蓝色 天蓝色 天蓝色 无色 无色 无色
SO42?
?
Na+
Cl-
K+
Br-
无色离子:
天蓝色:
?
配合物
[Cu(H2O)4]2+
H3O+
配合物
空轨道接受孤电子对
提供孤电子对
电子对给予体
电子对接受体
Cu2+
H2O
Cu
OH2
H2O
H2O
2+
OH2
配位键
1.配位键定义:提供孤电子对的原子与接受孤电子对的原子之间形成的共价键
2.形成条件:
3.表示形式:
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等
(2)成键原子另一方能提供空轨道。
(1)成键原子一方能提供孤电子对。
如H+、Al3+、B及过渡金属的原子或离子
A→B
A为提供孤电子对的原子,B为接受孤电子对的原子
配合物
H+
H+
四个 N-H 键性质完全相同
N
H
H
H
H
[ ]
+
4.特点:
c.配位键同样具有饱和性和方向性
如Ag+形成2个配位键;Cu2+形成4个配位键等
a.配位键是一种特殊的共价键
b.配位键的键参数与一般共价键的键参数相同
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的
配合物
配合物
1. 定义
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配合物)以配位键结合形成的化合物称为配位化合物,简称配合物
2.形成条件
中心原子提供空轨道,配位体提供孤电子对
配合物
配合物
3.配合物的构成
一般由内界和外界构成,内界由中心离子(或原子)、配位体构成
[Cu(N H 3)4 ] S O 4
配离子(内界)
配合物
离子(外界)
配位体
配位数
配位原子
中心离子
配合物
[ Cu ( NH3 ) 4 ] SO4
(1)中心原子(离子)
(3)配位数
过渡元素阳离子或原子,如Fe3+、Ag+、Ni
少数主族元素阳离子,如Al3+
(2)配位体:提供孤电子对的分子或离子
直接与中心原子相连的配位原子个数
(4)配位原子:配位体中提供孤电子对的原子
一般为2、4、6、8,最常见为4、6
常见的配位原子有 X、O、S、N、P 等
如:X-、OH-、CN-、SCN-、H2O、NH3、CO
能够提供空轨道接受孤电子对的金属原子或离子
配合物
4.配合物的命名
(1) 配离子念法:配位数→配体名称→合→中心原子(离子)名称
(2) 配合物→类似于盐(酸、碱)的念法
六氰合铁酸钾
氢氧化二氨合银
三氯一氨合铂酸钾
硫酸四氨合铜
[Cu(NH3)4] SO4
K3[Fe(CN)6]
[Ag(NH3)2]OH
K[Pt(NH3)Cl3]
对点练习
{08FB837D-C827-4EFA-A057-4D05807E0F7C}配合物
内界
外界
中心原子(离子)
配位体
配位数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]4-
K+
Fe2+
CN-
6
6
[AlF6]3-
Na+
Al3+
F-
Ni(CO)4
无
Ni
CO
4
[Co(NH3)5Cl]2+
Cl-
Co3+
Cl- NH3
6
5.配合物的制备
配合物
配合物
CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4 )2SO4
Cu(OH)2+(NH4)2SO4+2NH3·H2O=[Cu(NH3)4]SO4+4H2O
蓝色沉淀
深蓝色
再加入乙醇后,析出深蓝色晶体
5.配合物的制备
问题探究
推测[Cu(NH3)4]SO4溶液中存在哪些粒子并设计实验进行验证
①含有Cu2+、SO42?、NH3?H2O
②含有[Cu(NH3)4 ]2+、SO42?
?
①加入BaCl2溶液检验SO42?
②加入NaOH溶液检验Cu2+
③用pH试纸检验溶液酸碱性
?
[Cu(NH3)4]SO4=[Cu(NH3)4]2++?????????????????
?
配合物的内外界之间以离子键结合,在水溶液中内外界之间完全电离
方 法 技 巧
配合物
若配体为单核离子如Cl-等,可以不予计入。
配合物配离子中共价键数目的判断
配合物[Co(NH3)4Cl2]Cl的共价键数为:3×4+4+2=18。
若为分子,需要用配体分子内的共价键数乘以该配体的个数,此外,还要加上中心原子与配体形成的配位键,这也是σ键。
问题探究
稳定性:
Cu
NH3
H3N
H3N
H3N
2+
Cu
OH2
H2O
H2O
H2O
2+
<
H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,与Cu2+形成的配位键更强
向硫酸铜溶液中滴加氨水,为什么[Cu(H2O)4]2+转化为[Cu(NH3)4]2+呢?
配合物
铁离子与硫氢根离子的反应
5.配合物的制备
配合物
检验或鉴定溶液中存在 Fe3+、用于电影特技和魔术表演
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 c(SCN-) 大小而异)
5.配合物的制备
配合物
5.配合物的制备
配合物
AgCl + 2NH3·H2O=[Ag(NH3)2]+ + Cl- + 2H2O
5.配合物的制备
问题探究
NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子?你能写出NH3·BF3的结构式吗?
配合物
(1)溶解性的影响
6.配合物的形成对性质的影响
(2)颜色的改变
AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀转变为易溶于水的物质
Fe3+与SCN-在溶液中可生成配位数为1~6的红色的配离子
配合物
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
6.配合物的形成对性质的影响
配合物
血红素
叶绿素
配合物广泛存在于自然界中,跟人类生活有密切关系
配合物
在医药中的应用
在生产、生活中的应用
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]OH
第二代铂类抗癌药(碳铂)
7.配合物的应用
对点练习
1.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
B
对点练习
解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
对点练习
2.0.01 mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生
0.02 mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
新知导入
借分子间作用力形成复杂结构的超分子
新知导入
十四元瓜环与卟啉构筑的超分子聚合物
对称四甲基六元瓜环超分子
超 分 子
超分子
1.定义
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
2.存在形式
超分子定义中的分子是广义的,包括离子
3.形成方式
有人将其概括为非共价键,有人则将其限于分子间作用力
4.分子聚集体的大小
超分子这种分子聚集体,有的是有限的,有的是无限伸展的
5.范围
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,柱芳烃,瓜环葫芦等
超分子
(1) 分子识别——用超分子分离C60和C70
6.超分子特征
超分子
(1) 分子识别——用超分子分离C60和C70
C60
C70
6.超分子特征
超分子
(1) 分子识别——冠醚识别碱金属离子(如K+)
15-冠-5
12-冠-4
18-冠-6
6.超分子特征
超分子
冠醚识别钾离子
{616DA210-FB5B-4158-B5E0-FEB733F419BA}冠醚
冠醚空腔直径/pm
适合的粒子(直径/pm)
12-冠-4
15-冠-5
18-冠-6
21-冠-7
120~150
170~220
260~320
340~430
Li+(152)
Na+(204)
K+(276)
Rb+(304)
Cs+(334)
超分子
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
15-冠-5
12-冠-4
18-冠-6
Li+
Na+
K+
超分子
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
(2) 自组装
高度有序的双分子膜超分子
6.超分子特征
当堂小结
超 分 子
概 念 分 析
分 子 识 别
分子自组装
配 合 物
概 念 分 析
形 成 条 件
实验室制法
结构与组成
生命科学生产生活
1.我国科学家制得了SiO2超分子纳米管,其
微观结构如图所示,下列叙述中正确的是( )
?
A. SiO2是两性氧化物,既可与NaOH反应又可与HF反应
B. SiO2超分子纳米管可能选择性结合某些分子或离子
C. SiO2是光导纤维的成分,具有导电性
D. 水晶和玛瑙主要成分均为SiO2,均属于共价晶体
对点练习
B
2.利用超分子可分离C60 和C70。将混合物加入一种空腔大小适配的“杯酚”中进行分离的流程,如图所示。下列说法不正确的是( )
?
A.杯酚分子与C60可以形成分子间氢键
B.C60 和C70互为同素异形体
C.图中杯酚分子与C60可能是借助分子间作用力形成超分子
D.利用杯酚分离C60 和C70说明人类已经能够从分子层面进行物质的分离和提纯
A
对点练习
【解析】杯酚中的羟基之间形成氢建,而杯酚与C60有形成氢键,A错误;
C60 和C70是由石碳元素组成的不同单质,所以互为同素异形体,B正确;
两分子形成一体之间作用力为分子间作用力,C正确;
利用杯酚分离C60 和C70可以说人类能够从分子层面上进分离,提纯,因为C60 和C70单体为分子,D正确。
对点练习
3.超分子化学已逐渐扩展到化学的各个分支,还扩展
到生命科学和物理学等领域。由Mo将2个C60分子、2
个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的
超分子结构如图所示。
?(1)Mo处于第五周期第ⅥB族,核外电子排布与Cr相似,
它的基态价电子排布式是________;核外未成对电子数
是________个。
(2)该超分子中存在的化学键类型有________。
A.σ键 B.π键 C.离子键 D.氢键
对点练习
AB
4d55s1
6
对点练习
(3)该超分子中配体CO提供孤电子对的原子是________,
p?甲酸丁酯吡啶配体中C原子的杂化方式有________。
C
sp2和sp3
3.超分子化学已逐渐扩展到化学的各个分支,还扩展
到生命科学和物理学等领域。由Mo将2个C60分子、2
个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的
超分子结构如图所示。
对点练习
【解析】(1)Cr的基态价电子排布式为3d54s1,而Mo与Cr同主族,但比Cr多了一周期,因而基态价电子排布式为4d55s1,因而核外未成对的电子为6个。
(2)观察该超分子结构有双键,说明有σ键和π键,分子中不存在离子键,根据信息Mo形成配位键,因而答案选AB。
(3)CO提供孤电子对的是C原子,Mo提供空轨道,两个原子形成配位键,p?甲酸丁酯吡啶中碳原子有形成双键,说明其杂化方式为sp2,在丁基中C原子形成四个单键为sp3杂化。
本节内容结束
PEIHEWUYUCHAOFENZI
晶体结构与性质
目录
配合物
超分子
当堂小结
对点练习
CONTENTS
新知导入
CuSO4
CuSO4 是白色的,CuSO4·5H2O 晶体却是蓝色的,这是为什么呢?
CuSO4·5H2O
配 合 物
配合物
配合物
{7DF18680-E054-41AD-8BC1-D1AEF772440D}固体
CuSO4 CuCl2 ·2H2O CuBr2 NaCl K2SO4 KBr
固体颜色
白色 绿色 深褐色 白色 白色 白色
溶液颜色
天蓝色 天蓝色 天蓝色 无色 无色 无色
SO42?
?
Na+
Cl-
K+
Br-
无色离子:
天蓝色:
?
配合物
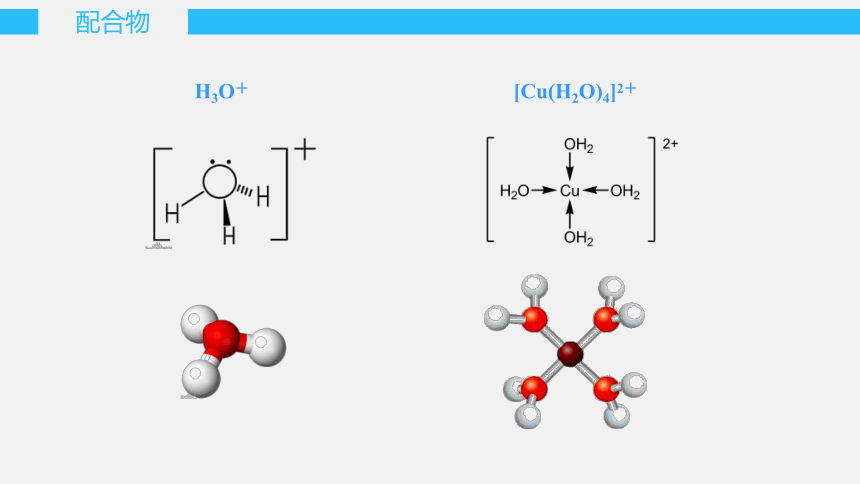
[Cu(H2O)4]2+
H3O+
配合物
空轨道接受孤电子对
提供孤电子对
电子对给予体
电子对接受体
Cu2+
H2O
Cu
OH2
H2O
H2O
2+
OH2
配位键
1.配位键定义:提供孤电子对的原子与接受孤电子对的原子之间形成的共价键
2.形成条件:
3.表示形式:
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等
(2)成键原子另一方能提供空轨道。
(1)成键原子一方能提供孤电子对。
如H+、Al3+、B及过渡金属的原子或离子
A→B
A为提供孤电子对的原子,B为接受孤电子对的原子
配合物
H+
H+
四个 N-H 键性质完全相同
N
H
H
H
H
[ ]
+
4.特点:
c.配位键同样具有饱和性和方向性
如Ag+形成2个配位键;Cu2+形成4个配位键等
a.配位键是一种特殊的共价键
b.配位键的键参数与一般共价键的键参数相同
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的
配合物
配合物
1. 定义
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配合物)以配位键结合形成的化合物称为配位化合物,简称配合物
2.形成条件
中心原子提供空轨道,配位体提供孤电子对
配合物
配合物
3.配合物的构成
一般由内界和外界构成,内界由中心离子(或原子)、配位体构成
[Cu(N H 3)4 ] S O 4
配离子(内界)
配合物
离子(外界)
配位体
配位数
配位原子
中心离子
配合物
[ Cu ( NH3 ) 4 ] SO4
(1)中心原子(离子)
(3)配位数
过渡元素阳离子或原子,如Fe3+、Ag+、Ni
少数主族元素阳离子,如Al3+
(2)配位体:提供孤电子对的分子或离子
直接与中心原子相连的配位原子个数
(4)配位原子:配位体中提供孤电子对的原子
一般为2、4、6、8,最常见为4、6
常见的配位原子有 X、O、S、N、P 等
如:X-、OH-、CN-、SCN-、H2O、NH3、CO
能够提供空轨道接受孤电子对的金属原子或离子
配合物
4.配合物的命名
(1) 配离子念法:配位数→配体名称→合→中心原子(离子)名称
(2) 配合物→类似于盐(酸、碱)的念法
六氰合铁酸钾
氢氧化二氨合银
三氯一氨合铂酸钾
硫酸四氨合铜
[Cu(NH3)4] SO4
K3[Fe(CN)6]
[Ag(NH3)2]OH
K[Pt(NH3)Cl3]
对点练习
{08FB837D-C827-4EFA-A057-4D05807E0F7C}配合物
内界
外界
中心原子(离子)
配位体
配位数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]4-
K+
Fe2+
CN-
6
6
[AlF6]3-
Na+
Al3+
F-
Ni(CO)4
无
Ni
CO
4
[Co(NH3)5Cl]2+
Cl-
Co3+
Cl- NH3
6
5.配合物的制备
配合物
配合物
CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4 )2SO4
Cu(OH)2+(NH4)2SO4+2NH3·H2O=[Cu(NH3)4]SO4+4H2O
蓝色沉淀
深蓝色
再加入乙醇后,析出深蓝色晶体
5.配合物的制备
问题探究
推测[Cu(NH3)4]SO4溶液中存在哪些粒子并设计实验进行验证
①含有Cu2+、SO42?、NH3?H2O
②含有[Cu(NH3)4 ]2+、SO42?
?
①加入BaCl2溶液检验SO42?
②加入NaOH溶液检验Cu2+
③用pH试纸检验溶液酸碱性
?
[Cu(NH3)4]SO4=[Cu(NH3)4]2++?????????????????
?
配合物的内外界之间以离子键结合,在水溶液中内外界之间完全电离
方 法 技 巧
配合物
若配体为单核离子如Cl-等,可以不予计入。
配合物配离子中共价键数目的判断
配合物[Co(NH3)4Cl2]Cl的共价键数为:3×4+4+2=18。
若为分子,需要用配体分子内的共价键数乘以该配体的个数,此外,还要加上中心原子与配体形成的配位键,这也是σ键。
问题探究
稳定性:
Cu
NH3
H3N
H3N
H3N
2+
Cu
OH2
H2O
H2O
H2O
2+
<
H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,与Cu2+形成的配位键更强
向硫酸铜溶液中滴加氨水,为什么[Cu(H2O)4]2+转化为[Cu(NH3)4]2+呢?
配合物
铁离子与硫氢根离子的反应
5.配合物的制备
配合物
检验或鉴定溶液中存在 Fe3+、用于电影特技和魔术表演
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 c(SCN-) 大小而异)
5.配合物的制备
配合物
5.配合物的制备
配合物
AgCl + 2NH3·H2O=[Ag(NH3)2]+ + Cl- + 2H2O
5.配合物的制备
问题探究
NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子?你能写出NH3·BF3的结构式吗?
配合物
(1)溶解性的影响
6.配合物的形成对性质的影响
(2)颜色的改变
AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀转变为易溶于水的物质
Fe3+与SCN-在溶液中可生成配位数为1~6的红色的配离子
配合物
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
6.配合物的形成对性质的影响
配合物
血红素
叶绿素
配合物广泛存在于自然界中,跟人类生活有密切关系
配合物
在医药中的应用
在生产、生活中的应用
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]OH
第二代铂类抗癌药(碳铂)
7.配合物的应用
对点练习
1.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
B
对点练习
解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
对点练习
2.0.01 mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生
0.02 mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
新知导入
借分子间作用力形成复杂结构的超分子
新知导入
十四元瓜环与卟啉构筑的超分子聚合物
对称四甲基六元瓜环超分子
超 分 子
超分子
1.定义
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
2.存在形式
超分子定义中的分子是广义的,包括离子
3.形成方式
有人将其概括为非共价键,有人则将其限于分子间作用力
4.分子聚集体的大小
超分子这种分子聚集体,有的是有限的,有的是无限伸展的
5.范围
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,柱芳烃,瓜环葫芦等
超分子
(1) 分子识别——用超分子分离C60和C70
6.超分子特征
超分子
(1) 分子识别——用超分子分离C60和C70
C60
C70
6.超分子特征
超分子
(1) 分子识别——冠醚识别碱金属离子(如K+)
15-冠-5
12-冠-4
18-冠-6
6.超分子特征
超分子
冠醚识别钾离子
{616DA210-FB5B-4158-B5E0-FEB733F419BA}冠醚
冠醚空腔直径/pm
适合的粒子(直径/pm)
12-冠-4
15-冠-5
18-冠-6
21-冠-7
120~150
170~220
260~320
340~430
Li+(152)
Na+(204)
K+(276)
Rb+(304)
Cs+(334)
超分子
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
15-冠-5
12-冠-4
18-冠-6
Li+
Na+
K+
超分子
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
(2) 自组装
高度有序的双分子膜超分子
6.超分子特征
当堂小结
超 分 子
概 念 分 析
分 子 识 别
分子自组装
配 合 物
概 念 分 析
形 成 条 件
实验室制法
结构与组成
生命科学生产生活
1.我国科学家制得了SiO2超分子纳米管,其
微观结构如图所示,下列叙述中正确的是( )
?
A. SiO2是两性氧化物,既可与NaOH反应又可与HF反应
B. SiO2超分子纳米管可能选择性结合某些分子或离子
C. SiO2是光导纤维的成分,具有导电性
D. 水晶和玛瑙主要成分均为SiO2,均属于共价晶体
对点练习
B
2.利用超分子可分离C60 和C70。将混合物加入一种空腔大小适配的“杯酚”中进行分离的流程,如图所示。下列说法不正确的是( )
?
A.杯酚分子与C60可以形成分子间氢键
B.C60 和C70互为同素异形体
C.图中杯酚分子与C60可能是借助分子间作用力形成超分子
D.利用杯酚分离C60 和C70说明人类已经能够从分子层面进行物质的分离和提纯
A
对点练习
【解析】杯酚中的羟基之间形成氢建,而杯酚与C60有形成氢键,A错误;
C60 和C70是由石碳元素组成的不同单质,所以互为同素异形体,B正确;
两分子形成一体之间作用力为分子间作用力,C正确;
利用杯酚分离C60 和C70可以说人类能够从分子层面上进分离,提纯,因为C60 和C70单体为分子,D正确。
对点练习
3.超分子化学已逐渐扩展到化学的各个分支,还扩展
到生命科学和物理学等领域。由Mo将2个C60分子、2
个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的
超分子结构如图所示。
?(1)Mo处于第五周期第ⅥB族,核外电子排布与Cr相似,
它的基态价电子排布式是________;核外未成对电子数
是________个。
(2)该超分子中存在的化学键类型有________。
A.σ键 B.π键 C.离子键 D.氢键
对点练习
AB
4d55s1
6
对点练习
(3)该超分子中配体CO提供孤电子对的原子是________,
p?甲酸丁酯吡啶配体中C原子的杂化方式有________。
C
sp2和sp3
3.超分子化学已逐渐扩展到化学的各个分支,还扩展
到生命科学和物理学等领域。由Mo将2个C60分子、2
个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的
超分子结构如图所示。
对点练习
【解析】(1)Cr的基态价电子排布式为3d54s1,而Mo与Cr同主族,但比Cr多了一周期,因而基态价电子排布式为4d55s1,因而核外未成对的电子为6个。
(2)观察该超分子结构有双键,说明有σ键和π键,分子中不存在离子键,根据信息Mo形成配位键,因而答案选AB。
(3)CO提供孤电子对的是C原子,Mo提供空轨道,两个原子形成配位键,p?甲酸丁酯吡啶中碳原子有形成双键,说明其杂化方式为sp2,在丁基中C原子形成四个单键为sp3杂化。
本节内容结束
